一哥出了一個本不該出的問題。6月FORM483事件的後續,恒瑞還有一次整改機會。
恒瑞的警告信還是來了,一哥在生產質控上這次栽了跟頭。
這次警告信是FDA在2024年1月8日至1月16日對連雲港經濟技術開發區黃河路38號製劑生產場地檢查結果的後續措施,但是向着不太好的方向進展,不過恒瑞仍有一次整改機會。
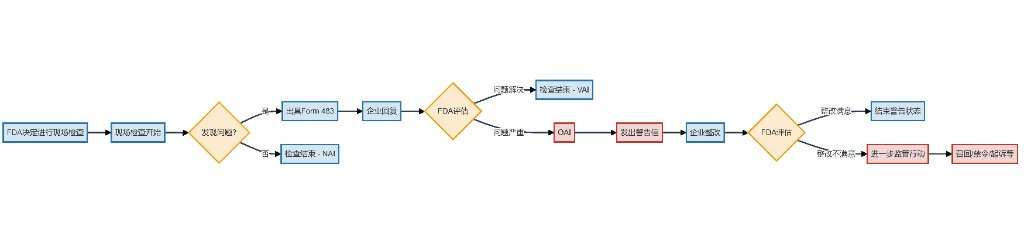
FDA現場檢查收到警告信意味着什麼?
此前6月恒瑞已經收到FORM 483表格,進入現場檢查的第二階段,OAI(Official Action Indicated)階段。此次警告信則意味着上一階段的整改並沒有全部得到FDA認可,進入更嚴肅監管的正式行動階段。
FDA現場檢查流程圖
 見智研究製圖
見智研究製圖
見智研究曾在文章《恒瑞的FORM 483,沒有那麼簡單 | 見智研究》中提示,恒瑞收到OAI意味着此次檢查已經嚴重階段,需要引起公司足夠重視。
而近日收到警告信,對於對於醫藥製造現場檢查來說,這個已經是極度嚴重的事件了。
從整個FDA檢查流程來看,恒瑞此次現場檢查已經進入最後一個階段,如果15日內提交的整改意見獲得通過,警告信將關閉;如果不能獲得FDA通過,則意味着將有召回和出口禁令等更嚴重後果。
FDA發現什麼違規事項?
此次警告信的核心內容集中在兩點,雖然不是直接影響產品質量安全,但無菌區域防污染不到位的風險仍不可小覷。
1)質量控制部門在文檔的監督和控制方面的履職不夠,未能確保生產的製劑符合CGMP要求;
2)設施設計不充分,用於生產無菌產品的區域沒有足夠的防止污染或混淆的措施。
針對此次檢查的問題,恒瑞醫藥向華爾街見聞·見智研究表示:公司始終將患者安全放在首位,高度重視藥監機構在檢查中提出的意見。針對FDA在本次警告信中提出的改進建議,公司將積極組織內外專家及第三方諮詢機構落實相關建議,並與FDA保持密切溝通,爭取儘快關閉警告信。同時,公司已經開展全面的調查評估,本次FDA警告信中指出的問題沒有影響到藥品質量安全。
據了解,此次警告信涉及的連雲港經濟技術開發區黃河路38號製劑生產場地啓用於1999年,2010年首次接受FDA檢查,後續分別於2012年、2014年、2016年和2018年接受過FDA的GMP現場檢查,5次均順利通過,其中2次爲零缺陷。
此次檢查的生產場地共有12個仿製藥品種獲得FDA上市許可,均不是恒瑞主要產品。該場地2023年出口美國市場產品的收入爲1240萬美元,佔本公司2023年度營業收入比重約爲0.39%;該場地2024年一季度出口美國市場的收入爲393.88萬美元(未經審計),佔本公司當期營業收入比重約爲0.47%。
關於當期業績影響,恒瑞向見智研究表示:預計本次警告信對公司2024年業績不會產生重大影響。
恒瑞醫藥在全國9個城市建有生產基地,其中在連雲港一共有國際化製劑生產基地、新醫藥產業園、生物醫藥生產基地、原料藥生產基地4個生產基地,此次警告信涉及的場地就是國際化製劑生產基地下屬的建成時間最早的一個場地。
恒瑞醫藥也進一步表示:本次警告信對公司其他生產場地無影響,目前公司出口美國的產品也未受影響。
對國內企業的啓示
作爲全球最嚴監管的FDA,每年在美國境內及境外的現場檢查超過17000次,從FDA官方數據來看,國際檢查數量總體逐年增加,意味着FDA對全球供應鏈的關注和對國際合規性的重視。

此外,OAI分類檢查在最近幾年有所增加,表明嚴重違規行爲的發現增多,可能導致更多的官方行動。
隨着國際旅行通暢,FDA的現場檢查會恢復常態,並且在新的國際背景下,有更加嚴厲的趨勢。對於中國醫藥出口企業來說,不僅需要更加註重自身產品質量關,更需要關注目標市場法規環境變化。
此外,對於使用多年的生產場地,中國藥企也需要對照法規要求進一步評估,提升生產質控,符合監管要求和患者健康,畢竟對於一家藥企來說生產合規藥品與治療患者同等重要。
