- In the RESILIENT SMA study, taldefgrobep alpha showed clinically meaningful improvements in motor function at all timepoints on the Motor Function Measurement-32 scale (MFM-32), but the treatment arm did not statistically separate on the primary outcome at Week 48 compared to the placebo+standard of care (SOC) group.
- Efficacy signals were observed in clinically relevant and biomarker-defined subgroups including those related to age, ambulatory status, background therapy, and baseline myostatin level.
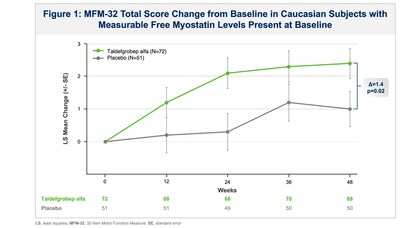
- Analyses of prespecified subgroups by race and ethnicity demonstrated that the largest study population (87% Caucasian; n=180) showed clinically meaningful improvements on the MFM-32 at all timepoints, including Week 48, compared to the corresponding placebo+SOC group (p < 0.05). Additional analyses of these subjects (n=123) who had measurable baseline myostatin (the pharmacological target of taldefgrobep) showed an improved efficacy signal within this myostatin-positive population (p=0.02).
- Biohaven plans to engage the FDA regarding potential next steps forward and will present the study data at an upcoming conference. The optional long-term extension phase of the trial will remain ongoing pending further data analysis as well as regulatory discussions.
- Prespecified outcome measures in the overall study population analyzing the change from baseline in body composition at Week 48 demonstrated a greater reduction in the percent change in total body fat mass in the taldefgrobep arm compared to the placebo+SOC arm (p=0.008) as measured by dual energy x-ray absorptiometry (DXA). The taldefgrobep arm also showed numerically larger increases in lean muscle mass and bone density compared to the placebo+SOC arm.
- Given the overall strength and consistency of the taldefgrobep-associated changes in body composition (i.e., fat mass, lean muscle mass, and bone density), Biohaven plans to rapidly advance taldefgrobep into a placebo-controlled Phase 2 obesity study in 4Q2024 using a user-friendly, self-administered autoinjector.
- Taldefgrobep demonstrated robust target engagement in the RESILIENT study, reducing myostatin levels below detection in all treated subjects over 48 weeks.
- Taldefgrobep was well-tolerated in the RESILIENT study with 97% of subjects continuing into the optional long-term extension. There were no taldefgrobep treatment-related serious adverse events (SAEs).
NEW HAVEN, Conn., Nov. 25, 2024 /PRNewswire/ -- Biohaven Ltd. (NYSE: BHVN) (Biohaven), a global clinical-stage biopharmaceutical company focused on the discovery, development and commercialization of life-changing therapies to treat a broad range of rare and common diseases, provided an update today regarding the taldefgrobep alfa development programs in SMA and obesity.
In the RESILIENT SMA study, taldefgrobep showed clinically meaningful improvements in motor function at all timepoints on the Motor Function Measurement-32 scale (MFM-32) but the treatment arm did not statistically separate on the primary outcome at 48 weeks compared to the placebo+standard of care (SOC) group. Signals of efficacy were observed in clinically relevant and biomarker-defined subgroups including those related to age, ambulatory status, background therapy, and presence of myostatin at baseline. Notably, there was an unexpectedly large subgroup (35%) of subjects without measurable levels of myostatin at baseline and imbalances in some genetic factors (SMN2 copy number, race) across treatment arms.
 Diverse populations are affected by SMA, but its genetic epidemiology and carrier rates vary with race or ethnicity, with more than a 2-fold higher prevalence in Caucasian compared to non-Caucasian populations1. Analyses of prespecified subgroups by race and ethnicity demonstrated that the largest study population (87% Caucasian; n=180) showed a 2.2-point change-from-baseline improvement with taldefgrobep treatment on the MFM-32 at Week 48 compared to a 1.1-point change-from-baseline improvement in the corresponding placebo+SOC group (p < 0.039). The improvement associated with taldefgrobep in this subgroup was further increased to a 1.4-point placebo adjusted change-from-baseline (p=0.02) when analyzed by subjects who had measurable myostatin levels at baseline (see Figure 1). These benefits on the MFM-32 continued to increase in the open-label extension period based on preliminary data through Extension Week 24. Moreover, a responder analysis of this myostatin-positive subgroup, with response defined as ≥ 3-point change from baseline improvement on the MFM-32 at Week 48, showed that 50% of taldefgrobep-treated subjects responded compared to 30% in the placebo+SOC arm.
Diverse populations are affected by SMA, but its genetic epidemiology and carrier rates vary with race or ethnicity, with more than a 2-fold higher prevalence in Caucasian compared to non-Caucasian populations1. Analyses of prespecified subgroups by race and ethnicity demonstrated that the largest study population (87% Caucasian; n=180) showed a 2.2-point change-from-baseline improvement with taldefgrobep treatment on the MFM-32 at Week 48 compared to a 1.1-point change-from-baseline improvement in the corresponding placebo+SOC group (p < 0.039). The improvement associated with taldefgrobep in this subgroup was further increased to a 1.4-point placebo adjusted change-from-baseline (p=0.02) when analyzed by subjects who had measurable myostatin levels at baseline (see Figure 1). These benefits on the MFM-32 continued to increase in the open-label extension period based on preliminary data through Extension Week 24. Moreover, a responder analysis of this myostatin-positive subgroup, with response defined as ≥ 3-point change from baseline improvement on the MFM-32 at Week 48, showed that 50% of taldefgrobep-treated subjects responded compared to 30% in the placebo+SOC arm.
Non-Caucasian subjects (n=26) had a higher than expected placebo response and did not separate from placebo on the MFM-32 at Week 48 (p=0.24). Significant enrichment of known, common genetic polymorphisms in non-Caucasian subjects, considered likely to confer myostatin-inhibitory independence for myostatin therapies, are probable in explaining this ethnic separation of responsiveness to therapy. This provides a potentially facile biomarker for identifying SMA patients likely to benefit from taldefgrobep and other myostatin therapies. Further analysis is ongoing to better understand the likely potential impact of these readily monitorable biomarker and genetic factors, including myostatin allele frequencies, in both the potential lower overall response in treated subjects and the overall higher response observed in placebo subjects.
In the overall study population, and relevant to activity of taldefgrobep on muscle and fat, prespecified outcome measures analyzing the change from baseline in body composition at Week 48 demonstrated a greater reduction in the percent change in total body fat mass in the taldefgrobep arm compared to the placebo+SOC arm (p=0.008) as measured by dual energy x-ray absorptiometry (DXA). The taldefgrobep arm also showed numerically larger increases in lean muscle mass and bone density compared to the placebo+SOC arm. Importantly, variables such as race or baseline myostatin levels did not alter the impact of taldefgrobep on the favorable effects on fat mass over the course of the study. These results suggest that the body composition changes observed in subjects treated with taldefgrobep, including lower fat mass, are not solely mediated by taldefgrobep's effects on myostatin but also through its effects on other targets such as activin A. The favorable effects observed on overall body composition (fat and lean mass) is consistent with nonclinical data showing that taldefgrobep has direct effects on adipose tissue mediated by activin receptor signaling through multiple ligands, including activin A, myostatin and others. Notably, taldefgrobep is the first and only myostatin blocking agent that has shown the ability to favorably change fat mass in people with SMA. This finding has important implications for the potential of taldefgrobep as a treatment for obesity in a broad population.
Based upon data from this study demonstrating target engagement (i.e., myostatin reduction) and taldefgrobep-associated changes in body composition (i.e., fat mass, lean muscle mass and bone density), Biohaven intends to accelerate taldefgrobep clinical plans in 4Q24, advancing a user-friendly, self-administered autoinjector in adults living with overweight and obesity, medical conditions defined by excess, abnormal body fat.
Biomarker analyses demonstrated that taldefgrobep achieved robust target engagement, reducing myostatin levels in all treated subjects below the level of detection at all time points measured through Week 48. Post hoc efficacy analyses in subjects with measurable baseline myostatin (the pharmacological target of taldefgrobep) showed an improved efficacy signal in this myostatin-positive population.
Cliff Bechtold, Taldefgrobep Development Lead and President of Biohaven Ireland, commented, "SMA is a devastating rare disease and although we are disappointed that taldefgrobep did not achieve a statistically significant difference in the broad study population on the MFM-32, we are encouraged that a majority subgroup did show a treatment benefit compared to the placebo arm. The observed treatment effect on motor function, which had a similar magnitude on the MFM-32 after 1 year of treatment as approved therapies (i.e., risdiplam), along with the strong biomarker evidence of target engagement, suggests that taldefgrobep may play a potentially beneficial role in a majority subgroup population of SMA patients. Additionally, taldefgrobep demonstrated an important beneficial effect on body composition which supports our plans to accelerate development in broader populations with obesity."
Taldefgrobep was well-tolerated in the RESILIENT trial with 97% of subjects continuing into the optional long-term extension, which will remain open and ongoing pending discussion with FDA. There were no taldefgrobep treatment-related SAEs.
Evaluation of additional RESILIENT clinical and biomarker data is ongoing, and Biohaven plans to engage with FDA regarding these emerging data to discuss a path forward. Full topline data will be presented at an upcoming scientific meeting.
Lindsey Lair, MD, MBA, Vice President of Neurology and Clinical Lead for SMA at Biohaven added, "Biohaven remains committed to fighting rare diseases and will engage SMA experts and regulatory authorities regarding the full dataset from the RESILIENT study. We are extremely grateful to the international SMA community - especially the participants and their families, investigators and their teams, and patient advocacy groups who made the trial possible."
About Taldefgrobep alfa
Taldefgrobep alfa is a fully human recombinant protein specifically designed to inhibit both myostatin and activin receptor signaling. By blocking the formation of the myostatin-activin receptor complex, taldefgrobep prevents downstream activity that leads to muscle atrophy and accumulation of fat mass. More information about taldefgrobep alfa can be found at the Biohaven website.
About SMA
SMA is a rare genetic neurodegenerative disorder characterized by the loss of motor neurons, atrophy of the voluntary muscles of the limbs and trunk and progressive muscle weakness that is often fatal and typically diagnosed in young children. The underlying pathology of SMA is caused by insufficient production of the SMN (survival of motor neuron) protein, essential for the survival of motor neurons, and is encoded by two genes, SMN1 and SMN2. Globally, SMA affects approximately 1 in 10,000 births, and about 1 in every 50 individuals is a genetic carrier.
About Biohaven
Biohaven is a biopharmaceutical company focused on the discovery, development, and commercialization of life-changing treatments in key therapeutic areas, including immunology, neuroscience, and oncology. The company is advancing its innovative portfolio of therapeutics, leveraging its proven drug development experience and multiple proprietary drug development platforms. Biohaven's extensive clinical and preclinical programs include Kv7 ion channel modulation for epilepsy and mood disorders; extracellular protein degradation for immunological diseases; TRPM3 antagonism for migraine and neuropathic pain; TYK2/JAK1 inhibition for neuroinflammatory disorders; glutamate modulation for OCD and SCA (spinocerebellar ataxia); myostatin inhibition for neuromuscular and metabolic diseases, including SMA and obesity; antibody recruiting bispecific molecules and antibody drug conjugates for cancer. For more information, visit .
Forward-looking Statements
This news release includes forward-looking statements within the meaning of the Private Securities Litigation Reform Act of 1995, including statements about Biohaven Ltd. and our planned and ongoing clinical trials, the timing of and the availability of data from those trials (including full Phase 3 RESILIENT data for taldefgrobep alfa), the timing and our decisions with our planned regulatory filings, the timing of and our ability to obtain regulatory approvals for our product candidates the clinical potential utility of our product candidates, alone and as compared to other existing potential treatment options, and the potential advancement of our early phase programs. The use of certain words, including "continue", "plan", "will", "believe", "may", "expect", "anticipate" and similar expressions, is intended to identify forward-looking statements. Investors are cautioned that any forward-looking statements, including statements regarding the future development, timing and potential marketing approval and commercialization of our development candidates, are not guarantees of future performance or results and involve substantial risks and uncertainties. Actual results, developments and events may differ materially from those in the forward-looking statements as a result of various factors including: the expected timing, commencement and outcomes of Biohaven's planned and ongoing clinical trials (including further clinical trials for taldefgrobep alfa); the timing of planned interactions and filings with the FDA; complying with applicable U.S. regulatory requirements; the potential commercialization of Biohaven's product candidates, and the effectiveness and safety of Biohaven's product candidates. Additional important factors to be considered in connection with forward-looking statements are described in the Biohaven's filings with the Securities and Exchange Commission, including within the sections titled "Risk Factors" and "Management's Discussion and Analysis of Financial Condition and Results of Operations". The forward-looking statements are made as of the date of this news release, and Biohaven does not undertake any obligation to update any forward-looking statements, whether as a result of new information, future events or otherwise, except as required by law. This news release may also contain references to published independent sources which are provided in good faith.
(1: )
Investor Contact:
Jennifer Porcelli
Vice President, Investor Relations
jennifer.porcelli@biohavenpharma.com
+1 (201) 248-0741
Media Contact:
Mike Beyer
Sam Brown Inc.
mikebeyer@sambrown.com
+1 (312) 961-2502
![big]()
View original content to download multimedia:
SOURCE Biohaven Ltd.

 SMA影響種群多樣,但其遺傳流行病學和攜帶者率因種族或族裔而異,而白種人的患病率比非白種人群高出兩倍以上。按照種族和族裔預先指定的亞組分析顯示,最大的研究人群(87% 白種人;n=180)在第48周的MFm-32上,taldefgrobep治療顯示出與基線相比的2.2分改善,而對照組(安慰劑+SOC)的對應改善爲1.1分(p < 0.039)。在基線可測量肌肉抑制素水平的受試者中分析後,該亞組的taldefgrobep相關改善進一步增加到1.4分安慰劑調整的基線變化(p=0.02)(請參見圖1)。這些關於MFm-32的好處在開放標籤延長期中繼續增加,根據第24周延長的初步數據。此外,根據肌肉抑制素陽性亞組的反應者分析,反應者定義爲在第48周MFm-32上與基線相比改善≥3分,顯示了50%的taldefgrobep受試者有反應,而安慰劑+SOC組爲30%。
SMA影響種群多樣,但其遺傳流行病學和攜帶者率因種族或族裔而異,而白種人的患病率比非白種人群高出兩倍以上。按照種族和族裔預先指定的亞組分析顯示,最大的研究人群(87% 白種人;n=180)在第48周的MFm-32上,taldefgrobep治療顯示出與基線相比的2.2分改善,而對照組(安慰劑+SOC)的對應改善爲1.1分(p < 0.039)。在基線可測量肌肉抑制素水平的受試者中分析後,該亞組的taldefgrobep相關改善進一步增加到1.4分安慰劑調整的基線變化(p=0.02)(請參見圖1)。這些關於MFm-32的好處在開放標籤延長期中繼續增加,根據第24周延長的初步數據。此外,根據肌肉抑制素陽性亞組的反應者分析,反應者定義爲在第48周MFm-32上與基線相比改善≥3分,顯示了50%的taldefgrobep受試者有反應,而安慰劑+SOC組爲30%。
 查看原始內容以下載多媒體:
查看原始內容以下載多媒體:
 Diverse populations are affected by SMA, but its genetic epidemiology and carrier rates vary with race or ethnicity, with more than a 2-fold higher prevalence in Caucasian compared to non-Caucasian populations
Diverse populations are affected by SMA, but its genetic epidemiology and carrier rates vary with race or ethnicity, with more than a 2-fold higher prevalence in Caucasian compared to non-Caucasian populations