現在、FDAのウェブサイトによると、恒瑞医薬の1月の現地検査がOAI段階に入ったことが発見されました。これは、FDAが企業の第一段階の回答と修正措置に不満であることを意味し、正式に監督決定を下したことを示しています。ただし、強調する必要があるのは、恒瑞がさらなる監督措置が採られる前に、改善措置を提出する機会があるということです。さらに、この現地検査は、双艾療法輸出とは無関係です。
最近、恒瑞医薬は、米国FDAの483フォームを受け取り、この検査は江蘇省連雲港の製剤生産現場を対象としており、検査期間は2024年1月8日〜16日です。FDAのウェブサイトによると、恒瑞のFORM 483は2024年6月4日にウェブサイトに掲載されました。
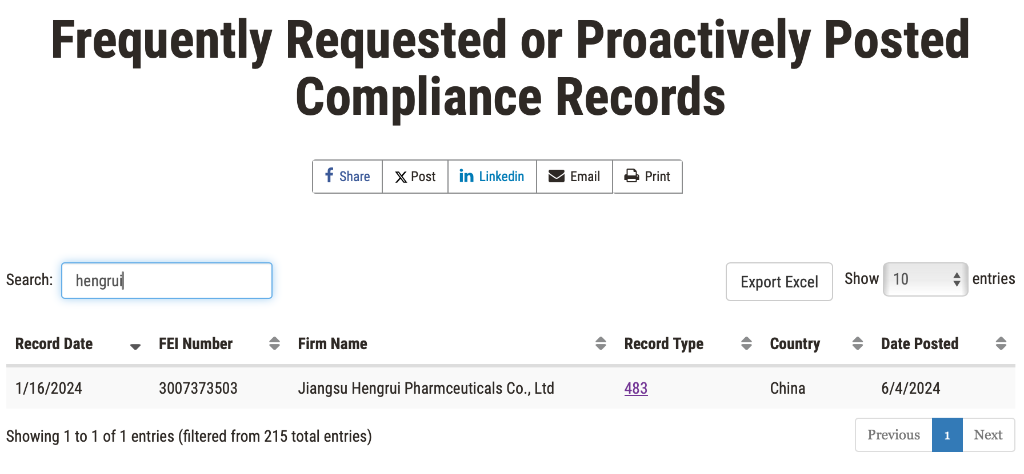
しかしながら、このFORM 483はもはや単純な第一段階の483ではありません。FDAのウェブサイトのデータベースによると、恒瑞のこの現地検査は、第二段階のOAI(Official Action Indicated)段階に入ったことが発見されました。これは、FDAが企業の初期回答と修正措置をレビューした後、正式な監督決定を下したということを意味します。
これは医薬品製造現場検査にとっては、重大な段階に入ったことを意味します。
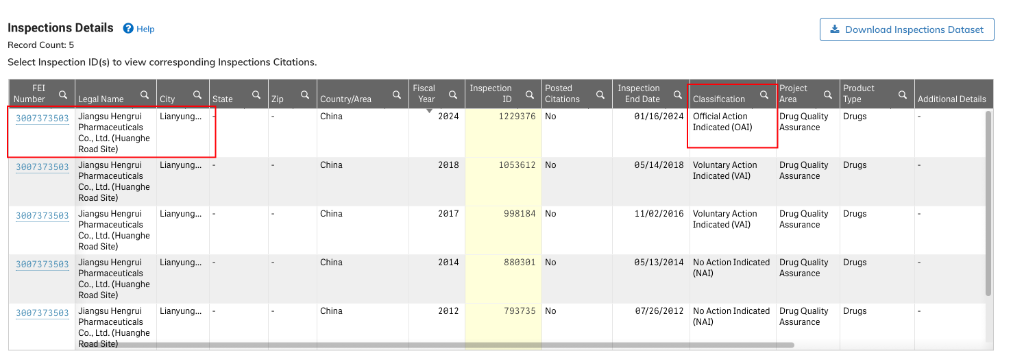
理論上は、恒瑞はOAIに対して返答や改善措置を提出するために、15日間の猶予期間があります。
「FORM 483」とは何ですか、また、「OAI」とは何を意味するのですか?
FDAフォーム483
FDAフォーム483、または「検査観察表」とは、米国食品医薬品局(FDA)が薬剤、医療機器、食品などの企業に対して検査を行い、その企業がFDA法令に違反していることを発見した場合、検査官がこれらの観察結果を記録するために使用するフォームです。Form 483の目的は、企業がGMP(良好な製造慣行)またはその他のFDA法令違反行為があることを通知することです。
主な特徴:
最終決定でないこと:Form 483は、プレリミナリーな観察結果であるため、最終的な監督決定を示すものではありません。
- 改善の機会:企業は、Form 483を受け取った後、FDAに回答を提出し、観察結果を説明し、改善計画を提供する機会があります。
- 後続行動:企業の回答と矯正措置がFDAが一層の監督行動を取るかどうかを決めることになります。
- Official Action Indicated(OAI)の意味は何ですか?
Official Action Indicated(OAI)
Official Action Indicated(OAI)は、FDAが企業の回答と改正措置をレビューした後、正式な監督決定を下したことを示すものです。OAIは、FDAが企業の違反行為が重大であり、公式な監督行動を取る必要があると考えていることを示します。
主な特徴:
- 重大な違反:OAIの状態は、企業がForm 483で指摘された問題を十分に解決できず、重大な違反行為があることを示しています。
- 監督行動:OAIは、FDAが警告書、輸入禁止、製品回収、法的訴訟などの様々な監督措置を採る可能性があることを意味します。
- 改善要求:企業は、OAIを受け取った後、通常、より広範な改善を行う必要があり、さらなるFDAの検査に直面する可能性があります。
関連する
Form 483とOAIの関係は以下の通りです:
- 初めに観察:FDA検査官は、企業検査中に問題を発見し、Form 483にこれらの初めに観察した結果を記録します。
- 企業回答:企業は、Form 483を受け取った後、FDAに回答をする機会があり、問題を説明し、改善計画を提供することができます。
- 評価と決定:FDAは、企業の回答と改善策を審査します。FDAが問題が十分に解決されていないと判断した場合、企業の状態をOAIにアップグレードする可能性があります。
- 公式な行動:OAIの状態で、FDAはより厳格な規制措置を取る可能性があり、企業に対して徹底した改革を要求し、FDA法に準拠していることを確認することが必要です。
したがって、恒瑞が1月の現地調査で最初の回答と改正を受け入れられなかったことから、すでに次のOAI段階に入っていると言えます。恒瑞には回答と改善の機会がもう一度ありますが、FDAの認可を得られなかった場合、恒瑞の工場は警告書、輸出禁止などの危機に直面することになります。
医薬品会社の品質管理にとって、これは最も厳しい罰則であり、企業が重視する必要があります。
世界で最も厳格なFDAとして、年間17,000回を超えるアメリカ国内外での現地検査が行われています。FDAの公式データによると、国際的な検査の数は年々増加しており、グローバルなサプライチェーンに対する関心と国際的なコンプライアンスへの重視を示しています。
さらに、最近の数年間でOAI分類検査が増加しており、重大な違反行為の発見が増加していることを示しています。これは、より多くの公式行動が起こる可能性があることを意味しています。
中国の製薬会社は、製造コンプライアンスを持続的に向上させ、競争優位性を維持する必要があります。
以前、Wall Street Journal | Jīan Zhì Researchは、「以药明康徳为代表的中国CXO产能,会被轻易取代吗?」という記事の中で、製造コンプライアンスの重要性に着目しました。インドなどの他の国に比べて、中国は高品質な製造能力のコンプライアンスで先行しています。コンプライアンスを確保することは、現在の国内製薬企業の優位性の一つでもあります。
さらに、市場での偽造に関する見解については、Form 483の具体的な内容から判断すると、企業の問題は偽造とは関係が少なく、主に設備とプロセスのコンプライアンスに集中しています。
具体的には、次のような主な問題があります:無菌保証の詳細な管理と、クリーンバリデーション評価の詳細不十分;文書管理ソフトウェアに欠陥があり、廃棄記録の文書破棄管理が不十分;産業用の個別の補助設備のコンピューターシステムが21CFR Part11の要件を満たしていない;倉庫の空調の故障保守が不十分であった;意図的な検査の遅延。
ただし、恒瑞カリラ珠単抗+アパチニブの双アリの市場での展開に対しては、今回の検査で問題が発生した製造場所との関係はありません。
昨年、Junshi Biosciencesは、PD-1が米国で上場する直前にForm 483を受け取りました。Jiān Zhì Researchは「Junshi PD-1が一歩先に進む」という記事の中でも、その解釈を示しました。当時、会社の協力者は3つの意見を受け取り、第一回FDAへの回答後、FDAが改善計画を承認し、法的措置を取る必要はなかったことが確認され、会社のTolucalipという抗体はその後スムーズに米国で承認を受けました。
したがって、恒瑞が現在OAI段階に入っているとはいえ、会社には引き続き回答と改善の機会があり、恒瑞はこれを受けてさらに反省し、速やかにコンプライアンス回答を行い、原因を内部で調査し、将来的に同様の問題が再発しないようにする必要があります。
附属の全文(翻訳+原文)
監視1
無菌製剤製品の微生物汚染を防止する手順は、無菌及び滅菌工程を適切に検証していない。具体的には:
A) プロダクト接触機器((b)(4)、センドパック、(b)(4))を適切に包装せずに滅菌し、A級プッシュカートからRABS内部に移動した防護策が不足している。クラス(b)(4)の充填室内では、A級エリア(RABSの外側)とB級エリア(部屋の残りの部分)の間に物理的な区切りがありません。エアフローの可視化調査は、A級とB級の過渡を含みませんでした。
B) 米国市場向けの一連の(b)注入剤の観察中に、私たちは定期的な介入操作による栓の追加を観察しました。その開始時刻は午後3時58分で、終了時刻は午後4時03分でしたが、貴社の記録によると、開始時刻と終了時刻は午後4時(16:00)から午後4時01分(16:01)と記録されており、私たちが観察した干渉時間とは著しい差があります。さらに、プロセスPO-101-007「充填ポジション操作プロセス」審査では、2023年11月30日に実施され、干渉開始および終了時間に関するプロセス定義が明確でないことが判明しました。
C) 培養基充填を含む工程の通常の注入操作に関する貴社の工程シミュレーション研究は、現在の商業生産操作を代表することができません。
D) 生産操作員の通常および非常干渉を実行するための再資格認定プロセスが十分でない。培養基充填研究の6つの観察では、多くの操作員が干渉を実行し、一部は数回干渉を実行し、一部は培養基充填研究中に干渉を実行しなかったが、これらのすべての操作員が再認定されました。したがって、すべての商業生産操作に参加する操作員が無菌操作プロセス中に干渉するための資格を持っていることが保証されません。
観察2
容器の密封システムは、医薬品製品の変質または汚染の原因になる可能性のある外部要因から十分に保護できていません。具体的には、
貴社のI(b)注射剤(USP)の容器のシール完全性試験は十分ではありません。テストには、充填されたボトルではなく空のボトルが使用されました。微生物チャレンジ研究には正のコントロールがありません。染料透過研究では、検出限度が指定されず、視覚検査の結果は「未検出」とされました。
観察3
装置や器具は適切に清掃されておらず、医薬品製品の安全性、身元、強度、品質、または純度を変更する可能性がある汚染を防止できません。具体的には、
A) 清掃の検証研究では、すべての機器の最も難しいクリーニング製品の濃度が考慮されていません。さらに、一部の製品の栓の処理には、クリーニング検証のための汚染物質が考慮されていません。
B) 清掃検証の最大サイクルは通常の清掃サイクルよりも必ずしも悪くありません。
C) 生物活性汚染物質(製品)の残留を検出する擦り拭きおよび洗浄サンプルには、「未検出」という結果が含まれていますが、検出限度は報告されていません。
観察4
品質管理部門は、医薬品製品の身元、強度、品質、および純度に影響を与えるすべてのプログラムまたは仕様に承認を与える責任がありません。具体的には、
A) 品質部門は、受制限文件(生産バッチ記録、検証プロトコルおよびレポート、変更管理および標準オペレーティングプロシージャなど)を十分にコントロールしていません。2024年1月8日のチェック中に、私たちはバッチレコード、検証レポート、変更管理の元の実行ページがゴミ箱に投棄されていることを観察しました。これらの元の記録は公式の記録と比較したとき、生産データなどの情報が一致しません。
B) 品質部門は、プロシージャPR-416「バッチレコードの準備、発行、審査およびアーカイブ管理」(2023年6月20日発効)およびQS-001「コントロールドキュメント管理(DMSシステム)」(2023年6月16日発効)に基づいて制御されている主生産バッチレコードを十分にコントロールしていません。検査の過程で、バッチレコードはDMSソフトウェアを介して生産者に署名させられて記録されるようになっており、生産者はバッチレコード上のQRコードをコピーすることができます。例えば、上記のチェックでゴミ箱に捨てられた元の実行/記入されたバッチレコードのページに関する情報を参照してください。
C) 視力検査操作員の公式眼科検査結果は、品質保証部門によって監査および管理されていません。
D) 破棄待ちの注射薬品製品の管理が不十分です。2024年1月8日のチェック中に、私たちは投棄された建物の(b)(4)のドアが開いており、誰もいなかったことを観察しました。この建物は公共の歩道と通りの向かい側にあり、フェンスは約3.5フィートの高さです。貴社によると、フェンスには私人がフェンスを乗り越えることを防ぐための警報装置が取り付けられていますが、私たちの検査の過程では、警報装置が作動していないことが判明しました。
E) データ完全性計画が不十分であり、品質保証部門による色素および非色素電子データ生成のすべての完全性、一貫性、および正確性を保証するために、電子データを総合的に審査する計画がありません。
観察5
承認された検査時に、医薬品生産に関連する保管期間内の記録がすぐに提供されていませんでした。具体的には、
当社はお客様の廃棄ファイルエリアを調査する際、廃棄されたオフィス用品が捨てられている区域に連れて行かれるよう要求しました。その場所まで連れて行かれた時に、少なくとも1人が携帯電話を使用しているのを目撃しました。指示されたタスクを完了した後、建物の外を迂回し、前のドアから会社に入るように案内されました。それにはおよそ4ブロック(約4時間)要しました。施設内の廃棄物容器に向かう途中、女性スタッフが迅速にファイルをごみ箱に捨てているのを目撃し、周りには2〜3人の見物人がいました。そのうちの2人は助手側ドア前に立っていました。見物人のうちの1人が速やかに前から後ろへ手を移動させ、手には文書のようなものがあるように見えました。その後、車の下に約8インチ厚のファイルの束があることに気づきました。これらのファイルの内容は、観察4で説明された内容と一致しています。これらの出来事および文書の内容の審査により、私たちは適時かつ適切に調査を行うことが遅れました。
コンピューターシステムまたは関連システムは、主生産および制御記録または他の記録の変更が認可された者によってのみ行われるよう適切な制御措置を講じていません。具体的には、
A) 貴社のGMP関連のコンピューターシステムおよび装置は、21 CFR Part 11の要件を満たしておらず、各製造ワークショップに散在しています。 例えば:
携帯用の非活性粒子の監視装置は、一般的な注射製造オペレーションの環境監視/クリーンルーム認証アクティビティのサポートに使用され、非活性粒子(NVP)計数を行うために使用されるテストデータを生成します。装置は、タイムスタンプされた監査トレース、データ管理、アラート管理、記録の保管と検索機能がありませんでした。。これらの装置の装置検証アクティビティが貴社によって行われたことを確認できませんでした。
B) 貴社が操作する容器完全性検査装置および一般的な注射製造操作をサポートする完全性検査装置は、タイムスタンプされた監査トレース、データ管理、アラート管理、記録の保管と検索機能がありませんでした。
備蓄品の保管用建物が適切に修理されていませんでした。具体的には、
2024年1月12日に行われた、貴社の倉庫施設(2 - 8℃保管庫)への調査では、床に約100平方フィートの水たまりがあるのを目撃し、既製品注射剤製品のトレイがこの水たまりに直接積まれている状況を確認しました。さらに、また別の冷房コンディショナー付近で第2の水たまりを見つけました。黒カビに似た成長を冷却器の下と周りの床で見つけ、既製品の注射薬から約1フィート以内の位置にあることを確認しました。ここに含まれる医薬品には、米国市場用のバッチ番号(b)(4)の(b)(4)注射液、英国市場用のバッチ番号(b)(4)の(b)(4)注射液、および米国および国際市場に輸出される医薬品が含まれます。
洗面所およびトイレ施設が冷水しかなかった。具体的には、
貴社が行っている無菌注射医薬品の製造に使用される(b)(4)の調査では、D級衣服消毒室に入る前の洗面設備に熱湯または温水がないことが確認できました。さらに、貴社の工場マネージャーが、洗面ステーションにはB級地域やC級地域を含め、工場のどの場所にも熱湯または温水がないことを確認しました。これらの施設は、米国市場向けに製造された無菌注射医薬品の製造に使用されます。
Observation 6
Observation 7
貴社のGMP関連のコンピューターシステムおよび装置は、21 CFR Part 11の要件を満たしておらず、各製造ワークショップに散在しています。 詳しくは、Observation 2を参照してください。
観察 6と観察7については、原文のままです。
調査日:2024年1月8日(月)から2024年1月16日(火)まで。
検査官の署名:Arsen Karapetyan、調査官、DOC。
Qiao Y. Bobo、部門長、CDER / OPQ / OPMA。









