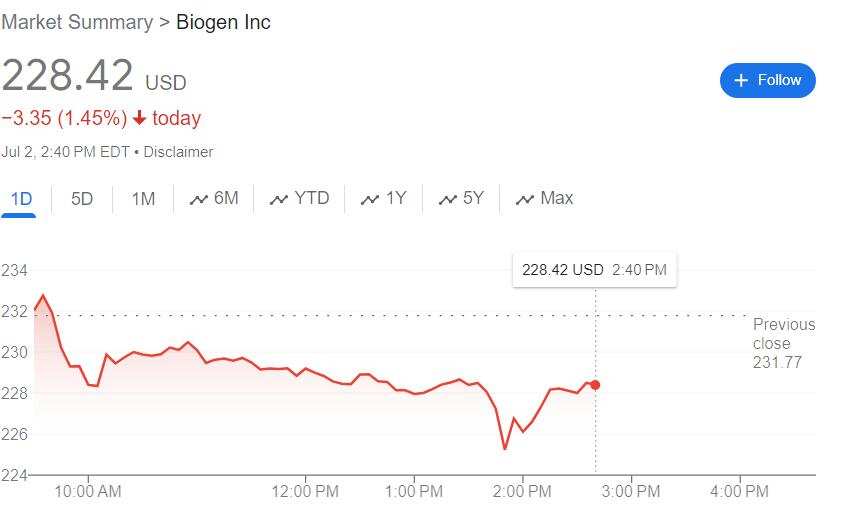
米国FDAは、Kisunlaという商品名で武田薬品工業のdonanemabを米国で販売することを許可し、脳萎縮症の治療薬として市場に参入する。また、米国の競合相手であるLeqembiの開発元であるBiogenは一時的に株価が3%近く下がった。
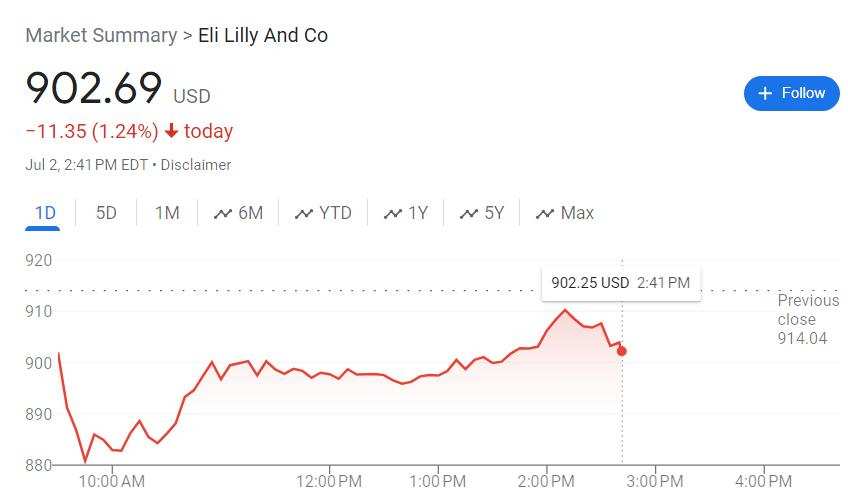
アルツハイマー病の治療に用いる新薬を開発した米国の製薬大手、イーライリリーは、薬の米国内での上市障壁を取り除き、株価の下落幅を大幅に縮小させた。
7月2日の米国株式市場の午前中、イーライリリー(Eli Lilly & Co.)は下落し、一時は3.9%を超えたが、後半には反発し、1%以内まで下落幅を縮小した。この日、米国の監督機関である食品医薬品局(FDA)は、早期アルツハイマー病(AD)の成人患者の治療に使用されるdonanemabの新薬をイーライリリー社に承認した。これにより、イーライリリー社は、Kisunlaという商品名でdonanemabを米国内で販売することができる。この薬は、市場に参入する米国で承認された2番目の脳萎縮症治療薬となる。
午後に入り、FDAは、治療対象である早期アルツハイマー病(AD)の成人患者に有効であると判断してdonanemabを承認した。この承認により、イーライリリーは、Kisunlaという商品名で米国内でdonanemabを販売することができ、米国で承認された2番目の脳萎縮症治療薬となる。
今回のFDAの承認は、大規模な3相二重盲検プラセボ対照試験に基づいている。1736人の早期AD患者が試験に参加し、donanemab/Kisunlaの注射またはプラセボを投与し、最長治療期間は72週間であった。主な結果は、総合的なAD評価スコア(iADRS)評価の最小二乗平均値(LSM)の変化であり、スコアが低いほど損傷が激しくなる。低/中関連病理タウタンパク質tau人口では、76週間時点で、Kisunla治療者のiADRSスコア相対基準値のLSM変化は-6.02であり、プラセボ群では-9.27であった。
Kisunlaは、4週間ごとに投与される単一クローン抗体静脈注射液で、1回あたりの投与量は350mg/20mLである。軽度認知障害(MCI)を有する患者や、軽度認知障害に進行した確認済みのAD患者に適応される。イーライリリーはKisunlaを、1本あたり695.65ドルで価格設定し、治療費用は1年で3.2万ドルとなる。
業界メディアによると、Kisunlaはアミロイド性タンパク質標的治療薬であり、脳内アミロイド斑が除去された場合に投与を中止するという世界初で唯一のエビデンスを持っている。このエビデンスにより、治療費用を削減し、薬剤注射回数を減らすことができる。
Kisunlaの承認は、イーライリリーおよび同社の投資家にとっては大きな勝利であると指摘する業界メディアがある。この薬物は3年以上前に臨床試験でADの治療効果が示されたものであり、以来、投資家たちはそれが市場に出ることを熱望してきたが、監督当局による承認が何度も延期された。この承認は、市場に発売される2番目の脳萎縮症治療薬であることを意味する。
Kisunlaの承認は予期されていたものであり、3週間前の6月10日には、FDAの専門家委員会が、薬の有効性を全票で承認し、ARIAの副作用などの問題についても、薬が患者に有益であると評価した。治療効果データは以下の通りである。76週間の治療により、iADRSが22%、CDR-SB評価が29%、低下が遅らされた。
Kisunlaの承認後、米国で去年初めに市場に導入されたLeqembiとEisai / Biogenが共同開発した薬物と直接競合することになると、一部の業界メディアは報じた。Leqembiも、軽度認知障害や軽度の認知障害があるAD患者に使用される。
Kisunlaの承認が発表されたと同時に、イーライリリーの株価は下落幅を縮小させた一方、Eisai/Biogenは日中安値を更新し、日中の下落幅が2.9%にまで拡大した。