一哥が想定外の問題を引き起こした。 6月のFORM483事件の後、恒瑞には改善の機会が残されています。
恒瑞からの警告状が届きました。生産品質管理に失敗した一哥です。
この警告状は、FDAが2024年1月8日から1月16日までに行われた連雲港経済技術開発区黄河路38号の製剤生産現場検査の結果に対しての追加措置ですが、向かう方向はあまり良くないです。恒瑞にはまだ改善の機会があります。
FDAの現場検査から警告状を受け取ることは何を意味するのですか?
 以前、6月に恒瑞はFORM 483フォームを受け取り、現場検査の第2段階、OAI(Official Action Indicated)段階に入りました。今回の警告状は、前段階の改善がFDAによって完全に承認されなかったことを意味し、より深刻な監督行動の段階に入ります。
以前、6月に恒瑞はFORM 483フォームを受け取り、現場検査の第2段階、OAI(Official Action Indicated)段階に入りました。今回の警告状は、前段階の改善がFDAによって完全に承認されなかったことを意味し、より深刻な監督行動の段階に入ります。
FDA現場検査フローチャート
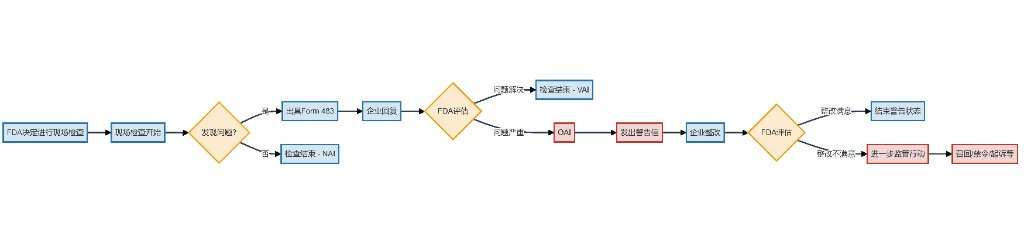 ジャイズリサーチの作図を参照してください
ジャイズリサーチの作図を参照してください
根据《恒瑞的FORM 483,没有那么简单 | 见智研究》一文,恒瑞收到OAI意味着此次检查已经严重阶段,需要引起公司足够重视。
そして最近、警告状を受け取ったことは、医薬品製造現場検査にとっては非常に深刻な事件です。
FDA検査フロー全体を見ると、恒瑞の現場検査は最後の段階に入っています。 15日以内に提出された改善提案が承認される場合、警告状は閉鎖されます。FDAに承認されない場合、より深刻な召回と輸出禁止などの後果が生じます。
FDAはどのような違反行為を発見したのですか?
今回の警告状の核心は2つのポイントに集約されており、直接的な製品品質と安全性に影響を与えるわけではありませんが、無菌区域の汚染防止が不十分である危険性は依然として小さくありません。
1)品質管理部門が文書の監督とコントロールの責務を果たしておらず、製剤の生産がCGMP要件に準拠していないことを確認できませんでした。
2)施設の設計が不十分であり、無菌製品の生産に使用される領域に汚染または混合を防止するための十分な措置がありません。
この検査に関する問題について恒瑞医薬はWSJ Intelligence-Jianzhi Researchに次のように述べています。 会社は常に患者の安全性を最優先に考え、医薬品監督機関による提案に十分な重要性を付けています。 FDAが今回の警告状で提出した改善提言に対応するため、会社は内部・外部の専門家と第三者コンサルタント団体を積極的に組織し、FDAと綿密に連絡を取り合って、できるだけ早く警告状を閉鎖するようにします。 同時に、会社は包括的な調査評価を実施し、今回FDAが警告した問題は医薬品の品質と安全に影響しなかったことを示しました。
今回の警告状に関係する連雲港経済技術開発区黄河路38号の製剤生産現場は、1999年に稼働し、2010年に初めてFDAによる検査を受け、その後2012年、2014年、2016年、2018年にそれぞれGMPの現場検査を受け、5回とも合格し、そのうち2回は欠陥ゼロでした。
今回の検査の生産現場では、12種類の後発医薬品がFDAの承認を受けていますが、これらは恒瑞の主要製品ではありません。 この場所からの2023年の米国市場への輸出品の収入は1240万ドルであり、当社の2023年の売上高の割合の約0.39%を占めます。この場所からの2024年第1四半期の米国市場への輸出収入は393.88万ドル(未審査)であり、当期売上高の約0.47%を占めます。
現在の業績への影響に関して、恒瑞医薬はWSJ Intelligence-Jianzhi Researchに次のように述べています。 今回の警告書は当社の2024年業績に重大な影響を与えるとは思われません。
恒瑞医薬は、中国の9都市に製造拠点を持っており、うち連雲港市にあるのは国際化製剤生産拠点、新医薬産業園、バイオ医薬品製造拠点、原料医薬品製造拠点という4つの製造拠点です。今回の警告書に含まれる現場は、国際化製剤生産拠点の中で最も古く建てられた現場です。
恒瑞医薬はさらに次のように述べています。 今回の警告書は当社の他の製造現場に影響を及ぼすものではありません。現在、当社が米国に輸出している製品に影響はありません。
国内企業の示唆
世界で最も厳格なFDAとして、年間17,000回を超えるアメリカ国内外での現地検査が行われています。FDAの公式データによると、国際的な検査の数は年々増加しており、グローバルなサプライチェーンに対する関心と国際的なコンプライアンスへの重視を示しています。

さらに、最近の数年間でOAI分類検査が増加しており、重大な違反行為の発見が増加していることを示しています。これは、より多くの公式行動が起こる可能性があることを意味しています。
国際旅行が順調に進んでいるため、FDAの現場検査は通常に戻り、新しい国際背景下で、より厳しい傾向があります。 中国の医薬品輸出企業にとって、自社の製品品質にもっと注意を払うだけでなく、目標市場の規制環境の変化にも注目する必要があります。
さらに、数年間使用された製造現場については、中国の医薬品企業も規制要件に沿って評価を進め、生産品質管理を向上させ、監督要件と患者の健康に適合する必要があります。 つまり、合法的な医薬品の生産と患者の治療に対して、医薬品企業にとって同等に重要である。


 此前6月恒瑞已经收到FORM 483表格,进入现场检查的
此前6月恒瑞已经收到FORM 483表格,进入现场检查的