国内のイノベーション薬品産業には、腫瘍標的分野などの"内向き"が長く続いています。現在、政策の明確な指向の下で、創新薬企業が提示する新しいテーマは"あるかどうか"の問題ではなく、"優れているかどうか"の問題になっています。例えば、Apichope Pharmaceuticalsなどの創新薬企業は、リソースを集約し、ある特定の分野で深く取り組むことで、差別化を実現することができます。こうすることで、内向き状態から脱却することができるでしょう。
Apichope Pharmaceuticalsが最新承認を受けた経口小分子GLP-1Rアゴニストを例として、公式発表によると、APH01727は、高活性・高選択性の胰島素様ペプチド-1受容体アゴニスト(GLP-1RA)であり、一日1回の経口小分子GLP-1Rアゴニストを目指して開発され、2型糖尿病、肥満/超重患者の治療に使用されます。
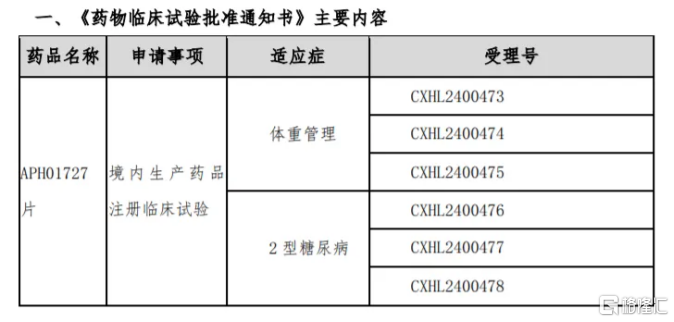
現在、GLP-1薬剤の開発は世界的にも盛んであり、ノボノルディスクのセフトリアキソンのようなヒット商品も存在していますが、APH01727が含まれる経口小分子GLP-1Rアゴニスト路線は、まだ国内外で承認された製品がありません。業界の見方では、大分子GLP-1RAと比較して、経口小分子GLP-1RAは明らかな利点があります。分子量が小さいため、皮下注射を回避でき、服用時に食事や用量に制限されず、患者の服薬順守を大幅に向上させることができます。
免疫チェックポイント阻害剤の開発や腫瘍適応症治療を主力とする他の創新薬企業とは異なり、Apichope Pharmaceuticalsは、痛風領域を主戦場として创新パイプライン戦略を絞り込むことを選択し、他の創新薬企業とは異なる特徴を持ちます。
市場の臨床価値に基づく観点から、世界中で生物学的製剤は痛風領域でまだ開拓段階にあります。現在、世界中の痛風患者数は増加傾向にあり、痛風の治療には長期的な薬剤の投与が必要です。現在の治療法や薬剤のベンチマーク、すなわちアロプリノールやフェブキソスタット等は、効果が限定されている上、薬剤の安全性のリスクが高いため、市場には新しい、安全な治療薬に対する未満足の需要が大きく存在しています。
URAT1抑制剤では、フェブキソスタットのみが国内で承認され、2021年1月22日に多替ノレンが申請されただけです。恒瑞医薬、瑛黎薬業、先声药业、シグナグループ、一品红などの企業が、現在研究の第一線にいます。
ただし、AR882のグローバルな多施設フェーズIIb臨床試験データによると、治療法は既存の療法と比較して劇的な改善が見られ、安全性もよく効果的です。AR882は、痛風患者のsUA値を低下させるだけでなく、痛風石を溶解し、尿酸結晶の負担を軽減し、急性痛風発作の発生率を大幅に低下させます。この製品は、Best-In-Classのポテンシャルを持っています。
AR882は、真の革新的な薬剤であり、尿酸を低下させ、痛風石を溶解する臨床的な成果は米国FDAに高く評価され、2023年の米国風湿病学会(ACR)年次会議や2024年の欧州風湿病学会(EULAR)年次会議で発表され、国際医学界から広く称賛されています。現在、このプロジェクトはグローバルな多施設フェーズIII臨床試験に進んでいます。
予定通り、今年6月、AR882は重要なマイルストーンであるグローバルなキーIII期臨床研究REDUCE 2試験において、最初の患者への投与に成功しました。この重要な進展により、AR882の臨床試験は新しい段階に入っています。REDUCE 2試験は、今年後半に開始される確認研究REDUCE 1と同時に展開されます。これにより、AR882の効果と安全性について、より包括的かつ深い科学的証拠が提供されるようになります。
市場の展望から見ると、中国国内だけでも、Frost&Sullivanによると2030年までに高尿酸血症と痛風の患者数は2.4億人に達し、国内の痛風薬市場は2016年の9億元から2020年に28億元に増加し、2030年には108億元に達すると予想されています。これは一品红にとって、今後さらなる成長空間を開拓する道を開く可能性があることを示しています。
注意すべきは、痛風分野に重点を置くことは、一品红が他のプロジェクトを放棄することを意味するわけではなく、パイプラインの重要なプロジェクトを推進するための方法を重点的に検討することです。上記のGLP-1Rアゴニストの他に、一品红は、高血圧患者向けのタンロドピンオルメサルタンエステル口服錠も開発しており、今年6月に一貫性評価が承認されました。
この薬剤はAR882のグローバル多施設フェーズIII臨床試験に進みます。国内で未承認の原薬剤が入手できない状況下で、この薬剤の販売は中国国内の大きな未満足の需要を満たすことができます。この薬剤はARB(血管紧张素Ⅱ受容体拮抗薬)クラスで、口溶けがよく、降圧作用と心臓および腎臓機能の保護を備えており、高血圧による心臓および脳血管障害のリスクを低減することができます。

