中国薬物臨床試験登録・情報公表プラットフォームの公式ウェブサイトは、最近、gsk plcが中国で未治療のdMMR/MSI-H局所進行直腸癌患者を対象にした2相単独非盲検の臨床研究を開始したことを最新の公示しています。
知通財経アプリによると、中国薬物臨床試験登録・情報公表プラットフォームの公式ウェブサイトは、最近、gsk plc(GSK.US)が中国で未治療のdMMR/MSI-H局所進行直腸癌患者を対象にした2相単独非盲検の臨床研究を開始したことを最新の公示しています。
公開された情報によると、dostarlimabはPD-1に対する抗体であり、今年7月に中国で初めて臨床承認を受けました。GSKは最近、該製品がdMMR/MSI-H局所進行直腸癌の第1治療として行われた2相臨床試験の最新の長期データを発表しました。この研究では、薬剤投与を受けた患者において100%の臨床完全寛解率(cCR)が示されました。今回中国で開始された2相臨床研究は、この適応症に対するものです。
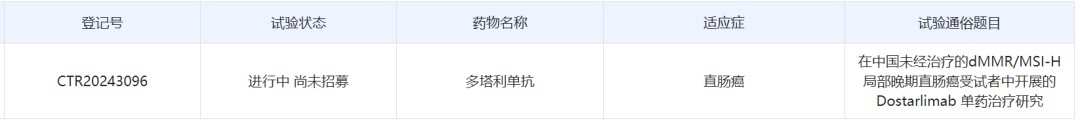
 スクリーンショット提供元: 中国薬物臨床試験登録・情報公表プラットフォームの公式ウェブサイト
スクリーンショット提供元: 中国薬物臨床試験登録・情報公表プラットフォームの公式ウェブサイト
dostarlimabはPD-1阻害抗体であり、PD-1受容体とPD-1リガンドPD-L1およびPD-L2の相互作用を阻害します。この製品は既に多くの適応症でFDAの承認を受けており、dMMR進行期または再発性子宮内膜癌、dMMRまたはMSI-H原発性進行期または再発性子宮内膜癌、およびdMMR再発または進行期の固形腫瘍を含みます。さらに、GSKはこの医薬品の治療潜在性を探るために複数の第3相臨床試験を継続しています。


 截图来源:中国药物临床试验登记与信息公示平台官网
截图来源:中国药物临床试验登记与信息公示平台官网