常習収益をさらに近づけました。
亜盛医薬は、2024年の中間業績報告を2022年8月22日の夜に発表しました。武田の選択権の支払いを確認した後、同社は2009年の設立以来初の利益を2024年上半期に達成しました。
武田との協力による追加のマイルストーン支払いと売上分配に鑑みると、亜盛医薬の通常の利益転換点も間もなく到来する見込みです。
上場以来初めての利益
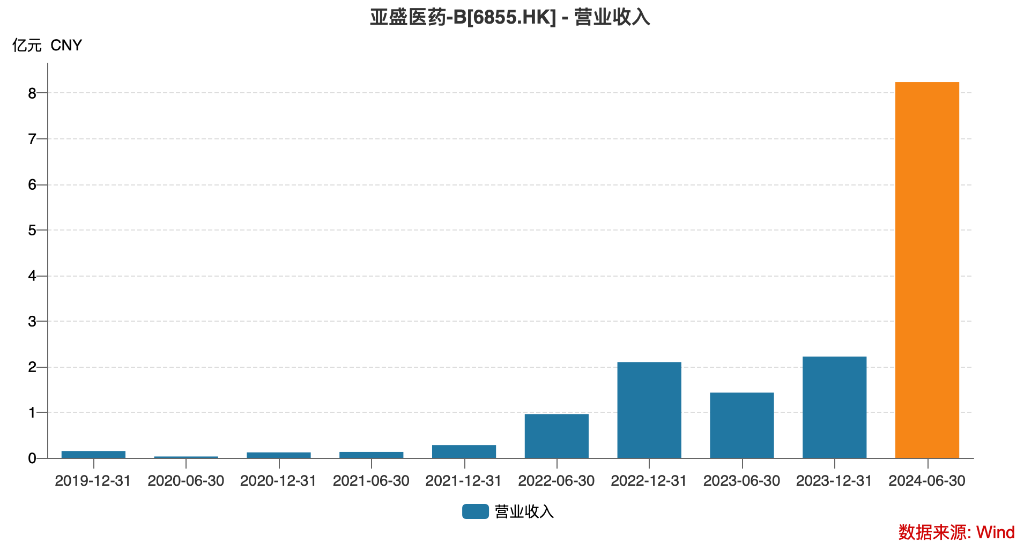
 2024年上半期、亜盛医薬の売上高は8.24億人民元に達し、前年比で477%の増加を記録しました。さらに注目すべきは、同社が初めて損失を利益に転換し、純利益が1.63億人民元に達したことです。
2024年上半期、亜盛医薬の売上高は8.24億人民元に達し、前年比で477%の増加を記録しました。さらに注目すべきは、同社が初めて損失を利益に転換し、純利益が1.63億人民元に達したことです。
1)製品の販売収益の増加
同社の主力製品であるオレバチニブ(商品名:ナルレクス)の販売収入は1.13億人民元に達し、前期比で120%増加し、前年比で5%増加しました。同社は電話会議で、今年の販売収入が50%以上増加すると予想しています。
これは、昨年下半期に医療汚職による影響で売上が低迷していたが、オレバチニブの売上が通常に戻ったことを示しています。ただし、前年比の増加率は限定的であり、新しい適応症が医療保険に含まれた後の増量スピードについては引き続き注視する必要があります。
2)製品のライセンス契約による収益が主な利益源となります。
今年上半期、当社は多国籍製薬企業である武田との間で「ネリディアの独占選択権契約」を締結しました。選択権が行使されると、武田はネリディアの世界的な開発および商業化の権利を獲得しますが、中国本土、香港、マカオ、台湾を除きます。
華爾街見聞・見智研究は以前、「アスセント・ファーマシューティカルズは小規模株主に対する約束を完了」という記事で、この取引の総額は93.6億人民元であり、そのうち7.2億人民元が選択権の支払いであり、残りの86.4億人民元が選択権の行使料および追加のマイルストーン支払いです。また、年間売上高に基づく2桁の増加する売上分配も受け取ります。
アセントファーマシューティカルは、選択権料として7.2億人民元と株式投資の追加支払い5.4億人民元を受け取りました。
ただし、報告書からは、選択権料6.78億人民元が確認されました。

選択権料と株式投資金を受け取った後の2024年6月30日時点の現金資金残高は11.34億人民元であり、2024年7月初旬時点の現金資金残高は18億人民元です。
3)研究開発および販売費用は引き続き増加していますが、現金フローの問題は解決されました。
研究開発費用は臨床試験のさらなる展開により43.4%増加し、2023年の3.10億人民元から4.44億人民元に増加しました。現在の現金残高のみを考慮すると、現在の企業の現金資金は約2.5年の研究開発プロセスをサポートすることができます。

しかし、亜盛は今後2年間で武田から受け取る12億ドルのマイルストーン料金と、進行中の米国IPOを考慮すると、ウォーリングはもはや問題ではありません。特に、会社は電話会議で、予想される米国IPOが今年の終わりまでに完了すると述べています。
亜盛は完全に現金フローの心配から解放されており、今後の製品開発や商業化においてはもはや現金フローのリスクを心配する必要はありません。
2024年上半期、亜盛の販売費用は8960万元で、前年比7.6%増加しました。しかし、オレバチニに比べてわずか5%の売上増加に対して、この費用のコントロールは理想的とは言えませんでした。販売費用は、当期の売上高の80%に達しました。特に、去年末からオレバチニの入院数が79%増加した背景に対して、この比率は特に顕著です。
全体を通して、亜盛は合法的な前提条件を確保しつつ、販売面でより効果的な行動を取る必要があります。

製品ラインに新しい動きがあります、Bcl-xL分解剤
亜盛医薬の主力製品であるオレバチニは、今年、多くの治療ガイドラインで推奨されています。
2024年1月、この薬剤は米国国立がん研究所(NCCN)の慢性骨髄性白血病(CML)治療ガイドラインに追加されました。さらに、レキソフェンは、2024年のCSCO悪性血液腫瘍診療ガイドラインのアップグレード推奨を受け、CML、フィラデルフィア染色体陽性急性リンパ芽球性白血病(Ph+ ALL)の治療をカバーし、多くの1次推奨も追加されました。

海外の重要な臨床試験では、2024年2月、レキソフェンは米国食品医薬品局(FDA)による承認を受けて、以前に治療を受けたCML-CP成人患者のグローバル登録III相臨床試験が開始されました。
これは、Nateraが米国FDAによって承認された最初の登録III相臨床試験であり、アセン製薬と武田との協力関係の重要な一歩でもあります。時間的には、すべての臨床試験が25年末に完了する可能性があり、製品は26年後半にアメリカで市場投入される可能性があります。
さらに、Nateraは今年6月にCDEの臨床試験許可を取得し、全身性治療に失敗したSDH欠損型消化管間質腫瘍(GIST)患者に対するグローバルな登録III相臨床試験を実施しました。
アセン製薬のもう1つの主力製品であるBcl-2選択的阻害剤APG-2575(リサフトクラックス)も、血液腫瘍領域での臨床展開を加速させています。
報告期間中、APG-2575(リサフトクラックス)はCDEの臨床試験許可を取得し、中高リスク骨髄増殖異常症(MDS)患者の新規診断時にアザシチジン(AZA)との併用で行われる登録III相臨床試験を開始しました。これはAPG-2575(リサフトクラックス)による四番目の登録III相臨床試験です。
次に、APG-2575の重要な焦点はまだ外部の許諾ですが、将来的には実質的な進展があることを期待しています。

イノベーションパイプラインに関しては、Nateraは中間報告書で、年末までに最初のBcl-xL降解剤を前臨床開発の候補薬として選定する予定であることを公表しました。これは、APG-1252をベースにして、血小板毒性をさらに制御し、この対象における開発に新たな進展をもたらしました。この措置により、Nateraの将来のパイプラインの潜在能力に対する疑問に力強く対応できます。
Nateraは以前、海外の許諾問題によって市場の懸念を受けましたが、2024年上半期にこの問題が解決し、現金フローの問題はもはや潜在的なリスクではありません。現在の資金および今後の資金の補充により、今後5年間の研究開発および商業化支出をサポートできる見込みです。将来の定期的な利益の観点から見ると、Nateraは投資家を喜ばせる時期を迎えるでしょう。


 2024年上半年,亚盛医药实现营业收入8.24亿元人民币,同比增长477%。更为瞩目的是,公司首次实现扭亏为盈,净利润达1.63亿元人民币。
2024年上半年,亚盛医药实现营业收入8.24亿元人民币,同比增长477%。更为瞩目的是,公司首次实现扭亏为盈,净利润达1.63亿元人民币。