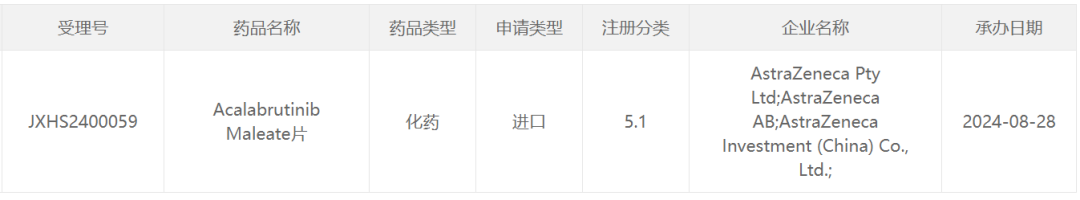
8月28日、中国の国家医薬品監督局(CDE)の公式ウェブサイトによれば、アストラゼネカ(AZN.US)の申請したアカラブルチニブメシル酸塩錠の上市申請が受理されました。
智通财经APPによれば、8月28日、中国の国家医薬品監督局(CDE)の公式ウェブサイトによれば、アストラゼネカ(AZN.US)の申請したアカラブルチニブメシル酸塩錠の上市申請が受理されました。公開されたデータによると、アカラブルチニブ(一般名:アクティノメチンカプセル)は、ブルトン氏酪アミノ酸キナーゼ(BTK)阻害剤であり、既に中国で2つの適応症が承認されています。アストラゼネカの公式ウェブサイトのパイプライン情報に基づくと、このアカラブルチニブの上市申請の新しい適応症は、一次治療の慢性リンパ球性白血病(CLL)である可能性があります。
データによると、アカラブルチニブは新しい世代の高選択性BTK阻害剤であり、BTKと共有結合してその活性を阻害します。B細胞では、BTKシグナルによってB細胞の増殖、輸送、趋化、接着に必要な経路が活性化します。中国では、アカラブルチニブは2023年3月に初めて承認されました。既存の少なくとも1つの治療を受けた成人のマントル細胞リンパ腫(MCL)患者の治療に使用されます。また、2023年9月に第二の適応症が承認され、既存の少なくとも1つの治療を受けた成人の慢性リンパ球性白血病(CLL)/小リンパ球性リンパ腫(SLL)患者に単剤で使用されます。

