11月6日、君実生物医薬(01877)は、シスプラチンに耐性のある再発/転移性鼻咽癌(R/M NPC)患者を対象とした臨床研究──トレプリムマブとジェムシタビンの第一線治療としてのシスプラチンに耐性のR/M NPCの第2相研究の最新データが国際誌『サイトソル医学報告』(Cell Reports Medicine)に掲載されました。
知通財経アプリによると、11月6日、君実生物医薬(01877)は、シスプラチンに耐性のある再発/転移性鼻咽癌(R/M NPC)患者を対象とした臨床研究──トレプリムマブとジェムシタビンの第一線治療としてのシスプラチンに耐性のR/M NPCの第2相研究の最新データが国際誌『サイトソル医学報告』(Cell Reports Medicine)に掲載されました。
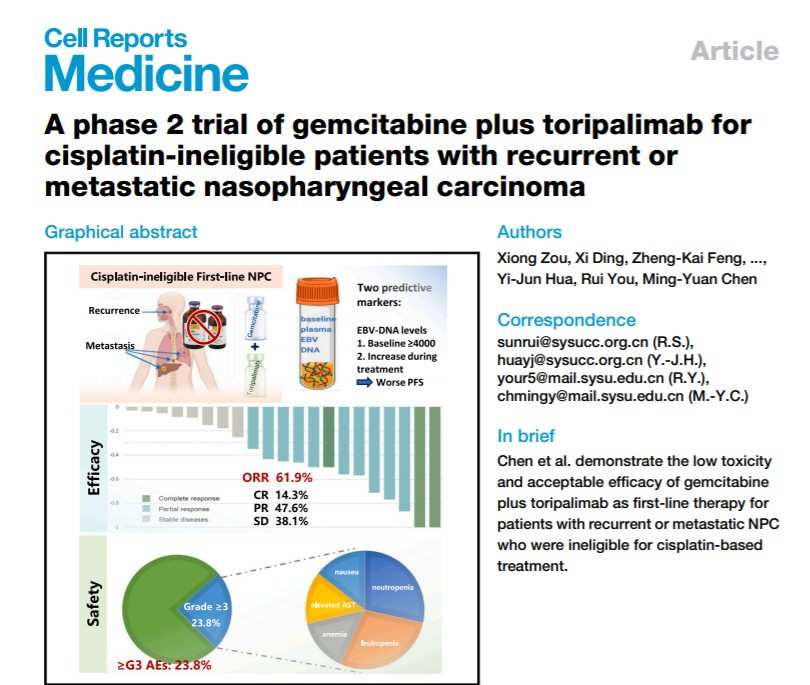
研究結果によると、患者の目的的緩和率(ORR)は61.9%、疾患管理率(DCR)は100%、中央無増進生存期(PFS)は11.8ヶ月であり、毒性は標準のプラチナ含有治療と比較して著しく低下し、患者の23.8%だけが≥3度の有害事象(AE)を経験しました。君実生物のプレスリリースによると、この治療法はR/M NPCに対するシスプラチンの耐性患者に治療効果と安全性の包括的な最適化と向上をもたらしました。
 トレプリムマブを代表とする抗PD-1モノクローナル抗体とジェムシタビン+シスプラチン(GP)治療法は、R/M NPC患者の第一線標準治療法となっています。しかし、シスプラチンの毒性は大きく、一部の患者は腎機能の損傷、体力状態の悪化、聴覚障害、心不全などの理由でシスプラチン治療に耐えられません。トレプリムマブは中国、米国、欧州連合でR/M NPC治療に承認されており、長期効果と低毒性の特徴を考慮して、この研究はトレプリムマブと低毒性の化学療法薬(ジェムシタビン)の併用が、療効を低下させることなく安全性を向上し、最終的にはプラチナを除去する目的を達成する可能性があると仮定しています。
トレプリムマブを代表とする抗PD-1モノクローナル抗体とジェムシタビン+シスプラチン(GP)治療法は、R/M NPC患者の第一線標準治療法となっています。しかし、シスプラチンの毒性は大きく、一部の患者は腎機能の損傷、体力状態の悪化、聴覚障害、心不全などの理由でシスプラチン治療に耐えられません。トレプリムマブは中国、米国、欧州連合でR/M NPC治療に承認されており、長期効果と低毒性の特徴を考慮して、この研究はトレプリムマブと低毒性の化学療法薬(ジェムシタビン)の併用が、療効を低下させることなく安全性を向上し、最終的にはプラチナを除去する目的を達成する可能性があると仮定しています。


 以特瑞普利单抗为代表的抗PD-1单抗联合吉西他滨+顺铂(GP)方案已成为R/M NPC患者的一线标准治疗方案。然而顺铂毒性较大,存在部分患者由于肾功能受损、体力状况较差、听力丧失或心力衰竭等原因无法耐受顺铂治疗。特瑞普利单抗已经相继在中国、美国、欧盟获批用于治疗R/M NPC。考虑到长期疗效和低毒性特征,本研究假设特瑞普利单抗联合毒性较小的化疗药物(吉西他滨)有望在不降低疗效的前提下提高安全性,最终达到去铂目的。
以特瑞普利单抗为代表的抗PD-1单抗联合吉西他滨+顺铂(GP)方案已成为R/M NPC患者的一线标准治疗方案。然而顺铂毒性较大,存在部分患者由于肾功能受损、体力状况较差、听力丧失或心力衰竭等原因无法耐受顺铂治疗。特瑞普利单抗已经相继在中国、美国、欧盟获批用于治疗R/M NPC。考虑到长期疗效和低毒性特征,本研究假设特瑞普利单抗联合毒性较小的化疗药物(吉西他滨)有望在不降低疗效的前提下提高安全性,最终达到去铂目的。