中国国家医薬品監督管理局医薬品審評中心(CDE)の最新の公示によると、翰森製薬(03692)の第三世代EGFR-TKI新薬である甲磺酸アメタニブ錠の新たな適応症上市申請が受理されました。
智通財経APPの報道によると、11月27日、中国国家医薬品監督管理局医薬品審評中心(CDE)の最新の公示によると、翰森製薬(03692)の第三世代EGFR-TKI新薬である甲磺酸アメタニブ錠の新たな適応症上市申請が受理されました。公開されている資料によれば、これはアメタニブ錠が中国で提出した5つ目の適応症上市申請となります。
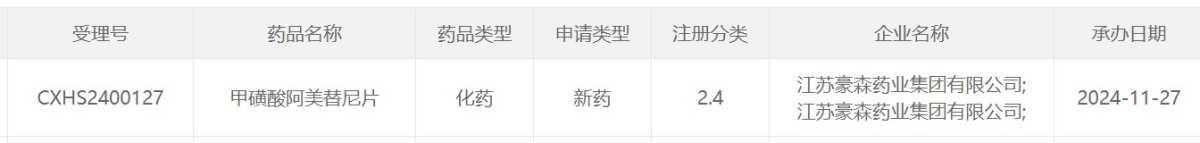
スクリーンショット出典: CDE公式ウェブサイト
 今年の10月22日、翰森製薬は、アメタニブ錠と化学療法を組み合わせた局所進行(IIIB-IIIC期)または転移性(IV期)EGFR変異非小細胞肺癌(NSCLC)患者の一線治療としての第3期登録試験AENEAS2が主要なエンドポイントである無進行生存期間(PFS)に達したと発表しました。翰森製薬は、この試験の詳細なデータは今後の医学会議で発表され、規制機関に提出されると述べました。これにより、今回のアメタニブの上市に向けた適応症になると推測されます。
今年の10月22日、翰森製薬は、アメタニブ錠と化学療法を組み合わせた局所進行(IIIB-IIIC期)または転移性(IV期)EGFR変異非小細胞肺癌(NSCLC)患者の一線治療としての第3期登録試験AENEAS2が主要なエンドポイントである無進行生存期間(PFS)に達したと発表しました。翰森製薬は、この試験の詳細なデータは今後の医学会議で発表され、規制機関に提出されると述べました。これにより、今回のアメタニブの上市に向けた適応症になると推測されます。


 今年10月22日,翰森制药宣布,一项阿美替尼片联合化疗作为局部晚期(IIIB-IIIC期)或转移性(IV期)EGFR突变非小细胞肺癌(NSCLC)患者的一线治疗方案的3期注册试验AENEAS2达到了其主要终点即无进展生存期(PFS)。翰森制药表示该试验的详细数据将在未来医学会议上发布及向监管机构递交。由此推测,这可能为本次阿美替尼申报上市的适应症。
今年10月22日,翰森制药宣布,一项阿美替尼片联合化疗作为局部晚期(IIIB-IIIC期)或转移性(IV期)EGFR突变非小细胞肺癌(NSCLC)患者的一线治疗方案的3期注册试验AENEAS2达到了其主要终点即无进展生存期(PFS)。翰森制药表示该试验的详细数据将在未来医学会议上发布及向监管机构递交。由此推测,这可能为本次阿美替尼申报上市的适应症。