8月27日,雲頂新耀-B(01952)2024年中報業績新鮮出爐。業績顯示,公司當期營業收入達到3.02億元(人民幣,單位下同),同比大幅增長3289.74%。
8月27日,雲頂新耀-B(01952)2024年中報業績新鮮出爐。業績顯示,公司當期營業收入達到3.02億元(人民幣,單位下同),同比大幅增長3289.74%。
作爲一個內在價值正在被業績持續驗證的優質標的,雲頂新耀商業化能力不斷提升,得益於公司「自主研發+授權引進」的雙輪驅動注入了澎湃動力,推動公司從患者的臨床實際需求出發,「內外兼修」全面加速自主研發與源頭創新。
 在美股市場指數大跌和A股紅利賽道轉換需求的背景下,港股市場顯示出賺錢效應,特別是經過連續三年深度調整的港股醫藥板塊,成爲投資者尋找高彈性投資目標的主要選擇。
在美股市場指數大跌和A股紅利賽道轉換需求的背景下,港股市場顯示出賺錢效應,特別是經過連續三年深度調整的港股醫藥板塊,成爲投資者尋找高彈性投資目標的主要選擇。
港股通資金流向成爲投資者挑選優質投資對象的重要指標。智通財經APP數據顯示,雲頂新耀自去年以來受到港股通資金顯著增持,當前持股比例高達38.32%,反映出市場對它的高度認可。
在投資風向標指引下,透過此次業績數據看雲頂新耀在產品商業化及研發層面具體表現,能讓投資者對公司「自主研發+授權引進」的雙輪引擎的內在價值有更清晰的認知。
強勁基本面落地或引市場搶籌
雖然今年上半年外部環境存在諸多不確定因素,恒生香港上市生物科技指數更是在期內下跌了近30%,但云頂新耀依舊保持了高增長態勢,通過良好的業績驗證其「自主研發+授權引進」策略的確定性,顯示出了極強的內生增長能力和抗風險能力。
報告期內,公司實現營業收入約3.02億元,較去年同期大幅增長約3289.74%。業績持續攀升,其背後體現的是雲頂新耀「自主研發+授權引進」的雙輪驅動策略的確定性,也在說明公司商業洞見價值正持續兌現。
與此同時,公司運營費用佔當期收入比重,環比降幅達到249%。從盈利角度來看,剔除無形資產攤銷情況下,公司毛利率已高達83.0%。報告期內,在不包括無形資產減值虧損情況下,公司淨虧損進一步大幅收窄25.70%至2.76億元,在持續的規模商業化變現情況下,公司距離盈虧平衡點僅剩一步之遙。在逐步踏上規模盈利的同時,雲頂新耀也擁有充足的「現金彈藥」。報告期內,公司現金儲備19.3億元。
此次業績的關鍵財務數據顯示出,雲頂新耀已形成一個擁有穩健支撐的強勁基本面,且公司基本面形態符合當前港股生物醫藥的投資邏輯。值得一提的是,不論是券商還是機構的持倉席位都已高度集中,截至目前公司券商持股佔比甚至已高達98.62%。這意味着,隨着此次公司中報披露的強勁基本面落地,引發市場上多頭搶籌,進而快速拉升股價。
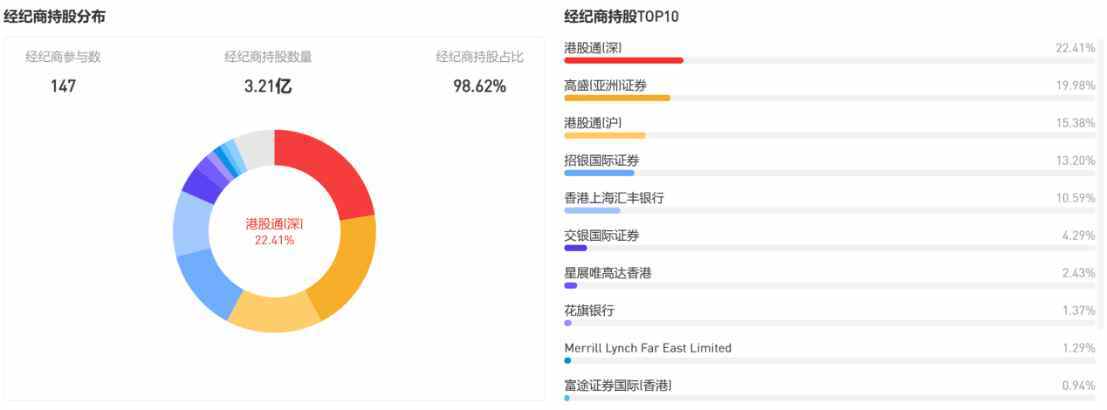
資料來源:富途牛牛
「雙輪驅動」下,商業洞見價值正持續兌現
在「自主研發+授權引進」雙輪驅動策略下,雲頂新耀瞄準高潛力、低競爭賽道,快速實現了差異化創新成果的商業化高效轉化。其背後體現的便是雲頂新耀獨特的商業洞見價值。如今,隨着公司創新產品管線規模商業化逐步推進,這一價值也在持續得到兌現。
雲頂新耀的商業洞見價值主要體現在,與同業公司動輒上千萬首付款重金授權引進的策略不同,公司幾乎所有Licence-in管線均以較低代價和較早階段引進,保證了未來較大的商業化空間。
以核心品種耐賦康爲例,2019年6月雲頂新耀從Calliditas引入耐賦康,之所以選擇這一品種,在於公司當時敏銳洞察到了中美IgA腎病患者巨大的數量差異,相較美國在該適應症上只有7-8萬患者的規模,中國卻有400-500萬患者潛在未滿足治療需求。
也正是在雲頂新耀的積極推動下,耐賦康成爲全球首款實現商業化的IgA腎病對因治療創新藥。從商業化進度來看,今年3月,基於耐賦康獲得了新適應症的完全批准,美國FDA授予其爲期七年的額外孤兒藥獨佔期至2030年12月;在亞洲地區,該藥已在中國內地、中國澳門、中國香港和新加坡獲批上市。值得一提的是,今年5月,耐賦康在中國首張處方成功落地,標誌着這款全球首個IgA腎病對因治療藥物開始正式惠及中國內地患者。
而在抗生素領域,雲頂新耀此前也以較低代價引入核心品種依嘉(依拉環素),源於公司洞察抗生素用量約佔世界的一半的中國擁有極大的抗多重耐藥性細菌藥物市場,相較與歐美有更大的新型抗生素需求。據智通財經APP了解,此次報告期內,依嘉已完成第一個完整銷售年度,增長勢頭保持強勁。另外,今年1月依嘉正式獲批臨床折點在中國臨床的使用,有望在後續惠及更廣大的患者。
上述兩款核心品種從License-in到順利商業化上市再到實現規模銷售,均顯現出公司在授權引進方面獨特的商業洞見價值,隨着公司授權引進業務上的持續推進,其後續管線產品如伊曲莫德(VELSIPITY,etrasimod)、他尼硼巴坦和Zetomipzomib(澤託佐米)還將繼續驗證雲頂新耀的市場洞見價值。
以伊曲莫德爲例,作爲雲頂新耀在自身免疫性疾病管線中的重磅產品,其早在2027年便以早期管線產品的形式被雲頂新耀引入。作爲一款選擇性鞘氨醇-1-磷酸(S1P)受體調節劑,伊曲莫德主要針對潰瘍性結腸炎(UC)與其他自身免疫疾病。
從市場需求來看,預計到2030年,中國的潰瘍性結腸炎患者人數預計將達到約100萬人,超過2019年患者人數的一倍以上,存在迫切且巨大的未被滿足的臨床需求,預期銷售峯值將達到20億元。正因如此,伊曲莫德大概率會成爲雲頂新耀產品線中的重要一極。今年5月,該藥的NDA已在中國澳門獲批,並預計2024年下半年在中國大陸提交NDA。
構建研產銷一體化優勢,打造雙輪驅動新引擎
作爲國內創新藥領域的頭部企業,雲頂新耀之所以能逆市實現對同行的「彎道超車」,堅持「自主研發+授權引進」策略,構建自有的研產銷一體化體系是關鍵性因素之一。
不同於同賽道企業專注「License-in」模式的道路,當前雲頂新耀已經補上自主研發的「短板」,通過構建屬於自身的研產銷體系化閉環,逐步成爲一家從源頭自研到臨床再到商業化的Biopharma。
以新一代共價可逆的BTK抑制劑EVER001爲例,作爲雲頂新耀創新自研管線中的重磅產品,EVER001是一款有效的共價可逆BTK抑制劑,適用於自身免疫性腎臟疾病。臨床結果顯示,與共價和不可逆BTK抑制劑相比, EVER001在保持高效的同時具有高選擇性,具有潛在更優的治療優勢。
從市場角度來看,目前中國有約200萬原發性膜性腎病患者,且其中超過30%的患者對目前的標準治療沒有應答,約30%達到緩解的患者會復發。但由於目前的標準治療有較大的副作用, 需要更安全的治療藥物,因而該適應症市場存在龐大的未滿足治療需求,在此市場背景下,EVER001有望爲市場提供更佳的治療選擇。
除了EVER001,在雲頂新耀創新自研板塊中,通過完全整合且經過臨床驗證並具備端到端一站式服務價值mRNA平台同樣值得投資者關注。智通財經APP了解到,經歷了短短三年時間,雲頂已成功將經臨床驗證的mRNA平台本地化,並建立了內部端到端能力來開發及製造mRNA治療性藥物。
腫瘤疫苗等治療性疫苗目前是雲頂自主研發的核心領域,2024年,公司有4款癌症疫苗項目正在開發中,預計首個mRNA個性化腫瘤疫苗EVM16將在2024年下半年正式進入臨床開發階段。臨床前數據證明了EVM16疫苗與PD-1抗體聯用後的協同抗腫瘤效果,支持個性化腫瘤疫苗與免疫檢查點抑制劑在臨床中的聯用。目前EVM16已在中國兩家頂級腫瘤醫院啓動研究者發起的臨床試驗項目。
此外,雲頂新耀也在研發其他腫瘤疫苗,包括腫瘤相關抗原(TAA)疫苗、免疫調節腫瘤疫苗,前者預計2025年初於美國遞交IND申請,而後者則預計2025年遞交IND申請。同時,公司還在開展基於mRNA的in vivo CAR-T項目,可用於治療腫瘤和自身免疫性疾病,其也將在今年Q4季度達到臨床前概念驗證。
在產能和質量管理體系建設方面,雲頂新耀的mRNA產業化基地投資規模超過9億元,擁有符合全球GMP標準認證的全套先進生產設施和完善質量保障體系,mRNA疫苗年產能達7億劑。
而在銷售方面,雲頂新耀正在圍繞現有商業化產品構建完備的自有銷售體系。例如,圍繞耐賦康,雲頂新耀已基本完成銷售團隊的搭建,由100多名專業銷售代表組成的銷售團隊將覆蓋全國400至600家核心醫院,佔國內IgA腎病患者群體的60%以上。公司還計劃於今年年底前將耐賦康銷售團隊擴大至約150名。
銷售團隊的核心構建是雲頂新耀自我「輸血」的關鍵,其豐富的市場經驗和廣泛的銷售網絡,無疑將助力公司後續每一款產品的成功上市。
結語
全球生物醫藥行業的融資預期因聯儲局減息預期波動而下降,融資寒冬的改善時間尚不確定。儘管如此,雲頂新耀仍能快速推進自主研發和核心產品商業化。在充足現金流的支持下,公司有望利用其強大的授權引進和市場BD能力,以及持續完善的研產銷創新閉環,在全球研發和商業化競爭中釋放價值,加速估值增長。

 在美股市场指数大跌和A股红利赛道转换需求的背景下,港股市场显示出赚钱效应,特别是经过连续三年深度调整的港股医药板块,成为投资者寻找高弹性投资目标的主要选择。
在美股市场指数大跌和A股红利赛道转换需求的背景下,港股市场显示出赚钱效应,特别是经过连续三年深度调整的港股医药板块,成为投资者寻找高弹性投资目标的主要选择。