Biohaven Ltd. (NYSE:BHVN) (Biohaven or the Company), today announced positive topline results from pivotal Study BHV4157-206-RWE (NCT06529146) demonstrating the efficacy of troriluzole on the mean change from baseline in the f-SARA after 3 years of treatment. The study achieved the primary endpoint and showed statistically significant improvements on the f-SARA at years 1 and 2 (Figure 1). SCA is a rare, progressively debilitating neurodegenerative disease that affects approximately 15,000 people in the United States and 24,000 in Europe and the United Kingdom. There are no FDA approved treatments for SCA.
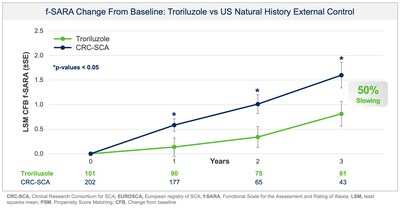
Collectively, data across multiple analyses demonstrate a robust and clinically meaningful slowing of disease progression in SCA patients. These treatment benefits translate into a 50-70% slower rate of decline compared to untreated patients, representing 1.5-2.2 years delay in disease progression over the 3-year study period. Additionally, in a responder sensitivity analysis, disease progression when defined by a 2 point or greater worsening on the f-SARA at 3 years showed an odds ratio (OR) of 4.1 (95% CI: 2.1, 8.1) for the untreated external control arm versus troriluzole treated subjects (p < 0.0001; pooled analysis).
 Dr. Susan Perlman, Director of Ataxia Clinic and Neurogenetics Clinical Trials at the David Geffen School of Medicine at UCLA stated, "SCA is a debilitating, relentlessly progressive disease that destroys quality of life, leaving patients unable to care for themselves, walk, or speak. Troriluzole is the very first treatment to show a delay in disease progression that can give patients additional years of independence, where they can walk without assistance, continue to work, play with their children, and participate in daily activities. This is an exciting and hopeful moment for the SCA community."
Dr. Susan Perlman, Director of Ataxia Clinic and Neurogenetics Clinical Trials at the David Geffen School of Medicine at UCLA stated, "SCA is a debilitating, relentlessly progressive disease that destroys quality of life, leaving patients unable to care for themselves, walk, or speak. Troriluzole is the very first treatment to show a delay in disease progression that can give patients additional years of independence, where they can walk without assistance, continue to work, play with their children, and participate in daily activities. This is an exciting and hopeful moment for the SCA community."
Study BHV4157-206-RWE was designed, in discussion with the US Food and Drug Administration (FDA), to assess the effectiveness of troriluzole in SCA after 3 years of treatment as measured by the change from baseline in the f-SARA. The study utilized Phase 3 data and an external control of matched, untreated SCA subjects from the US Clinical Research Consortium for the Study of Cerebellar Ataxia (CRC-SCA) in accordance with FDA's Guidance on Real-World Evidence (RWE) of effectiveness. All endpoints were prespecified, and both the study protocol and statistical analysis plan were submitted to, and reviewed by, FDA prior to topline data analysis. The new analysis doubled the previously available 3 year data with 63 subjects now completing 3 years of treatment with troriluzole and matched to the external control arm. Propensity Score Matching (PSM) was used to ensure that untreated patients from the CRC-SCA study were rigorously matched to treated patients from Study BHV4157-206 on baseline characteristics. The primary objective was to examine the treatment effects of troriluzole for up to 3 years, by comparing data on the f-SARA from patients treated with troriluzole in Study BHV4157-206 to untreated patients from the natural history study. Troriluzole-treated patients demonstrated statistically significant and sustained benefits at years 1, 2 and 3 on the f-SARA compared to a rigorously matched natural history control.
Additionally, prespecified analyses in the protocol employed a separate, independent natural history control from the European SCA natural history study (EUROSCA) for global regulatory purposes. Results using the EUROSCA patients, in addition to a pooled analysis using both CRC-SCA and EUROSCA patients, as the external controls were also statistically significant and consistent with the primary efficacy analysis at all timepoints (see Figure 2 and Figure 3). The addition of EUROSCA data increased the external control sample size and added to the robustness of the statistically significant treatment differences at years 1, 2, and 3, favoring troriluzole.
Jeremy Schmahmann, M.D., Professor of Neurology at Harvard Medical School and Founding Director of the Ataxia Center at Massachusetts General Hospital commented, "The stabilization of SCA symptoms as reflected by the topline data at 3 years along with the previously reported reductions in falls show the therapeutic potential of troriluzole. I cannot underscore enough the impact of a potential treatment that can slow SCA disease progression and the effect on patients and caregivers who have helplessly watched generations of family members deteriorate and die from SCA. These new data provide support for troriluzole as a safe and effective once daily treatment for patients with SCA."
Spinocerebellar ataxia is a group of dominantly inherited neurodegenerative disorders characterized by progressive loss of voluntary motor control and atrophy of the cerebellum, brainstem and spinal cord. Patients experience significant morbidity, including progression to a wheelchair, impaired gait leading to falls, inability to communicate due to speech impairment, difficulty swallowing, and premature death. While signs and symptoms can appear anytime from childhood to late adulthood, SCA typically presents in early adulthood and progresses over a number of years. Currently, there are no FDA-approved treatments and no cure for SCA.
Vlad Coric, M.D., Chief Executive Officer and Chairman of Biohaven stated, "Advancing new therapies for patients with rare diseases is often a multiyear process of collaboration across academic, patient advocacy, regulatory and industry partners. The Biohaven team has always been committed to rigorously following the science in this area, and through our partnership with the National Ataxia Foundation and collaboration with leading SCA experts across the globe, our SCA development program has provided the first evidence of a clinically meaningful treatment benefit as well as slowing disease progression in SCA patients. We were excited to receive the positive topline results from Study BHV4157-206-RWE, which was designed with FDA input and pursuant to the principles outlined in the FDA's guidance for the use of real-world evidence. The need for treatments for this deadly neurodegenerative disease is urgent. As a company, we remain committed to developing novel therapies for patients living with rare disorders with no approved therapies, like SCA. We look forward to interacting with regulatory agencies to bring troriluzole to patients with SCA."
Andrew Rosen, Chief Executive Officer of the National Ataxia Foundation (NAF), shared, "Biohaven was the first company to join NAF's Drug Development Collaborative (DDC), a group of pharmaceutical companies dedicated to bringing together advocates, clinicians, regulatory agencies, and the patient community to advance research and facilitate the development of therapies for ataxia. Today's topline results are the culmination of years dedicated to studying troriluzole as a treatment for SCA. Patients and families have been waiting for decades for a treatment that could slow disease progression in this devastating and relentlessly progressive disorder".
Based upon the topline data from Study BHV4157-206-RWE, and previous safety and efficacy data from the troriluzole development program in SCA, Biohaven plans to submit a New Drug Application (NDA) to the FDA in Q4 2024. The troriluzole development program has generated the largest clinical trial dataset in SCA and now has follow-up in some patients treated with troriluzole for over 5 years. Biohaven has previously received both Fast-Track and Orphan drug designation (ODD) from the FDA, and ODD from the European Medicines Agency, for troriluzole in SCA. An NDA with ODD is eligible for priority FDA review. Biohaven will be prepared to commercialize SCA in the US in 2025, if ultimately approved, based on potential priority review timelines.
バイオヘブン株式会社(nyse:BHVN)(バイオヘブンまたは同社)は、本日、スタディBHV4157-206-RWE(NCT06529146)からの主要なトップライン結果を発表し、3年間の治療後の基準線からのf-SARAにおけるトリリュゾールの有効性を示しました。この研究は主要エンドポイントを達成し、年1および2のf-SARAにおいて統計的に有意な改善が示されました(図1)。SCAは、米国で約15,000人、ヨーロッパとイギリスで約24,000人に影響を与える希少で徐々に悪化する神経変性疾患です。SCAにはFDAの承認を受けた治療法がありません。

複数の分析データが集合的に、SCA患者の病気の進行が劇的かつ臨床的に有意であることを示しています。これらの治療上の利益は、未治療の患者と比較して病気の進行が50〜70%遅くなり、3年間の研究期間中に病気の進行が1.5〜2.2年遅れることを表しています。さらに、応答者感受性解析では、f-SARAでの3年後の2点以上の悪化による病気の進行について、未治療の対照群とトリリュゾール治療対象者のオッズ比(OR)が4.1(95%CI:2.1、8.1)であり(p<0.0001;総合分析)。
 「SCAは、QOLを破壊し、患者が自分自身のケア、歩行、話すことができないようにする、惨めな進行性疾患です。トリリュゾールは、患者に独立した追加の年を与え、支援なしで歩行し、仕事を続け、子供たちと遊び、日常活動に参加できる唯一の治療法です。SCAコミュニティにとって、これは興奮し希望に満ちた瞬間です。」
「SCAは、QOLを破壊し、患者が自分自身のケア、歩行、話すことができないようにする、惨めな進行性疾患です。トリリュゾールは、患者に独立した追加の年を与え、支援なしで歩行し、仕事を続け、子供たちと遊び、日常活動に参加できる唯一の治療法です。SCAコミュニティにとって、これは興奮し希望に満ちた瞬間です。」
スタディBHV4157-206-RWEは、米国食品医薬品局(FDA)との協議のもと、f-SARAでの基準線からの3年間のトリリュゾールの有効性評価を目的として設計されました。この研究は、効果の実証にFDAの助言書である実世界証拠(RWE)に関するガイダンスに従って、「小脳運動失調症(CRC-SCA)研究の米国臨床研究連合会」から一致した未治療のSCA患者を外部対照として使用しました。すべてのエンドポイントは事前に指定され、研究プロトコルおよび統計解析計画は、トップラインデータ分析の前にFDAに提出および審査されました。新しい分析では、以前に利用可能だった3年間のデータが倍増し、現在63人の患者がトリリュゾールの治療を3年間受けた結果が外部対照群と一致しました。Suite Score Matching(PSM)を使用して、CRC-SCA研究からの未治療患者が、基準線特性に厳格に一致するように保証されました。主要な目的は、スタディBHV4157-206でトリリュゾールを最大3年間使用した際の治療効果を、自然経過研究における未治療患者と比較することでした。トリリュゾール治療患者は、基準線から1、2、3年目のf-SARAにおいて、自然経過コントロールと統計的に有意で持続的な利益を示しました。
さらに、プロトコルで事前に定義された分析は、グローバルな規制目的のためにヨーロッパSCA自然歴研究(EUROSCA)から独立した自然歴コントロールを使用しました。 EUROSCA患者を使用した結果は、CRC-SCA患者とEUROSCA患者の両方を使用した合同分析を追加した結果、全ての時間点で主要な有効性分析と一貫性があり、統計的に有意でした(図2および図3を参照)。 EUROSCAデータの追加により、外部コントロールサンプルサイズが増加し、1年、2年、および3年での統計的に有意な治療差が強化されました。
ハーバード医学部の神経病学の教授であり、マサチューセッツ総合病院の運動失調センターの創設者であるジェレミー・シュマーマン博士は、「3年後のトップラインデータに反映されるSCA症状の安定化と以前に報告された転倒の減少は、トリルズオールの治療的潜在性を示しています。 SCA疾患の進行を遅らせる可能性のある治療の影響は、世代を超えて家族がSCAで衰弱し死亡するのを見守るしかない患者や介護者にどのくらい大きいかを強調することはできません。 これらの新しいデータは、SCA患者にとって安全で有効な1日1回の投与薬としてトリルズオールをサポートしています。
スピノセレベラ運動失調は、進行性の自発運動制御の喪失および小脳、脳幹、脊髄の萎縮を特徴とする優性遺伝性の神経変性障害群です。 患者は、車椅子への進行、転倒を引き起こす歩行障害、言語障害による意思疎通不能、飲み込み困難、および早期死を経験します。 徴候や症状は、幼少期から成人後期までいつでも現れる可能性がありますが、SCAは通常、早期成人期に発症し、数年にわたって進行します。 現在、SCAにはFDA承認された治療法も治療法もありません。
バイオヘブンの最高経営責任者であり会長であるウラド・コリッチ博士は、「希少疾患患者のための新たな治療法を推進することは、学術、患者支援、規制および業種のパートナーとの長年にわたる協力の過程であることがよくあります。 バイオヘブンチームは、この分野の科学に厳密に従うことに常にコミットしており、米国運動失調財団と連携し、世界中の主要なSCA専門家と協力して、SCA開発プログラムが臨床的に意義のある治療効果およびSCA患者の病態進行の遅延の初めての証拠を提供しています。 我々は、FDAの指導に沿ってFDAの提案するリアルワールドエビデンスの使用についての原則に基づき、研究BHV4157-206-RWEからのポジティブなトップライン結果を受け取れたことを喜んでいます。 包括で死に至る神経変性疾患の治療法の必要性が切実です。 弊社としては、SCAなどの承認されていない疾患で生活している患者向けに新しい療法を開発することにコミットしており、トリルズオールをSCA患者に提供するために規制当局との連携を楽しみにしています。
ナショナル・アタキシア財団(NAF)の最高経営責任者であるアンドリュー・ローゼンは、「バイオヘブンは、NAFの薬物開発連携(DDC)に参加した最初の企業であり、アタキシアの治療法を進め、運動の倡議者、臨床医、規制機関、および患者コミュニティを結集することに尽力する一群の医薬品会社です。本日のトップライン結果は、SCAの治療薬としてトロリルゾールの研究に数年を費やした集大成です。患者や家族は、この壊滅的で着実に進行する障害の病気進行を遅らせる可能性のある治療法を何十年も待ち望んできました」。
SCAのトロリルゾール開発プログラムからのトップラインデータと、BHV4157-206-RWEの研究からの以前の安全性および有効性データに基づき、バイオヘブンは2024年第4四半期にFDAに新薬承認申請(NDA)を提出する予定です。トロリルゾール開発プログラムは、SCAにおける最大規模の臨床試験データセットを生成し、現在、5年以上の期間トロリルゾール治療を受けた一部の患者のフォローアップを行っています。バイオヘブンは、FDAからファストトラックおよび製薬法孤児品指定(ODD)、ヨーロッパ医薬品庁からトロリルゾールのODDを以前に受け取っており、ODD付きのNDAは優先的にFDAに審査されます。最終的に承認されれば、バイオヘブンは、潜在的な優先審査期間に基づいて、2025年に米国でSCAを商品化する準備が整います。

 「SCAは、QOLを破壊し、患者が自分自身のケア、歩行、話すことができないようにする、惨めな進行性疾患です。トリリュゾールは、患者に独立した追加の年を与え、支援なしで歩行し、仕事を続け、子供たちと遊び、日常活動に参加できる唯一の治療法です。SCAコミュニティにとって、これは興奮し希望に満ちた瞬間です。」
「SCAは、QOLを破壊し、患者が自分自身のケア、歩行、話すことができないようにする、惨めな進行性疾患です。トリリュゾールは、患者に独立した追加の年を与え、支援なしで歩行し、仕事を続け、子供たちと遊び、日常活動に参加できる唯一の治療法です。SCAコミュニティにとって、これは興奮し希望に満ちた瞬間です。」 

 Dr. Susan Perlman, Director of Ataxia Clinic and Neurogenetics Clinical Trials at the David Geffen School of Medicine at UCLA stated, "SCA is a debilitating, relentlessly progressive disease that destroys quality of life, leaving patients unable to care for themselves, walk, or speak. Troriluzole is the very first treatment to show a delay in disease progression that can give patients additional years of independence, where they can walk without assistance, continue to work, play with their children, and participate in daily activities. This is an exciting and hopeful moment for the SCA community."
Dr. Susan Perlman, Director of Ataxia Clinic and Neurogenetics Clinical Trials at the David Geffen School of Medicine at UCLA stated, "SCA is a debilitating, relentlessly progressive disease that destroys quality of life, leaving patients unable to care for themselves, walk, or speak. Troriluzole is the very first treatment to show a delay in disease progression that can give patients additional years of independence, where they can walk without assistance, continue to work, play with their children, and participate in daily activities. This is an exciting and hopeful moment for the SCA community."