11月17日,亞盛醫藥發佈公告稱,公司細胞凋亡管線核心品種Bcl-2抑制劑APG-2575(擬定中文通用名:力勝克拉片)的新藥上市申請(NDA)已獲國家藥品監督管理局(NMPA)藥品審評中心(CDE)受理,並被推薦納入優先審評程序,用於治療難治或複發性(r/r)慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(CLL/ SLL)。這無疑是亞盛醫藥APG-2575的關鍵里程碑,預示着該產品商業化正式進入倒計時。
在經歷今年9月中旬至10月初的一輪牛市後,港股創新藥板塊迎來一個多月的回調期,港股創新藥指數(931787)從最高940.84點跌至11月15收盤的733.49點,區間跌幅達22.04%。
在此背景下,亞盛醫藥-B(06855)近期雖在盤面上受大市影響出現一定橫盤震盪,但總體走出了一條逆市大幅上漲的路徑。智通財經APP觀察到,亞盛醫藥作爲港股創新藥9月牛市率先啓動的標的,自9月11以來,股價漲幅已達33.65%。
 拉長時間線來看,在4月19日觸及階段性底部後,亞盛醫藥股價後續走出了一段穩步上升的長牛行情。從低點15.42港元一路升至10月21日的高點48.85港元,區間累漲高達216.80%。
拉長時間線來看,在4月19日觸及階段性底部後,亞盛醫藥股價後續走出了一段穩步上升的長牛行情。從低點15.42港元一路升至10月21日的高點48.85港元,區間累漲高達216.80%。
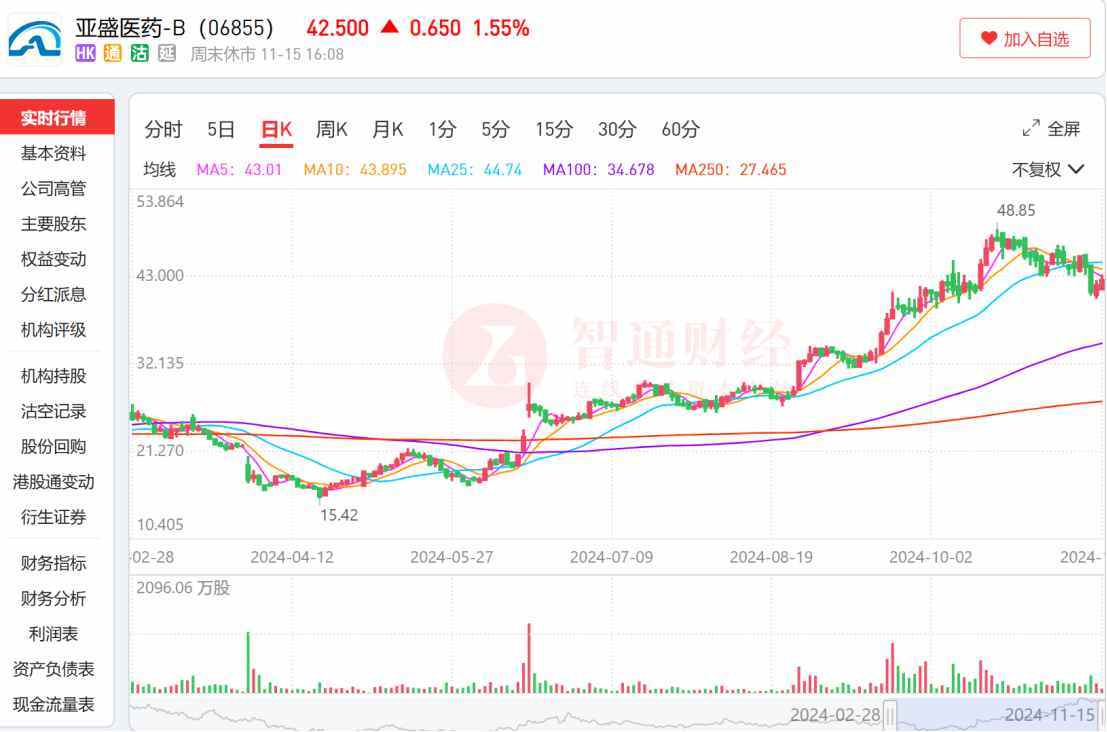
雖然今年港股創新藥板塊波動不止,但投資者依舊選擇用腳投票助力亞盛醫藥股價在半年內實現2倍漲幅。究其原因,則在於多重利好催化下,公司的「投資確定性」得到持續驗證。
智通財經APP了解到,11月17日,亞盛醫藥發佈公告稱,公司細胞凋亡管線核心品種Bcl-2抑制劑APG-2575(擬定中文通用名:力勝克拉片)的新藥上市申請(NDA)已獲國家藥品監督管理局(NMPA)藥品審評中心(CDE)受理,並被推薦納入優先審評程序,用於治療難治或複發性(r/r)慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(CLL/ SLL)。
這無疑是亞盛醫藥APG-2575的關鍵里程碑,預示着該產品商業化正式進入倒計時。APG-2575作爲繼耐立克之後第二款有望躋身國際市場競爭陣營的核心品種,待上市後或將帶動亞盛醫藥的規模化增長進一步全新臺階,彰顯公司的「創新標杆價值」。
投資確定性背後的創新驅動
APG-2575自2018年1月獲美國FDA批准新藥臨床以來,一直受到全球業界和市場的廣泛關注。回顧APG-2575的研發路程,自2018年以來,亞盛醫藥始終在APG-2575的研發和商業化進程上穩步推進,並不斷取得重要階段性成果。
去年8月,APG-2575獲美國FDA批准開展用於治療既往接受治療的CLL/SLL患者的全球註冊性III期臨床研究。這是繼該品種於2021年12月獲CDE批准開展用於治療R/R CLL/SLL患者的關鍵註冊II期臨床研究後的又一重要里程碑。
在此之前APG-2575已多次在國際亮相,屢次獲得國內外權威機構的充分背書。智通財經APP了解到,APG-2575此前共獲5項美國FDA授予的孤兒藥資格,用於治療華氏巨球蛋白血癥(WM)、慢性淋巴細胞白血病(CLL)、多發性骨髓瘤(MM)、急性髓系白血病(AML)和濾泡性淋巴瘤(FL)。
在國際會議參與方面,2021年,APG-2575的美國36例血液腫瘤患者I期研究結果便在當年ASCO年會入選口頭報告;同年,其中國I期臨床試驗數據入選ASH年會口頭報告;2022EHA和ASCO會議上,亞盛醫藥公佈了APG-2575的中國R/R CLL/SLL患者Ib期和II期臨床試驗成果;此外,APG-2575聯藥治療的多項成果則分別在2022ASH年會、2023ASCO年會及2023 AACR年會上公佈。而在今年的ASCO年會和2024EHA年會上,亞盛醫藥則相繼公佈了APG-2575聯藥在AML、R/R MM或 R/R AL等適應症上的研究。在今年12月即將召開的2024ASH年會上,APG-2575將繼續展示在R/R CLL/SLL、MM、骨髓增生異常綜合徵(MDS)領域的臨床進展,其中MM研究的數據還獲選口頭報告。
從最新的研究進度來看,目前,APG-2575正在開展多項註冊III期臨床試驗,分別爲聯合BTKi治療經治CLL/SLL患者的全球註冊III期臨床試驗(由美國FDA許可);聯合阿可替尼一線治療初治CLL/SLL患者的全球註冊III期臨床試驗;聯合阿扎胞苷(AZA)一線治療新診斷老年或不耐受標準化療的急性髓系白血病(AML)的全球註冊III期臨床試驗;聯合AZA一線治療新診斷中高危骨髓增生異常綜合徵(MDS)患者的全球註冊III期臨床試驗。
隨着未來更多適應症的探索與獲批,APG-2575這一中國原創、國際領先的藥物將爲全球血液腫瘤患者帶去新的治療選擇。
依託BIC屬性有望釋放20億美元銷售潛力
不難看到,作爲全球第二個、中國首個看到明確療效、並進入關鍵註冊臨床階段的Bcl-2抑制劑,APG-2575自I期臨床研發之初便高曝光於各大國際權威會議上,展現出了在多種血液腫瘤和實體瘤治療領域具備的廣闊治療前景,並獲得了全球業界的一致認可。而此次APG-2575在國內NDA獲受理並被推薦納入優先審評程序,對於該藥來說無疑是又一重大里程碑。
據智通財經APP了解,CLL/SLL是成人白血病最常見的類型,佔西方國家白血病病例的四分之一,全球每年新增病例超過10萬例。儘管當前的一線治療,如免疫療法、化療和BTK抑制劑對初治患者有顯著反應,但復發和耐藥是主要的臨床挑戰。CLL/SLL的治療中仍存在着顯著的、未滿足的臨床需求,迫切需要新的治療選擇。
雖然Bcl-2抑制劑的出現讓CLL/SLL的治療有了進一步的革新。然而BCL-2靶點研發門檻較高。由於BCL-2靶點結合的界面比較大及跨線粒體膜運輸問題,導致該靶點成藥設計十分艱難。BCL-2靶點發現至今40年,目前全球獲批上市的Bcl-2抑制劑也僅有艾伯維的Venetoclax,充分展現了該領域的研發難度與挑戰。
亞盛醫藥董事長、CEO楊大俊博士表示:「目前全球僅有一款Bcl-2抑制劑獲批上市, 充分說明了該領域藥物研發的難度和挑戰。亞盛醫藥創始團隊在細胞凋亡領域已有20多年的研發歷史,針對Bcl-2靶點更是深度佈局。」
從市場層面來看,2024年全球血液惡性腫瘤治療藥物市場規模達400億美元,2024-2029年CAGR增長達6%。以目前全球唯一一款獲批上市的Bcl-2抑制劑Venetoclax爲例,其目前全球在研臨床超過250項,2023年銷售額達22.9億美元,同比增長13.9%,足以從側面看出全球市場對Bcl-2抑制劑的龐大未滿足需求。
目前,美國國家綜合癌症網絡(NCCN)指南已將Bcl-2抑制劑推薦爲BTKi治療失敗的CLL/SLL患者的治療首選,當前,國外的CLL/SLL臨床治療已進入了「無化療」「固定療程」的新時代。然而,在CLL/SLL治療領域,國內目前尚未有任何一款Bcl-2抑制劑獲批。此次APG-2575的NDA受理,意味着該藥物有望成爲國內CLL/SLL領域首個上市的Bcl-2抑制劑,填補臨床急需。
而亞盛醫藥APG-2575受到廣泛關注的關鍵原因在於,此前多項臨床數據驗證其與Venetoclax相較,安全性優勢更加突出,且在多種血液腫瘤治療領域具備廣闊的治療前景,特別在CLL/SLL患者中具有單藥和聯合治療潛力。
以CLL/SLL適應症治療爲例,據中信建投研報,APG-2575在治療維奈克拉無效的 BTK 耐藥患者中顯示出有效性,並且與 BTKi 聯合使用時,對初治CLL/SLL 患者達到100%的 ORR,對R/R CLL/SLL患者也實現98%的ORR。在安全性方面,APG-2575中性粒細胞減少症和血小板減少症的發生率分別爲30.3 %和13%,相較於維奈克拉顯著降低(分別爲45%和21%),同時臨床腫瘤溶解綜合徵的風險也較低。APG-2575與 BTKi 的聯用中未觀察到DDI,且無劑量限制毒性。基於APG-2575+BTKi的聯合療法將在CLL 適應症中大有可爲。
參考Venetoclax市場表現,市場預計APG-2575未來銷售有望超20億美元,峯值銷量逐漸向維奈克拉看齊。
亞盛醫藥目前擁有奧雷巴替尼和APG-2575兩款具備十億美元分子潛力的核心產品,並有諸如APG-115、APG-2449、APG-5918潛在的FIC/BIC在研產品。在目前奧雷巴替尼全球商業化價值愈發顯現的情況下,即將邁入商業化階段且全球市場潛力巨大的的APG-2575無疑將成爲引爆亞盛醫藥估值增長的下一個重磅炸彈。

 拉长时间线来看,在4月19日触及阶段性底部后,亚盛医药股价后续走出了一段稳步上升的长牛行情。从低点15.42港元一路升至10月21日的高点48.85港元,区间累涨高达216.80%。
拉长时间线来看,在4月19日触及阶段性底部后,亚盛医药股价后续走出了一段稳步上升的长牛行情。从低点15.42港元一路升至10月21日的高点48.85港元,区间累涨高达216.80%。