2024年12月16日、広東東陽光薬業株式会社、杭州東陽光薬業株式会社は、国家医薬品監督管理局から発行された《医薬品臨床試験承認通知書》を受け取り、1類新薬HEC169584カプセルの非アルコール性脂肪肝炎に対する臨床試験を行うことが承認されました。
智通财经APPによると、2024年12月16日、広東東陽光薬業株式会社、杭州東陽光薬業株式会社は、国家医薬品監督管理局から発行された《医薬品臨床試験承認通知書》を受け取り、1類新薬HEC169584カプセルの非アルコール性脂肪肝炎に対する臨床試験を行うことが承認されました。
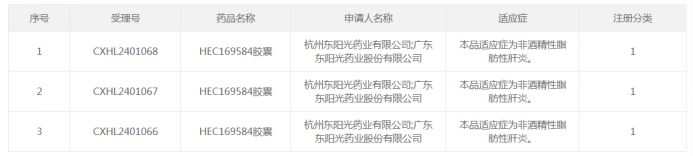
スクリーンショットはCDE公式サイトからのものです。
 非アルコール性脂肪肝炎(NASH、別名代謝機能障害関連脂肪肝炎またはMASH)は、発病機序が複雑な慢性代謝病であり、非アルコール性脂肪肝疾患(NAFLD、別名代謝機能障害関連脂肪肝疾患またはMASLD)の一つの深刻なタイプです。その進行に伴い、肝臓の線維化、肝硬変、肝癌に変化する可能性があります。近年、食事や生活習慣の変化、肥満率の上昇などの要因により、中国ではNASH患者の数が大幅に増加しています。フロスト・アンド・サリバンの報告によると、2023年の中国のNASH患者数は4250万人に達し、2030年には5490万人に達する見込みです。2024年3月、リズメタローム(Resmetirom)がFDAの承認を受けて上市され、これは経口甲状腺ホルモン受容体(THR)-β作動薬であり、成人NASH伴う中等度から重度の肝線維症を治療するためにFDAに承認された初めての薬です。しかし、現在のところ、中国およびヨーロッパではNASHを治療するための承認された薬は存在せず、NASH領域には依然として大きな市場の可能性と未充足の臨床ニーズがあります。
非アルコール性脂肪肝炎(NASH、別名代謝機能障害関連脂肪肝炎またはMASH)は、発病機序が複雑な慢性代謝病であり、非アルコール性脂肪肝疾患(NAFLD、別名代謝機能障害関連脂肪肝疾患またはMASLD)の一つの深刻なタイプです。その進行に伴い、肝臓の線維化、肝硬変、肝癌に変化する可能性があります。近年、食事や生活習慣の変化、肥満率の上昇などの要因により、中国ではNASH患者の数が大幅に増加しています。フロスト・アンド・サリバンの報告によると、2023年の中国のNASH患者数は4250万人に達し、2030年には5490万人に達する見込みです。2024年3月、リズメタローム(Resmetirom)がFDAの承認を受けて上市され、これは経口甲状腺ホルモン受容体(THR)-β作動薬であり、成人NASH伴う中等度から重度の肝線維症を治療するためにFDAに承認された初めての薬です。しかし、現在のところ、中国およびヨーロッパではNASHを治療するための承認された薬は存在せず、NASH領域には依然として大きな市場の可能性と未充足の臨床ニーズがあります。
HEC169584は、東陽光薬がAI駆動の小分子薬物設計プラットフォームを通じて得た初の候補薬です。チームはHEC-GENモデル(希薄グラフ注意力神経ネットワークに基づく分子断片生成モデル)を利用して、THR-βターゲットポケットに基づき、多くの異なる構造のリガンド小分子を生成し、分子ドッキング技術を通じてそれらとターゲットタンパク質の親和性を評価しました。これらのAI技術の手法を通じて、会社は最終的に良好な体内外の薬効、成薬性、安全性を持つ候補薬HEC169584を決定しました。前臨床研究の結果は、HEC169584がTHR-β細胞に対して高い体外活性を示し、肝鋳向性が強いこと、肝血比が24.5(AUC比)であることを示し、甲状腺軸、心臓などの組織への影響を減少させることができることを示しています。NASH伴う肝線維症マウスモデルにおいて、肝機能、血脂、肝臓脂質、肝臓炎症、肝臓NAFLD活動スコア、肝臓線維症の改善効果を示しました。現在国内では同類薬は上市されておらず、HEC169584は臨床を迅速に進めることが期待されており、患者に新たな治療選択肢を提供することが期待されています。
NASHの発病機序は複雑であり、異なるターゲットに対する併用療法も臨床開発の新しいトレンドとなっています。東陽光薬はNASHの領域において前向きな戦略的展開を採用し、NASH薬の開発における主流のターゲットに対しても触れています。GLP-1/FGF21二重ターゲット作動薬、FXR作動薬、THR-β作動薬、ACC阻害剤などの研究中の薬剤が臨床段階に相次いで進んでおり、NASHの併用治療に新たな突破口をもたらすことが期待されています。


 非酒精性脂肪性肝炎(NASH,又称为代谢功能障碍相关脂肪性肝炎或MASH)是一种发病机制复杂的慢性代谢疾病,是非酒精性脂肪性肝病(NAFLD,又称为代谢功能障碍相关脂肪性肝病或MASLD)的一种严重类型,随着其进展,可能演变为肝脏纤维化、肝硬化及肝癌。近年来,由于膳食及生活习惯转变、肥胖率升高等因素,中国NASH患者人数大幅增长,根据弗若斯特沙利文报告,2023年中国NASH患者人数达4250万人,预计2030年将达到5490万人。2024年3月,瑞司美替罗(Resmetirom)获得FDA批准上市,该药是一款口服甲状腺激素受体(THR)-β激动剂,成为FDA批准的首款治疗成人NASH伴中晚期肝纤维化的药物。但截至目前,中国及欧洲尚无获批治疗NASH的药物,NASH领域仍存在巨大的市场空间和未满足的临床需求。
非酒精性脂肪性肝炎(NASH,又称为代谢功能障碍相关脂肪性肝炎或MASH)是一种发病机制复杂的慢性代谢疾病,是非酒精性脂肪性肝病(NAFLD,又称为代谢功能障碍相关脂肪性肝病或MASLD)的一种严重类型,随着其进展,可能演变为肝脏纤维化、肝硬化及肝癌。近年来,由于膳食及生活习惯转变、肥胖率升高等因素,中国NASH患者人数大幅增长,根据弗若斯特沙利文报告,2023年中国NASH患者人数达4250万人,预计2030年将达到5490万人。2024年3月,瑞司美替罗(Resmetirom)获得FDA批准上市,该药是一款口服甲状腺激素受体(THR)-β激动剂,成为FDA批准的首款治疗成人NASH伴中晚期肝纤维化的药物。但截至目前,中国及欧洲尚无获批治疗NASH的药物,NASH领域仍存在巨大的市场空间和未满足的临床需求。