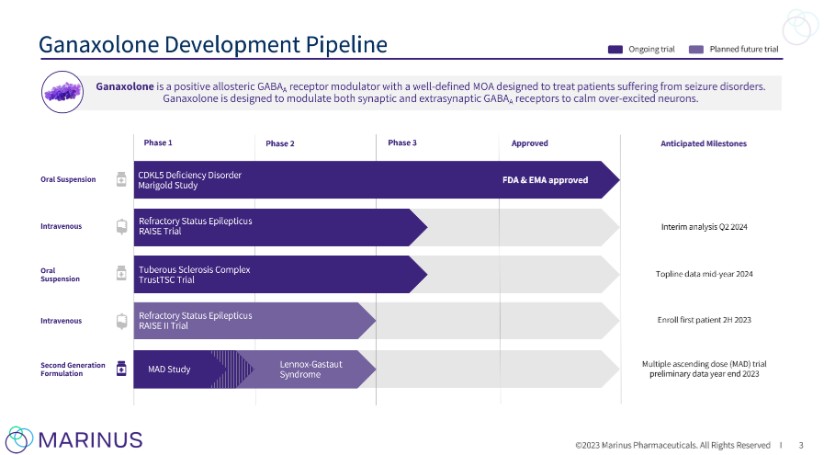
股票期權
截至2023年7月31日,續借貸款協議下未償還的借款額爲7,188,661 截至2023年9月30日,股票期權的未行使數量爲X股,加權平均行權價格爲$X。9.75 每股股價包括797,872份普通股,以及行使超額配售選擇權的承銷商的預先撥出的優先認購權,購買價格爲每股23.4999美元,並均在扣除承銷折扣和佣金前計算。根據本次發行,公司獲得了約2,000萬美元的募集總額(在扣除承銷折扣和佣金以及其他發行費用後,淨收益爲約1,600萬美元)。截至2024年6月30日,以下爲公司普通股可行使的股票購買權: 2,124,159 除2014計劃外,以用於吸引新員工的股票期權爲X股。 在截至2023年9月30日的九個月內,股票期權的數量爲X股,加權平均行權價格爲$X。 1,971,291 股票期權被授予員工和董事,加權平均行權價格爲$X。6.34 per share. Of the options granted, 1,550,766 options were granted pursuant to the 2014 Plan and 420,525 were granted outside of the 2014 Plan as inducements for new employees.
受限股份和受限股份單位
All issued and outstanding restricted shares of common stock are time-based, and become vested within 發生 of the grant date, pursuant to the 2014 Plan. Compensation expense is recorded ratably over the requisite service period. Compensation expense related to restricted stock is measured based on the fair value using the closing market price of our common stock on the date of the grant. As of September 30, 2023, we did not have any restricted shares of common stock outstanding.
During the nine months ended September 30, 2023, we granted 974,940 受限股票單位,在授予日起內解禁。 三年 截至2023年9月30日,我們擁有 1,265,316 未解禁的受限股票單位。
報表中所有期權、受限股票獎勵和受限股票單位的總補償成本如下(以千爲單位):
| | | | | | | | | | | | | |
| | 截至三個月結束 | | 截至九個月的結束日期 | |
| | 截至2023年9月30日年
度報告 | | 截至2023年9月30日年
度報告 | |
| | 2023 | | 2022 | | 2023 | | 2022 | |
研發 | | $ | 1,519 | | $ | 1,394 | | $ | 4,329 | | $ | 4,069 | |
銷售、一般及行政費用 | | | 2,487 | | | 2,501 | | | 7,309 | | | 7,022 | |
總費用 | | $ | 4,006 | | $ | 3,895 | | $ | 11,638 | | $ | 11,091 | |
優先股
截至2023年9月30日,所有的A系列可轉換優先股(優先股)已全部轉換和
無 在2023年9月30日結束的九個月中,
4,300 股我們的優先股被轉換爲
860,000 股普通股股票。
與Ovid許可協議相關的股票發行
2022年3月29日,根據與Ovid Therapeutics Inc.(Ovid)達成的專利獨家許可協議,我們向Ovid發行了 123,255 股普通股。這些股票是根據《1933年證券法修正案》(證券法)第4(a)(2)條和該法的監管D項下,作爲一家發行人不涉及任何公開發行的銷售而發行的(參見第II部分,第2條。 未註冊的股票股權銷售和籌款用途這些股票的公允價值反映在2022年9月30日結束的9個月營業費用中。
承銷公開發行
與2022年11月的一項承銷公開發行及其相關的承銷商選擇權行使的關閉相結合,我們總共發行了 12,421,053普通股2,105,264 通過發行實期認股權證(即Pre-funded Warrants),實現總淨收入,減去承銷折扣、佣金、公開募股和費用,共計$ million。每個實期認股權證的行權價格和可行權的普通股股數在特定股票分紅和發放、拆股並股、股票組合、重新分類或類似事件發生時將適當調整。64.5 百萬美元。每個實期認股權證的行權價格和可行權的普通股股數在特定股票分紅和發放、拆股並股、股票組合、重新分類或類似事件發生時將適當調整。