全米
証券取引委員会 および取引所
ワシントンD.C. 20549
フォーム
(表1)
四半期末日:
移行期間:_____から_____までの期間
報告書番号:
(設立状況に記載された登録者名)
| (所在地州その他の管轄区域 ) | (税務署の雇用者 |
| (I.R.S.雇用者識別番号) | 識別番号) |
(主要執行事務所の住所)(郵便番号)
1-
(登録者の電話番号 市外局番を含む)
同法に基づき登録された証券12(b):
| タイトル 各クラスの | 取引 シンボル | 名前 登録された各取引所の | ||
註:本式においては、証券取引法第13条又は15(d)条に定められた すべての報告書を、前12カ月間(或いは短い期間であれば、その間に当社が該当する報告書を提出 することが求められた期間内に)提出したか否か、及び過去90日間において該当の申し出 義務があったか否かに基づき、「○」の適当な記号で明示すること。
☒
過去12か月間(または登録者がこのようなファイルを提出する必要があった期間)、Rule405 of Regulation S-T(この章の§232.405)に基づき提出が必要なすべてのインタラクティブデータファイルを電子的に提出したかどうかを、チェックマークで示してください。
☒
1
「大規模早期届出者」「加速された届出者」「小規模報告会社」「新興成長企業」の定義については、取引所法第12002条のルールに示されているものを確認してください。
| ☒ | 加速ファイラー | ☐ | ||
| 非加速ファイラー | ☐ | レポート義務のある中小企業 | ||
| 新興成長企業 |
新興成長企業である場合、証券登録者がセクション13(a)に基づく取引所法の規定に従って、新しいまたは改訂された財務会計基準の遵守に拡張された移行期間を使用しないことを選択したことをチェックマークで示してください。
☐
取引所法の規則12b-2で定義されたシェル企業かどうか、チェックマークで示してください。
☐ はい
最新実施日時点で、発行者の普通株式の発行済み株式数を示してください。 2024年8月6日現在の発行済み普通株式の株式数。
2
目次
| 第I部−財務情報 | 4 |
| 項目1.財務諸表 | 4 |
| ITEM 2. 財務状況及び業績に関する経営陣の分析と説明 | 19 |
| 項目3。市場リスクに関する数量・質的な開示。 | 38 |
| 項目 4. 統制および手順 | 38 |
| 第II部-その他の事項 | 39 |
| 項目 1. 法的手続き | 39 |
| 項目 1A. リスク ファクター | 39 |
| 項目 2. 登録されていない株式の販売と処理に係る収益利用 | 39 |
| 項目3。上位証券の債務不履行。 | 39 |
| 項目4。鉱山安全性の開示。 | 39 |
| 項目5。その他の情報。 | 39 |
| 項目 6. 展示物 | 40 |
| 署名 | 41 |
3
第I部−財務情報
項目1.財務諸表
4
アナベックス・ライフ・サイエンシズ社 リサーチ&ビジネス開発 フリーダイヤル:1-844-689-3939 電子メール:info@anavex.com
簡約連結中間財務諸表
2024年6月30日
(未確定)
5
アナベックス ライフサイエンス株式会社。
簡略化された統合中間バランスシート
3ヶ月間累計
| 6月30日 | 9月30日 | |||||||
| 2024 | 2023 | |||||||
| (未確定) | ||||||||
| 資産 | ||||||||
| 現在の任期 | ||||||||
| 現金及び現金同等物 | $ | $ | ||||||
| インセンティブと税金の債権 | ||||||||
| 前払費用およびその他の流動資産 | ||||||||
| 総資産 | $ | $ | ||||||
| 負債及び株主資本 | ||||||||
| 流動負債 | ||||||||
| 支払調整 | $ | $ | ||||||
| 支払利息:注記4 | ||||||||
| 先高授与金:注記3 | ||||||||
| 純負債合計 | $ | $ | ||||||
| 契約及び補償:注記6 | ||||||||
| 資本金 | ||||||||
| 認可済み:優先株式、1株当たりの額「$」、普通株式、1株当たりの額「$」。 | ||||||||
| 優先株式、1株当たりの額「$」。。 | ||||||||
| 普通株式、1株当たりの額「$」。。 | ||||||||
| 発行済みおよび未払い:普通株式のクラス別、その他の項目が必要な場合は注記で開示する。 | ||||||||
| 普通株式(2023年9月30日-82,066,511)) | ||||||||
| 資本剰余金 | ||||||||
| シェアの受取資産 | ( | ) | ||||||
| 累積欠損 | ( | ) | ( | ) | ||||
| 株主資本の合計 | $ | $ | ||||||
| 負債と純資産の合計 | $ | $ | ||||||
添付された財務諸表の注釈を参照してください
6
アナベックス・ライフ・サイエンシズ社 リサーチ&ビジネス開発 フリーダイヤル:1-844-689-3939 電子メール:info@anavex.com
総合利益及び損益の中間 condensed 連結財務諸表
(単位:千ドル、株式数および株式当たり金額を除く)
(未確定)
| 6月30日に終了した3か月間、 | 6月30日までの9か月間 | |||||||||||||||
| 2024 | 2023 | 2024 | 2023 | |||||||||||||
| 営業経費 | ||||||||||||||||
| 一般と管理 | $ | $ | $ | $ | ||||||||||||
| 研究開発 | ||||||||||||||||
| 営業費用の合計 | ||||||||||||||||
| 営業損失 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| その他の収入 (費用) | ||||||||||||||||
| 助成金収入 | ||||||||||||||||
| 研究開発インセンティブ収入 | ||||||||||||||||
| 利息収入、純額 | ||||||||||||||||
| その他の資金調達費用 | ( | ) | ||||||||||||||
| 為替差益 (損失) | ( | ) | ||||||||||||||
| 買掛金の決済による利益 | ||||||||||||||||
| その他の収益合計、純額 | ||||||||||||||||
| 所得税引当金控除前の純損失 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||
| 所得税控除(費用)、現在 | ( | ) | ( | ) | ( | ) | ||||||||||
| 純損失と包括損失 | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||
| 1株当たりの純損失 | ||||||||||||||||
| ベーシックと希釈 | $ | ) | $ | ) | $ | ) | $ | ) | ||||||||
| 加重平均発行済株式数 | ||||||||||||||||
| ベーシックと希釈 | ||||||||||||||||
添付された財務諸表の注釈を参照してください
7
アナベックス ライフサイエンス株式会社。
株主資本の変更の間にまとめられた簡略化された中間計算報告書
2024年6月30日までの3か月と2023年6月30日までの3か月
3ヶ月間累計
(未確定)
| 普通株式 | 追加支払い済み | 収益を分かち合う | 累積 | |||||||||||||||||||||
| 株式 | 額面価格 | 資本 | 売掛金 | 赤字 | 合計 | |||||||||||||||||||
| 残高、2024年4月1日 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||
| 2023年の購入契約に基づいて発行された株式 | ||||||||||||||||||||||||
| 株式を購入する | ||||||||||||||||||||||||
| コミットメントシェア | ||||||||||||||||||||||||
| ストックオプションの行使に従って発行された株式 | ( | ) | ||||||||||||||||||||||
| 株式ベースの報酬 | — | |||||||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||||||
| 残高、2024年6月30日 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||
| バランス、2023年4月1日 | $ | $ | $ | $ | ( | ) | $ | |||||||||||||||||
| 2023年の購入契約に基づいて発行された株式 | ||||||||||||||||||||||||
| 株式を購入する | ||||||||||||||||||||||||
| コミットメントシェア | ||||||||||||||||||||||||
| ストックオプションの行使に従って発行された株式 | ||||||||||||||||||||||||
| 株式ベースの報酬 | — | |||||||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||||||
| バランス、2023年6月30日 | $ | $ | $ | $ | ( | ) | $ | |||||||||||||||||
添付された財務諸表の注釈を参照してください
8
アナベックス・ライフ・サイエンシズ社 リサーチ&ビジネス開発 フリーダイヤル:1-844-689-3939 電子メール:info@anavex.com
株主資本の変動に関する連結中間財務諸表
2024年6月30日までの9ヶ月と2023年の終了時
(単位:千ドル、株式数および株式当たり金額を除く)
(未確定)
| 普通株式 | 追加支払い済み | 収益を分かち合う | 累積 | |||||||||||||||||||||
| 株式 | 額面価格 | 資本 | 売掛金 | 赤字 | 合計 | |||||||||||||||||||
| バランス、2023年10月1日 | $ | $ | $ | $ | ( | ) | $ | |||||||||||||||||
| 2023年の購入契約に基づいて発行された株式 | ||||||||||||||||||||||||
| 株式を購入する | ||||||||||||||||||||||||
| コミットメントシェア | ||||||||||||||||||||||||
| ストックオプションの行使に従って発行された株式 | ( | ) | ||||||||||||||||||||||
| 株式ベースの報酬 | — | |||||||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||||||
| 残高、2024年6月30日 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||
| バランス、2022年10月1日 | $ | $ | $ | $ | ( | ) | ||||||||||||||||||
| 2023年の購入契約に基づいて発行された株式 | ||||||||||||||||||||||||
| 初期コミットメント株式 | ||||||||||||||||||||||||
| 株式を購入する | ||||||||||||||||||||||||
| コミットメントシェア | ||||||||||||||||||||||||
| ストックオプションの行使に従って発行された株式 | ||||||||||||||||||||||||
| 株式ベースの報酬 | — | |||||||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||||||
| バランス、2023年6月30日 | $ | $ | $ | $ | ( | ) | ||||||||||||||||||
添付された財務諸表の注釈を参照してください
9
アナベックス・ライフ・サイエンシズ社 リサーチ&ビジネス開発 フリーダイヤル:1-844-689-3939 電子メール:info@anavex.com
簡易連結中間キャッシュ・フロー計算書
(単位:千ドル、株式数および株式当たり金額を除く)
(未確定)
| 6月30日までの9ヶ月 | ||||||||
| 2024 | 2023 | |||||||
| 営業活動によるキャッシュ・フローの増減 | ||||||||
| 純損失 | $ | ( |
) | $ | ( |
) | ||
| オペレーションに使用されたネットキャッシュに調整するための変更: | ||||||||
| 非現金に関連する財務上の負担 | ||||||||
| 支払調整に関する利益 | ( |
) | ||||||
| 株式報酬費用 | ||||||||
| 運転に関連する運転資本残高の変更: | ||||||||
| インセンティブと税金の債権 | ||||||||
| 前払費用および前払金 | ( |
) | ( |
) | ||||
| 支払調整 | ( |
) | ||||||
| 未払費用 | ||||||||
| 先延ばしにされた補助金の受取額 | ||||||||
| 営業によるキャッシュフローの純流出 | ( |
) | ( |
) | ||||
| 財務活動からの現金の流れ | ||||||||
| 普通株式の発行 | ||||||||
| ストックオプションの行使からの資金調達 | ||||||||
| 財務活動による純現金流入額 | ||||||||
| 当期現金及び現金同等物の増減 | ( |
) | ||||||
| 現金及び現金同等物期首残高 | ||||||||
| 期末現金及び現金同等物 | $ | $ | ||||||
| 補足的なキャッシュ・フロー情報 | ||||||||
| 州および地方の最低所得税の支払いに対する現金 | $ | $ | ||||||
添付された財務諸表の注釈を参照してください
10
アナベックス ライフサイエンス株式会社。
財務諸表の簡略集計に関する注記
2024年6月30日
(未確定)
ノート1 ビジネスの説明
ビジネス
アナベックス・ライフ・サイエンシズ株式会社(「アナベックス」または「当社」)は、高い未解決ニーズを持つ中枢神経系(CNS)疾患に対して精密医療を応用することによって差別化された治療法を開発する臨床段階のバイオ医薬品会社です。アナベックスは臨床試験からの遺伝子ゲノムデータを分析してバイオマーカーを特定し、神経変性疾患および神経発達疾患の治療のための臨床試験においてこれらのバイオマーカーを分析することに活用しています。
同社の主力化合物ANAVEX®2-73は、アルツハイマー病、パーキンソン病、およびレット症候群などの希少な中枢神経系疾患を含む、他の中枢神経系疾患の治療に使用されることを目的として、開発されています。レット症候群とは、X連鎖遺伝子、メチル化CpG結合タンパク質2(「MECP2」)の突然変異によって引き起こされる、希少で重度の神経疾患です。
ノート2報告の基礎
報告の基礎
これらの添付された未監査の簡略化された連結中間財務諸表は、証券取引委員会(「SEC」)の規則および規制、およびアメリカ合衆国(「米国」)の一般的に受け入れられた会計原則(「米国GAAP」)に従って、中間報告のために準備されました。したがって、米国GAAPに従って通常年次財務諸表に含まれる一部の情報および注記披露事項は、このような規則および規制に従って簡略化または省略されました。マネジメントの意見では、開示内容は提示された情報の誤解を招かないように十分であります。
これらの添付された未監査の簡略化された連結中間財務諸表は、マネジメントの意見により、正確な表示に必要とされる通常の再発生性の調整を含んでいます。2023年9月30日の連結貸借対照表は監査された年次財務諸表から導かれましたが、米国GAAPで必要なすべての開示を含んでいません。添付の未監査の簡略化された連結中間財務諸表は、2023年9月30日に米国証券取引委員会に提出された年次報告書(フォーム10-K)に含まれる監査済みの連結財務諸表および注記と併せて参照して読む必要があります。会社は中間報告書の作成において、同じ会計ポリシーに従っています。
2024年6月30日までの9か月間の業績は、2024年9月30日締め切りの年間業績を予想する上で必ずしも指標となるわけではありません。
流動性
会社の可能性がある全ての薬剤化合物は臨床開発段階にあり、会社は研究および開発の努力が成功するか、成功した場合でも、その潜在的な薬剤化合物が医薬品会社への販売に承認されるか、商業的な収益を生み出すかどうかを保証することはできません。現在までに、運営活動からの収益を生成していません。会社は、将来の現金流が負になることが予想されるビジネスを継続し、ビジネスがいつ経済的に採算性があるようになるかどうかを予測することはできません。
会社は、この添付の簡略化された未監査の連結中間財務諸表が発行された後の次の12か月を超える作業資本要件を満たすための現在の運転資本の位置は十分であると考えています。薬剤の開発プロセスは高額になる場合があり、臨床試験のタイミングと結果は不確定なものです。会社がその見積もりに基づいている前提条件は定期的に評価され、変更される可能性があります。会社の支出額は、将来の臨床試験の設計、タイミング、期間、会社の研究および開発プログラムの進捗状況、および利用可能な財務リソースのレベルを含むいくつかの要因によって異なります。会社は、将来の臨床試験のタイミングに基づいて運営計画の支出水準を調整することができます。
11
アナベックス ライフサイエンス株式会社。
財務諸表の簡略集計に関する注記
2024年6月30日
(未確定)
2023年購入契約関連の権利を除き、追加の資金調達が必要になった場合、追加の資金調達が利用可能である保証はありません。もし会社が必要とする場合、追加の資金調達を適時に取得できない場合、研究および開発活動の一部または全部を延期または縮小せざるを得なくなるでしょう。
見積もりの使用
米国GAAPに従って財務諸表を準備するには、マネジメントが期末日の資産および負債の報告額、および報告期間中の収益および費用の報告額に影響を与える見積もりと仮定を行う必要があります。会社は、研究開発費の会計やインセンティブ収益の債権、繰延税金資産の評価と回収可能性、株式報酬、損失に関する不確実性などの会計関連の見積もりと仮定を定期的に評価しています。会社は、キャリングバリューやコストおよび費用の支払を評価する上で、現在の事実や過去の経験、およびさまざまなその他の状況下で合理的であると信じているさまざまな要因に基づいて見積もりと仮定を立てます。実際の結果は、会社の見積もりと不利な影響を及ぼす場合があります。見積もりと実際の結果に重大な差異がある場合は、今後の業績に影響を与える可能性があります。
連結財務諸表の原則
これらの連結財務諸表には、Anavex Life Sciences Corp.とその完全子会社であるAnavex Australia Pty Limited(「Anavex Australia」)(オーストラリア法に基づいて設立された会社)、Anavex Germany GmbH(ドイツ法に基づいて設立された会社)、Anavex Canada Ltd.(カナダオンタリオ州法に基づいて設立された会社)のアカウントが含まれます。すべての子会社間の取引と残高は、除外されています。
公正価値測定
GAAPにおける公正価値階層は、次の3つの入力レベルに基づいています。最初の2つは観察可能であり、最後の1つは観察不可能であり、公正価値を測定するために使用される可能性がある。
レベル1 - 同一の資産や負債についての活発な市場で引用された(非調整)価格;
レベル2 - 観察可能な、レベル1以外の入力、アクティブな市場で類似の資産や負債の引用価格、非活発な市場で同一または類似する資産や負債の引用価格、および入力が観察可能であるか、その重要な価値推進要因が観察可能なモデル起因の価格;および
レベル3 - 小規模な市場活動によって観察不可能であり、資産または負債の公正価値に重要である資産や負債。
2023年9月30日および2024年6月30日時点で、当社にはレベル3の資産または負債がありませんでした。
1株当たり基本利益/(損失)は、当期純利益/(損失)を期間中の普通株主に利用できる希薄化後の普通株式の加重平均数で割ったものとして算出されます。 1株当たり希薄化後の利益/(損失)は、(1)期間中の加重平均の普通株式の数、(2)自己株式法を用いたオプションおよびワラントの行使想定の希薄化効果、および(3)その他の潜在的に希薄化する証券の希薄化効果の合計で普通株主に利用可能な当期純利益/(損失)を分配します。希薄化後の1株当たりの損失を除く計算では、オプションとワラントは潜在的に希薄化する証券であり、彼らの影響はアンチ・ダイルーシヴとなるため、希薄化後の1株当たりの損失の計算から除外されます。
2024年6月30日現在、株当たり損失は以下の内容を除外して計算されています: (2023年6月30日: )、未行使のオプションおよびウォランツに関連する普通株式の発行が抑制効果をもっていたため、これらは含めていません。
12
アナベックス ライフサイエンス株式会社。
財務諸表の簡略集計に関する注記
2024年6月30日
(未確定)
最近の会計基準 大切な報告区分開示に改善をもたらすASU No. 2023-07「Segment Reporting:Improvements to Reportable Segment Disclosures」が2023年11月に米国会計基準審議会(FASB)から発行されました。このガイダンスは、年次および中間期における報告区分情報の増分開示を求めるものです。2025年9月30日に終了する私たちの会計年度および2026年9月30日に終了する当会計年度の中間期に適用される予定です。当社では、このガイダンスが開示に与える影響を現在評価しています。
2023年12月に、FASBは子会社計算方法や所得税の開示に関する改善をもたらすASU No.2023-09「Income Taxes: Improvements to Income Tax Disclosures」を発行しました。当該指針は、税率調整表における一貫したカテゴリーの使用と所得税の支払いに関する情報のより細かい分解を求めます。この改正案は、2026年9月30日までの当会計年度に適用されます。当社では現在、この指針が開示に与える影響を評価しています。
注釈3 2024年3月31日現在、当社はパーキンソン病に関連する主要化合物ANAVEX2-73の臨床試験を資金提供するため、マイケル・J・フォックス財団から授与された1,000万ドルの研究助成金を受け取っています。総額のうち、700万ドルは2023年9月30日までの1年間、300万ドルは2021年9月30日までの1年間に受け取りました。この助成金収入は、関連する研究開発費用が発生するにつれて、受け取ると先送りされ、その後他の収入に分配されます。2024年3月31日現在、当社は3,000,000ドル(2023年9月30日: 2,500,000ドル)の未実現助成金収入を計上しており、これは、関連する経費がその収入を相殺するために発生するとき、損益計算書で収益として認識されます。三ヶ月、および2024年3月31日、会社は、それぞれ(2023年:それぞれ)非課税歳入として筆頭声明に120万ドルを認識しました。2024年3月31日時点で未実現の助成金収入額は、3,000,000ドル(2023年9月30日:2, 500,000ドル)で、まだ他の収入に計上されていないこの助成金収入が、関連する経費が発生するにつれて損益計算書に認識されます。
ノート3 その他の収入
補助金収入
2024年6月30日時点で、会社は$を受け取りました
助成金収入は
受領時に繰り延べられ、関連する研究開発費が発生したため、他の収入に償却されています。中に
2024年6月30日までの3か月と9か月で、当社は$を認識しました
研究開発 インセンティブ収入
研究開発 インセンティブ収入とは、オーストラリアのR&DクレジットによってAnavexオーストラリアが稼いだ収入を表します。このキャッシュインセンティブは、Anavexオーストラリアが年次所得税申告書に関連する請求を提出した際に、Anavexオーストラリアが受け取ります。
2024年6月30日までの3か月および9か月間、同社は期間中に発生した研究開発促進収入を$
2024年6月30日時点で、インセンティブと税金の債権には$が含まれています。
オーストラリアR&Dクレジットプログラムは自己評価プログラムであり、会社は毎年自己評価を行い、(i)エンティティが資格を有するか、(ii)特定のR&D活動が資格を有するか、および(iii)個々のR&D支出がそのR&D活動に対して適切であるかを決定する必要があります。 会社は、最新かつ関連性があるデータに基づいて、各貸借対照表日付時点で税制刺激プログラムの資格を評価します。 Anavexオーストラリアは、対象の研究開発費を今後も支出し続け、資格を維持し続ける限り、引き続きR&D税制優遇措置を申請することができます。
13
アナベックス ライフサイエンス株式会社。
財務諸表の簡略集計に関する注記
2024年6月30日
(未確定)
同社は、すべての申告期間において必要な資格条件を満たしていると信じていますが、オーストラリア税務局(ATO)は4年間にわたり、会社の資格プログラムおよび関連する支出をレビューする権利があります。 もしATOがレビューを行った場合、ATOが特定の資格要件を異なる解釈をする可能性があります。 ATOが会社の評価およびそれに関連するその後の申し立てに異議を唱えた場合、ATOは既に受領した現在または前の年度の請求額を調整および返済することができます。 加えて、会社がそのような請求に対して釈明可能な立場を示せない場合、ATOはそのような調整についての罰金および利息を評価することができます。
現在、2020年から2023年の税務免除請求は、詐欺が疑われる場合を除き、無期限の可能性があります。こうした将来的な調整が発生した場合に備え、会社はそれらに対するいかなる手当も提供していません。
注 4 未払負債
未払費用の主要な部品は、次の通りです(千ドル単位):
| 6月30日 | 9月30日 | |||||||
| 2024 | 2023 | |||||||
| 臨床現場および患者訪問費用の未払費用 | $ | $ | ||||||
| 未払い賃金・福利厚生費 | ||||||||
| 固定契約の未払費用 | ||||||||
| マイルストーン契約の未払費用 | ||||||||
| その他の未払費用 | ||||||||
| 未払費用の合計 | $ | $ | ||||||
注 5 エクイティ・オファリング
45.84
普通株式は投票権を持ち、取締役会(「取締役会」)の裁量に基づいて宣言された配当金を受け取る権利があります。
優先株式
会社の取締役会は、1つ以上のシリーズで優先株式を発行し、そのシリーズの株式の数、またはシリーズの指定などの権利、特典、特権、制限を定める権限を有しています。
2020年のセールス契約
2018年7月6日に制御資本引き受け販売契約(「2020年販売契約」と改定された)をCantor Fitzgerald & Co.およびSVb Leerink LLC(以下、「販売代理人」という)と締結し、有効な登録声明に基づき、株式(「株式」)を時期を問わず販売代理人を通じて提供できるようにすること(「オファリング」)。
2020年販売契約の規定に従い、当社の指示に基づく配置通知の受領後、Sales Agents は「市場における」オファリング、時価に対応するあるいはその市場価格に関連する価格での交渉取引、その他法的に許容される方法による売却を行うことができる。ただし、当社の事前書面による同意を得る必要がある。また、当社は2020年販売契約において、株式の売却を義務付けられるものではない。当社または Sales Agents は、条件に応じて互いに通知を送信することにより、株式のオファリングを中止または終了することができる。Sales Agents は、商業上合理的な方法で通常の取引や販売の実践方法、および適切な州法、連邦法、規則、法規、そして Nasdaq の規則に基づき代理で行動するものとする。
14
アナベックス ライフサイエンス株式会社。
財務諸表の簡略集計に関する注記
2024年6月30日
(未確定)
会社は2020年の販売契約に基づく株式の売却手数料として、売上高の最大%を販売代理人に支払うことに同意しました。会社はまた、慣例的な免責および貢献権を販売代理人に提供することにも同意しました。2024年6月30日までの9か月間および2023年、発行に基づく株式が売却されました。2024年6月30日時点で、有効な登録声明に基づいて、$(100万)の金額が登録されました。会社は2024年7月24日に2020年の販売契約を終了しました。
2023年購入契約
2023年2月3日、同社はリンカーン・パーク・キャピタル・ファンド、LLC(「リンカーン・パーク」)との15億ドルの購入契約(「2023年購入契約」)を締結し、同社はリンカーン・パークに対して普通株式の売り及び発行の権利を有し、リンカーン・パークは2026年2月3日までの3年間、時期を問わず最大1.5億ドル相当の普通株式を購入する義務を負う。
2023年購入契約を締結することを考慮して、同社はリンカーンパークに普通株式の株式をコミットメント料として発行し、さらにその株数を追加することに同意しました。同社はリンカーンパークに普通株式の株式をコミットメント料として発行し、さらにその株数を追加することに同意した。同社は、自己の裁量により、リンカーンパークが1億5000万ドルの総コミットメントを購入した場合、比例的に最大額の1000万ドルの普通株式を発行することに同意しました。
2024年6月30日までの9ヶ月間、同社は2023年購入契約に基づき、リンカーン・パークに対して、総計2455646株の普通株式を発行し、そのうち11383200ドルの購入価格で、普通株式の株式を発行しています。2023年6月30日までの9ヶ月間、同社は、2023年購入契約に基づき、リンカーンパークに対して、総計3138348株の普通株式を発行し、そのうち26687017株の普通株式のコミットメント・シェアおよび13348株のコミットメント・シェアと初期コミットメント・シェアを含みます。 2023年購入契約に基づく普通株式の株式発行を含め、2455646株の普通株式 11283200ドルの総購入価格での株式発行を含む普通株式の株式数
2024年6月30日に、金額$
ノート6コミットメントとコンティンジェンシー
リース
会社は、12ヶ月以下の初期期間を持つ運転リースによってオフィススペースをリースしています。オフィスリースの条件により、会社は運営費用の相当なシェアを支払うことが求められています。
2024年6月30日および2023年の三か月と九か月間にわたり、運営リース費用は以下のとおりです(千ドル単位):
| 2024年6月30日終了の3か月間 | 6月30日までの9ヶ月 | |||||||||||||||
| 2024 | 2023 | 2024 | 2023 | |||||||||||||
| リース料:オペレーティングリース費用 | $ | $ | $ | $ | ||||||||||||
従業員401(k)年金制度
同社は、内国税法第401(k)条に基づく定義貢献型貯蓄プランを持っている。同プランは、全米の従業員を対象としている。プランに参加できる米国の従業員は、内国歳入庁の規定に従って現在の法定制限額まで貢献できる。401(k)プランは、社員の貢献に代わる追加のマッチング貢献を同社に許可している。
15
2023年および2024年6月30日終了時点で、会社は以下のように401(k)プランに対する追加拠出金を行いました(千ドル単位):
| 2024年6月30日終了の3か月間 | 6月30日までの9ヶ月 | |||||||||||||||
| 2024 | 2023 | 2024 | 2023 | |||||||||||||
| 401(k)プランへの貢献 | $ | $ | $ | $ | ||||||||||||
訴訟
会社はビジネスの通常運営に起因する主張や訴訟に対象となっています。そのような問題は本質的に不確実であり、そのような問題の結果が会社に有利に決定される保証はなく、そのような問題の解決が会社の財務諸表に対して重大な不良影響をもたらすことはないという保証もありません。会社は、そのような保留中の主張や訴訟のうち、いずれも自己の財務諸表に対して重大な不良影響をもたらすとは思っていません。
2024年3月13日、米国ニューヨーク南部地区連邦地方裁判所において、株主集団訴訟が起こされました。 この訴訟は、訴状にBlum v. Anavex Life Sciences, Corp. et al.、事件番号は1:24-cv-01910で、当社と Christopher Misslingを被告として名指しされています。 訴状は、特定の臨床試験に関する開示および発言に対する、1934年証券取引法違反を主張しています。®2-73. 2024年7月12日、原告代表が修正訴状を提出しました。当社は、この訴状が根拠なしであると考えています。当社は、弁護に精力的に取り組んでおり、訴訟で主張されるすべての請求を取り下げさせる可能性を追求しています。
2024年5月8日、同社の別の株主が同じ被告を相手に同様の主張を起こすことを目的とした訴訟を起こし、加えてAVATAR試験に関する開示と声明に関する主張を提起しました。株主は、訴訟を統合し、統合された訴訟のリードプレイントとして指名されるよう求めました。裁判所は、2024年6月13日に統合動議とリードプレイント動議を否認しました。同社は、この訴訟を強く防御する予定です。
2024年5月13日、自称株主が会社を代表して取締役会に対して代表訴訟を提起しました。クレームは様々な一般法的主張(違反行為)と同様に、一定の臨床試験に関する開示と声明について、二つの自称集団訴訟での主張を問題視した第14条(a)違反に関するものです。会社は名義上の被告として名指されています。被告は訴訟を激しく抗弁する予定です。
シェア購入ワラント
以下に、会社の未決済の株式購入ワラントの状況の概要を示します。
| ワランツの数 | 加重平均行使価格 ($) | ||||||||
| 2022年と2023年の9月30日の残高 | |||||||||
| 期限切れ | ( | ) | |||||||
| 2024年6月30日の残高 | |||||||||
2024年6月30日時点で、会社は以下のように未行使株式購入権を持っていました:
| 番号 | 行使価格 | 満期日 | ||||||
| $ | | |||||||
株式ベースの報酬プラン
2015年株式オプションプラン
2015年オムニバスインセンティブプラン(以下、「2015 Plan」)が、2015年9月18日に、当社の取締役会によって承認されました。このプランは、当社の役員、社員、顧問に株式オプションや制限株式を付与することを規定しています。
当社の発行済み普通株式の最大数は株式、会社の資本構造変更があった場合に調整の対象となる。
16
アナベックス ライフサイエンス株式会社。
財務諸表の簡略集計に関する注記
2024年6月30日
(未確定)
2019年株式オプションプラン
2019年1月15日、当社の取締役会は、2019年オムニバスインセンティブプラン(以下、「2019 Plan」)を承認し、当社の取締役、役員、社員、顧問、アドバイザーに対する株式オプションや制限株式を付与することを規定しています。
当社の発行済み普通株式の最大数は株式、会社の資本構造変更があった場合に調整の対象となる。
2022年9月30日までの1年間において、2019年度計画および2015年度計画で以前に利用可能であったオプションは、2022年度計画の下で以前に利用可能でありました(以下で定義されています)。
2022年株式オプション計画
2022年3月25日に、理事会は2022年オムニバスインセンティブプラン(以下、「2022年プラン」といいます)を承認しました。2022年プランは、2022年5月24日に株主に承認されました。2022年プランの条件に従い、追加の普通株式の株式発行枚数が、2019年度計画および2015年度計画の下で利用可能な株式に追加して、計画の下で発行可能になります。以前の株式オプション計画の下で未払いの報酬は、そのような計画の下で支払われ続け、そのような計画の下で未払いの報酬の対象となっている株式は、(株での精算を理由とすることを除き)自動的に2022年プランの下で発行可能になります。
2022年プランは、理事会によって管理されることができます。また、理事会は、その責任を委員会に委任することができます。行使価格は、授与時に理事会によって決定され、その日の公正市場価値に少なくとも等しくなければなりません。授与日に株式の10%以上を保有する者は、行使価格は、その日の当社の普通株式の公正市場価額の110%未満とはなりません。株式オプションは、該当オプションの授与日から10年間、または理事会が決定するより短い期間まで授与することができます。ただし、2022年プランの条件に従って早期に終了する場合があります。2024年6月30日時点で、
以下は、2023年9月30日終了時および2024年6月30日までの9か月間の株式オプションの活動に関する情報をまとめたものです。
| オプション数 | 加重平均行使価格 ($) | 加重平均授与日フェアバリュー ($) | 集計内在価値 ($) | ||||||||||||||
| 2022年9月30日時点で未決済のオプション | |||||||||||||||||
| 承諾されました | — | ||||||||||||||||
| 行使 | ( | ) | |||||||||||||||
| 没収 | ( | ) | — | ||||||||||||||
| 2023年9月30日まで有効な優れたもの | |||||||||||||||||
| 承諾されました | — | ||||||||||||||||
| 行使 | ( | ) | |||||||||||||||
| 没収 | ( | ) | — | ||||||||||||||
| 2024年6月30日時点で未決済 | |||||||||||||||||
| 2024年6月30日現在、行使可能な株式数 | |||||||||||||||||
17
アナベックス ライフサイエンス株式会社。
財務諸表の簡略集計に関する注記
2024年6月30日
(未確定)
以下は、2024年6月30日時点の株式オプションの行使価格範囲に関する情報の概要です。
| 行使価格の範囲 | 保有する株式数 | 加重平均残存償還期間 | 会計期間終了日 % of 前期同期日 % of | 保有する株式数 | 会計期間終了日 % of 前期同期日 % of | |||||||||||||||||||||
| 発 | 着 | 未行使オプション数 | 契約期間(年) | 加重平均行使価格は1株あたり3.79ドルです。 | 付与済オプション数 | 加重平均行使価格は1株あたり3.79ドルです。 | ||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | $ | $ | |||||||||||||||||||||||
| $ | $ | |||||||||||||||||||||||||
2024年6月30日に付与されたオプションの加重平均の公正価値は$でした。です(2023年9月30日:$2024年6月30日時点で、未行使のオプションの加重平均契約期間は 年です(2023年9月30日:年)、行使可能なオプションについては年です(2023年9月30日: 年でした。
累積固有価値は、2024年6月30日にイン・ザ・マネーとなったオプションに対して、基礎となる賞与の行使価格と、会社の株価の引用市場価格との差額で計算されます。
2024年6月30日までの3か月と9か月間において、当社はサービスの提供に対するストックオプションおよびワラントの発行およびベスト時に関連して、それぞれ1百万ドル、2023年には1百万ドルの株式報酬費用を認識しました。これらの金額は、次のように当社の要約連結決算表における一般および管理費用、研究開発費用に含まれています。(単位:千ドル)百万ドルと$ 2023年の場合は、それぞれ1百万ドルです。百万ドルと$ 。これらの金額は、次のように当社の要約連結決算表における一般および管理費用、研究開発費用に含まれています。(単位:千ドル)
| 2024年6月30日終了の3か月間 | 6月30日までの9ヶ月 | |||||||||||||||
| 2024 | 2023 | 2024 | 2023 | |||||||||||||
| 一般管理費用 | $ | $ | $ | $ | ||||||||||||
| 研究開発 | ||||||||||||||||
| 株式報酬総額 | $ | $ | $ | $ | ||||||||||||
およそ $の金額 百万株ベース 報酬は、2026年度までのそのようなオプションの残りの期間にわたって計上される予定です。
2024年6月30日および2023年終了時の3か月および9か月にわたって付与された各オプションのフェアバリューは、以下の重み付け平均前提に基づいて、グラント日にブラック-ショールズオプション価格モデルを使用して見積もられます。
| 2024 | 2023 | |||||||
| リスクフリー金利 | % | % | ||||||
| オプションの期待寿命(年) | ||||||||
| 年間ボラティリティー | % | % | ||||||
| 配当率 | % | % | ||||||
2024年6月30日および2023年6月30日に終了した3か月および9か月に認識された株式報酬費用の公正価値は、付与日に会社の株式の報告された市場価格を参考に決定されました。
注 7 後続イベント
2024年7月24日、会社は2020年の販売契約を終了しました。
18
種類2. マネジメントによる財務状況と業績の分析
出典:Nutex Health, Inc。
この10-Qフォームの四半期報告書には、将来に関する見解が含まれています。この四半期報告書10-Qに含まれる歴史的事実以外のすべての声明、当社が予期する将来の臨床および規制上の重要なマイルストーンイベント、将来の財務状況、ビジネス戦略および計画、および当社の経営陣が将来の業務のための目的を立てる計画を含む、業務戦略と計画に関する声明は、将来を見据えた声明です。「信じる」「可能性がある」「推定する」「継続する」「予想する」「意図する」「予期する」「予測する」「潜在的な」「予想される」「行うつもりである」「示唆する」「計画する」などの表現は、当社に関連するものであり、将来を見据えた声明を特定するために意図されています。このような将来を見据えた声明には、次のようなものが含まれます。:
| ● | 当社株価と市場全般の変動; | |
| ● | 当社の製品候補に関するクリニカル試験の実施の成功; | |
| ● | 追加資本を有利な条件で調達する能力とその活動が株主や株価に与える影響; | |
| ● | 売上高を生成する能力、または事業を継続する能力; | |
| ● | 予算内で時間通りに研究開発計画を実行する能力; | |
| ● | 製品候補が有効性または受容可能な安全性プロファイルを示す能力; | |
| ● | 有資格な科学協力者のサポートを受け取る能力; | |
| ● | 販売承認が得られた場合、製品候補のいずれかを単独でまたは商業パートナーと共同で成功裏に販売する能力; | |
| ● | 追加の製品候補を識別および取得する能力; | |
| ● | クリニカル試験以外の研究を第三者に依存する場合の能力; | |
| ● | 製品責任請求を防御する能力; | |
| 普通株式 | セキュリティ侵害に対する防御能力; | |
| ● | 製品候補の知的財産保護を十分に取得および維持する能力; | |
| ● | 知的財産ライセンス契約に従う能力; | |
| ● | 知的財産侵害請求に対する防御能力; | |
| ● | 政府特許庁の維持要件を遵守する能力; | |
| ● | 世界中で自社の知的財産権を保護する能力; | |
| ● | 競合関係; | |
| ● | 現在実施中および将来のクリニカル試験の予想開始日、期間および完了日; | |
| ● | 将来のクリニカル試験の予想デザイン | |
| ● | 適格な従業員を引きつけ、維持する能力; | |
| ● | 実際のFDA承認を受けるためのファストトラック指定の影響; | |
| ● | 孤児薬またはファストトラック指定を含む製品候補の開発と市場化のために規制当局への今後の申請と承認を受ける能力;および | |
| ● | 今後のキャッシュポジションと事業運営のための資金調達の能力。 |
我々は、規制当局、財務動向、財務状況、業績、ビジネス戦略、事前臨床試験および臨床試験への予想される反応を含む将来のイベントに関する現在の期待と予測に基づいて、これらの先見的声明を立てています。これらの先見的な声明は、年次報告書の第I部、項目1Aの「リスク要因」に記載されているリスクを含め、数多くのリスク、不確実性、仮定に従うもので、これらのリスクは完全なものではありません。この四半期報告書の他のセクションには、当社のビジネスおよび財務業績に否定的な影響を与える可能性のある追加要因が含まれています。さらに、我々は非常に競争力のある急速に変化する環境で事業を行っています。新しいリスク要因が時々現れますし、全てのリスク要因を我々の管理チームが予測することはできませんし、リスク要因が我々の事業に与える影響を評価することもできません。将来のイベントに対する先見的な声明を予測にしないでください。先見的な声明には、実際の結果と異なる場合があり、イベントと状況は、先見的な声明に反映されたとおりに達成されるとは限らず、我々は、それらのイベントおよび状況が実現されるかどうかを保証することはできません。また、米国の証券法を含む適用法により求められる以外に、先見的な声明を更新または補完する必要はないと思われます。
19
この第10-Qフォームの四半期報告書で使用される「我々」、「私たち」、「私たちの」、「会社」、「Anavex」は、その文脈が明らかに示していない限り、Anavex Life Sciences Corp.を意味します。
私たちの現在のビジネス
アナベックス・ライフ・サイエンシズは、高い未満たされた需要を持つ中枢神経系(「CNS」)疾患に対して、精密医療を適用した差別化治療薬の開発に従事する臨床段階のバイオ製薬企業です。私たちは、臨床試験からゲノムデータを分析して、バイオマーカーを特定し、それを臨床試験の解析に利用しています。
私たちの主力製品候補であるアナベックス®2-73 (ブラーカメシン)は、アルツハイマー病、パーキンソン病、そして潜在的に他の中枢神経を治療するために開発されています の突然変異によって引き起こされるまれな重度の神経性単原性障害であるレット症候群などの希少疾患を含むシステム疾患 X連鎖遺伝子、メチルCPG結合タンパク質2(「MECP2」)。
現在、当社は2つの基幹プログラムと2つのシードプログラムを有しています。 当社の基幹プログラムは、神経変性疾患および神経発達障害に関する臨床および臨床前段階の開発のさまざまな段階にあります。
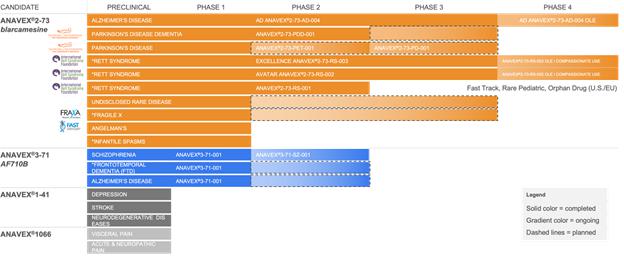
以下の表は、当社のプログラムに関する重要な情報をまとめたものです:

*=FDAによる孤児薬品指定
アナベックスは、シグマ-1受容体(SIGMAR1)結合活性にバリエーションがある化合物のポートフォリオを持っています。 SIGMAR1遺伝子はSIGMAR1タンパク質をコードし、細胞間のコミュニケーションに重要な役割を持つ細胞内シャペロンタンパク質です。 SIGMAR1はまた、核外膜での転写調節にも関与し、活性化された場合に細胞機能のホメオスタシスと回復を刺激します。我々の化合物が定量的にSIGMAR1を活性化する能力を検証するために、スタンフォード大学との協力の下、マウスで定量的な陽電子放射断層撮影(PET)イメージングスキャンを行い、投与量依存性のANAVEX2-73(ブラルカメシン)のターゲットエンゲージメントまたは受容体占有率が脳内SIGMAR1と示されました。®脳内でのSIGMAR1に対するANAVEX2-73(ブラルカメシン)のターゲットエンゲージメントまたは受容体占有率は、投与量依存性が示されました。
20

出典:Reyes Sら、Sci Rep。2021年8月25日; 11(1):17150
細胞ホメオスタシス
多くの疾患は、脳細胞の慢性的なホメオスタシスの不均衡や細胞ストレスによって直接引き起こされる可能性があります。小児疾患において、レット症候群や幼児けいれん症など、遺伝子の常時的な突然変異が慢性的な細胞ストレスを引き起こす可能性があります。老年性神経変性疾患であるアルツハイマー病やパーキンソン病において、慢性的な細胞ストレスは、細胞への侵害の積み重ねに伴う老化によって引き起こされる可能性があります。具体的には、タンパク質やリボ核酸(RNA)のホメオスタシスの欠陥が、神経細胞の死亡や神経系の機能障害を引き起こします。アルツハイマー病やパーキンソン病に見られるタンパク質病変は、タンパク質の合成、輸送、折りたたみ、処理または分解の障害から生じるタンパク質病所特有の特徴であるタンパク質病です。脳内の高分子の除去は、神経細胞の集合や退化を引き起こす不均衡に特に敏感です。たとえば、アルツハイマー病病理学は、アミロイドプラーク、神経原線維状タングル、微小グリアの炎症などのマーカーである高リン酸化Tauタンパク質の蓄積を特徴としています。SIGMAR1アゴニストによるSIGMAR1活性化、例えばANAVEX 2-73 (blarcamesine)により、細胞バランス(すなわちホメオスタシス)を回復することが、私たちのアプローチです。細胞ホメオスタシスの欠陥を正す治療法は、神経発達障害や神経変性疾患の進行を停止または遅延させる可能性があります。®セルラーバランス(すなわちホメオスタシス)を回復することを目的とする治療法は、神経発達障害や神経変性疾患の進行を停止または遅延させる可能性があります。SIGMAR1アゴニストによるSIGMAR1活性化、例えばANAVEX 2-73(blarcamesine)を使用した治療法が、細胞のバランスを回復することができます。
ANAVEX®2-73(ブラルカメシン)特異的な バイオマーカー
当社の一部の臨床試験において、私たちはゲノム解析を組み込んでおり、臨床プログラムが有益と考えられる潜在的な人口をよりよく理解することができます。私たちの臨床試験において、アルツハイマー病患者を対象に ANAVEX 2-73 (blarcamesine) を投与した場合の完全なゲノム解析を実施することで、実行可能な遺伝的変異を特定することができました。ゲノムバイオマーカー SIGMAR1(ANAVEX 2-73 (blarcamesine) の直接的なターゲット)と記憶機能に関与する遺伝子 COMt が、薬物反応レベルに重大な影響を与えることが特定され、ANAVEX 2-73 (blarcamesine) 特異的なバイオマーカー仮説が早期に確立されました。将来の研究で、発症前の患者を選別するために、SIGMAR1 のバイオマーカー変異をもつ患者(人口の約 10%〜20%)は、臨床的に有意な機能的および認知スコアの改善を示す患者の約 80%〜90%を同定することができます。 ANAVEX 2-73 (blarcamesine) に関連する同定された DNA と RNA データの一貫性は、アルツハイマー病の病理学とは独立したものであり、複数のエンドポイントと時間点での一致が示されており、ANAVEX 2-73 (blarcamesine) の精密医療臨床開発の可能性を支持しています。試験人口内で同定された遺伝子バイオマーカーを使用して ANAVEX 2-73 (blarcamesine) の作用機序を確認するか、ANAVEX 2-73 (blarcamesine) 治療に最も反応しやすい患者をターゲットにすることができます。将来的に、このようなアプローチをアルツハイマー病だけでなく、パーキンソン病認知症やレット症候群などの指標にも適用することがあります。ANAVEX 2-73 (blarcamesine) の現在の研究が行われています。®ANAVEX 2-73 (blarcamesine) 治療を受けたアルツハイマー病患者の完全なゲノム解析によって、実行可能な遺伝的変異を同定しました。®ANAVEX 2-73(blarcamesine)が直接のターゲットであるゲノムバイオマーカー SIGMAR1 と記憶機能に関与する遺伝子 COMt は、薬物反応レベルに重大な影響を与えることが特定され、ANAVEX 2-73(blarcamesine)特異的なバイオマーカー仮説が早期に確立されました。® 手数料を除く 発症前の患者を選別するために、SIGMAR1 のバイオマーカー変異を持つ患者(人口の約 10%〜20%)は、臨床的に有意な機能的および認知スコアの改善を示す患者の約 80%〜90%を同定することができます。®アルツハイマー病の病理学とは独立した ANAVEX 2-73(blarcamesine)に関連する同定された DNA と RNA データの一貫性は、精密医療臨床開発の可能性を支持しています。®試験人口内で同定された遺伝子バイオマーカーを使用して、ANAVEX 2-73(blarcamesine)の作用機序を確認するか、ANAVEX 2-73(blarcamesine)治療に最も反応しやすい患者をターゲットにすることができます。®ANAVEX 2-73(blarcamesine)のターゲット患者を確認するために、試験人口内で同定された遺伝子バイオマーカーを使用することができます。®将来的に、アルツハイマー病だけでなく、パーキンソン病認知症やレット症候群などの指標にも ANAVEX 2-73(blarcamesine)の精密医療臨床開発にこのようなアプローチを使用することがあります。®ANAVEX 2-73(blarcamesine)の現在の研究は、アルツハイマー病だけでなく、パーキンソン病認知症やレット症候群などの指標でも研究されています。
21
臨床試験の概要
認知症
2016年11月、ANAVEX2-73を使用した軽度〜中程度のアルツハイマー病患者を対象に、Part AおよびPart bから成る計57週間のフェーズ2a臨床試験を完了しました。このオープンラベル無作為化試験は、オーストラリアで主要および二次エンドポイントの両方を満たし、ANAVEX2-73の安全性と探索的な有効性を評価することを目的として設計されました。®ANAVEX2-73はシグマ-1およびムスカリン受容体をターゲットにしており、アルツハイマー病に見られる病理的な特徴を逆転し、細胞内恒常性を回復すると考えられる脳内のストレスレベルを低下させることを前臨床試験で示されています。2017年10月、フェーズ2a臨床試験の陽性の薬物動態学(PK)および薬力学(PD)データを発表しました。これにより、ANAVEX2-73と試験測定値の間に濃度-効果関係が確立されました。®2-73は、アルツハイマー病にみられる病態学的特徴を逆転させるとされる脳内ストレスを減らし、細胞内恒常性を回復させる作用があるという前臨床研究に基づいています。®この全ての患者によって取得された試験中の57週間の探索的な認知および機能的スコア、脳活動の生物マーカーシグナルを含む試験測定結果から、臨床試験はまた、ANAVEX2-73の活性代謝物(ANAVEX19-144)によって向上したことが示されました。この代謝物は、親分子よりも半減期が約2倍長くシグマr1受容体をターゲットにしています。®全セクターの翌月には、Part AおよびPart Bから成る合計57週間のアナベックス2-73の第2a相臨床試験、すなわち軽度〜中程度のアルツハイマー病患者のオープンラベル無作為化試験が完了しました。この臨床試験は、ANAVEX2-73と試験測定値の間に濃度-効果関係が確立され、アルツハイマー病における病理学的な特徴が逆転し、細胞内恒常性が回復すると考えられる脳内ストレスレベルを低下させることが前臨床試験で示されたシグマ-1およびムスカリン受容体をターゲットにする薬剤であるANAVEX2-73の安全性および探索的有効性を評価するために設計されました。全ての参加者から得られた試験中の57週間の探索的な認知および機能的スコア、脳活動の生物マーカー信号を含む測定結果は、ANAVEX2-73とANAVEX19-144の代謝活性が向上したことも示唆しています。®ANAVEX2-73の活性代謝物(ANAVEX19-144)の存在下でANAVEX2-73の活性が増強されたことも示唆されたシグマr1受容体もターゲットにする、代謝活性半減期が親分子よりも約2倍長いANAVEX19-144も同様にシグマr1受容体を効果的に止めることが既に前臨床試験で示されています。
第2a相の2回連続の試験拡張により、試験のPart bを52週間完了した参加者は、ANAVEX-2-73を継続して服用し続けることができるようになりました。®その結果、累積期間5年間にわたる拡大した安全性データを収集する機会が提供されました。2020年8月、これらの第2a相の試験拡張を完了した患者は、オーストラリア政府保健省の許可により、ANAVEX-2-73の治療を継続することが認められました。®また、オーストラリア政府保健省 - 臨床特例早期入手制度(特例使用承認制度)を通じて、ANAVEX-2-73の継続的なアクセスが許可されています。
ANAVEX 2-73のアルツハイマー病に対するより大きなフェーズ2b / 3の二重盲検プラセボ対照試験が2018年8月に開始されました。フェーズ2b / 3試験には509人の患者が登録され、便利な1日1回の経口製剤であるANAVEX 2-73を48週間投与され、2種類の異なるANAVEX 2-73療法またはプラセボにランダム化されました。試験は北アメリカ、ヨーロッパ、および豪州の52の施設で行われました。安全性、認知症および機能的有効性の両方を評価するための主要および二次エンドポイントは、アルツハイマー病アセスメントスケール-認知サブスケールテスト(ADAS-Cog)、アルツハイマー病共同研究-日常生活活動(ADCS-ADL)および認知および機能用のクリニカル認知障害評価-ボックスの合計(CDR-SB)を介して測定されました。これらのエンドポイントに加えて、ANAVEX 2-73のフェーズ2b / 3試験設計には、前もって指定された統計解析が組み込まれており、以前にANAVEX 2-73フェーズ2a臨床試験で同定された可能性のあるゲノム精密医療バイオマーカーに関連するものでした。試験は2022年半ばに完了し、2022年12月に会社はフェーズ2b / 3臨床試験の最上位の結果を発表しました。すべての統計分析は外部のコンサルティング会社によって実行されました。®ANAVEX 2-73のアルツハイマー病に対するより大きなフェーズ2b / 3の二重盲検プラセボ対照試験が2018年8月に開始されました。フェーズ2b / 3試験には509人の患者が登録され、便利な1日1回の経口製剤であるANAVEX 2-73を48週間投与され、2種類の異なるANAVEX 2-73療法またはプラセボにランダム化されました。®ANAVEX 2-73のアルツハイマー病に対するより大きなフェーズ2b / 3の二重盲検プラセボ対照試験が2018年8月に開始されました。フェーズ2b / 3試験には509人の患者が登録され、便利な1日1回の経口製剤であるANAVEX 2-73を48週間投与され、2種類の異なるANAVEX 2-73療法またはプラセボにランダム化されました。®ANAVEX 2-73のアルツハイマー病に対するより大きなフェーズ2b / 3の二重盲検プラセボ対照試験が2018年8月に開始されました。フェーズ2b / 3試験には509人の患者が登録され、便利な1日1回の経口製剤であるANAVEX 2-73を48週間投与され、2種類の異なるANAVEX 2-73療法またはプラセボにランダム化されました。®ANAVEX 2-73のアルツハイマー病に対するより大きなフェーズ2b / 3の二重盲検プラセボ対照試験が2018年8月に開始されました。フェーズ2b / 3試験には509人の患者が登録され、便利な1日1回の経口製剤であるANAVEX 2-73を48週間投与され、2種類の異なるANAVEX 2-73療法またはプラセボにランダム化されました。試験は北アメリカ、ヨーロッパ、および豪州の52の施設で行われました。安全性、認知症および機能的有効性の両方を評価するための主要および二次エンドポイントは、アルツハイマー病アセスメントスケール-認知サブスケールテスト(ADAS-Cog)、アルツハイマー病共同研究-日常生活活動(ADCS-ADL)および認知および機能用のクリニカル認知障害評価-ボックスの合計(CDR-SB)を介して測定されました。これらのエンドポイントに加えて、ANAVEX 2-73のフェーズ2b / 3試験設計には、前もって指定された統計解析が組み込まれており、以前にANAVEX 2-73フェーズ2a臨床試験で同定された可能性のあるゲノム精密医療バイオマーカーに関連するものでした。®ANAVEX 2-73のアルツハイマー病に対するより大きなフェーズ2b / 3の二重盲検プラセボ対照試験が2018年8月に開始されました。フェーズ2b / 3試験には509人の患者が登録され、便利な1日1回の経口製剤であるANAVEX 2-73を48週間投与され、2種類の異なるANAVEX 2-73療法またはプラセボにランダム化されました。試験は北アメリカ、ヨーロッパ、および豪州の52の施設で行われました。安全性、認知症および機能的有効性の両方を評価するための主要および二次エンドポイントは、アルツハイマー病アセスメントスケール-認知サブスケールテスト(ADAS-Cog)、アルツハイマー病共同研究-日常生活活動(ADCS-ADL)および認知および機能用のクリニカル認知障害評価-ボックスの合計(CDR-SB)を介して測定されました。これらのエンドポイントに加えて、ANAVEX 2-73のフェーズ2b / 3試験設計には、前もって指定された統計解析が組み込まれており、以前にANAVEX 2-73フェーズ2a臨床試験で同定された可能性のあるゲノム精密医療バイオマーカーに関連するものでした。試験は2022年半ばに完了し、同年12月に会社はフェーズ2b / 3臨床試験の最上位の結果を発表しました。すべての統計分析は外部のコンサルティング会社によって実行されました。
さらに、すべての事前指定臨床エンドポイントは、繰り返し測定モデル(MMRM)を使用して分析されました。 多重性制御規則の下、各エンドポイントの有意性がP<0.05である場合、または1つの共同主要エンドポイントの有意性がP<0.025である場合、試験は共同主要エンドポイントを満たすために成功します。主要エンドポイントが1つだけで、0.025のαレベルで有意である場合、2次エンドポイントは同じ0.025のレベルで評価されます。 ANAVEX 2-73とプラセボ群のADAS-Cog13の最小二乗平均(LSM)変化の差およびCDR-Sbの変化の差は、早期のアルツハイマー病患者においてP<0.025のレベルで有意であったため、この試験は成功しました。®早期アルツハイマー病患者における、ADAS-Cog13およびCDR-Sbに対するANAVEX 2-73とプラセボ群の最小二乗平均変化の差は、P<0.025のレベルで有意であったため、この試験は成功した。
個別投与群とプラセボの比較は、blarcamesineの有効性も支持しています。主要エンドポイントであるADAS-Cog13において、blarcamesineは、50 mgグループ(-2.149;P = 0.021)および30 mgグループ(-1.934;P = 0.026)の両方でプラセボよりも有意に優れており、48週間の臨床進行を、50 mgおよび30 mgグループではそれぞれ38.5%、34.6%遅らせたことを示しています。機能的な共同主要エンドポイントであるADCS-ADLは、48週時点で正の方向に傾いていましたが、有意差に達していませんでした。主要な第二エンドポイントであるCDR-Sbは、50 mg(-0.465;P = 0.045)および30 mg(-0.502;P = 0.020)グループの両方で、48週時点でプラセボに比べて有意に改善されました。CGI-Iも、50 mgグループ(-0.314;P = 0.008)および30 mgグループ(-0.248;P = 0.024)の両方で、48週時点でプラセボに比べて有意に改善されました。血漿Aβ42/40比率および脳萎縮の低下などのバイオマーカーによって、これらの結果が支持されています。Blarcamesineは、全脳(37.6%)、全灰白質(63.5%)、側脳室(25.1%)を含む重要領域で、脳萎縮を有意に遅らせました。 63.5%の全灰白質、25.1%の側脳室を含む、The comparison of individual dose groups vs placebo also supports blarcamesine’s efficacy. For the primary endpoint ADAS-Cog13, blarcamesine is significantly better than placebo for both the 50 mg (−2.149; P = 0.021) and the 30 mg (−1.934; P = 0.026) blarcamesine dosage groups at Week 48, representing that blarcamesine slowed clinical progression at 48 weeks by 38.5% and 34.6% in 50 mg and 30 mg groups vs. placebo, respectively. The functional co-primary endpoint, ADCS-ADL, was trending in a positive direction but did not reach significance at Week 48. The key secondary endpoint CDR-Sb was significantly improved vs. placebo in both 50 mg (−0.465; P = 0.045) and 30 mg (−0.502; P = 0.020) groups at Week 48. CGI-I was also significantly improved vs. placebo in both the 50 mg (−0.314; P = 0.008) and the 30 mg (−0.248; P = 0.024) groups at Week 48. The findings are supported by biomarkers, including plasma Aβ42/40-ratio and reduction of brain atrophy. Blarcamesine significantly slowed brain atrophy in key regions of interest, including the whole brain by 37.6%, total grey matter by
それぞれの安全集団において、一般的な治療関連の副作用はめまいであり、一過性であり、主に軽度から中程度の重症度であり、ANAVEX®2-73を使用した調節中に120人(35.8%)で、プラセボのチトレーション中に10人(6.0%)とメンテナンス中に9人(5.6%)で発生しました。
ANAVEXの追加の長期オープンラベル拡張研究が行われました®48週間の第2b/3フェーズプラセボ対照試験を完了した患者を対象に、ATTENTION-AD試験として知られる2-73の拡張試験が開始されました。96週間にわたる試験延長は2024年6月に完了しました。 この試験では、アルツハイマー病患者におけるANAVEX 2-73の追加の長期安全性および有効性データを提供します。®アルツハイマー病患者における2-73の効果について、試験が行われました。
22
レット症候群
2016年2月、私たちはRett症候群というまれな神経発達障害に対するANAVEX-2-73の前臨床データを発表しました。このデータでは、神経症状がRett症候群を模倣するMECP2-null突然変異を有するマウスモデルにおいて、行動および歩行パラダイムの多くで量依存性の著しい改善が示されました。この研究は国際Rett症候群財団(「Rettsyndrome.org」)によって資金提供されました。2017年1月、私たちはRett症候群の治療におけるANAVEX-2-73の多施設第2相臨床試験の一部をカバーするために、Rettsyndrome.orgから少なくとも60万ドルの資金援助を受けました。この賞は2018年度から開始された四半期支払いで受け取りました。®Rett症候群の治療に対するANAVEX-2-73の多施設第2相臨床試験の一部をカバーするために、Rettsyndrome.orgから少なくとも60万ドルの資金援助を受けました。この賞は2018年度から開始された四半期支払いで受け取りました。®2018年度から開始された四半期支払いで、Rett症候群の治療に対するANAVEX-2-73の多施設第2相臨床試験の一部をカバーするためにRettsyndrome.orgから少なくとも60万ドルの資金援助を受けました。
2019年3月、ANAVEXの計画されたRett症候群プログラムの第2フェーズの臨床試験を開始しました。この臨床試験は、ANAVEX 2-73の経口液体一日1回の投与形態を使用し、患者の年齢や地理的領域の範囲内で実施されています。®Rett症候群の治療のためのANAVEX 2-73の臨床試験は、患者の年齢層や地理的領域の範囲内で、口内液一日一回投与の形で実施されています。®ANAVEX 2-73の治療のための臨床試験が行われています。
第1フェーズ2試験(ANAVEX 2-73-RS-001)は、アメリカで実施され、2020年12月に完了しました。この試験は、25人のRett症候群の成人女性患者を対象とした、ランダム化二重盲検プラセボ対照の安全性、耐容性、Pkおよび有効性試験で、経口液状ANAVEX 2-73の試験で、ANAVEX 2-73特異的なゲノム精密医療バイオマーカーを含みました。1次試験エンドポイントは安全性でした。5mgのANAVEX 2-73の投与はよく耐えられ、投与量に比例したPkを示しました。試験のすべての2次評価エンドポイントは、Rett症候群行動尺度(「RSBQ」)の反応においてプラセボと比較して意図的に治療(ITT)集団全体(全参加者、p=0.011)で統計学的に有意で臨床的に有意な反応を示しました。ANAVEX 2-73を投与した被験者の66.7%が、ITT集団(全参加者、p=0.011)でプラセボの被験者の10%に比べて統計学的に有意なRSBQの応答改善を示しました。ANAVEX 2-73の治療は、ITT集団(全参加者、p = 0.014)でプラセボと比較して、7週間の臨床試験全体で持続的な臨床グローバル印象改善(CGI-I)反応の向上につながりました。これは、以前のANAVEX 2-73臨床試験と一致しています。ANAVEX 2-73で治療された、SIGMAR1遺伝子の一般的な形を持つ患者は、既定の有効性エンドポイントでより強い改善を経験しました。®2-73-RS-001における最初のフェーズ2試験は、アメリカで行われ、2020年12月に完了しました。この試験は、25人の成人女性患者を対象とし、口から摂取する液体のANAVEX 2-73の安全性、耐容性、Pkおよび有効性をプラセボ対照二重盲検法で評価しました。ANAVEX 2-73固有のゲノム精密医療バイオマーカーを含め、7週間の治療期間を含みました。試験の主要評価項目は安全性でした。5mgのANAVEX 2-73の投与は、用量比例のPkを示し、よく耐えられました。試験のすべての2次有効性評価項目は、意図的に治療された(ITT)集団全体で、Rett症候群行動尺度レスポンス(RSBQ)においてプラセボと比較して統計的に有意で臨床的に意義のある反応を示しました(全参加者、p = 0.011)。ANAVEX 2-73を投与した被験者の66.7%はITT集団(全参加者、p = 0.011)で応答の改善がプラセボの被験者の10%に比べて統計学的に有意であることを示しました。ANAVEX 2-73の治療は、ITT集団(全参加者、p = 0.014)で持続的な臨床グローバル印象改善(CGI-I)反応の向上が見られ、7週間の臨床試験期間でプラセボと比較して有意でした。以前のANAVEX 2-73の臨床試験と一貫した結果です。ANAVEX 2-73で治療されたSIGMAR1遺伝子の一般的な形を持つ患者は、治療反応指標でより強い改善を示しました。®Rett症候群を持つ25人の成人女性患者を対象とした2-73の口から摂取する液体ANAVEX治療を含む、7週間の治療期間を有する、ランダム化二重盲検プラセボ対照の安全性、耐容性、Pkおよび有効性試験(ANAVEX 2-73-RS-001試験)について、主要評価項目は安全性でした。試験のすべての2次有効性評価項目は、意図的に治療された(ITT)集団全体で、Rett症候群行動尺度レスポンス(RSBQ)においてプラセボと比較して統計的に有意で臨床的に意義のある反応を示しました(全参加者、p = 0.011)。ANAVEX 2-73を投与した被験者の66.7%はITT集団(全参加者、p = 0.011)で応答の改善がプラセボの被験者の10%に比べて統計学的に有意であることを示しました。®試験の主要評価項目は安全性であり、25人の成人女性患者を対象とした2-73の口から摂取する液体ANAVEX治療を含む、7週間の治療期間を有する、ランダム化二重盲検プラセボ対照の安全性、耐容性、Pkおよび有効性試験でした。試験のすべての2次有効性評価項目は、意図的に治療された(ITT)集団全体で、Rett症候群行動尺度レスポンス(RSBQ)においてプラセボと比較して統計的に有意で臨床的に意義のある反応を示しました(全参加者、p = 0.011)。ANAVEX 2-73を投与した被験者の66.7%はITT集団(全参加者、p = 0.011)で応答の改善がプラセボの被験者の10%に比べて統計学的に有意であることを示しました。®試験のすべての2次有効性評価項目は、意図的に治療された(ITT)集団全体で、Rett症候群行動尺度レスポンス(RSBQ)においてプラセボと比較して統計的に有意で臨床的に意義のある反応を示しました(全参加者、p = 0.011)。ANAVEX 2-73を投与した被験者の66.7%はITT集団(全参加者、p = 0.011)で応答の改善がプラセボの被験者の10%に比べて統計学的に有意であることを示しました。®ANAVEX 2-73を投与した被験者の66.7%はITT集団(全参加者、p = 0.011)で応答の改善がプラセボの被験者の10%に比べて統計学的に有意であることを示しました。®ANAVEX 2-73の治療は、ITT集団(全参加者、p = 0.014)で持続的な臨床グローバル印象改善(CGI-I)反応の向上が見られ、7週間の臨床試験期間でプラセボと比較して有意でした。これは、以前のANAVEX 2-73臨床試験と一致しています。®以前のANAVEX 2-73臨床試験と同じく、ANAVEX 2-73で治療されたSIGMAR1遺伝子の一般的な形を持つ患者は、既定の有効性エンドポイントでより強い改善を経験しました。®以前のANAVEX 2-73臨床試験と同じく、ANAVEX 2-73で治療されたSIGMAR1遺伝子の一般的な形を持つ患者は、既定の有効性エンドポイントでより強い改善を経験しました。
ANAVEXの第2回国際試験であるAVATAR試験が、Rett症候群の治療に対して、2-73を用いたものであり、2019年6月に開始されました。®この試験は、Rett症候群のための米国ベースの第2相試験よりも高い投与量を使用して、オーストラリアとイギリスで行われました。この試験は、ANAVEX2-73の有効性と安全性を評価するために行われた、第3相ランダム化二重盲検プラセボ対照試験であり、成人患者33人を7週間の治療期間にわたり対象として、ANAVEX2-73専用の精密医療バイオマーカーも含まれていました。 米国の第2相Rett症候群試験(ANAVEX2-73-RS-001)からのフィードバックに基づき、AVATAR試験のエンドポイント(ANAVEX2-73-RS-002)を、国際協和医薬品開発手順(ICH)のガイドラインに従って適切に評価するように更新しました。これらの更新はAVATAR試験が行われたイギリスおよびオーストラリアの各規制当局によって承認されました。®ANAVEX2-73を使用した33人の成人患者を、ANAVEX2-73専用の精密医療バイオマーカーを含めた7週間の治療期間にわたり、第3相ランダム化二重盲検プラセボ対照試験に採用し、ANAVEX2-73の安全性と有効性を評価しました。®アメリカの第2相Rett症候群試験(ANAVEX2-73-RS-001)からのフィードバックに基づいて、AVATAR試験(ANAVEX2-73-RS-002)のエンドポイントを適切に評価するために、ANAVEX2-73専用の精密医療バイオマーカーを含む33人の成人患者を、7週間の治療期間にわたり、第3相ランダム化二重盲検プラセボ対照試験に採用しました。®AVATAR試験(ANAVEX2-73-RS-002)のエンドポイントを、国際協和医薬品開発手順(ICH)のガイドラインに従って適切に評価するために、アメリカの第2相Rett症候群試験(ANAVEX2-73-RS-001)から得られたフィードバックに基づいて、エンドポイントを更新しました。®AVATAR試験が行われたイギリスおよびオーストラリアの各規制当局によって、AVATAR試験(ANAVEX2-73-RS-002)のエンドポイントの更新が承認されました。
AVATAR試験からのデータは2022年2月に公開されました。この臨床試験は、すべての第一および第二有効性および安全性評価項目に満たし、主要有効性評価項目であるRSBQ応答(p=0.037)および副次的有効性評価項目であるADAMS(不安、抑うつおよびムードスケール)(p=0.010)およびCGI-I応答(p=0.037)に一貫性のある改善が見られました。有効性評価項目は、レット症候群の症状を統計的に有意で臨床的に有意な程度に減少させることを示しました。ANAVEX 2-73の1日1回の口内液体投与は、最大30mgまで便利で、良好な薬の服用順守性がありました。本試験に参加したすべての患者は、任意のオープンラベル拡張プロトコルおよびそれに続く同情的使用プログラムでANAVEX 2-73を受ける資格がありました。®全セクターの患者は、よい医薬品遵守性と共に、ANAVEX 2-73もよく耐えられました。®ボランタリーオープンラベル拡張プロトコルおよびその後の同情的使用プログラムにより、本試験に参加したすべての患者はANAVEX 2-73を受け取る資格がありました。
ANAVEXの非常に最初の試み®小児期レット症候群患者に対する2-73 EXCELLENCE試験は、2023年2月に登録を完了しました。この小児レット症候群患者のための無作為化二重盲検プラセボ対照の第2/3相試験は、カナダ、豪州、イギリスの試験サイトを含みました。5歳から17歳までの92人の小児レット症候群患者が、1日に最大30mgのANAVEXを投与されました。®2-73。参加者は2:1(ANAVEX:プラセボ)にランダム化され、12週間治療を受け、その後、第16週の安全性評価を行い、この試験のトップライン結果は、2024年1月初旬に発表されました。®
23
12週後、患者の介護者によって複数のRett症候群の特徴を評価するための詳細な45項目アンケートである主要共通エンドポイントRSBQに改善が見られました。 他の主要共通エンドポイントであるCGI-Iは、サイトの調査者が7点評価を用いて(1=「大いに改善した」から7=「非常に悪化した」まで)評価した、より詳細でない評価を表しませんでした。
定義済みの繰り返し測定用混合効果モデル(MMRM)法を使用したアドホック分析により、治療12週後のANAVEX 2-73投与患者のRSBQ総合スコアの平均(SE)が、プラセボ投与患者の平均(SE)である-8.32(2.537)点に対し-12.93(2.150)点向上しました。投与群とプラセボ群の平均差(SE)である-4.61(2.439)点は、統計学的有意性(n=77、p=0.063)に達しませんでした。ANAVEX 2-73-treated ®アドホック分析により、治療後4週間で、ANAVEX 2-73投与患者のRSBQ総合スコアの平均(SE)が、プラセボ投与患者の平均(SE)である-5.67(2.413)点に対し-10.32(2.086)点向上しました。投与群とプラセボ群の平均差(SE)である-4.65(2.233)点は、統計学的有意性(n=77、p=0.041)に達しました。 ®明らかな治療効果があります。ANAVEX 2-73-treated
主要セカンダリーエンドポイントであるADAMSも好ましい傾向を示しました。同様の解析において、全RSBQおよびADAMSのサブスケールのスコアは、研究期間中に改善されました。集合的に、RSBQおよびADAMSは、特に反復運動、夜間の妨害行動、社会的回避の複数の領域で改善が示されました。
安全性結果の暫定的なレビューによれば、ANAVEXに観察された好ましいかつ管理可能な安全性プロファイルが補強され、EXCELLENCE試験で新しい安全信号は見られませんでした。®2-73までの日付。
全セクターの試験に参加したすべての患者には、自発的なオープンラベル拡張プロトコルの下でANAVEXを受ける資格がありました。®2-73は自発的なオープンラベル拡張プロトコルの下で行われました。
オープンラベル延長(「OLE」)の高い登録率(91%を超える)と、慈善用途プログラムへの高い要求レベル(93%)は、慈善用途承認下でRET症候群患者からの報告された肯定的な実世界証拠(RWE)に堅固な数値的根拠を提供します。治験で薬剤またはプラセボを服用していた家族は、ANAVEX2-73を服用したことによる子供たちの日常生活の改善について肯定的にコメントしました。®慈善用途プログラムにおけるANAVEX2-73治療。
パーキンソン病
2016年9月に、アナベックスの前臨床データを発表しました。®パーキンソン病の動物モデルにおいて、行動、組織学的、神経炎症学的評価項目で有意な改善が示されました。この研究は、マイケル・J・フォックス財団によって資金提供されました。2017年10月には、アナベックス2-73が実験的パーキンソニズムにおいて強力な神経修復を引き起こすことを示す追加のデータが発表されました。®この前臨床試験モデルで得られた励みに加え、この製品候補がアルツハイマー病試験において好ましいプロファイルを有していることが示唆されており、アナベックス2-73がパーキンソン病性認知症の治療に有望であると考えています。®パーキンソン病性認知症の治療に、アナベックス2-73が有望であると考えられます。
2020年10月に、ANAVEX-2-73化合物を使用したパーキンソン病性認知症の認知と運動機能障害に対する効果を調べる、スペインおよび豪州での二重盲検、無作為化、プラセボ対照のPhase 2検証の概念証明試験が完了しました。®Phase 2試験は、約132名を14週間に渡り登録し、2種類のANAVEX-2-73用量(30mgと50mg)またはプラセボに1:1:1の割合でランダム化しました。®ANAVEX-2-73 Phase 2パーキンソン病性認知症試験デザインは、ANAVEX-2-73 Phase 2aアルツハイマー病試験で特定されたゲノム精密医療バイオマーカーを取り入れました。®また、ANAVEX-2-73 Phase 2試験には、ANAVEX-2-73 Phase 2aアルツハイマー病試験で特定されたゲノム精密医療バイオマーカーが組み込まれました。®
この試験では、ANAVEXが安全で、1日50 mgの経口投与まで適応可能であったことが示された。その結果、認知薬剤研究(“CDR”)コンピュータ化評価システム分析において、臨床的に有意で、投与量依存性があり、統計的に有意な改善が見られた。ANAVEXによる治療は、ドパミンエルゴチン製剤、レボドパなどの標準治療に加えて、14週間の治療後にパーキンソン病症状の重症度のグローバル総合スコア、MDS-Unified Parkinson’s Disease Rating Scale(“MDS-UPDRS”)総合評価の臨床的に有意な改善も示唆され、ANAVEX 2-73がパーキンソン病における進行する症状を遅延、逆転する潜在的な能力を持つことが示唆された。さらに、この試験は、遺伝子バイオマーカーとしてSIGMAR1を標的とする精密医療アプローチを確認し、ANAVEX 2-73が改善した臨床的アウトカムをもたらす可能性があることを確認した。®1日1回50mgまでの経口投与で、2-73は安全でありよく耐容性も示した。この結果、認知薬剤研究(“CDR”)コンピュータ化評価システムの分析で、臨床的意味のある、投与量依存的な、統計的に有意な改善が観察された。ANAVEX 2-73での治療は、14週間の治療後にパーキンソン病症状の重症度のグローバル総合スコア、MDS-Unified Parkinson’s Disease Rating Scale(“MDS-UPDRS”)総合評価の臨床的意義のある改善も示唆され、ドパミンエルゴチン製剤、レボドパ等の標準治療に加えて、その効能が確認された。それは、ANAVEX 2-73が、パーキンソン病の症状進行を遅らせ、逆転させる可能性を持つことを示唆をした。®パーキンソン病症状の重症度のグローバル総合スコア、MDS-Unified Parkinson’s Disease Rating Scale(“MDS-UPDRS”)総合評価のクリニック的に意義のある改善が標準治療、ドパミンエルゴチン製剤、レボドパ、およびその他の抗PD薬を含めた治療に加えて、2-73 ANAVEXの治療で14週間後に観察され、ANAVEX 2-73がパーキンソン病の進行する症状を遅らせ、逆転する可能性があることを示唆した。®ANAVEX 2-73がパーキンソン病における進行する症状を遅延、逆転する潜在的な能力を持つことを示唆し、遺伝子バイオマーカーとしてSIGMAR1を標的とする精密医療アプローチを確認するため、この試験を実施した。®ANAVEX 2-73による治療は、改善された臨床結果を引き起こす可能性があります。
24
ダブルブラインドのプラセボ対照の ANAVEX2-73-PDD-001 Phase 2 試験が完了した後、参加者には 48 週間の OLE ANAVEX2-73-PDD-EP-001 Phase 2 試験が提供されました。OLE 試験では、安全性、耐容性、効果を評価し、他のものの中で、MDS 統合パーキンソン病評価尺度パート I、II、III、REM 睡眠行動障害スクリーニング質問紙(RBDSQ)、臨床的総合印象 - 改善(CGI-I)、認知効果のエンドポイントモントリオール認知評価(MoCA)を 48 週間にわたって測定しました。
2023年3月、当社は初期段階のANAVEX2-73-PDD-EP-001 OLE試験データを報告し、ANAVEX2-73の長期的な良好な効果が示されたことがわかりました。®事前指定の主要および第二次元的目標において、ANAVEX2-73は良好なパフォーマンスを示しました。®前臨床試験において、ANAVEX2-73は一般的に安全であり、安全上の問題があった場合は既知の安全性プロファイルと一致していました。®効果に関しては、全ての有効性評価点において、患者はANAVEX2-73を服用した方が良好な結果が得られました。®COVID-19による薬剤休止期間中、全ての患者はDb EOTとOLE Baseline間での薬剤休止期間中に、予測される麻痺性疾患であるパーキンソン病においてMDS-UPDRS Part II + IIIおよびCGI-Iなどの各々の有効性評価点が悪化していました。しかしながら、患者が再びANAVEX2-73の日常的な経口投与を始めた後、OLE BaselineからOLE Week 24、OLE Week 48までの延長期間中、一貫して改善がみられました。®この研究で評価された主要および主要の二次評価点であるMDS-UPDRS Part II + IIIおよびCGI-Iは、当社が今後行う6か月間のパーキンソン病臨床試験の計画主要および主要の二次評価点です。
2021年1月に、我々はパーキンソン病に対するANAVEX2-73の開発のため、The Michael J. Fox Foundation for Parkinson’s Researchから100万ドルの研究助成金を受け取りました。®この助成金は、PETイメージングバイオマーカーの利用を探索し、パーキンソン病を持つ人々を含めた臨床的に関連性のある用量でSIGMAR1のターゲットエンゲージメントと経路活性化の測定を可能にすることを目的としています。
統合失調症、前頭側頭型認知症、アルツハイマー病
2020年7月には、ANAVEXの第一人者フェーズ1臨床試験が開始されました。®3-71. ANAVEX®FDAにより、前頭側頭型認知症(「FTD」)の治療に対してオーファンドラッグ指定を受けたことがあります。ANAVEX 3-71は、神経変性疾患に有益な作用を有するように設計された、σ-1およびM1ムスカリン受容体をターゲットとする経口投与の小分子です。事前臨床試験では、3-71は、アルツハイマー病の主要な特徴である認知障害、アミロイドとtauの病理学的異常、およびミトコンドリア機能障害および神経炎症に対して、疾患修飾活性を示しました。®3-71は、神経変性疾患に有益な作用を有するように設計された、σ-1およびM1ムスカリン受容体をターゲットとする経口投与の小分子です。 ANAVEX®3-71は、遺伝子組み換え(3xTg-AD)マウスにおいて、認知機能障害、アミロイドおよびtau病理学的異常、ミトコンドリア機能障害および神経炎症に対して疾患修飾作用を示しました。
第1フェーズ臨床試験は、オーストラリアでの前向き二重盲検ランダム化プラセボ対照試験でした。合計36名の健康男女が含まれました。健康なボランティアにおける食品摂取および性別の影響と、ANAVEX 3-71の安全性、耐容性、薬物動態学を評価するため、ANAVEX 3-71のシングルエスカレート性投与量が行われました。®ANAVEX 3-71の安全性、耐容性、薬物動態学を評価するために、ANAVEX 3-71の単回昇量投与が行われ、その食品および性別の影響が健康なボランティアにおいて調査されました。®そして、ANAVEX 3-71の単回昇量倍増投与によるANAVEX 3-71の薬物動態学とその食品及び性別の影響を評価するために、健康なボランティアに投与されました。
この試験は、安全性の主要および副次エンドポイントを満たし、重篤な有害事象(SAE)や投与量制限毒性は観察されませんでした。®ANAVEXを受け取ったすべてのコホートで安全に耐容された3-71®試験では、200 mgまでの単回投与量であるANAVEX 3-71が使用されました。すべての被験者で、重篤な有害事象(SAE)や有意な検査異常は観察されませんでした。®ANAVEX 3-71は、線形のPkを示しました。また、160mgまでの投与量において、薬物代謝動態学は投与量に比例的でした。性別は薬物代謝動態に影響を与えず、食事はANAVEX 3-71の生体利用性に影響を与えませんでした。®この試験は、ANAVEX 3-71の効果を特徴付ける副次目的を達成しました。®試験全体を通して、臨床的に有意な心電図(ECG)パラメーターはありませんでした。被験者のQTcF測定は、すべての投与量群で正常であり、ANAVEX 3-71とプラセボの間に違いはありませんでした。®ANAVEX 3-71とプラセボの間に違いはありませんでした。
2023年10月、Neurobiology of Aging誌に掲載された査読済み論文「アルツハイマー様アミロイド病理を示す遺伝子組み換えラットモデルにおけるM1およびsigma-1受容体アゴニストの早期治療による認知障害の予防」で、経口投与可能な小分子ANAVEXが注目されました。®プレクリニカルスタディにおいて、ANAVEX 3-71(AF710B)の潜在的な疾患修飾効果が述べられ、アルツハイマー病の潜在的な一日一回の経口予防戦略の可能な薬剤候補として述べられました。®アルツハイマー病に対する一日一回経口予防戦略の可能な薬剤候補としてANAVEX 3-71があり、この薬剤はアルツハイマー病の病理学に対しても効果を持つとされています。
25
2024年1月に、ジャーナル『Clinical Pharmacology in Drug Development』で他の査読済み出版物として公開された。 『Clinical Pharmacology in Drug Development』というジャーナルです。『フロントテンポラル認知症、統合失調症、アルツハイマー病の治療に開発中のノベルSigma-1受容体およびアロステリックM1ムスカリン受容体アゴニストであるANAVEX3-71の薬物動態と食物効果の人口ベースの特性評価』と題された文章。ANAVEX3-71の薬物動態と食物効果の人口ベースの特性評価は、健康な被験者を対象にした単回昇量試験の一部として行われた。主目的は、ANAVEX3-71の用量比例性を評価すること、および食事がANAVEX3-71の薬物動態に与える影響を特徴付けることであった。ANAVEX3-71の人口ベースの特性評価では、健康な被験者を対象とした単回昇量試験の一環として行われた。®主目的は、ANAVEX3-71の用量比例性を評価することであり、健康な被験者を対象にした単回昇量試験の一部として行われた。®ANAVEX3-71の薬物動態に対する食物の影響を特徴付けることが目的であった。®この特性評価の結果、ANAVEX3-71の単回昇量投与において、用量比例性があり、時間不変性があり、線形であることが示された。®食事がANAVEX3-71の薬物動態に影響を与えなかったことが示された。®この第一人称の研究で達成された安全性の目的をさらに拡大し、ANAVEX3-71の薬物開発プログラムをさらに支援する。®これは、ANAVEX3-71の初の人体試験における安全性目標をさらに拡大し、その薬物開発プログラムをさらに支援するデータです。
これらの結果に基づいて、またANAVEXに基づいて®3-71の試験管前プロフィールに基づき、ANAVEX3-71を進めるつもりです®アルツハイマー病、FTD、および統計的バイオマーカーを活用した治療の長期効果を評価するために、アナベックス3-71を臨床開発認知症プログラムに進める予定です®3-71。
統合失調症
2024年3月に、米国FDAが承認したANAVEX3-71-SZ-001臨床試験を開始しました。これは、2つの部分から構成される2相試験で、メイ数の高い用量を持つ統合失調症患者を対象に、28日間の治療を行います。治験には、統合失調症の標準的な臨床的アウトカム評価尺度であるPANSS(陽性・陰性症状尺度)が使用され、また、産業連合が開発した統合失調症における脳波/ERPバイオマーカーの進歩を活用した、新たな流体および電気生理的バイオマーカーも評価されます。電気生理学的バイオマーカーに加えて、統合失調症病態生理学とANAVEX3-71の交差点にある、新しい神経炎症性、代謝反応性、および転写バイオマーカーも適用されます。®ANAVEX3-71の3-71-SZ-001臨床試験は、二重盲検、プラセボ対照の2相試験で、統合失調症の患者による複数の昇量用法の探索と、更に大規模な集団における28日間の治療期間にわたって検査を行います。試験では、陽性・陰性症状尺度(PANSS)をはじめとする統合失調症の標準的臨床効果測定尺度を使用し、経頭蓋脳図または観察電位(EEG/ERP)バイオマーカーの進歩を協力企業連盟ERPバイオマーカー資格認定コンソーシアムと共同で開発します。電気生理学的バイオマーカーに加えて、新しい神経炎症性、代謝反応性、転写バイオマーカーも、統合失調症の病態生理学とANAVEX3-71の交差点で適用されます。®3-71は新しい二重作用機序を持っています。
私たちのパイプライン
私たちの研究開発パイプラインには、ANAVEXを含んでいます。®2-73は現在、3つの異なる臨床試験適応症で、その他数種類の化合物が臨床前段階や臨床開発の異なる段階にあります。
私たちの専有の SIGMACEPTOR™ ディスカバリープラットフォームは、シグマ受容体についての理解に基づいて、ユニークな作用機序を持つ低分子医薬候補を生み出しています。シグマ受容体は、アルツハイマー病などの神経変性疾患、および Rett 症候群などの神経発達性疾患を含む、多くの人間の疾患の治療ノドとなる可能性があります。適切なリガンドによって結合されると、シグマ受容体は、疾患の病原性(起源または発展)に関与する複数の生化学的シグナルの機能に影響を与えます。SARS-CoV-2 (COVID-19)を含む多くのウイルスは、細胞内ミトコンドリア細胞死とそれに関連する他の細胞的プロセスによって細胞ストレスを誘発し、生存と複製を確保します。そのため、SIGMAR1が細胞反応をウイルス感染に対して調節し、病原性を緩和する役割を果たす可能性があります。
私たちの研究対象となった化合物には以下が含まれます:
ANAVEX®2-73 (ブラルカメシン)
私たちはANAVEXを信じています®2-73は、SIGMAR1の活性化による神経変性疾患および神経発達疾患の病気改善アプローチを提供する可能性があると考えられています。ANAVEX®2-73は、Rett症候群などの稀な疾患用の経口液体1日1回投与製剤と、アルツハイマー病などの疾患用の経口1日1回カプセル製剤として開発されています。
レット症候群において、ANAVEXの投与®液体形態のANAVEX 2-73の投与は、MECP2 HEtレット症候群の疾患モデルにおいて、多数の行動パラダイムの改善につながる有意で用量依存性の改善をもたらしました。さらに、Rettsyndrome.orgによって後援された別の実験では、7ヶ月のマウスにおいて自動的な視覚反応と呼吸テストを評価し、進行した病理学的状態が明らかになる年齢で行われました。車両で治療されたMECP2マウスは野生型マウスよりも自動的な視覚反応が少なかった。ANAVEX 2-73の投与により、4週間の治療でMECP2レット症候群の疾患ネズミにおける自動的な視覚応答が有意に増加しました。加えて、6.5週間にわたるANAVEX 2-73の慢性経口投与を、筋肉の協調性、バランス、運動学習、筋肉の強度などのいくつかのRett症候群で観察される主な欠陥を評価するために、MECP2 HEtレット症候群の疾患マウスモデルで行いました。ANAVEX 2-73の投与により、MECP2 HEtレット症候群の疾患モデルにおいて、これらの行動パラダイムの改善につながる有意で用量依存性の改善をもたらしました。®自動視覚反応と呼吸テストにおいて、7ヶ月のマウスでANAVEX 2-73が評価されました。®4週間の治療によるANAVEX 2-73の投与は、MECP2レット症候群疾患ネズミにおける自動視覚反応の有意な増加をもたらしました。®MECP2 HEtレット症候群疾患マウスモデルでの筋肉の協調性、バランス、運動学習、筋肉の強度の異なる側面を評価するために、5.5週齢のMECP2 HEtレット症ネズミに対して、ANAVEX 2-73の1日あたりの慢性経口投与が実施されました。ANAVEX 2-73の投与により、これらの中心的な欠陥のいくつかに対する多数の行動パラダイムの改善につながる有意で用量依存性の改善が見られました。®液体形態のANAVEX 2-73の投与は、MECP2 HEtレット症候群疾患モデルにおいて、多数のこれらの行動パラダイムの改善につながる有意で用量依存性の改善をもたらしました。
26
2016年5月と6月に、FDAはANAVEX 2-73に対してオーファンドラッグ指定を与えました。®レット症候群および幼児痙攣症の治療に対して、2019年11月にFDAはANAVEX 2-73に希少小児疾患(RPD)指定を与えました。RPD指定は、希少小児疾患の治療法の開発を促進することを目的としています。®RPD指定は、希少小児疾患の治療法の開発を促進することを目的としています。
さらに、2020年2月にFDAはANAVEX-2-73のレット症候群治療のためのファストトラック指定を付与しました。FDAのファストトラックプログラムは、重大かつ生命を脅かす疾患の治療において、未治療の医学的ニーズを解決する新薬の開発と審査を円滑化し、促進することを目的としています。®FDAのファストトラックプログラムは、重大かつ生命を脅かす疾患の治療において、未治療の医学的ニーズを解決するための新薬の開発と審査を円滑化し、促進することを目的としています。
パーキンソン病において、疾患修飾動物モデルにおいて機能の有意な改善と回復がデータで示されています。行動、組織学的、および神経炎症性エンドポイントのすべての測定で、有意な改善が見られました。2020年10月、ANAVEX2-73を使用したパーキンソン病痴呆の、認知および運動障害の両方に対するcompoundの影響を調べる2相試験を、二重盲検、ランダム化、プラセボ対照で行いました。®2つの異なるANAVEX2-73投与量、30mgと50mg、またはプラセボに1:1:1の割合で無作為に割り付けた約132名の患者を14週間に渡って登録しました。®ANAVEX2-73 Phase 2パーキンソン病痴呆試験のデザインは、ANAVEX2-73 Phase 2aアルツハイマー病試験で同定されたゲノム精密医療バイオマーカーを組み入れました。®2-73®全セクターでのコンパウンドのテーマに沿ったANAVEX2-73 Phase 2aアルツハイマー病試験で同定されたゲノム精度医療バイオマーカーを持つパーキンソン病疾患修飾動物モデルにおいて、すべての測定で有意な改善と機能の回復が示されたデータがあります。
この試験では、ANAVEXが安全であり、一日に50mgまでの経口投与量で耐用性があることが示されました。結果は、CDRコンピューター評価システム分析において、臨床的に有意で剂量依存性があり、統計的に有意な改善を示しました。今後、FDAに試験結果を提出して規制指導を得た後、パーキンソン病性認知症においてANAVEX 2-73のさらなる臨床試験を予定しています。®一日に一度の50mgまでの経口投与量で、2-73は安全で耐用性がありました。結果は、CDRコンピュータ評価システム分析において臨床的に有意で、剂量依存性があり、統計的に有意な改善を示しました。ANAVEX 2-73のさらなる臨床試験を実施する予定です。®試験の結果をFDAに提出して規制指導を得た後、パーキンソン病性認知症においてANAVEX 2-73のさらなる臨床試験を予定しています。
アルツハイマー病の動物モデルにおいて、ANAVEXは潜在的な神経保護、抗アミュノール薬、抗てんかん薬、抗うつ薬としての薬理学的、組織学的、および行動的証拠を示し、SIGMAR1に対する強力な親和力およびM1-4型ムスカリン受容体に対する適度な親和性によるものです。さらに、ANAVEX 2-73は、アミロイド、タウ病理、および炎症に影響する可能性のある二重の機序を示しました。また、遺伝子組み換えアルツハイマー病の動物モデルであるTg2576において、ANAVEX 2-73は、マウス脳における酸化ストレスの発展に対する統計的に有意な神経保護効果を誘発し、明らかにアミロイドβ非依存的な機能的およびシナプス可塑性マーカーの発現を有意に増加させました。また、両性にわたって、空間的作業記憶および長期空間参照記憶の両面において、動物たちが時間とともに発展した学習および記憶の欠損症状を統計学的に軽減しました。®2-73は、ポテンシャルのある神経保護剤、抗アミネート剤、抗てんかん剤、抗うつ薬として、SIGMAR1に強い親和性を示し、M1-4型ムスカリン受容体に適度な親和性を示したアナベックスです。®ANAVEX 2-73は、アミロイド、タウ病理、炎症に影響する可能性のある2つの機構を持っており、遺伝子組み換えアルツハイマー病の動物モデルTg2576でも、マウス脳に対する酸化ストレス発展に対して有意な神経保護効果を誘発しました。®性別にかかわらず、空間的作業記憶と長期空間参照記憶の両方において、ANAVEX 2-73は動物の時間とともに発展する学習と記憶の欠陥症状を軽減しました。これは、統計的に有意であり、アミロイドβ非依存的です。
前臨床試験の結果に基づき、ANAVEX 2-73の単回昇量(SAD)臨床試験を開始し、完了しました。®この1回のSAD試験において、プロトコルで最大耐用単回投与量は55-60mgと定義されました。この量はアルツハイマー病マウスモデルで有効な影響を示した投与量よりも高いです。研究室検査やECGパラメータに有意な変化はありませんでした。ANAVEX 2-73は、最大耐容単回投与量以下では、一部の被験者において軽微な有害事象のみが報告されました。最大耐容単回投与量を超えた用量で観察された有害事象には、頭痛やめまいがあり、中等度のもので回復性でした。これらの副作用は、アルツハイマー病を含むCNS疾患を対象とする薬剤にしばしば見られます。®2-73は、最大耐容単回投与量以下では、一部の被験者において軽微な有害事象のみが報告されました。最大耐容単回投与量を超えた用量では、頭痛やめまいなどの有害事象が中等度で可逆的でした。これらの副作用は、アルツハイマー病を含むCNS疾患を対象とする薬剤にしばしば見られます。
2016年11月には、アナベックス(治療薬 ANAVEX 2-73)のアルツハイマー病における第2a相臨床試験を完了しました。®オープンラベルのランダム化試験は、軽度~中程度のアルツハイマー病を持つ32人の患者を対象に、ANAVEX 2-73の安全性と探索的有効性を評価するために設計されました。®第2a相試験は試験の主要および副次的目的を達成しました。
2018年7月、フェーズ2a臨床試験参加者のゲノムDNAおよびRNA評価の結果を発表しました。33,000以上の遺伝子が、ANAVEX 2-73で治療された患者のDNAおよびRNAデータを分析するための中立、データ駆動型、機械学習、人工知能(AI)システムを使用して分析されました。®分析により、ANAVEX 2-73への反応に影響を与える遺伝的変異が特定されました。®その中には、ANAVEX 2-73の標的であるSIGMAR1に関連する変異が含まれます。®結果により、世界の人口の約80%に推定される一般的なSIGMAR1野生型遺伝子変異を持つ試験参加者は、認知(MMSE)および機能(ADCS-ADL)スコアが向上したことが示されました。この評価の結果は、これらのシグネチャを今後のANAVEX 2-73を用いた神経学的な指標に適用できるので、今後の臨床試験において、ゲノム情報の引き続き評価を支持しました。®これには、アルツハイマー病、パーキンソン病痴呆症、レット症候群を含む、ANAVEX 2-73で検証された神経学的疾患が含まれます。
27
ANAVEX®第2b/3相プラセボ対照試験に進行するために、データには事前条件が必要です。2018年7月2日、オーストラリアの人間研究倫理委員会は、ANAVEXの第2b/3相、二重盲検、ランダム化、プラセボ対照の48週間の安全性および有効性試験を開始するために承認しました。®早期アルツハイマー病の治療のための2-73。カナダ、イギリス、オランダ、ドイツの臨床試験サイトも追加されました。この第2b/3相試験デザインには、ANAVEX 2-73の遺伝子精密医療バイオマーカーの含有が取り入れられています。®ANAVEX 2-73の第2a相試験で特定された遺伝子精密医療バイオマーカーの含有が、この第2b/3相試験にも取り入れられています。
私たちの研究からの動物実験前データも、その他の神経変性疾患に対する潜在的なプラットフォーム薬としてANAVEX-2-73の研究をサポートしていると考えています。具体的には、てんかん、乳児痙攣、フラジャイルX症候群、エンジェルマン症候群、多発性硬化症、そして最近、結節性硬化症(TSC)などを含みます。ANAVEX-2-73は、それぞれの動物実験前モデルでこれらの指標すべてにおいて重大な改善を示しました。®ANAVEX-2-73は、アルツハイマー病、パーキンソン病、またはレット症候群以外の神経変性疾患の潜在的なプラットフォーム薬として、てんかん、乳児痙攣、フラジャイルX症候群、エンジェルマン症候群、多発性硬化症、そして最近は結節性硬化症(TSC)についても研究されています。®ANAVEX-2-73は、それぞれの動物実験前モデルでこれらの指標すべてにおいて重大な改善を示しました。
ファンデーションによるプレクリニカル研究によると、エンジェルマン症候群向けにスポンサーされたANAVEX-2-73は、耳刺激性発作の発症モデルマウスで評価されました。結果は、ANAVEX-2-73の投与により、マウスの耳刺激性発作が有意に減少したことを示しました。 FRAXAリサーチ財団による研究では、データが示しました。 ANAVEX-2-73は、脳内の海馬部分の総合性発達因子(BDNF)発現を正常レベルに回復させました。BDNFの発現不足は多くの神経発達障害や神経変性疾患で観察されており、BDNFのシグナル伝達は興奮性および抑制性シナプスの成熟を促進します。 ANAVEX-2-73によるBDNF発現の正常化は、エンジェルマン症候群やフラジャイルX症候群など神経発達障害や神経変性疾患において、観察された陽性のプレクリニカルデータの貢献要因となりうることが示唆されました。®ANAVEX-2-73は、耳刺激性発作の発症モデルマウスで評価されました。結果は、ANAVEX-2-73の投与により、マウスの耳刺激性発作が有意に減少したことを示しました。®フラジャイルX症候群に関するFRAXAリサーチ財団による研究で、データが示しました。ANAVEX-2-73は、海馬の総合性発達因子(BDNF)発現を正常レベルに回復させました。®BDNFの発現不足は多くの神経発達障害や神経変性疾患で観察されており、BDNFのシグナル伝達は興奮性および抑制性シナプスの成熟を促進します。®ANAVEX-2-73によるBDNF発現の正常化は、エンジェルマン症候群やフラジャイルX症候群など神経発達障害や神経変性疾患において、観察された陽性のプレクリニカルデータの貢献要因となりうることが示唆されました。
さらに、現在のプレクリニカルデータは、ANAVEX 2-73が持つ可能性があることを示しています ミトコンドリア酵素複合体の保護効果を示すぽてんしゃるです。これらが機能障害を起こすと、神経変性や神経発達性疾患の発症に関連する可能性があるからです。®2-73には、病理学的状態中におけるミトコンドリア酵素複合体の保護効果を示す可能性があります。これらの複合体が障害を受けると、神経変性や神経発達性疾患の発症に関与することがあるからです。
さらに、多発性硬化症に関連するANAVEX-2-73の動物前臨床データは、ANAVEX-2-73が多発性硬化症の髄鞘形成を促進できる可能性があることを示しています。さらに、私たちのデータは、ANAVEX-2-73がOPCの保護と増殖を増加させることで修復を支援し、中枢神経系のニューロンの保護に加えて、組織培養におけるOPC増殖と熟成の増加による修復を助ける可能性があることを示しています。®ANAVEX-2-73は多発性硬化症に関連するものであり、ANAVEX-2-73に関する前臨床データは、多発性硬化症の再髄鞘形成を促す可能性があることを示しています。®さらに、私たちのデータは、ANAVEX-2-73がOPCおよび中枢神経系のニューロンの保護を提供する可能性があることを示しており、組織培養におけるOPCの増殖と熟成の促進による修復にも役立つことを示しています。®ANAVEX-2-73は、線維芽細胞増殖因子受容体アゴニストであり、多発性硬化症に関連したANAVEX-2-73の前臨床試験データによると、ANAVEX-2-73はOPCと中枢神経系ニューロンの保護を提供し、OPCの増殖と熟成を増加させ、組織培養において修復を促進する可能性があります。
2018年3月、私たちはTSC(結節性硬化症)の遺伝子マウスモデルでANAVEX-2-73の動物前臨床データを発表しました。TSCは、多くの部位で良性腫瘍の成長を特徴とするまれな遺伝性疾患で、てんかんの発生率が高いです。前臨床データにより、ANAVEX-2-73の投与は、これらのマウスにおける生存率を著しく増加させ、てんかんを減少させたことが示されました。®ANAVEX-2-73 TSCは、多くの部位で良性腫瘍の成長を特徴とするまれな遺伝性疾患で、てんかんの発生率が高いです。前臨床データにより、ANAVEX-2-73の投与は、これらのマウスにおける生存率を著しく増加させ、てんかんを減少させたことが示されました。®これらのマウスにおいて、ANAVEX-2-73の治療は、生存率を著しく増加させ、てんかんを減少させたことが前臨床データで示されました。
アナベックス®3-71
ANAVEX®3-71は、SIGMAR1の活性化とM1ムスカリン受容体のアロステリック調節による新しい作用機序を持つ臨床薬候補であり、アルツハイマー病モデルでの神経保護と認知の向上を示した。ANAVEX®3-71は、認知障害に対するCNS透過性のある可能性のある疾患修正治療薬であり、転位表現型(3xTg-AD)マウスで、認知機能の障害、アミロイド病変、タウ病変などの主要なアルツハイマー病の特徴に非常に小さい用量で効果的であると信じており、炎症やミトコンドリア機能の改善にも有益な影響があると考えられている。ANAVEX®3-71は、SIGMAR1の活性化とM1ムスカリン受容体のアロステリック調節による神経保護と認知の向上能力により、アルツハイマーやその他のタンパク質凝集関連疾患において幅広い治療上の利点を示している。
ANAVEXのレスポンスを調べた1つの臨床前研究は、遺伝子組み換え老化動物モデルで行われ、ANAVEXの投与により、認知機能の欠陥、アミロイドβ病理学、炎症の割合を有意に減少させたことを示した。®遺伝子組み換え老化動物モデルで行われた臨床前研究では、ANAVEXの投与により、認知障害、アミロイドβ病理学、炎症の割合を有意に減少させた。®2016年4月、ANAVEXに対してFDAは孤発性薬剤指定を付与した。®FTDの治療に対して、ANAVEXに孤発性薬剤指定を付与した。
病理学的状態の間,ANAVEX 3-71は,アストロサイト数の異常な増加を引き起こすことなく,神経細胞間に新しいシナプス(シナプトジェネシス)の形成を示しました。アルツハイマー病やパーキンソン病などの神経変性疾患では、シナプトジェネシスが妨害されると考えられています。追加の臨床前データにより、ANAVEX 3-71は、酸化ストレスを減らすだけでなく、神経変性疾患や神経発達障害疾患の病因に関与すると考えられるミトコンドリア酵素複合体の保護効果を示す可能性があることが示されました。®3-71は、神経学的な疾患(アルツハイマーやパーキンソン病など)において、シナプトジェネシスが阻害されると考えられていますが、病的な状態下では、新しいシナプスの形成(シナプトジェネシス)が起こることを示し、アストロサイトの数の異常な増加も起こりません。®3-71は、病理学的状態下でミトコンドリア酵素複合体の保護的効果を示す可能性があります。この酵素複合体が損傷すると、神経変性疾患や神経発達障害の発症に関与すると考えられています。
28
2020年7月、私たちはANAVEX3-71の第1相臨床試験を開始しました。®この試験は、オーストラリアで実施され、健康なボランティアにおいて、ANAVEX3-71の口服増量投与に関する安全性、耐容性およびPK、通常の食事および性差の影響を評価する二重盲検、ランダム化、プラセボ対照の第1相試験でした。®この試験は、健康なボランティアにおいて、ANAVEX3-71の口服増量投与に関する安全性、耐容性およびPK、通常の食事および性差の影響を評価する二重盲検、ランダム化、プラセボ対照の第1相試験でした。 この試験では、重篤な有害事象(SAEs)や投与量制限性毒性は観察されず、安全性の主要エンドポイントおよび二次エンドポイントが達成されました。 上述のように、臨床試験の概要-統合失調症、前頭側頭型認知症、アルツハイマー病のクリニカル試験のセクションで説明しました。 臨床試験の概要-統合失調症、前頭側頭型認知症、アルツハイマー病のセクションでより詳細に説明されているように、この試験は、健康なボランティアにおいて、ANAVEX3-71の口服増量投与に関する安全性、耐容性およびPK、通常の食事および性差の影響を評価する二重盲検、ランダム化、プラセボ対照の第1相試験でした。.
これらの結果に基づいて、またANAVEXに基づいて®会社は、3-71臨床前プロファイルを進める意向があります。®アルツハイマー病、FTD、および統計的バイオマーカーを活用した治療の長期効果を評価するために、アナベックス3-71を臨床開発認知症プログラムに進める予定です®3-71。この臨床試験と臨床前研究の結果を基に、米国の対応する登録試験に進展することができると考えています。
これらの試験の最初のものであるANAVEX®3-71-SZ-001臨床試験は2024年3月に開始され、上記の「統合失調症の臨床試験概要」の下で より詳しく説明されています。 臨床試験概要-統合失調症
アナベックス®1-41
ANAVEX®1-41はシグマ-1作動薬です。前臨床試験では、細胞内小器官、ミトコンドリア、酸化ストレスを調節することにより、神経細胞の退化や死を防止する効果が明らかになりました。さらに、動物モデルでは、学習、感情、記憶を調節する脳の部位である海馬における細胞死や細胞の減少を引き起こす主要な酵素であるcaspase-3の発現を抑制することが示されました。これらの活動は、筋弛緩作用とシグマ1系統の両方を含んでいます。®1-41は、アポトーシス(プログラムされた細胞死)と細胞の喪失に重要な役割を果たす酵素であるcaspase-3の発現を抑制し、学習、感情、記憶を調節する脳の部位である海馬における細胞死や細胞の減少を防止することが示されています。これらの活動には、新しい作用機序を介するムスカリン性とシグマ1系統の両方が関与しています。
また、提示された予臨床データは、ANAVEXが病態条件下でミトコンドリア酵素複合体の保護効果を示す可能性があることを示しています。このことは、神経変性疾患および神経発達疾患の病因に関与すると考えられているものである場合、非常に重要な発見です。®1-41は、病理条件下でミトコンドリア酵素複合体の保護効果を示す可能性があり、これらが妨害された場合、神経変性および神経発達疾患の病因に関与すると信じられています。
ANAVEX®1066
ANAVEX®潜在的な神経因性疼痛および内臓疼痛の治療のために設計された、混合シグマ-1 /シグマ-2リガンドの 1 つである 1066 。ANAVEX®1066は、ラットで広く検証された神経因性疼痛および内臓疼痛の 2 つの動物モデルで試験されました。神経因性疼痛の慢性絞扼損傷モデルでは、ANAVEXの単回経口投与により、特定の脚の痛覚閾値が正常レベルに回復し、健側の健康な脚は変化しませんでした。その有効性は迅速で、 2 時間間持続しました。内臓疼痛のモデルでは、炎症性物質を結腸に直接注射することにより、慢性大腸過敏性を誘発し、ANAVEXの単回経口投与により、1066は痛覚閾値を投与量依存的に正常レベルに戻しました。®バッテリーは投与量依存的に 2 時間間持続し、健康な消化管のトランジットに影響を与えないことを示す、行動測定のバッテリーで好ましい安全性プロファイルを示しました。1066。®1066は、投与量依存的に制御レベルに痛覚閾値を回復させることを示し、ラットの関連研究では、ANAVEXの正常な消化管のトランジットに対する影響は見られませんでした。®行動的な測定のバッテリーで好ましい安全性プロファイルが示され、ANAVEX 1066はリラックスし、消化を促進する別の物質と併用しても問題ありません。
アナベックス®1037
ANAVEX®1037は、前立腺がんや膵臓がんの治療のために設計されています。低分子量の合成化合物であり、ナノモルのシグマー1受容体に高親和性を示し、ミクロモルのレベルでシグマ-2受容体やナトリウムチャネルに中程度の親和性を示します。高度な前臨床試験では、この化合物には抗腫瘍効果があることが示されています。また、がん細胞を選択的に殺し、正常な/健康な細胞に影響を与えることなく、免疫不全マウスモデルの腫瘍成長を有意に抑制することが示されました。科学的な出版物は、これらのリガンドがさまざまな腫瘍細胞株で腫瘍成長を停止し、選択的細胞死を誘発する可能性を強調しています。シグマ受容体は、異なる腫瘍細胞タイプで高度に発現しています。適切なシグマ-1および/またはシグマ-2リガンドによる結合は、選択的なアポトーシスを誘発することができます。また、腫瘍細胞の膜の再編とイオンチャネルとの相互作用を通じて、私たちの薬剤候補は、転移(がん細胞が原発部位から体の他の部位に広がること)、血管新生(新しい血管の形成)、腫瘍細胞増殖の抑制に重要な役割を果たす可能性があると考えています。
ANAVEX®1037は現在、臨床前および臨床試験段階にあり、臨床前モデルで示された活性が人間の試験で示される保証はありません。
29
我々は、プログラムを効果的に進め、株主の価値を高めるために、潜在的な戦略的および商業的パートナーとの関係を特定し、議論を開始し続けています。さらに、新しい知的財産を取得または開発し、我々の目標を達成するために知的財産の譲渡、ライセンス、またはその他の移転を行うことがあります。
私たちのターゲット指標
私たちは、幅広いカテゴリーといくつかの具体的な適応症に潜在的な応用可能な化合物を開発しています。以下に例を挙げます:
中枢神経系ディー海
| ● | アルツハイマー病 -アルツハイマー協会によると、2024年には約6,900,000人のアメリカ人がアルツハイマー病に苦しんでいます。®アルツハイマー協会は、アルツハイマー病やその他の認知症の新規発症件数が2050年までに倍増すると見込まれると推定しています。® 市場に出ている薬はアルツハイマー病の症状のみを治療することができて、その発症または進行を止めることができません。私たちは、アルツハイマー病の病気を治療するための疾患修正療法、およびより良い症状的治療に対して緊急かつ未だ満たされていないニーズがあると考えています。 |
| ● | パーキンソン病 - パーキンソン病は、震え、筋肉の硬直、遅い不正確な動きを特徴とする神経系の進行性疾患です。それは脳の基底核の変性と神経伝達物質であるドーパミンの欠乏に関連しています。パーキンソン病は、現在、世界中で1000万人以上の患者がいて、通常、中年以上の人々に影響を与えます。パーキンソン病市場は、GlobalDataによれば2029年までに115億ドルに達する見込みです。 |
| ● | Rett症候群 - Rett症候群は、脳の発達に影響を与える稀なX連鎖の遺伝性神経および発達障害であり、タンパク質転写が変異することによって、重度なニューロンのホメオスタシスの混乱が引き起こされます。それは希少な進行性神経発達障害と考えられ、MECP2遺伝子の一つの突然変異によって引き起こされます。男性は女性と染色体構成が異なるため、遺伝的にMECP2突然変異を持っている男児は壊滅的な影響を受けます。それらのほとんどは生まれる前または生後初期に死亡します。乳児期を生き残った女性にとって、Rett症候群は重度の障害を引き起こし、子供の生活のほぼすべての側面に影響を与えます。重度の知的障害、話す能力、歩く能力、食事、睡眠障害、けいれん、さらには呼吸が容易でない能力に影響を与えます。Rett症候群は、約1万人から1万5000人の女性に発生します。 | |
| ● | 統合失調症 - 統合失調症は、思考、感情、行動に影響を及ぼす持続的でしばしば障害的な精神疾患であり、世界保健機関によると、世界中で2400万人、米国では280万人を超える人々に影響を与えています。それは三つの症状領域に特徴があります。陽性症状(幻覚や妄想)、陰性症状(人生を楽しむことができず他人から離れること)、認知機能の障害(記憶、集中力、意思決定の欠如)。現在の治療法に制限があるため、統合失調症を持つ人々はしばしば雇用を維持し、独立生活を送り、人間関係を管理することが難しいです。現在の治療法は一部の症状を管理するのに有効ですが、世界保健機関によると、約30%の人々は治療に反応せず、追加の50%は症状の部分的な改善または受け入れがたい副作用を経験しています。 | |
|
| ● | フラジャイル X – 脆弱X症候群(FXS)は、主に男児に影響を与える知的障害および自閉症スペクトラム障害の最も一般的な遺伝形態です。ほとんどの神経発達障害と同様に、FXSはシナプスの発達と機能の状態と考えられます。病気にはFMR1遺伝子の「拡張」と関連する特定の遺伝的変化に応じて、様々な臨床症状があります。病気は長期増強とホメオスタシス可塑性の欠損に特徴があります。 FXSは、すべての人口および民族集団で検出されています。研究者は、正確なフル変異FXSを持つアメリカ人の数を正確には分かりません。研究によると、病気は約1:4,000の男児と1:6,000-8,000の女児に影響を与えており、世界中で140万人以上がFXSの影響を受けていると推定されています。 |
| ● | うつ病-うつ病は、世界保健機関によると、全世界で重要な罹患率の原因です。アライドマーケットリサーチによると、グローバル抗うつ薬市場は2030年までに210億ドルに達する見込みです。うつ病の医薬品治療は、ブランド力があるものが歴史的に主流でした。しかし、主要ブランドの優位性は低下しており、抗うつ薬の承認数の増加が大きな要因となっています。 |
30
| ● | てんかん-てんかんは、再発性の未引き金発作を特徴とする一般的な慢性神経疾患です。これらの発作は、脳内の異常、過剰または同期した神経活動の一時的なサインおよび/または症状です。米国疾病予防管理センターによると、2015年には340万人のアメリカ人がてんかんにかかりました。現在、てんかんは、従来の抗てんかん薬と第2世代の抗てんかん薬に分類される薬剤で頻度を抑えることができます。しかし、てんかんは患者によってさまざまな方法で影響するため、従来の抗てんかん薬と第二世代の抗てんかん薬の両方と組み合わせて使用する薬剤が必要です。 |
| ● | ニューロパシックペインとは、全身のどの部位の痛覚受容体の刺激に関係のない痛みを指します。ニューロパシックペインは、通常の疼痛薬によく反応しないため、他の疼痛の種類よりも治療が困難です。メンブレン安定剤や抗うつ薬のような特別な薬が、通常ニューロパシックペインに対してよく効くとされています。 |
がん
| ● | 悪性黒色腫- 皮膚が主ながんですが、腸や目の中にあるメラノサイトでも発症することがあります。悪性黒色腫は皮膚がん死亡者の大多数を占めており、治療には腫瘍切除、補助治療、化学療法や免疫療法、放射線療法が含まれます。iHealthcareAnalyst、Inc.によると、世界的な悪性黒色腫市場規模は2029年までに750百万ドルに成長する見込みです。 |
| ● | 前立腺がん - 男性特有の前立腺がんは、男性の生殖系にある腺である前立腺に発生するがんの一種です。がん細胞は前立腺から他の体の部位、特に骨やリンパ節に転移する可能性があります。市場調査会社であるマーケットリサーチフューチャーによると、前立腺がんの医薬品治療は、2030年末までに約101億ドルまで増加すると予測されています。 |
| ● | 膵臓がん-膵臓がんは膵臓の悪性腫瘍です。アメリカ合衆国では、約62,000件の新しい膵臓がんが今年診断され、約50,000人の患者ががんのために亡くなると、アメリカがん学会によって発表されています。市場データ予測によると、グローバルな膵臓がんの医薬品治療市場は2027年までに370億ドルに増加すると予測されています。 |
特許、商標、知的財産
私たちは、私たちの薬剤候補、それに関連する方法、および私たちの研究プログラムに関連する、25の米国特許、25の米国特許出願、およびさまざまなPCTまたは国外特許出願の所有権または排他的権利を持っています。
「ANAVEX 2-73およびある抗コリンエステラーゼ阻害剤の組成物および神経保護用方法」という1つの米国特許を取得しています。これはANAVEX化合物の物質組成を主張し、規制上の遅延がなければ2034年6月に期限切れになります。また、「A2-73の結晶多形物の組成および使用方法」というもう1つの米国特許を取得して、ANAVEXの結晶、投与量形式、および医薬製剤を主張し、規制上の遅延がなければ2039年7月に期限が切れます。さらに、ANAVEX2-73の結晶態フォームを主張する4つの米国特許を取得しており、これらは2026年6月から2036年10月までの範囲で期限が切れる予定です。薬事規制上の遅延があれば期限が延長されます。さらに、てんかん治療のための3つの米国特許を所有しています。このうち、2つの特許はANAVEX2-73および19-144の低用量抗てんかん薬との併用による治療法に関するもので、期限は2028年から2038年までの範囲内で規制上の遅延がなければ切れます。残りの1つの特許は、一定の結晶態フォームのANAVEX2-73を製造する方法に関するものです。期限は217/10月までに規制上の遅延がなければ切れる予定です。®ANAVEX2-73の物質組成を主張する「ANAVEX 2-73およびある抗コリンエステラーゼ阻害剤の組成物および神経保護用方法」という1つの米国特許を所有しています2-73。規制上の遅延がなければ、この特許は2034年6月に期限切れになります。®ANAVEX2-73の新規で相乗的な神経保護用化合物とドネペジルおよびその他のコリンエステラーゼ阻害剤との組み合わせを主張する「ANAVEX 2-73およびある抗コリンエステラーゼ阻害剤の組成物および神経保護用方法」という1つの米国特許を所有しています。規制上の遅延がなければ、この特許は2034年6月に期限切れになります。®ANAVEX2-73の結晶態フォームを主張する4つの米国特許のうちの1つが、「ANAVEX 2-73の結晶態フォームの使用方法、投与量形式、及び製薬組成物」を主張しています。期限は2026-2036年内で規制上の遅延があれば、期限が延長されます。®ANAVEX2-73の結晶、投与量形式、及びこれらを含む組成物を主張する「ANAVEX 2-73の使用方法に関する物質及び製剤の組成物」を主張する4つの米国特許のうちの1つです。規制上の遅延があれば、この特許は2036年7月に期限切れになります。®アルツハイマー病の治療方法を主張する投与量形式を含む、ANAVEX2-73による治療方法、それらを使用する組合せ、およびそれらを含む薬剤組成物を主張する「ANAVEX 2-73の使用方法に関する物質及び製剤の組成物」を主張する4つの米国特許のうちの1つです。規制上の遅延があれば、この特許は2036年7月に期限切れになります。®ANAVEX2-73を含む薬物組成物によるアルツハイマー病の治療方法を主張する、4つの米国特許のうちの1つです。期限は2026年6月から2036年10月までの範囲で期限が切れる予定です。薬事規制上の遅延があれば期限が延長されます。®ANAVEX2-73を含むアルツハイマー病の治療に使用される薬剤組成物を主張する4つの米国特許のうちの1つです。期限は2026年6月から2036年10月までの範囲で期限が切れる予定です。規制上の遅延があれば期限が延長されます。®ANAVEX2-73の特定の結晶態フォームを製造する方法を主張する4つの米国特許のうちの1つです。期限は2026年6月から2036年10月までの範囲で期限が切れる予定です。規制上の遅延があれば期限が延長されます。®低用量の抗てんかん薬とANAVEX2-73、その活性代謝産物ANAVEX19-144のいずれかを組み合わせた治療法の1つを主張する3つの米国特許のうちの1つです。規制上の遅延があれば、この特許は2038年までに期限切れになります。®低用量の抗てんかん薬とANAVEX2-73、その活性代謝産物ANAVEX19-144のいずれかを組み合わせた治療法の1つを主張する3つの米国特許のうちの1つです。規制上の遅延があれば、この特許は2038年までに期限切れになります。®ANAVEX19-144を用いた治療法を主張する2つの米国特許のうちの1つです。規制上の遅延があれば、この特許は2038年までに期限切れになります。®低用量の抗てんかん薬とANAVEX19-144を組み合わせた治療法を含む、3つの米国特許のうちの1つです。規制上の遅延があれば、この特許は2038年までに期限切れになります。
31
または(ii)ANAVEX 19-144 ® およびANAVEX 2-73 ®。これら3つの特許のうち、第3特許は(i)ANAVEX 19-144、(ii)ANAVEX 2-73を含むてんかん治療用投与量形態を主張し、または(iii)ANAVEX 19-144およびANAVEX 2-73の組み合わせを主張します。これら3つの特許は、規制の遅れのため特許期間が延長されない限り、2035年10月に期限が切れると予想されています。また、私たちは、神経発達障害の治療に関する請求項を持つ4つの米国特許を所有しています。これらの特許は、神経発達障害、多発性硬化症、それらに関連する生化学的および機能的異常、または神経発達障害に関連する機能低下を、ANAVEX 2-73、ANAVEX 19-144、および/またはANAVEX 1-41(ANAVEX 2-73に類似したシグマ受容体リガンド、またはそれらの組成物)を投与することによって治療する方法を主張します。これら4つの特許は、規制の遅れのため特許期間が延長されない限り、2037年1月に期限が切れると予想されています。さらに、ANAVEX 2-73に関連した化合物を用いた黒色腫の治療方法に関する請求項を持つ米国特許が1つあります。この特許は、規制の遅れのため特許期間が延長されない限り、2030年2月に期限が切れると予想されています。また、ANAVEX 19-144の結晶形態、該結晶形態を含む投与量形態および組成物、アルツハイマー病の治療方法に関する請求項を持つ米国特許が1つあります。この特許は、規制の遅れのため特許期間が延長されない限り、2036年7月に期限が切れると予想されています。さらに、ANAVEX 2-73を用いた心機能不全の治療方法に関する請求項を持つ米国特許が1つあります。この特許は、規制の遅れのため特許期間が延長されない限り、2038年7月に期限が切れると予想されています。さらに、不眠症、不安、または興奮に対する治療の請求項を持つ2つの米国特許を所有しています。2つ目の特許は、ANAVEX 2-73、ANAVEX 19-144、および/またはANAVEX 1-41のいずれかまたはそれらの組み合わせを含む投与量形態を主張します。この特許は、規制の遅れのため特許期間が延長されない限り、2038年9月に期限が切れると予想されています。2つ目の特許は、ANAVEX 2-73、ANAVEX 19-144、および/またはANAVEX 1-41のいずれかまたはそれらの組み合わせを含む投与量形態を主張します。この特許は、規制の遅れのため特許期間が延長されない限り、2038年9月に期限が切れると予想されています。®19-144(ii)、ANAVEX®2-73、または(iii)ANAVEX®19-144およびANAVEX 2-73を組み合わせて、低用量の抗てんかん薬をOPtionally含むてんかん軽減用投与量形態を主張する、全セクター3つの特許は、規制当局の遅れがない場合、2035年10月に期限切れすると予想されています。私たちはまた、神経発達障害を治療するために請求項を持つ4つの米国特許を所有しています。これらの特許には、ANAVEX®(2-73)、ANAVEX®19-144、および/またはANAVEX®1-41(ANAVEX®(ANAVEX®2-73に類似したシグマ受容体リガンド、またはそれらの組成物)を含む、全セクター4つの特許は、規制の遅れのため、2037年1月に期限が切れると予想されています。さらに、私たちはANAVEX®2-73に関連した化合物を用いた黒色腫の治療方法に関する請求項を持つ米国特許が1つあります。この特許は、規制の遅れのため特許期間が延長されない限り、2030年2月に期限が切れると予想されています。また、ANAVEX®19-144の結晶形態、該結晶形態を含む投与量形態および組成物、アルツハイマー病の治療方法に関する請求項を持つ米国特許が1つあります。この特許は、規制の遅れのため特許期間が延長されない限り、2036年7月に期限が切れると予想されています。さらに、心機能不全の治療方法に関する請求項を持つANAVEX 2-73の発行済み米国特許1件があります。この特許は、規制の遅れのため特許期間が延長されない限り、2038年7月に期限が切れると予想されています。さらに、不眠症、不安症、または興奮症状の治療に関する2つの発行済み米国特許を所有しています。このうち、2つ目の特許は、ANAVEX®2-73、ANAVEX®19-144、および/またはANAVEX®1-41を含む、不眠症または不安症を治療する方法の請求項を持つ最初の特許は、セクター1つです。この特許は、規制の遅れのため特許期間が延長されない限り、2038年9月に期限が切れると予想されています。2つ目の特許は、ANAVEX®19-144、および/またはANAVEX®1-41を含む、全セクター2つの特許は、不眠症、不安、または興奮を治療するための投与量形態を主張します。この特許は、規制の遅れのため特許期間が延長されない限り、2038年9月に期限が切れると予想されています。最初の特許はANAVEX®2-73、ANAVEX®19-144、または/またはANAVEXを含む投与量形態を有する、全セクター2つの特許を所有しています。®1-41. この特許は規制上の遅延による特許期間延長を除いて、2038年7月に期限切れになる見込みです。さらに、私たちはANAVEXを使用して収縮期高血圧を治療する方法に関する請求項を持つ、1つの発行された米国特許を所有しています。®2-73. この特許は規制上の遅延による特許期間延長を除いて、2039年7月に期限切れになる見込みです。さらに、私たちはANAVEXの(-)エナンチオマーの製薬用投与形態に関する請求項を持つ、1つの発行された米国特許を所有しています。®2-73. この特許は規制上の遅延による特許期間延長を除いて、2036年7月に期限切れになる見込みです。
私たちはまた、ANAVEXに関連する3つの米国特許を所有しています。®この2つの特許の最初のものは、(+)ANAVEXを使用して痛みを治療または予防する方法を主張しています。®第2特許は、(-)ANAVEXを使用して痛みを治療または予防する方法を主張しています。®第3特許は、(+)ANAVEXを含む投与形態と医薬組成物を主張しています。®いかなる特許期間延長もなければ、3つの特許は全セクターで2036年11月に期限切れとなる予定です。
ANAVEXのために®2-73、ANAVEX®19-144、ANAVEX®1-41、そしてANAVEX®1066については、オーストラリア、カナダ、中国、ヨーロッパ、日本、香港において、特許の付与または申請があり、2035年以降に期限切れとなる見込みです。
ANAVEXに関して言えば、ANAVEX 3-71に対するそれぞれの権利を持ち、アルツハイマーを含む様々な疾患の治療方法に関する発行済みの米国特許を2つ独占的に所有しています。これらの特許は、規制の遅延のため特許期間延長がない場合、それぞれ2030年4月と2030年1月に期限切れになることが予想されています。また、オーストラリア、カナダ、中国、ヨーロッパ、日本、韓国、ニュージーランド、ロシア、南アフリカで特許または出願が認められている関連特許の独占的な権利も保有しており、これらは2030年1月に期限切れになることが予想されています。®ANAVEX 3-71化合物と同様に、アルツハイマーをはじめとする様々な疾患の治療方法に対するそれぞれの主張を持った2つの発行済み米国特許の独占的な権利を所有しています。これらの特許は、規制の遅延のため特許期間延長がない場合、それぞれ2030年4月と2030年1月に期限切れになることが予想されています。®これらの特許は、それぞれ2030年1月に期限切れになることが予想されています。この特許は、オーストラリア、カナダ、中国、ヨーロッパ、日本、韓国、ニュージーランド、ロシア、南アフリカで認められている関連特許または出願の独占的な権利も所有しています。
私たちは、エナンチオマー、結晶、製剤、使用法、および患者選択方法に関するその他の特許出願および特定の外国特許も所有しており、これらが私たちの1つ以上の製品候補に追加の保護を提供する可能性があります。
特許やその他の知的財産権は企業の資産と見なしています。そのため、知的財産の価値を最適化することを目指し、我々はビジネス戦略の開発において知的財産権の選択的な開発、保護、活用を含めて取り組んでいます。知的財産権に関する申請に加えて、情報の共有や伝達のために十分に慎重に考慮されたプロセス、機密保持契約および実行する契約に同様の規定を用いることで知的財産権および機密情報を保護しています。どのような契約も絶対的な保護を提供するわけではありませんが、そのような契約は開示または予期される開示の場合に何らかの救済措置を提供します。
32
私たちの知的財産の立場は、多くの生物医学企業と同様に不確定であり、重要な法的原則が未解決の複雑な法的および技術的問題を含んでいます。既存または将来の特許に対する課題に関する詳細については、2023年11月27日に証券取引委員会に提出された年次報告書のパートI、アイテム1Aの「リスクファクター」を参照してください。
当社の売上高は、2023年に2.3百万ドル、または6.8%増の3,630万ドルに増加し、2022年の3,400万ドルと比較して増加しました。これは、キャッシュイン輸送ビジネス、Guardforce Digital Machine、および北京萬家警備からの収益増加に主によるものです。粗利益は、約43%増の2022年の380万ドルから2023年の540万ドルに増加しました。コスト面のうまい管理により、当社の粗利益率は2022年の11.1%から2023年の14.9%に増加しました。また、調整後の純損失を前年比61.5%または2.9百万ドル縮小すると共に、粗利益の改善およびコスト管理イニシアチブの成果に基づき、大きな進歩を遂げました。2023年の純損失は、2022年の純損失1,860万ドルに対し2,960万ドルでした。この変動の主な原因は、RaaSからロボットAIソリューションへのビジネス移行にあり、2023年にはロボティクスの陳腐化した在庫や資産による非現金減損の影響が生じたためです。2023年の1株当たりの純損失は4.53ドルで、2022年の純損失14.97ドルに比べて減少しました。2023年12月31日および2022年は、当社が現金及び現金同等物(制限付き現金を含む)を約22.0百万ドルと8.2百万ドル保有していました。
この議論は、このレポートの他の場所に含まれる当社の簡略化された連結中間財務諸表および関連する注記と共に読まれる必要があります。過去の業績結果は、将来の期間に発生する可能性のある結果を必ずしも示すものではありません。この議論には、数多くのリスクと不確定要素を伴う先行きの声明が含まれています。このレポートに含まれる「先行きに関する声明」を参照してください。
2004年の設立以来、開発段階にあり、まだ売上高がありません。私たちは、製品を開発、共同開発、ライセンス供与、取得、マーケティングするために、他の企業と提携できるまで、売上高の獲得は見込まれていません。
当社の運営費用は、主に臨床試験および臨床製造、製剤費用、また、これらの臨床試験を支援するための第三者委託研究機関(CRO)費用を含めた、研究開発活動に関する費用で構成されています。研究開発費用には、給与や賃金などの人件費、そして直接当社の研究開発活動を支援する従業員やコンサルタントに付与されたオプションおよびその他の株式報酬に関連する非現金ストックベースの報酬費用も含まれます。
一般および管理費用は、人件費、外部プロフェッショナルサービス費、および公開企業としての運営に関連する費用から構成されます。人件費は、総務・管理部門の給与及び賃金、福利厚生、株式ベースの報酬などで構成されます。外部プロフェッショナルサービスおよび公開企業の費用には、規制や報告に関する費用、保険費用の追加費用、監査及びSOXコンプライアンス、特許研究、申請及び申請書類、投資家および株主関係活動、その他の行政およびプロフェッショナルサービスに関連する費用が含まれます。
2024年6月30日終了の3ヶ月および9ヶ月と2023年の比較
営業費用
2024年6月30日終了の四半期の営業費用は1,470万ドルで、2023年6月30日終了の同等四半期の1,350万ドルに比べています。 2024年6月30日終了の9か月間の総営業費用は3,850万ドルで、同等の9か月間である2023年6月30日終了の4,310万ドルに比べています。
2024年6月30日までの3か月間の研究開発費は1,190万ドルであり、2023年6月30日までの3か月間の1,030万ドルと比較して増加しています。3か月間の期間中の研究開発費の増加は、主に以下の理由に関連しています:
| (i) | 新しいコンサルタントの加入に関連する人件費の増加があり、このMAAの投稿の準備に協力するために雇われたいくつかの新しいコンサルタントに関連するもので、人件費コストは130万ドル増加しました。 |
| (ii) | ANAVEXの製造活動に関連する期間に比べ、約260万ドルの増加がありました。®商業利用の可能性がある2-73のサポート、およびMAAのサポートのため。 |
| (iii) | ANAVEXに関する支出に関連する比較期間よりも90万ドル増加しました。®臨床試験3-71-SZ-001は、財務2024年第2四半期に開始されました。 |
33
これらの増加に対し、以下により部分的に相殺されました。(i) 3か月の期間における株式報酬費用の減少、前回のオプション授与の帰趨化による$900,000の減少(ii) EXCELLENCE試験の完了とAVATAR試験の相応するオープンラベル延長によるRett症候群プログラムにおける3か月の期間について出費が約$1,000,000減少(iii) Alzheimer’s プログラムに関連する比較期間における出費の $900,000程度の減少、Phase 2b/3臨床試験の完了によるもの。
2024年6月30日終了時点の9か月間の当社の研究開発費は3,030万ドルで、2023年6月30日までの比較期間の3,370万ドルに対して低下しています。 9か月間の研究開発費の減少は、主に以下の理由に関連しています:
| (i) | その前のオプション授与とマイルストーンベースの授与期間の延長の結果、9か月間の株式報酬費用が4.2百万ドル減少しました。 |
| (ii) | 当社のレット症候群プログラムに関連した比較可能な期間における支出の9か月間の減少は、EXCELLENCEトライアルとAVATARトライアルの各オープンラベル延長の完了の結果、約310万ドル前後となりました。 |
| (iii) | アルツハイマーのプログラムに関連する期間における支出について、Fase 2b/3の臨床試験の完了により、前年同期比で約$230万の支出減少がありました。 |
これらの減少は、ANAVEXに関する9か月間の支出の増加により、140万ドルの増加で部分的に相殺されました。®ANAVEXの臨床試験3-71-SZ-001の費用が、3分の1の期間において140万ドル増加しました。これは、2024年第2四半期に開始された臨床試験です。また、パーキンソン病の第2/3相臨床試験の計画に関連するスタートアップコストについては、比較期間に対して120万ドルの増加があり、ANAVEX製造活動については、比較期間に対して約280万ドルの増加がありました。®商業用途のANAVEX2-73の可能性をサポートし、MAAを支援するために、いくつかの新しいコンサルタントが追加されたことに関連して、約120万ドルの増加がありました。また、MAAの提出準備を支援するために、いくつかの新しいコンサルタントが追加されたことに関連して、約120万ドルの増加がありました。
以下の表は、2024年6月30日終了時点の3か月および9か月間の研究開発費を要約したものです。(単位:千ドル)
| 2024年6月30日終了の3か月間 | 6月30日までの9ヶ月 | |||||||||||||||
| 2024 | 2023 | 2024 | 2023 | |||||||||||||
| 外部サービスプロバイダーの費用 | $ | 6,263 | $ | 5,224 | $ | 15,995 | $ | 17,443 | ||||||||
| 人件費 | 3,928 | 2,628 | 9,538 | 7,416 | ||||||||||||
| 株式報酬認識支払い | 1,491 | 2,416 | 4,524 | 8,733 | ||||||||||||
| その他の共通費用 | 188 | 15 | 226 | 65 | ||||||||||||
| 総研究開発費 | $ | 11,870 | $ | 10,283 | $ | 30,283 | $ | 33,657 | ||||||||
2024年6月30日及び2023年、製品候補毎の外部サービス提供者にかかる費用は以下の通りでした(千ドル単位):
| 2024年6月30日終了の3か月間 | 6月30日までの9ヶ月 | |||||||||||||||
| 2024 | 2023 | 2024 | 2023 | |||||||||||||
| ANAVEX®2-73 | $ | 4,656 | $ | 4,288 | $ | 12,647 | $ | 15,038 | ||||||||
| ANAVEX®3-71 | 1,322 | 863 | 2,775 | 2,103 | ||||||||||||
| 全セクターのその他の製品候補 | 5 | — | 71 | 3 | ||||||||||||
| その他の外部サービスプロバイダー費用 | 280 | 73 | 502 | 299 | ||||||||||||
| 全セクターのその他の外部サービスプロバイダー費用の合計 | $ | 6,263 | $ | 5,224 | $ | 15,995 | $ | 17,443 | ||||||||
2024年6月30日までの3ヶ月間の一般および管理費は290万ドルであり、2023会計年度の同じ四半期と比較して320万ドルであった。2024年6月30日までの9ヶ月間の一般および管理費は830万ドルであり、2023年会計期間の同じ期間の940万ドルに対して減少しています。一般および管理費の減少の主な原因は、3ヶ月の期間における株式報酬費用の50万ドル、9ヶ月の期間における株式報酬費用の150万ドルの削減であり、前回のオプションの付与とマイルストーンベースの付与による時間枠の延長の結果です。
34
レジスタンスを進めつつ、ANAVEXの臨床プログラムを推進することにより、研究開発費用は現在の水準から上昇することが予想されています。®3-71試験に関するスキゾフレニア、EMAへのMAA提出の準備、ANAVEXの計画的な進展®パーキンソン病の2-73、フラジャイルXの臨床試験の2-73を開始する計画、これらの臨床イニシアチブを管理しサポートするための追加スタッフの採用を続けることで®これらの臨床的イニシアチブを管理・サポートするための追加スタッフの採用を続けることと共に、フラジャイルXの臨床試験のためのANAVEX 2-73やさらなる進展にも取り組みます。
その他の収入(純額)
2024年6月30日までの3か月間のその他の収入の純額は240万ドルで、2023年6月30日までの比較対象期間の230万ドルに対して増加しています。2024年6月30日までの9か月間のその他の収入の純額は、2023年6月30日までの比較的な9か月間の580万ドルに対して730万ドルに増加しています。年初からのその他の収入の増加は、2023年購入契約(以下で説明した)の締結に伴う、比較的な9か月間のどちらにも認識された900万ドルの一時的な融資費用と、利子率の上昇に関連する利息収入の増加に主に関係しています。
純損失
2024年6月30日までの3か月間の純損失は、1220万ドル、1株当たり0.14ドルであり、2023年度の比較四半期の1130万ドル、1株当たり0.14ドルに対して減少しました。2024年6月30日までの9か月間の純損失は、3140万ドル、1株当たり0.38ドルであり、比較される9か月間の3740万ドル、1株当たり0.47ドルに比べて下がりました。年初からの純損失の減少は、研究開発費の減少と上記の他の収益の増加に主に関連しています。
流動資産は2023年9月30日現在、現金が768,159米ドル、総流動資産が17,018,359ドル、総流動負債が6,259,310米ドルであった。純流動資産は10,759,049米ドルであり、運転資本比率は0.36であった。 2023年9月30日現在、当社の総資産と総負債はそれぞれ20,753,700米ドルと7,986,428米ドルでした。 2023年9月30日現在、当社の株主資本合計は12,767,272米ドルであり、ギアリング比率(銀行借入金÷株主資本)は18.3%でした。
運転資本(千単位)
| 2023年6月30日 2024年 |
2023年9月30日 | |||||||
| 流動資産 | $ | 141,535 | $ | 154,386 | ||||
| 流動負債 | 11,754 | 12,534 | ||||||
| 運転資本 | $ | 129,781 | $ | 141,852 | ||||
2024年6月30日時点で、私たちは総流動資産額が1億4150万ドルで、2023年9月30日の年度末に比べて約1億2900万ドル減少しました。総流動資産の減少は、主に事業活動で使用された現金によるもので、2023年の購入契約に基づく1億1900万ドルの現金によって部分的に相殺されました。
2024年度の最初の9か月間において、$24.2 millionの現金及び現金同等物を使用して、2023年度の同じ期間に比べて$21.9 millionの運営資金を提供しました。2024年6月30日時点で、現金残高は$138.8 millionであり、当社の2023年9月30日の決算期末時点の$151.0 millionに比べて低下しています。
アナベクスの臨床試験を推進するために、当社の資本資源を引き続き活用する予定です。®2-73とアナベクス®3-71とパイプライン化合物の将来的な開発のために必要な作業を実施する予定です。
キャッシュ・フロー
以下の表は、2024年6月30日および2023年に終了した9か月間のキャッシュフローを要約したものです(単位:千円)。
| 2024 | 2023 | |||||||
| 営業活動による純キャッシュフロー | $ | (24,154 | ) | $ | (21,936 | ) | ||
| 財務活動による純キャッシュフロー | 11,886 | 27,595 | ||||||
| 現金及び現金同等物の増加/(減少) | $ | (12,268 | ) | $ | 5,659 | |||
35
営業活動によるキャッシュフローの使用
2024年6月30日までの9ヶ月間の営業活動による正味現金使用額は2420万ドルであり、2023年6月30日までの同期間の2190万ドルに比べ増加しました。その主な理由は、同じ期間において非現金の株式報酬を考慮した正味現金費用が約70万ドル増加し、また、現在の9ヶ月間と比較して他の運転資本勘定のポジティブな変化があったからです。
財務活動によるキャッシュフロー
2024年6月30日までの9か月間の財務活動による現金提供額は1,190万ドルであり、2023年6月30日までの比較的同じ9か月間の段階での2,760万ドルに比べて低いです。両期間の財務活動による現金の提供は、2023年購入契約の下で、さまざまな市場価格で普通株式を発行して受け取った現金に主に帰因します。
その他の資金調達
2023年購入契約
2023年2月3日、同社はLincoln Park Capital Fund, LLC(「Lincoln Park」という)と150,000,000ドルの購入契約(「2023 Purchase Agreement」という)を締結し、同社はLincoln Parkに時期によって最大$15000万ドル相当の普通株式を売却および発行する権利があり、Lincoln Parkは2026年2月3日までの3年間で時期によって同社の普通株式を購入する義務を負います。
通常の取引条件に基づき、会社は一定の条件を満たす場合に株式200,000株までの購入をLincoln Parkに指示することができ、それぞれを「通常の購入」と呼びます。通常の購入の金額は、普通株式の市場価格に基づいて一定の状況に応じて増加する可能性があります。ただし、Lincoln Parkの通常の購入に対するコミットメント期間中にLincoln Parkの誓約する義務は、400万ドルを超えることはないことが条件です。普通株式の購入価格は、2023年購入契約書に記載された時点の市場価格に基づいて決定されます。2023年購入契約書では、Lincoln Parkが支払う購入価格の上限はありません。また、会社が通常の購入で利用可能な普通株式の全額をLincoln Parkに指示した場合、2023年購入契約書で定められた「加速購入」と「追加加速購入」と呼ばれる追加購入をLincoln Parkに指示することができます。
2023年の購入契約により、企業は、(i)このような数量以上を発行するために株主の承認が得られた場合、または(ii)2023年の購入契約に基づくすべての適用売却の平均価格が、執行日の直前のナスダック・キャピタル・マーケットでの普通株式の終値(A)または直近の5営業日の普通株式の終値(B)の下限を上回る場合を除き、普通株式の販売をリンカーン・パークに制限して15,606,426株の普通株式、発行済み普通株式の19.99%を表します。
2023年購入契約により、リンカーンパークが既に保有する全普通株式と合わせて、リンカーンパークとその関連企業が、任意の時点で、発行済の全普通株式の総数に対して 4.99% を超える権利を有する場合、当該株式の購入要請をすることはできません。この計算は、「1934年証券取引法」第13(d)条およびその下部規則13d-3に従って行われます。
2023年の購入契約締結を考慮し、当社はリンカーン・パークに対して、コモン・ストックの75,000株を承認料として発行しました(「初期承諾株」)。2023年9月30日までの期間中、150,000,000ドルの総額コミットメントに基づき、リンカーン・パークが、当社の裁量に基づいて購入した場合、初期承諾株と合わせて比例的に75,000株を発行することに同意しました。
36
2024年6月30日終了時点の9か月間にわたり、会社は2023年購入契約に基づき、Lincoln Parkに対して普通株式245万5646株、価格1130万ドルを含む普通株式245万株及びコミットメント株5646株を発行しました。また、2023年6月30日終了時点の9か月間にわたり、会社は2023年購入契約に基づき、Lincoln Parkに対して普通株式312万8348株、価格2670万ドルを含む普通株式312万5000株及びコミットメント株13348株、さらに75000株の初期コミットメント株を発行しました。
2024年6月30日には、2023年の購入契約の下で1,108万ドルが利用可能でした。
コントロールされた株式公開販売契約書
2020年5月1日、当社はCantor Fitzgerald & Co.およびSVb Leerink LLC(以下、「販売代理店」といいます)と改訂された販売契約(以下、「2020年販売契約」といいます)を締結し、販売代理店を通じて時折、有効な登録声明書に記録された普通株式の株式を提供し、売却することができる(「市場での販売」といいます)。
当社の指示に基づいて配当通知が届いたら、2020年の販売契約の条件の下で、営業代理人は「市場公開」と見なされる方法で普通株式の株式を、売却時の市場価格または関連市場価格で交渉して売却し、または当社の事前書面による同意を得て交渉による取引を含む、法律で許可される他の方法で売却できる。2020年の販売契約の下で株式の販売を行う義務はなかった。当社または営業代理人は、相手方に通知することで「市場公開」を中止または解除することができますが、特定の条件に従う必要があります。営業代理人は、一般的な取引や販売プラクティス、適用法令、及びナスダックの規則に基づき、商業的に合理的な努力を行います。
2020年の販売契約に基づく普通株式の売却益の総額の3.0%に対するセールスエージェントの手数料を支払うことに合意しました。また、慣行的な免責と貢献権を販売エージェントに提供することにも同意しました。
2024年6月30日までの9ヶ月間において、2020年の販売契約においては株式が売却されませんでした。同社は2020年の販売契約を2024年7月24日に終了しました。
報告書日付の外債残高
私達には、現在または将来、私達の財務状況、財務状況の変化、収益または費用、業績の結果、流動性、投資資本支出または資本リソースに重要な影響を与えるものはない外形貸借対照表はありません。これは私達の株主にとって重要なものです。
重要な会計方針
当社は米国で一般的に承認された会計原則に従って当社の総括的な中間財務諸表を準備し、資産、負債、売上高、経費、および関連するリスクの開示に影響を与える見積もりや仮定を行っています。当社の見積もりは、歴史的な経験やその他の合理的だと思われる仮定に基づいていますが、実際の結果はこれらの見積もりと異なる場合があります。また、条件に応じて当社の事前開示書に基づいています。
当社の年次報告書(フォーム10-K)に記載されている会計方針や見積もりについては、2023年9月30日に終了した会計年度に関して、連邦証券取引委員会に提出された2023年11月27日付のものと同様に、重要な変更はありませんでした。
最近の会計関連の発表
このフォーム10-Qに含まれる当社の短縮連結中間財務諸表の注記2「最近の会計基準」を参照してください。
37
項目3。市場リスクに関する数量・質的な開示。
当社は、2023年9月30日に終了した年次報告書の項目7Aで開示された市場リスクに対する当社の露出に関して、特記すべき変更はありません。
項目 4. 統制および手順
情報開示コントロールおよび手順
私たちは、証券取引法下に提出される定期報告書で開示が必要な重要な情報が、所定の期間内に記録、処理、要約、報告されるように設計された開示管理および手順を維持し、このような情報が蓄積され、当社の経営陣、最高経営責任者、およびプリンシパルファイナンシャルグループ責任者に通知され、必要な開示に対するタイムリーな決定ができるようにしています。
当社の取締役会、および当社の最高執行責任者および主要財務責任者を含めた当社管理陣の監督の下、ルール13a-15(e)に定義された開示コントロールおよび手順のデザインおよび運用の有効性について、この四半期報告書書式10-Qの期間の終わりまでに当社が実施した評価に基づき、当社の最高執行責任者および主要財務責任者は、2024年6月30日現在、当社の開示コントロールおよび手順が有効であると結論づけた。
財務報告に関する内部統制の変更
2024年6月30日までの四半期において、私たちの財務報告に対する内部統制について、経営陣の評価により、Exchange Actの規則13a 15(d)または15d 15(d)に基づいて特定され、財務報告に重大な影響を及ぼす可能性がある、または合理的に影響を及ぼすと思われる事象はありませんでした。
38
第II部-その他の事項
項目 1. 法的手続き
2024年3月13日、米国ニューヨーク南部地区連邦地方裁判所において、株主集団訴訟が起こされました。 この訴訟は、訴状にBlum v. Anavex Life Sciences, Corp. et al.、事件番号は1:24-cv-01910で、当社と Christopher Misslingを被告として名指しされています。 訴状は、特定の臨床試験に関する開示および発言に対する、1934年証券取引法違反を主張しています。®2-73. 2024年7月12日、原告代表が修正訴状を提出しました。当社は、この訴状が根拠なしであると考えています。当社は、弁護に精力的に取り組んでおり、訴訟で主張されるすべての請求を取り下げさせる可能性を追求しています。
2024年5月8日、同社の別の株主が同じ被告を相手に同様の主張を起こすことを目的とした訴訟を起こし、加えてAVATAR試験に関する開示と声明に関する主張を提起しました。株主は、訴訟を統合し、統合された訴訟のリードプレイントとして指名されるよう求めました。裁判所は、2024年6月13日に統合動議とリードプレイント動議を否認しました。同社は、この訴訟を強く防御する予定です。
2024年5月13日、自称株主が会社を代表して取締役会に対して代表訴訟を提起しました。クレームは様々な一般法的主張(違反行為)と同様に、一定の臨床試験に関する開示と声明について、二つの自称集団訴訟での主張を問題視した第14条(a)違反に関するものです。会社は名義上の被告として名指されています。被告は訴訟を激しく抗弁する予定です。
私たちは、ビジネスに付随する通常の訴訟を除いて、当社または当社の子会社が関与している、またはその財産が対象となっている法的手続きを知りません。私たちの取締役、役員、関係者の中で、5%以上の株式を所有する登録株主または有益株主、またはその関係者が、私たちまたは私たちの子会社の利益に反する有利な当事者である、またはその関心に矛盾する関心を持つ他の手続きはありません。
項目 1A. リスク ファクター
「リスクファクター」において説明されたリスクファクターについて、2023年9月30日に終了した財務年度に関する年次報告書10-Kの第I項1Aにおいて議論があった以降、重大な変更はありません。2023年11月27日にSECに提出されました。
項目 2. 登録されていない株式の販売と処理に係る収益利用
この四半期報告書(フォーム10-Q)の期間中、私たちは、証券法第1933号に登録されていない、以前に報告されていない株式証券を売却していませんでした。フォーム8-Kの現行報告書で報告されていない株式証券を売却していませんでした。
項目3。上位証券の債務不履行。
なし。
項目4。鉱山安全性の開示。
該当なし。
項目5。その他の情報。
インサイダー取引計画
オン
39
Thomas 10b5-1取引計画に関するものを除き、本社取締役またはSection 16役員から、2024年6月30日までの3ヶ月間に「Rule 10b5-1取引計画」または「非Rule 10b5-1取引計画」(それぞれRegulation S-KのItem 408(a)で定義される)に関する通知は一切ありませんでした。
項目 6. 展示物
| 展示資料 数字 |
説明 |
| (3) | 定款および規約 |
| 3.1 | 定款(2021年9月30日締めの年次報告書10-Kの付表3.1を参照のこと) |
| 3.2 | 規約(当社が提出した現在報告書8-Kを参照のこと) |
| (31) | Rule 13a-14(a)/ 15(d)-14(a)証明書 |
| 31.1* | Christopher Missling、PhDの証明書。 |
| 2002年サーバンス・オクスリー法第302条に基づく主要財務責任者の証明書 | Sandra Boenischの証明書 |
| (32) | セクション1350認証書 |
| サーバンス・オクスリー法第906条に採択された18 U.S.C.セクション1350に基づく主要な執行役員の証明書 | Christopher Missling、PhDとSandra Boenischの証明書。 |
| (101) | XBRL |
| 101.INS* | XBRL INSTANCE DOCUMENT |
| 101.SCH* | XBRL TAXONOMY EXTENSION SCHEMA |
| 101.CAL* | XBRL TAXONOMY EXTENSION CALCULATION LINKBASE |
| 101.DEF* | XBRL TAXONOMY EXTENSION DEFINITION LINKBASE |
| 101.LAB* | XBRL TAXONOMY EXTENSION LABEL LINKBASE |
| 101.PRE* | XBRL TAXONOMY EXTENSION PRESENTATION LINKBASE |
*付属。
** これに添付されます。
40
署名
1934年の証券取引法の要件に基づき、登録者は、下記の者が正当に代理し、署名したことにより、この報告書を提出しました。
アナベックス・ライフ・サイエンシズ・コーポレーション
| //クリストファー・ミスリング、博士 | |
| クリストファー・ミスリング博士 | |
| 最高経営責任者 | |
| (最高執行役員) | |
| 日付:2024年8月6日 |
| /s/サンドラ・ベーニッシュ | |
| サンドラ・ベーニッシュ、CPA、CGA | |
| プリンシパルファイナンシャルオフィサー | |
| (プリンシパルファイナンシャルおよび会計責任者) | |
| 日付:2024年8月6日 |
41