Exhibit 99.2

管理层对财务状况和业务成果的讨论和分析
介绍
本管理层讨论与分析(“MD&A”)旨在回顾COSCIENS生物制药股份有限公司(原Aeterna Zentaris Inc.)截至2024年6月30日的三个月和六个月的经营业绩、财务状况和现金流量。在本MD&A中,“COSCIENS”、“公司”、“我们”、“我们的”均指COSCIENS生物制药股份有限公司及其子公司。这一讨论应当与公司未经审计的中期简明合并财务报表(“未经审计的合并财务报表”)以及截至2024年6月30日以及2024年和2023年六个月的相关附注信息一起阅读。我们的未经审计的合并财务报表依照国际会计准则理事会(“IFRS”)颁布的国际财务报告准则编制。
2024年6月3日,Aeterna Zentaris公司和Ceapro公司完成了其全股票并购交易,2024年6月9日,公司更名为COSCIENS Biopharma公司。更多交易详情以及本管理讨论与分析报告的呈现基础,请参见下文的“安排计划”和“名称更改”,以及未经验收的合并财务报表注释3。
本公司的普通股同时在纳斯达克交易所和多伦多证券交易所上市,交易标的为“CSCI”。
所有板块 此管理层讨论与分析中的金额均以千美元为单位,除股份和每股数据外,另有注明的除外。本管理层讨论与分析自2024年8月12日董事会批准。本管理层讨论与分析日期为2024年8月12日。
关于 前瞻性陈述
本报告中的信息截至2024年8月12日编制。本报告中某些陈述被称为“前瞻性陈述”,构成美国《证券诉讼改革法》(已修订)下的“前瞻性陈述”以及加拿大证券法规下的“前瞻性信息”。与历史事实无关的所有说明、情况、活动或进展的声明均属于前瞻性陈述。在本报告中使用“预计”、“假设”、“相信”、“可能”、“要出现”、“预测”、“未来”、“目标”、“指引”、“打算”、“可能”、“会”或否定或类似术语以及通常用于未来和条件的术语通常意味着确定前瞻性陈述,尽管并非所有前瞻性陈述都包括此类词语。
本 MD&A 中的前瞻性声明包括但不限于以下方面:公司的专利技术和价值驱动产品及其开发,Macrilen(macimorelin)和公司的相关计划,包括商业化和临床项目;公司的业务策略;公司在目标市场的定位;公司加速将 PGX 技术扩展至商业层面的能力;临床前和临床研究和试验及其预期的时间和结果,包括在此类研究和试验后将某些产品推向市场的潜力;我们制药治疗性资产能够应对多种适应症的未满足医疗需求;管理层的假设、估计和判断;流动性和资本资源;财务资源是否充足以支持运营和支出需求;内部财务报告控制的限制;以及公司的计划、目标、未来展望和财务状况等。前瞻性声明必须基于公司在做出此类声明时认为合理的许多因素和假设,这些因素和假设本质上受到重大的业务、经济、运营和其他风险、不确定性、不确定因素和其他因素的影响,包括以下因素所述,这些因素可能导致公司的实际结果、业绩或成果与此类前瞻性声明所表达或暗示的结果、业绩或成果有实质性的不同,因此不得对此类前瞻性声明放置过度依赖。® (macimorelin)及公司在此方面的计划,包括商业化和临床项目;公司的业务策略;公司在其目标市场中的定位;公司加速将 PGX 技术扩展至商业层面的能力;临床前和临床研究和试验及其预期的时间和结果,包括在此类研究和试验后将某些产品推向市场的潜力;我们制药治疗性资产能够应对多种适应症的未满足医疗需求;管理层的假设、估计和判断;流动性和资本资源;财务资源是否充足以支持运营和支出需求;内部财务报告控制的限制;以及公司的计划、目标、未来展望和财务状况等。本 MD&A 中的前瞻性声明包括但不限于,涉及公司的专利技术和价值驱动产品及其开发,以及 Macrilen(macimorelin)。前瞻性声明必须基于公司在做出此类声明时认为合理的许多因素和假设,这些因素和假设本质上受到重大的业务、经济、运营和其他风险、不确定性、不确定因素和其他因素的影响,你需要注意。这些因素可能导致公司的实际结果、业绩或成果与此类前瞻性声明所表达或暗示的结果、业绩或成果有实质性的不同,因此不得对此类前瞻性声明放置过度依赖。
| 1 |
前瞻性声明涉及众所周知和未知的风险和不确定性,包括但不限于:公司目前和未来的业务策略;运营表现在预期范围内;预期未来现金流;公司所处的环境中的地方和全球经济状况;预期资本和运营成本;技术开发以及产品开发和相关临床试验和验证研究的不确定性,包括我们在欧盟和美国儿科临床试验成功的依赖性。® (马西莫林)DETECt 试验的结果可能不支持儿童生长激素缺陷的监管批准;由昆士兰大学正在进行或计划中的马西莫林的前期临床研究或我们正在研发的其他产品的结果可能不成功或不支持将产品推进人类临床试验;我们筹集资金并获得融资以继续我们目前计划的业务的能力;我们现在严重依赖马西莫林(macimorelin)的成功和相关的出让安排以及继续可用的资金和资源成功销售该产品;能够保障战略合作伙伴的安全用药,进行宣传推广,开发,生产,营销和分销我们的产品,包括我们能否在Novo Nordisk AG的许可协议终止后进入新的许可协议或类似安排;我们能否与其他制药公司达成外出让管理,开发,生产,营销和分销协议并保持这些协议的有效性;我们保护和执行我们的专利组合和知识产权的能力;以及我们能否继续在纳斯达克上市我们的普通股。® 苹果 CEO 库克大规模出售股票,套现逾 3 亿港元。
投资者应查询我们在加拿大和美国证券委员会的季度和年度报告以获取更多的风险和不确定性信息,包括在我们的20-F表的年度报告和在2024年5月14日提交给SEC的6-k表的“风险和不确定性”标题下提到的内容,该文件在www.sedarplus.ca的公司档案和EDGAR上可查询到www.sec.gov。除非被政府机构或适用法律要求这样做,否则我们不承担更新这些风险或不确定性声明或公开宣布此处任何前瞻性声明的任何修订以反映未来的结果、事件或发展的义务。
关于未来业绩、财务状况或现金流的某些前瞻性声明可能构成财务展望。这些声明基于管理层认为合理的未来事件假设,截至本文日期,基于经济情况、拟议采取的行动和管理层对当前可用相关信息的评估。公司管理层已在本文日期批准了该财务展望。读者应该注意,此处包含的财务展望信息不应该用于除披露之外的其他目的。
关于 材料信息
本MD&A包括我们认为在考虑所有情况后对投资者有重要意义的信息。我们认为信息和披露如果导致或有合理的预期导致我们的证券市场价格或价值发生重大变化,在决定投资时,合理的投资者将考虑这些信息和披露至关重要。
我们是加拿大所有省份证券立法下的报告发行人,我们的证券已在美国证券交易委员会(“SEC”)注册。因此,我们必须向适当的证券监管机构提交或提供持续披露信息,例如中期和年度财务报表、管理层讨论和分析、代理或信息通告、年度20-F表格报告、重大变更通告和新闻发布。公司的其他信息和这些文件的副本可通过我们的公司秘书或以下网址免费索取:www.cosciensbio.com,www.sedarplus.ca和所有板块。 www.sec.gov.
| 2 |
公司概览
COSCIENS生物制药公司是一家专业的生物制药公司。公司开发和销售多元化产品组合,包括化妆品、营养保健品和药品。这些产品使用公司专有技术生产。公司拥有的专利技术包括高压气体膨胀(PGX)技术,该技术是一种独特和颠覆性的技术,可以从自然植物资源中产生高价值的活性成分,用于新型化妆品、营养保健和治疗产品。公司的两种价值驱动产品——燕麦β-葡聚糖和燕麦田酰胺——被广泛应用于许多知名化妆品和个人护理品牌。这些产品采用公司专有的燕麦提取制造技术生产,以其广为人知的健康益处而著名。
公司的主要药品产品macimorelin(Macrilen;Ghryvelin),是美国FDA和欧洲委员会批准的唯一口服检测药品,用于诊断成人生长激素缺乏症(AGHD)。公司正在利用macimorelin的临床成功和安全性来开发儿童生长激素缺乏症(CGHD)的诊断,这是一个重要的未满足的需求领域。®; Ghryvelin®是首个也是唯一一款获美国FDA和欧洲委员会批准的口服试剂,用于诊断成年人生长激素缺乏症(AGHD)。该公司正在利用macimorelin的临床成功和显著的安全性,开发其用于儿童早发性生长激素缺乏症(CGHD)的诊断,这是一个重要的未满足的需求领域。
公司还致力于开发其治疗资产,建立了潜在用于处理多种适应症的临床前开发管道,包括治疗基于炎症的疾病,特发性肺纤维化(IPF),神经脊髓炎光谱障碍(NMOSD),帕金森病(PD),低副甲状腺素血症和肌萎缩侧索硬化症(ALS;路易·格里克病)。
安排计划
2024年6月3日,Aeterna Zentaris Inc.(“Aeterna”)和Ceapro Inc.(“Ceapro”)通过全股票并购交易(“Transaction”)完成了交易。交易是通过法院批准的安排计划完成的,根据Aeterna和Ceapro于2023年12月14日签署的安排协议的条款进行的。由于交易的影响,每个未清偿的Ceapro普通股都被交换成0.02360的Aeterna普通股。此外,作为交易的一部分,Aeterna在交易完成前立即向其股东发行0.47698股的股票购买权(“新权证”),每股Aeterna普通股或权证持有0.47698股。
交易完成后,Ceapro的前股东完全摊薄基础上拥有约50%的Aeterna普通股,而Aeterna的前股东在完全摊薄基础上拥有约50%的Aeterna普通股。出于财务报告和会计目的,在该交易中,Ceapro是收购Aeterna。 COSCIENS Biopharma Inc.的合并财务报表反映了Ceapro在报告期内的经营成果和财务状况,并包括2024年6月30日和2023年12月31日以及截至2024年6月30日和2023年的三个月和六个月的运营结果,包括交易后28天Aeterna的运营结果。该交易于2024年6月3日完成。
伴随而来的基本报表包括COSCIENS生物制药股份有限公司及其全资子公司(“集团”)的账目。COSCIENS生物制药股份有限公司是集团的最终母公司。该公司目前拥有6个直接和间接的全资子公司,其中包括总部位于加拿大的Ceapro公司及其全资子公司Ceapro(P.E.I.)和Juvente公司。根据《安排》,购买者将购买公司的所有流通的普通股("流通的下属投票股")和普通股("多重投票股"),除了"Rollover股权"外,每股价格为34美元现金。该公司及其全资子公司(“集团”)合并财务报表中,包含COSCIENS生物制药股份有限公司及其全资子公司(“集团”)的账目。COSCIENS生物制药股份有限公司是集团的最终母公司。该公司目前拥有6个直接和间接的全资子公司,其中包括总部位于加拿大的Ceapro公司及其全资子公司Ceapro(P.E.I.)和Juvente公司。DC 苹果CEO库克大规模出售股票,套现逾3亿港元。依特钠在德国设立的全资子公司为依特钠Zentaris GmbH(“AEZS Germany”),在法兰克福设立的全资子公司为Zentaris IVF GmbH,依特钠在美国德拉华州成立,办公室位于南卡罗来纳州的Summerville。
| 3 |
更名
在2024年7月16日公司的全年股东大会和特别股东大会上(当时该公司名为Aeterna Zentaris Inc.),公司股东批准了一项特别决议,授权董事会实施更改公司名称为“COSCIENS生物制药股份有限公司”的名称更改(“名称更改”)。于2024年8月6日,公司根据章程进行了修改以实现名称更改。 (以下简称“CBCA”),该法案于2022年8月31日生效,为董事会建立了多数投票要求。具体地,CBCA要求,在仅有一个被提名人竞选每个董事会席位的选举中,股东应分别为(而不是“投”或“保留”)各位被提名人投票,并且只有当他们获得赞成票的多数时,每位候选人才能当选。CBCA规定,如果现任董事在这些情况下未能当选,董事可继续任职,直至(i)选举之日后的第90天,或(ii)任命或选举其继任者的日子。以实现名称更改。
2024年8月9日,公司的普通股开始在 tsx 和纳斯达克上交易,交易标的为“CSCI”,同时停止使用原交易标的“AEZS”。此次更名并未导致公司股本结构发生任何变化。
关键 运营发展
活性成分
公司的活性成分业务专注于利用我们在天然来源的提取、生产和商业化方面的独特专业知识。公司的商业化产品在美容保健市场中处于良好地位,主要关注于从燕麦中提取的两种生物活性物质(β-葡聚糖和燕麦素)所记录的健康益处。这些产品包括:
| ● | 一个由天然有效成分组成的商业化产品线,包括β-葡聚糖、燕麦苷(胶体燕麦提取物)、燕麦粉、燕麦油和燕麦多肽,通过我们的分销合作伙伴和直销渠道销往个人护理、化妆品、医疗和动物保健行业; | |
| ● | 一个由天然抗衰老的护肤品产品线,采用β-葡聚糖和燕麦苷等活性成分,通过我们的全资子公司Juvente销售给化妆品市场;DC 公司本身; | |
| ● | 给日本和亚洲的兽医制备和销售的治疗产品,包括一种燕麦洗发水、一种耳部清洁剂和一种皮肤复合物/润肤剂。 |
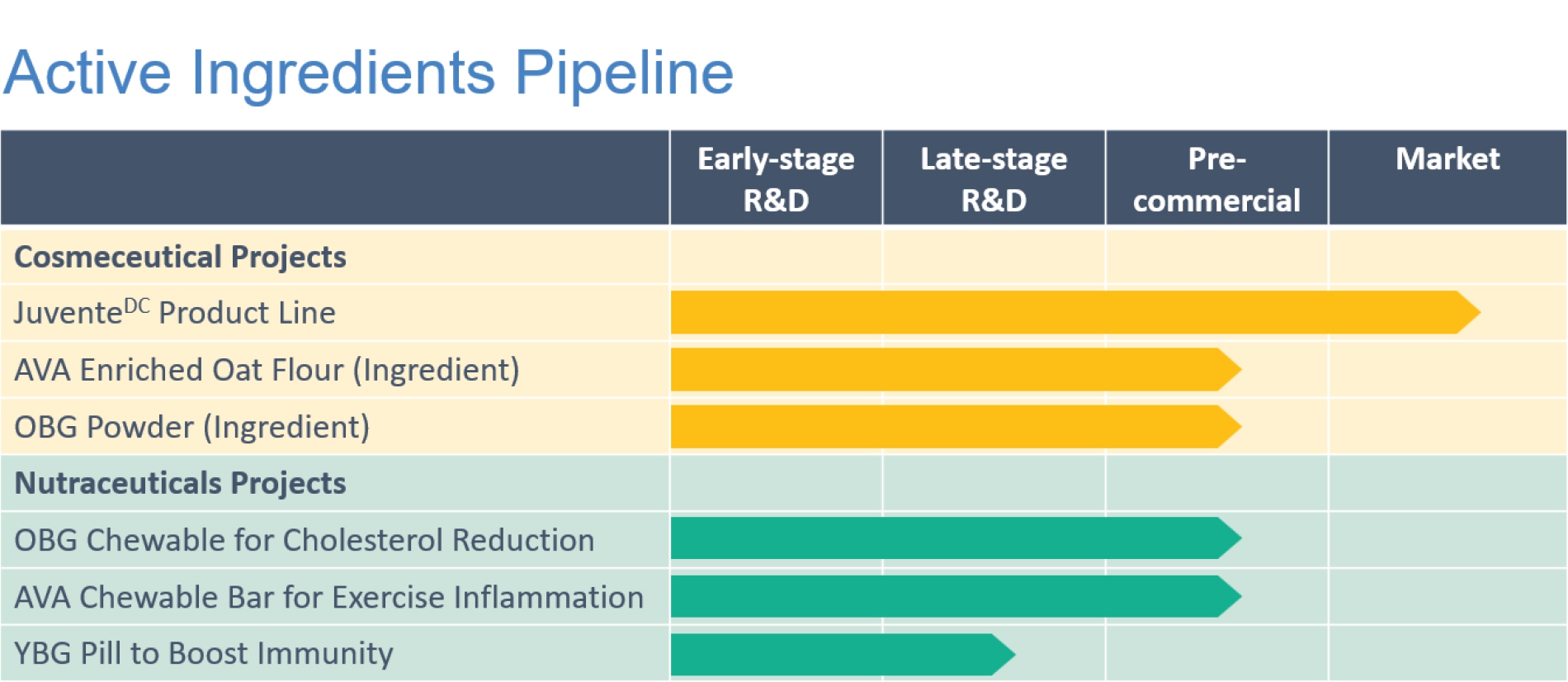
公司用于提取和处理生物活性成分的核心技术包括专有的乙醇分馏工艺(EFP)和加压膨胀燃料币技术(PGX)。EFP 主要用于生产液体配方,而 PGX 用于粉末配方。 PGX 是一项专利的、独特的、具有多项关键优势的颠覆性技术,可以将生物聚合物处理成高价值和新型生物复合材料。在使用绿色溶剂的同时,它能够一步制备纯化的高孔隙聚合物复合材料,如气凝胶,而这是传统的干燥技术所无法制备的。 2023 年,公司开始与位于奥地利的NATEX Prozesstechnologie GesmbH合作,加速 PGX 技术在其Edmonton工厂和Natex Termitz工厂的商业化规模化,这两项计划均预计于2024年完成。
考虑到燕麦β-葡聚糖和莜麦苷具有降低胆固醇和抗炎作用,我们正在积极地开发基于燕麦的产品线,以满足营养保健品市场的未满足需求,战略重点放在以下方面:
| 4 |
燕麦 β-葡聚糖 - 可咀嚼以降低胆固醇
利用加拿大、美国和欧盟批准的燕麦β葡聚糖作为降低胆固醇的有效成分,并于2023年12月获得了加拿大卫生部的批准,公司开发出一种健康的食品产品,能够提供足够的燕麦β葡聚糖剂量以符合所有监管和健康要求。已经制备出商业化制造样品,证明了即使需要高水平的燕麦β葡聚糖才能在人类中提供科学证明的降低胆固醇的能力,也能生产出一种健康美味的食品产品。公司打算通过各种电子商务平台将该产品提供给B2C的健康和功能性食品市场。
艾维尼糠酰胺 -抗炎营养成分可咀嚼制剂
除了化妆品应用外,当口服时,燕麦苷还可以治疗基于炎症的疾病,如运动引起的炎症、关节炎以及胃肠道和心血管水平的炎症。
通过使用独特的色谱纯化技术,公司成功地开发出高度纯化和严格表征的药品级粉末配方,目的是将此类原料药作为营养保健品和药品制剂提供。
公司初期使用avenanthramides制造保健品的活动集中在明尼苏达大学李丽姬博士的领导下,评估该复合物的生物利用度和生物功效。在2018年完成生物利用度研究后,公司成功完成了两项生物功效研究,使用了低和高剂量的Avenanthramides与年轻男女一起,证明Avenanthramides在减轻运动诱导炎症方面的功效,在血液中炎症生物标志物显著降低。这些研究为开发产品铺平了道路,如富含Avenanthramides的超细燕麦粉制成的可嚼燕麦棒作为保健品,以及用于临床试验的药品级片剂的开发。公司正在Edmonton工厂开始小批量生产富含Avenanthramides的燕麦粉。
酵母β-葡聚糖(YBG)-营养保健胶囊,可作为免疫增强剂。
虽然酵母β-葡聚糖是一种商业产品,具有众所周知的免疫特性,但要获得高纯度产品却是供应商面临的重大挑战。使用PGX技术,该公司成功处理了几种酵母β-葡聚糖配方,并且现在能够提供一个具有非常明确规格的高纯度YBG产品。该公司进一步证明了该产品的作用机制 在体外和页面。,为抑郁症、焦虑症和其他沉思性障碍提供了有前景的新疗法。研究。
本产品已被用于在埃德蒙顿设施完成PGX技术5倍放大和在奥地利进行的10倍放大工作。在埃德蒙顿生产的粉剂配方将以胶囊形式提供,作为免疫性增强剂产品。
| 5 |
药品
公司还致力于发展其药品治疗资产,并建立了一个临床和临床前研发流水线,以潜在地应对多种症状的未满足医疗需求,包括生长激素缺乏的诊断测试,潜在治疗基于炎症的疾病和纤维病如特发性肺纤维化(IPF),神经变性状况如视神经脊髓病谱系障碍(NMOSD),帕金森病(PD),甲状旁腺功能减退),肌萎缩侧索硬化症(ALS;路易·格里格病)。)以及内分泌病理学如甲状旁腺功能减退症。
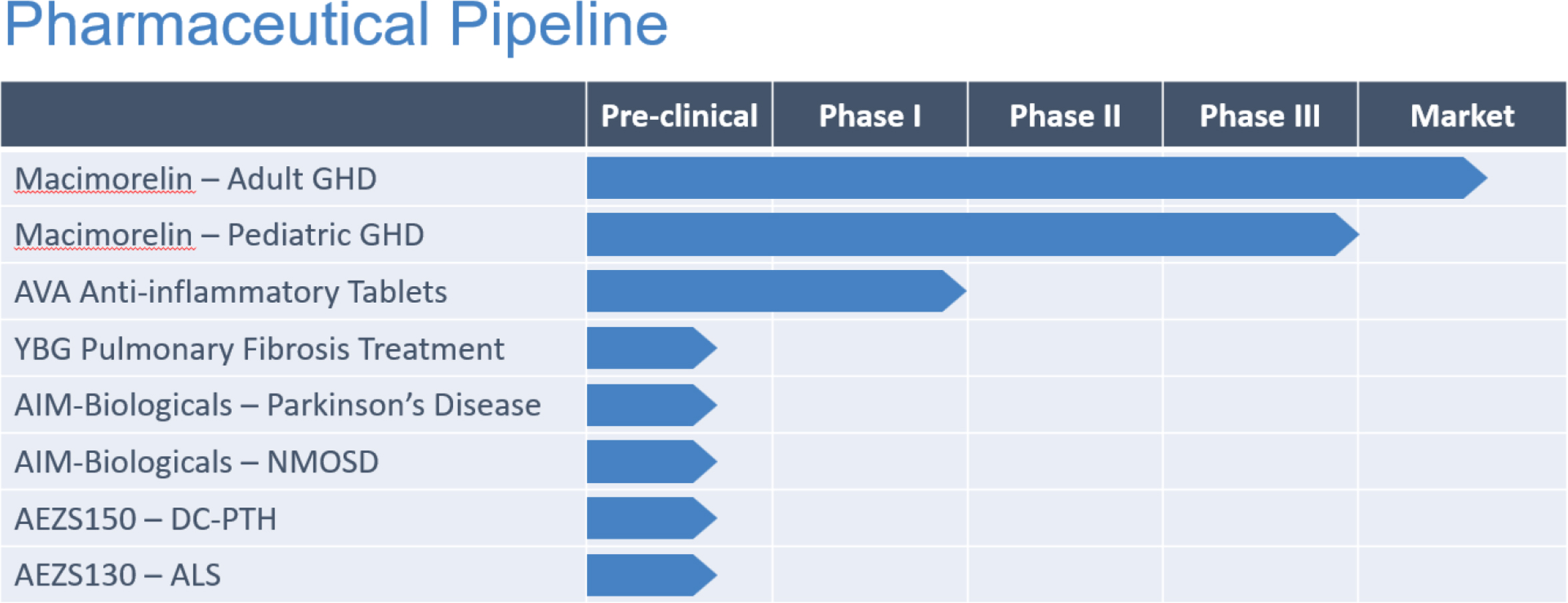
Macimorelin商业化计划
Macrilen® (macimorelin)是美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)唯一获批用于诊断成人生长激素缺乏症(AGHD)的口服检测工具。Macimorelin目前在欧洲经济区和英国通过与Pharmanovia的独家许可协议营销,已在英国、瑞典、丹麦、芬兰、德国、荷兰和奥地利发布。更多欧盟国家将在待重新协商后推出。公司的其他几个许可和商业化伙伴也正在寻求在以色列和巴勒斯坦权力机构、韩国、土耳其和一些非欧盟巴尔干国家商业化macimorelin的批准。该公司正积极寻求商业化macimorelin在北美、亚洲和其他国家的发展机会。® 在欧洲经济区(EEA)和英国,Ghryvelin是第一个也是唯一一个经过欧洲药品管理局认可的口服检测工具,通过Pharmanovia的独家许可协议推向市场。到目前为止,该产品已在英国、瑞典、丹麦、芬兰、德国、荷兰和奥地利推出。更多的欧盟国家将在待重新协商后推出。该公司的几个其他许可和商业化合作伙伴也在寻求批准将macimorelin商业化在以色列和巴勒斯坦权力机构、韩国、土耳其和一些非欧盟巴尔干国家。该公司正在积极开发商业化macimorelin在北美、亚洲和世界其他地区的机会。
Macimorelin 临床方案
2020年底,公司进入AEZS-130-P02(DETECt-trial)临床安全性和有效性研究的初创阶段,评估macimorelin诊断儿童生长激素缺乏症(CGHD)。DETECt临床试验是一项开放标签、单剂量、多中心和多国际研究,预计全球招募约100名受试者(包括美国和欧洲的研究中心),其中至少40名于青春期前,40名于青春期时。如果成功,该研究设计预计适合支持独立的潜在检测要求。2021年4月22日,与该临床试验相关的美国FDA授权使用新药申请被激活(详见:https://clinicaltrials.gov/ct2/show/NCT04786873),公司计划继续执行试验。 https://clinicaltrials.gov/ct2/show/NCT047868732024年第二季度,在欧洲成功完成了最后一名受试者的访视,该研究已在欧洲和北美招募了100名受试者。公司仍按计划于2024年第三季度报告DETECt试验的头条数据。
用于炎症性疾病的潜在应用的燕麦素类化合物
由于具有强效抗氧化和抗炎作用等建议生物活性,avenanthramides引起了重要兴趣。在体外和页面。,为抑郁症、焦虑症和其他沉思性障碍提供了有前景的新疗法。2023年11月,公司启动了第一阶段安全性研究,评估其旗舰产品avenanthramides在管理与炎症相关的疾病方面的潜在应用。该第一和第二阶段研究(“AvenActive”)是双盲、安慰剂对照、随机、适应性的首次人体研究,旨在评估avenanthramide单个和多个口服剂量的安全性、耐受性和药代动力学。在该试验的第一阶段中,将招募72名健康受试者。单剂量递增(SAD)组包括8名健康受试者的6个队列,而多剂量递增(MAD)组将包括8名健康受试者的3个队列。
| 6 |
该研究的SAD阶段已完成,每组8名健康受试者接受每日剂量从30mg到960mg的剂量,共6组。在SAD阶段中未观察到任何重大不良反应。公司预计在2024年夏季第三季度开始MAD阶段。第一阶段完成后,如果结果成功,AvenActive方案还包括为表现轻度至中度炎症证据的患者设计的第2a期。该阶段将招募24名患者。
该1-2a阶段的试验旨在评估avenanthramides的安全性并收集其潜在疗效的初步见解。随着试验的进展,公司仍专注于与监管机构、医疗专业人员和患者社区合作,将这种创新疗法推向市场。
酵母 β-葡聚糖作为治疗特发性肺纤维化(IPF)的方法
IPF是一种渐进性疾病,中位生存期为2-7年。虽然IPF可以发生在任何年龄段,但65岁及以上的人中,每200个人中就有1个人患有IPF。随着人口老龄化以及大量COVID-19患者在感染后发展出IPF,IPF的患病率和影响预计将增加。
PGX处理的酵母β-葡聚糖(PGX-YBG)可以作为一种传递系统“装载”多种生物活性物质,用于吸入治疗。 2019年,该公司与麦克马斯特大学合作,开始评估初步收集的数据以评估适用于特发性肺纤维化(IPF)治疗的输送系统的优化。虽然酵母β-葡聚糖似乎是一种有前途的化合物,但研究人员认为,治疗纤维化肺部疾病的理想配方应该是开发一种由目前市场上的药物装载到PGX-YBG上而产生的可吸入复合物。在对PGX-YBG单独和与市售药物联合使用的初步实验之后,团队得出结论:PGX-YBG可以作为单独的活性成分用于治疗纤维化肺病、新型抗纤维化治疗,包括COVID-19患者。
2023年,我们与麦克马斯特大学合作完成了一项进一步的临床前CHRP研究,评估PGX-YBG作为潜在治疗选择,用于患有间质性肺疾病(ILD)的个体。CHRP研究的积极结果,不仅证明了PGX-YBG是可以呼吸的,而且它可以在小鼠肺部安全可靠地重新编程巨噬细胞,这使人们对其可能在自行使用手持吸入器时能够安全地穿透人类肺部充满信恳智能给予了。这些结果于2023年5月24日至26日在2023年CSPS / CC-CRS年会 - 制药科学的下一个前沿上展示。
公司正在评估PGX-YBG对ILD的下一步计划。如果公司决定将其推进到临床试验作为治疗严重ILF的潜在可吸入免疫治疗药物(可能包括IPF和COVID-19相关的肺纤维化病变)的首选药物,则我们需要先进行并获得产生IND的毒理学研究结果。
| 7 |
AIM 生物制剂:定向、高度特异的自身免疫修饰治疗药物,适用于治疗神经脊髓病谱障碍(NMOSD)和帕金森病。
AIM 生物制品基于自然的孕期过程,在这一过程中,将部分外来的胎儿抗原注入母体免疫系统,使其耐受。胎儿蛋白会以某些免疫抑制性的主要组织相容性复合体类I分子为载体进行处理和呈递,从而诱发这种耐受。在自身免疫性疾病中,免疫系统会被误导并攻击自身的蛋白质。我们的AIm生物制品旨在恢复针对这些蛋白质的耐受性,以治疗自身免疫性疾病。我们的AIm生物制品计划专注于NMOSD这种罕见的孤儿病以及第二大最常见的神经退行性疾病——帕金森病。
2021年1月,我们与德国Wuerzburg大学签订了排他性专利许可和研究协议,获得了全球开发、制造和商业化AIm生物制品治疗NMOSD的权利。此外,我们聘请了麻省总医院(MGH)的神经免疫学家迈克尔·莱维博士作为科学支持和建议的顾问,他在炎症性中枢神经系统“CNS”疾病、神经系统自身免疫性疾病和NMOSD领域拥有专业知识。2021年9月,我们与Würzburg大学签订了额外的排他性许可协议,旨在开展面向帕金森病潜在治疗的早期临床前期研究。2022年5月12日,我们宣布了一个创新的帕金森病小鼠模型的阳性临床前研究结果,α-Synuclein AIm生物制品的治疗表现出一种向更好的运动功能趋势,以及显著诱导调节性T细胞和营救黑质天然色素神经元的能力。这些数据在2022年5月6日至10日在美国免疫学家协会的年度活动IMMUNOLOGY2022™上发布,该活动于在俄勒冈州波特兰举办。2022年6月13日,我们宣布已经在人体和小鼠模型中实现了NMOSD治疗的概念验证。这些发现在2022年6月10日至13日在希腊雅典举办的第13届国际自身免疫病大会上公布。2022年10月,我们与波士顿MGH和迈克尔·莱维博士签订了一项研究和开发协议,以开展NMOSD的临床前研究。 我们的候选物LP-284在多种血液肿瘤中显示出了有前途的体外抗癌活性,这些血液肿瘤与LP-184所瞄准的指标不同。LP-284正在进行第1A期的临床试验,该试验于2023年第四季度开始。和鼠模型中均获得NMOSD治疗的阳性结果。这些发现在2022年6月10日至13日在希腊雅典举办的第13届国际自身免疫病大会上公布。th 2022年10月,我们与波士顿MGH和迈克尔·莱维博士签订了一项研究和开发协议,以开展NMOSD的临床前研究。 离体和页面。光学成像研究 在美国波士顿的麻省总医院和神经免疫学家迈克尔·莱维博士的支持下,进行NMOSD的临床前研究。
NMOSD是一种自身免疫性疾病,其靶向蛋白质是主要存在于视神经和脊髓中的水通道蛋白4。该疾病导致失明和瘫痪,患病率为每10万人中0.7-10人。NMOSD往往会经历危及生命的复发,需要使用高剂量类固醇和血浆置换进行积极治疗。目前的治疗选择包括使用免疫抑制性单克隆抗体进行治疗,但会带来严重感染的风险。我们正在评估已获得的数据,并考虑使用AIm生物平台治疗NMOSD的计划。
帕金森病是一种神经性疾病,通常伴随着运动问题,具有缓慢和快速进展形式。这是世界上影响1000万人的第二种最普遍的神经退行性疾病。PD的标志是神经元包含主要是α-突触核蛋白(αSyn)与生产多巴胺细胞死亡相关。多巴胺能药物是PD症状的主要治疗方法。目前还没有药物治疗可用于预防或延缓疾病进展。为了开发生物制品作为潜在的PD治疗药物,艾特纳利用创新神经退行性动物模型,如AAV-A53万亿中的α-突触核蛋白特异性T细胞与αSyn帕金森病小鼠等,在其中进行了研究。目前,我们正在继续测试抗原特异性AIm生物制品候选分子,用于潜在的帕金森病治疗。 体外和页面。光学成像研究 用于潜在的帕金森病治疗的抗原特异性AIm生物制品候选分子目前正在测试中。
| 8 |
AEZS-150 - 延迟清除(“DC”)甲状旁腺激素(“PTH”)(“DC-PTH”)融合多肽:慢性甲状旁腺功能减退的潜在治疗方法
于2021年3月11日,我们与英国谢菲尔德大学签订了排他性许可协议,其知识产权涉及PTH融合多肽在人类使用领域的覆盖,该技术最初将由爱泰纳用于潜在的慢性甲状旁腺功能减退症(“HypoPT”)治疗。根据协议条款,我们获得了全球开发、制造和商业化PTH融合多肽在所有人类用途下所涵盖的专利申请的权利。我们将负责进一步开发、生产、获批和商业化许可产品。
谢菲尔德大学的研究人员已经开发出一种方法,以增加肽的血清清除时间,该公司正在将其应用于治疗HypoPt的开发中。 HypoPt是一种孤儿疾病,在这种疾病中PTH水平异常低或缺失,在美国每10万人中有37例,在丹麦有22例,在挪威有9.4例,在意大利有5.3至27例。标准治疗是钙和维生素D补充。首席候选药物AEZS-150正在开发中,为成人提供每周治疗慢性甲状旁腺功能减退症的选择。最近的进展包括成功验证并再现了来自谢菲尔德大学的前体内数据,该数据用于治疗甲状旁腺功能减退症的大鼠模型。我们还正在审查AEZS-150的潜在制造工艺,并与该公司的合同开发和制造组织进行合作。
AEZS-130 - Macimorelin临床前项目
2021年1月13日,我们与昆士兰大学签订了一份物质转移协议,并在2022年7月与该大学的商业化公司UniQuest Pty Ltd.签订了一份研究和许可协议,旨在进行临床前研究并推进macimorelin作为治疗ALS的潜在治疗方法的开发。
ALS是一种罕见的进行性神经系统疾病,主要影响控制自主运动的神经元,导致失去控制运动,如行走、讲话和咀嚼能力。大多数ALS患者死于呼吸衰竭,通常是在诊断后3-5年。目前还没有治愈ALS或停止或逆转疾病进展的有效治疗方法。Ghrelin是一种具有广泛生物活性的激素,最为人所知的是刺激生长激素释放,已经显示出作为ALS治疗的新证据。
通过我们在昆士兰大学资助的研究,我们一直在进行临床前实验,旨在寻找一种潜在的替代配方,适用于肌萎缩侧索硬化症患者使用,我们目前正在评估其结果。
| 9 |
压缩 中期综合损失陈述及综合损失数据
| (以美元千为单位,每股亏损除外) | 截至三个月结束时 | 截至2022年6月30日的六个月 | ||||||||||||||
| 6月30日, | 6月30日, | |||||||||||||||
| 2024 | 2023 | 2024 | 2023 | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 收入 | 2,337 | 1,392 | 4,394 | 3,977 | ||||||||||||
| 销售成本 | (1,518 | ) | (595 | ) | (2,671 | ) | (1,992 | ) | ||||||||
| 毛利润 | 819 | 797 | 1,723 | 1,985 | ||||||||||||
| 研发 | 1,530 | 691 | 2,592 | 1,115 | ||||||||||||
| 销售、一般及行政费用 | 3,044 | 1,220 | 4,710 | 2,352 | ||||||||||||
| 经营亏损 | (3,755 | ) | (1,114 | ) | (5,579 | ) | (1,482 | ) | ||||||||
| 由于货币变化而获得的收益 | 17 | - | 42 | - | ||||||||||||
| 财务成本 | (22 | ) | (24 | ) | (85 | ) | (90 | ) | ||||||||
| 其他收入 | 109 | 43 | 158 | 114 | ||||||||||||
| 认股权证和DSU负债公允价值变动 | 1,755 | - | 1,755 | - | ||||||||||||
| 其他收入 | 1,859 | 19 | 1,870 | 24 | ||||||||||||
| 税前亏损 | (1,896 | ) | (1,095 | ) | (3,709 | ) | (1,458 | ) | ||||||||
| 所得税收回 | 474 | 235 | 886 | 313 | ||||||||||||
| 净亏损 | (1,422 | ) | (860 | ) | (2,823 | ) | (1,145 | ) | ||||||||
| 其他综合损失: | ||||||||||||||||
| 可能随后重新分类为利润或损失的项目: | ||||||||||||||||
| 外币翻译调整 | (47 | ) | 479 | (506 | ) | 546 | ||||||||||
| 综合亏损 | (1,469 | ) | (381 | ) | (3,329 | ) | (599 | ) | ||||||||
| 每股基本和摊薄亏损 | (0.64 | ) | (0.47 | ) | (1.39 | ) | (0.62 | ) | ||||||||
| 加权平均基本和稀释后的股份数量 | 2,220,303 | 1,846,775 | 2,033,539 | 1,846,759 | ||||||||||||
| 10 |
财务状况中期综合报表摘要
| (以美元千为单位) | 6月30日, 2024 | 12月31日 2023 | ||||||
| $ | $ | |||||||
| 现金及现金等价物 | 27,804 | 6,678 | ||||||
| 交易和其他应收款项以及其他流动资产 | 4,020 | 1,398 | ||||||
| 库存 | 3,055 | 4,009 | ||||||
| 限制性现金等价物 | 332 | 8 | ||||||
| 财产、设备和无形资产 | 14,834 | 11,652 | ||||||
| 总资产 | 50,045 | 23,745 | ||||||
| 应付款项、应计及未付税款 | 5,949 | 1,012 | ||||||
| 拨备的短期部分 | 430 | - | ||||||
| 递延收入-短期 | 97 | - | ||||||
| 租赁负债 | 1,687 | 1,698 | ||||||
| 非金融非流动负债 (1) | 15,655 | - | ||||||
| 负债合计 | 23,818 | 2,710 | ||||||
| 股东权益 | 26,227 | 21,035 | ||||||
| 负债和股东权益总计 | 50,045 | 23,745 | ||||||
| (1) | 主要由员工福利、准备金和递延收入的非流动部分组成。 |
| 11 |
营业收入 和销售成本
下表总结了我们在指定期间获得的毛利率:
| (以千美元为单位,除百分比外) | 截止到6月30日的三个月 | |||||||||||||||
| 2024 | 2023 | 变更 | 变更 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 营业收入 | ||||||||||||||||
| 活性成分 | 2,334 | 1,392 | 942 | 68 | % | |||||||||||
| 药品 | 3 | - | 3 | 100 | % | |||||||||||
| 总收入 | 2,337 | 1,392 | 945 | 68 | % | |||||||||||
| 销售成本 | ||||||||||||||||
| 活性成分 | 1,514 | 595 | 919 | 154 | % | |||||||||||
| 药品 | 4 | - | 4 | 100 | % | |||||||||||
| 销售成本合计 | 1,518 | 595 | 923 | 155 | % | |||||||||||
| 毛利率 | 819 | 797 | 22 | |||||||||||||
| 毛利率% | 35 | % | 57 | % | ||||||||||||
截至2024年6月30日为止的三个月的总营业收入增加了90万美元。这次增长是由于相比2023年同期,Avenanthramides、Beta Glucan和燕麦油的销售增加了。截至2024年6月30日的三个月的销售成本增加了90万美元,这主要是由于本期销售量的增加以及生产成本的增加。
| (以千美元计,百分比除外) | 截至6月30日的六个月 | |||||||||||||||
| 2024 | 2023 | 改变 | 改变 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 收入 | ||||||||||||||||
| 活性成分 | 4,391 | 3,977 | 414 | 10 | % | |||||||||||
| 制药 | 3 | - | 3 | 100 | % | |||||||||||
| 总收入 | 4,394 | 3,977 | 417 | 10 | % | |||||||||||
| 销售成本 | ||||||||||||||||
| 活性成分 | 2,667 | 1,992 | 675 | 34 | % | |||||||||||
| 制药 | 4 | - | 4 | 100 | % | |||||||||||
| 总销售成本 | 2,671 | 1,992 | 679 | 34 | % | |||||||||||
| 毛利率 | 1,723 | 1,985 | (262 | ) | ||||||||||||
| 毛利率% | 39 | % | 50 | % | ||||||||||||
2024年6月30日结束的六个月的总营业收入增加了40万美元。增加是由于2024年上半年与2023年同期相比,Avenanthramides和Beta Glucan的销售增加。2024年6月30日结束的六个月的销售成本增加了70万美元。增加主要是由于该期间销售量的增加以及生产成本的上升。
| 12 |
研发费用
以下表格总结了我们在指定期间内发生的研发费用:
| (以千美元为单位,除百分比外) | 截止到6月30日的三个月 | |||||||||||||||
| 2024 | 2023 | 变更 | 变更 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 直接研发支出: | ||||||||||||||||
| 用于炎症性疾病的燕麦氨酸衍生物 | 522 | 262 | 260 | 99 | % | |||||||||||
| Macimorelin儿童DETECt试验 | 381 | - | 381 | 100 | % | |||||||||||
| PGX | 19 | 44 | (25 | ) | -57 | % | ||||||||||
| 其他项目 | 286 | 190 | 96 | 51 | % | |||||||||||
| 小计 | 1,208 | 496 | 712 | 144 | % | |||||||||||
| 应计费用包括以下内容:员工相关费用 | 301 | 190 | 111 | 58 | % | |||||||||||
| 厂房、折旧和其他费用 | 21 | 5 | 16 | 320 | % | |||||||||||
| 总费用 | 1,530 | 691 | 839 | 121 | % | |||||||||||
2024年6月30日结束的三个月的总研发支出为150万美元,相比于2023年同期的70万美元,增加了80万美元。这主要是由于:
| ● | 通过向MHI投资30万美元,增加用于燕麦苷治疗基于炎症的疾病的一二期临床研究的支出;和 | |
| ● | 由于收购Aeterna,导致DETECt试验成本增加40万美元,员工相关成本增加10万美元。 |
| (以千美元为单位,除百分比外) | 六个月截至6月30日, | |||||||||||||||
| 2024 | 2023 | 变更 | 变更 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 直接研发支出: | ||||||||||||||||
| 用于炎症性疾病的燕麦酰胺 | 1,273 | 299 | 974 | 326 | % | |||||||||||
| Macimorelin儿科DETECt试验 | 381 | - | 381 | 100 | % | |||||||||||
| PGX | 49 | 85 | (36 | ) | -42 | % | ||||||||||
| 其他项目 | 336 | 302 | 34 | 11 | % | |||||||||||
| 小计 | 2,039 | 686 | 1,353 | 197 | % | |||||||||||
| 应计费用包括以下内容:员工相关费用 | 526 | 418 | 108 | 26 | % | |||||||||||
| 厂房、折旧和其他费用 | 27 | 11 | 16 | 145 | % | |||||||||||
| 总费用 | 2,592 | 1,115 | 1,477 | 132 | % | |||||||||||
2024年6月30日结束的六个月期间,我们的总研发费用为260万美元,与2023年同期的110万美元相比增加了150万美元。这一增幅主要是由于:
| ● | 将开展对杂谷甾醇治疗基于炎症的疾病的1-2a临床研究,估计总投资额为100万美元;并增加了支出。 | |
| ● | DETECt试验成本增加了40万美元,员工相关成本增加了10万美元,因收购Aeterna而产生。 |
| 13 |
销售、一般及行政开支
下表总结了我们发生的销售、一般和管理费用的期间。
| (以千美元为单位,除百分比外) | 截止到6月30日的三个月 | |||||||||||||||
| 2024 | 2023 | 变更 | 变更 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 销售、一般和管理费用: | ||||||||||||||||
| 薪酬和福利 | 492 | 513 | (21 | ) | -4 | % | ||||||||||
| 保险 | 117 | 58 | 59 | 102 | % | |||||||||||
| 专业费用 | 1,339 | 232 | 1,107 | 477 | % | |||||||||||
| 其他办公和一般费用 | 1,096 | 417 | 679 | 163 | % | |||||||||||
| 总销售、一般及管理开支 | 3,044 | 1,220 | 1,824 | 150 | % | |||||||||||
截至2024年6月30日的三个月内,我们的总销售、总务及管理费用为300万美元,相比2023年同期的120万美元增长了180万美元。这一增长主要是由于对艾特纳的收购。
| (以千美元为单位,除百分比外) | 六个月截至6月30日, | |||||||||||||||
| 2024 | 2023 | 变更 | 变更 | |||||||||||||
| $ | $ | $ | % | |||||||||||||
| 销售、一般和管理费用: | ||||||||||||||||
| 薪水和福利 | 855 | 980 | (125 | ) | -13 | % | ||||||||||
| 保险 | 151 | 99 | 52 | 53 | % | |||||||||||
| 专业费用 | 2,183 | 512 | 1,671 | 326 | % | |||||||||||
| 其他办公及费用 | 1,521 | 761 | 760 | 100 | % | |||||||||||
| 总销售、一般及管理开支 | 4,710 | 2,352 | 2,358 | 100 | % | |||||||||||
截止2024年6月30日,我们的总销售、一般和管理费用为470万美元,相比于2023年同期的230万美元增长240万美元。这主要归因于:
| ● | 由于在上述安排计划中并购永恒公司,法律及专业费用增加了170万元,其他办公室和一般性开支增加了80万元;但是被抵消掉了。 | |
| ● | 由于前期全职员工数量的减少,导致工资和福利减少了10万元。 |
其他 收入(成本)
截至2024年6月30日的三个月和六个月期间,我们的其他净收入为190万美元,而去年同期分别为1.9万美元和2.4万美元,同比增长了190万美元。这主要归因于认股权证和DSU负债公允价值变动180万美元以及更高的利息收入10万美元。
| 14 |
净亏损
截止2024年6月30日的三个月期间,我们报告了一项综合净亏损140万美元,每股普通股亏损0.64美元,相比之下,2023年同期综合净亏损为90万美元,每股普通股亏损0.47美元。净亏损增加的50万美元归因于:
| ● | 由于燕麦苷的成本上涨和DETECt临床试验成本上涨,研发费用增加了$800,000;和 | |
| ● | 由于收购Aeterna公司,销售、一般和管理费用增加了$1,800,000;抵消了 | |
| ● | 由于认股权证和DSU负债公允价值的变化,其他收入增加了$1,900,000;和 | |
| ● | 所得税收入增加了$300,000。 |
截止2024年6月30日的六个月内,我们报告了一项280万美元的综合净亏损,每股普通股损失1.39美元,相比之下,2023年同期的综合净亏损为110万美元,每股普通股亏损0.62美元。净亏损增加的170万美元归因于以下几个方面:
| ● | 营收增加了40万美元,但由于销售量增加和生产成本上升,销售成本增加了70万美元; | |
| ● | 研发成本增加了150万美元,主要是由于avenanthramides和DETECt临床试验成本增加; | |
| ● | 销售、总务和行政成本增加了240万美元,主要由于收购Aeterna而抵消; | |
| ● | 其他收入增加了190万美元,主要是由于权证和DSU负债公允价值变化; | |
| ● | 所得税减免增加了60万美元; |
选择的季度财务数据
| 截至三个月结束时 | ||||||||||||||||
| (以美元计,每股数据以千为单位) | 6月30日, 2024 | 3月31日 2024 | 12月31日 2023 | 2020年9月30日 2023 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 收入 | 2,337 | 2,057 | 1,213 | 1,952 | ||||||||||||
| 净亏损 | (1,422 | ) | (1,401 | ) | (1,565 | ) | (776 | ) | ||||||||
| 每股净亏损(基本和稀释) (1) | (0.64 | ) | (0.47 | ) | (0.52 | ) | (0.26 | ) | ||||||||
| 截至三个月结束时 | ||||||||||||||||
| (以千美元为单位,除每股数据外) | 6月30日, 2023 | 3月31日 2023 | 12月31日 2022 | 2020年9月30日 2022 | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 收入 | 1,392 | 2,585 | 2,447 | 2,944 | ||||||||||||
| 净亏损/利润 | (1,339 | ) | (285 | ) | (170 | ) | 774 | |||||||||
| 每股基本与稀释净亏损/利润 (1) | (0.47 | ) | (0.09 | ) | (0.06 | ) | 0.26 | |||||||||
| (1) | 每股净亏损是基于每个报告期内流通股份的加权平均数,这可能会季度对比有所不同。因此,每个季度的净亏损每股金额之和可能不等于全年每股净亏损。 |
历史季度业绩和净损失不能反映可预测趋势的营业收入或支出模式,这在很大程度上是由于我们某些营收元件的非经常性和汇率期货的净金融收入和亏损的不可预测季度波动。历史季度销售和业绩主要受客户订单时间的变化,不同产品组合和我们生产能力最优利用的变化影响。
| 15 |
流动性和资本资源 流动性是一家公司支持其当前和未来运营、满足其义务以及以其他方式进行经营的能力。截至2023年12月31日和2023年9月30日,公司现金约为$,不包括客户委托现金。
管理资本(包括股东权益,其主要成分为现金及其等价物)的公司目标是确保足够的流动性,以资助研发成本、生产成本、销售费用、一般行政费用和运营资本需求。在过去的几年中,我们通过公开和私募股权发行和发行以及进入许可和合作安排来筹集资本,这些筹资及偿付款项与股权发行的收益一起,一直是我们的主要流动性来源。公司的资本管理目标与以前期间相同。分红的政策是保留现金以保持资金可用性,为推进公司的产品开发组合所需的活动提供资金,并在适当的商业机会出现时追求适当的商业机会。公司不受任何监管机构或其他外部来源强制实施的资本要求。 考虑到股权发行的相应报酬和我们的主要流动性来源,我们的首要流动性来源是协议性和合作性安排。 公司管理资本(包括股东权益,现金和现金等价物是其主要组成部分)的目标是确保足够的流动性,以资助研发成本、生产成本、销售费用、一般和行政费用以及运营资本需求。在过去几年中,我们通过公开和私募股权发行和证券发行以及参与许可和合作协议来筹集资本,并通过考虑到相应的报酬和股权发行的收益来增加我们的流动性。公司的资本管理目标与以前时期相同。分红政策是保留现金以保持资金的可用性,以资助推进公司的产品开发组合所需的活动并追求适当的商业机会。公司不受任何监管机构或其他外部来源强制实施的资本要求。
现金流 流量
以下表格显示了我们合并现金流量的汇总。
| (以千美元计) | 三个月结束了 | 六个月已结束 | ||||||||||||||
| 6月30日 | 6月30日 | |||||||||||||||
| 2024 | 2023 | 2024 | 2023 | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 现金和现金等价物—期初 | 3,506 | 9,295 | 6,678 | 10,190 | ||||||||||||
| 用于经营活动的净现金 | (1,389 | ) | (813 | ) | (3,790 | ) | (1,642 | ) | ||||||||
| 用于融资活动的净现金 | (126 | ) | (70 | ) | (198 | ) | (133 | ) | ||||||||
| 用于投资活动的净现金 | 25,880 | (54 | ) | 25,316 | (85 | ) | ||||||||||
| 汇率变动对现金及现金等价物的影响 | (67 | ) | 180 | (202 | ) | 208 | ||||||||||
| 现金和现金等价物-期末 | 27,804 | 8,538 | 27,804 | 8,538 | ||||||||||||
运营活动
截至2024年6月30日为止,营运活动所使用的现金为140万美元,相比于2023年同期的80万美元有了60万美元的增长,主要原因是:
| ● | 由于燕麦苷的成本上涨和DETECt临床试验成本上涨,研发费用增加了$800,000;和 | |
| ● | 由于收购Aeterna而导致销售、一般和管理成本增加了180万美元;抵消了 | |
| ● | 由于收购Aeterna,经营资产和负债增加了200万美元。 |
截至2024年6月30日的六个月期间,运营活动使用现金为380万美元,而2023年同期为160万美元。这220万美元的现金流出增加主要归因于:
| ● | 销售成本升高导致毛利率下降30万美元; | |
| ● | 研发成本增加了150万美元,主要是由于avenanthramides和DETECt临床试验成本增加; | |
| ● | 由于收购Aeterna所致,销售、总务及行政费用增加240万美元;同时抵消的是 | |
| ● | 由于收购Aeterna所致,经营资产和负债增加了200万美元。 |
投资活动
截至2024年6月30日的三个月期间,投资活动提供的现金净额为2590万美元,而2023年同期为10万美元。这2580万美元的投资现金流入增加主要归因于与Aeterna收购相关的现金流入2600万美元,抵消了20万美元的固定资产购买成本。
| 16 |
股本
截至2024年8月9日,我们共发行并已发行的普通股为3115974股,以及80878份期权、114230份推迟股份单位和693534份权证。每份期权、推迟股份单位和权证均可行使购买1股普通股。
财政资源充足度
截至2024年6月30日,公司保留收益为670万美元,净亏损为140万美元,经营活动现金流为负140万美元,涵盖了截至2024年6月30日的三个月。我们认为现有手头现金足以支付未来12个月的预计运营和资本支出要求。我们计划主要通过产品销售和手头现金为未来的运营和资本支出融资。此外,我们也认为,现有手头现金足以支持未来的预计运营和资本支出要求,覆盖到2025年。我们进行了一些假设,这些假设可能是错误的,我们可能会比预期更早地耗尽资本资源。我们还可能需要额外的资本来追求其他产品候选方案的授权或收购。
我们支持业务的资金能够维持的时间段的预测是一种前瞻性声明,包含风险与不确定性,实际结果可能因各种因素而有实质性变化;我们未来的资本需求难以预测,将取决于许多因素,包括:
| ● | 我们可能建立的其他合作、许可和其他安排的条款和时间; | |
| ● | 我们当前和未来的潜在产品候选品的临床前研究和临床试验的启动、进展、时间和完成情况,以及其他研究和开发项目; | |
| ● | 我们与FDA在监管批准要求方面的一致性; | |
| ● | 我们追求的产品候选品的数量和特征; | |
| ● | 监管批准结果、时间和成本; | |
| ● | 因改变监管要求而可能导致的延迟; | |
| ● | 聘请新员工以支持我们持续增长以及任何关键人员离职可能导致的潜在费用和时间; | |
| ● | 提交和审理专利申请以及执行和捍卫专利权的成本; | |
| ● | 提交和审理知识产权权利以及执行和捍卫任何知识产权相关权利的成本; | |
| ● | 与任何潜在的贸易及其他应收款项的迟延或未收款有关的成本; | |
| ● | 与外汇波动或利率变化可能带来的潜在成本有关的成本; | |
| ● | 扩大我们的客户基础及相关需求波动的能力; | |
| ● | 与原材料供应可能中断或质量影响相关的成本; | |
| ● | 应对和捍卫自身投诉和潜在诉讼的成本; | |
| ● | 为我们的产品候选品采购临床和商业用途的供应的成本和时间; | |
| ● | 我们收购或许可其他产品候选品和技术的程度。 |
截至2024年6月30日的合同义务和承诺
报告期末尚未确认为负债的重要支出如下:
| (以美元千为单位) | TOTAL | |||
| $ | ||||
| 不满1年 | 4,352 | |||
| 1 - 5年 | 54 | |||
| 4,406 | ||||
| 17 |
公司与开发合作伙伴签订了各种协议,包括许可和类似安排。这些协议可能需要公司在开发阶段、上市或营业收入里程碑达成时进行支付,尽管公司通常有权在不受罚款的情况下终止这些协议。公司可能需要在实现特定产品的销售额、监管或其他里程碑时支付高达38573美元。
附带条件
在正常的业务操作过程中,公司可能会涉及各种索赔和法律诉讼,例如合同终止和员工相关等事宜。
重要 会计政策、估计和判断
按照IFRS编制简明中期综合财务报表需要管理层对未来进行判断,估计和假设,这些会影响公司资产、负债、收入、费用和相关披露的报告数额。这些判断、估计和假设是基于历史经验、预期、当前趋势和管理层认为在编制公司简明中期综合财务报表时相关的其他因素。
管理层定期审查公司的会计政策、假设、估计和判断,以确保以适用于中期财务报表的国际财务报告准则(IFRS)公平地呈现了精简的中期合并财务报表。对估计的修订应作出远期公布。关键会计估计和假设,以及在编制公司精简的中期合并财务报表中应用会计政策所使用的关键判断与ap。除下文所述之外,它们与Ceapro截至2023年12月31日年度合并财务报表应用的相同:
| ● | 定义利益义务的衡量:主要精算假设;以及 | |
| ● | 业务收购:识别收购人,确定转让对价的公允价值以及获得的某些资产和负债的公允价值。 |
金融 风险因素和其他金融工具
我们面临的来自金融工具的风险性质和范围,包括信用风险、流动风险和市场风险,以及我们如何管理这些风险,详见 Ceapro 审计的年度综合财务报表 15 注。
关联交易
除了我们与管理层的雇佣合同和赔偿协议外,没有任何相关方交易。
表外安排
截至2024年6月30日,我们没有任何利益于特殊目的实体或任何其他离题安排。
风险因素和不确定性
我们的证券投资存在很高的风险。除了MD&A以及相关的基本报表中包括的其他信息外,我们还建议投资者仔细考虑以下"最新年度报告20-F"的风险说明以及2024年5月14日向SEC提交的表格6-k中展示的"风险和不确定性",以便讨论可能会重大影响我们业务的各种风险。目前还未被我们知晓的风险和不确定因素,或者我们目前认为不重要的风险和不确定因素,也可能会极大地损害我们的业务,运营结果和财务状况,并可能导致您全部投资损失。 “风险因素”中所述的其他风险 请参考2023年12月31日结束的年度报告,以及我们于2024年5月14日向美国证券交易委员会提交的6-k表中标注为“风险和不确定性”下的99.2表,了解可能会对我们业务产生重大影响的各种风险。我们还不知道的或者我们目前认为不重要的风险和不确定性也可能对我们的业务、经营业绩和财务状况产生重大损害,并可能导致您的投资全部损失。
| 18 |
我们在2024年5月14日提交给美国证券交易委员会的20-F年度报告和6-k表格附录99.2已在相关的加拿大和美国证券监管机构网站www.sedarplus.ca和www.sec.gov进行了备案。建议投资者参考这些文件中的风险因素。
信息披露控制和程序
公司的首席执行官和致富金融(临时代码)负责建立和维护我们的披露控制和程序(如规则13a-15(e)和15d-15(e)所定义,适用于交易所法和加拿大证券法)。我们的披露控制和程序旨在确保在U.S.和Canadian证券法要求披露信息被记录、处理、汇总和报告的时间内,在证券交易委员会的规则和表格中所规定的时间内,我们需要在根据交易所法提交的报告中披露的信息被累积并传达给我们的管理层,包括首席执行官和致富金融(临时代码),以便及时做出披露决策。
任何控制和程序,无论多么精心设计和运作,都只能提供实现所需控制目标的合理保证,管理团队必须根据成本效益关系评估可能的控制和程序。截至2024年6月30日的三个月期间,我们的披露控制和程序没有发生重大变化,也不太可能对披露控制和程序产生重大影响。
财务报表内部控制
我们的管理层负责建立和维护足够的财务报告内部控制(如《证券交易法》第13a-15(f)和15d-15(f)条以及加拿大证券法规定义的那样)。 我们的财务报告内部控制是一个旨在根据由IASB发布的IFRS为外部目的的财务报告和财务报表的可靠性提供合理保证的过程。
我们的基本报表内部控制包括以下政策和程序:(i)涉及维护记录的那些文件,以合理的细节准确地和公正地反映依特钠资产的交易和处置;(ii)提供合理的保证,以便按照IASB发行的IFRS编制财务报表,并且公司的收款和支出仅按照发行管理层和董事的授权进行;以及(iii)为防止或及时发现潜在对财务报表具有重大影响的公司资产的未经授权的获取、使用或处置,提供合理的保证。
由于其固有的限制,我们的财务报告内部控制可能无法防止或检测到错误。另外,对有效性的任何评估的任何预测都会面临这样的风险,即由于条件的变化而导致控制措施不足,或者遵守政策或程序的程度会下降。
财务报告内部控制的变化
我们在2024年6月3日完成了与Ceapro的业务合并交易,并进行了逆向收购的会计处理。我们目前正在整合Ceapro的财务报告内部控制。除了Ceapro业务合并事项之外,2024年6月30日结束的三个月内,我们的内部控制体系没有发生重大变化,也没有影响或可能影响内部控制体系的事项发生。其他事项没有影响我们的业务。
| 19 |