--
アメリカ合衆国
証券取引委員会
ワシントン D. C. 20549
形式
1934 年証券取引所法第 13 条または第 15 条 ( d ) に基づく年次報告書 |
本財政年度末まで
OR
1934 年証券取引所法第 13 条または第 15 条 ( d ) に基づく移行報告書 |
移行期になります トゥ .
委員会ファイル番号 :
(登録者の正確な氏名はその定款に記載)
|
|
|
|
||
(明またはその他の司法管轄権 会社や組織) |
|
(税務署の雇用主 識別番号) |
(主な行政事務室住所)(郵便番号)
(
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
|
|
|
|
|
クラスごとのタイトル |
|
取引 記号 |
|
各取引所名 それに登録されている |
|
|
♪the the the |
同法第12条(G)に基づいて登録された証券:
なし
(クラス名)
登録者が証券法第 405 条で定義されている、よく知られた経験豊富な発行者であるかどうかをチェックマークで示します。 はい —
登録者が第 13 条または第 15 条 ( d ) に基づいて報告書を提出する必要がない場合は、チェックマークで示します。 はい —
登録者が ( 1 ) 過去 12 ヶ月間に 1934 証券取引法第 13 条または第 15 条 ( d ) によって提出されるすべての報告書を提出したかどうか ( または登録者がそのような報告書を提出することを要求された短い期間 ) 、および ( 2 ) 過去 90 日間にそのような提出要件の対象となっていたかどうかをチェックマークで示します。
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大規模な加速ファイラー、加速ファイラー、非加速ファイラー、小規模報告会社、または新興成長企業かどうかをチェックマークで示します。取引法第 120 条第 2 項の「大手加速ファイラー」、「加速ファイラー」、「小規模報告会社」、「新興成長会社」の定義を参照してください。
|
|
|
|
|
|
|
大型加速ファイルサーバ |
|
↓ ↓ |
|
ファイルマネージャを加速する |
|
↓ ↓ |
|
|
|
|
|||
|
」と |
|
規模の小さい報告会社 |
|
||
|
|
|
|
|||
|
|
|
|
新興成長型会社 |
|
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらの誤り訂正のいずれかが、関連する回復期間中に登録者の執行役員によって受け取られたインセンティブベースの報酬の回復分析を必要とする再記述であるかどうかをチェックマークで示します。 §^ a b c d e f g h 『官報』第 10 号。 ↓ ↓
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、違います
非関連会社が保有する議決権および無議決権の普通株式の総時価は、ナスダック資本市場における登録者の普通株式 1 株当たり決算価格に基づいて、約 $
2024 年 9 月 13 日現在、
美医薬株式会社
TABLE OF 内容
|
|
|
|
|
|
|
|
|
|
|
ページ |
|
|
|
|
|
|
|
|
|
項目 1: |
|
|
|
5 |
|
|
項目 1A: |
|
|
|
20 |
|
|
項目 1B : |
|
|
|
30 |
|
|
項目 1C : |
|
|
|
30 |
|
|
項目 2 : |
|
|
|
31 |
|
|
項目 3: |
|
|
|
31 |
|
|
項目 4 : |
|
|
|
32 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
項目 5: |
|
|
|
32 |
|
|
項目 6 : |
|
|
|
33 |
|
|
項目 7 : |
|
|
|
33 |
|
|
項目 7 a : |
|
|
|
38 |
|
|
項目 8: |
|
|
|
39 |
|
|
項目 9 : |
|
|
|
63 |
|
|
項目 9 A : |
|
|
|
63 |
|
|
項目 9B : |
|
|
|
63 |
|
|
項目 9C : |
|
|
|
64 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
項目 10 : |
|
|
|
65 |
|
|
項目 11 : |
|
|
|
71 |
|
|
項目 12 : |
|
|
|
85 |
|
|
項目 13 : |
|
|
|
86 |
|
|
項目 14 : |
|
|
|
86 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
項目 15 : |
|
|
|
87 |
|
|
項目 16 : |
|
|
|
89 |
|
|
前向きに陳述する
このForm 10-k年次報告書(年次報告書)は、多くのリスクおよび不確定要因に関連する前向きな陳述を含む。これらの前向きな陳述は、一般に、陳述された文脈が、“可能”、“できる”、“予定”、“計画”、“信じ”、“予想”、“予想”、“予測”、“潜在”、“継続”、“可能”または“機会”などの語、これらの語または他の類似語の否定を含むので、一般に、このようなものと考えることができる。同様に、私たちの未来の計画、戦略、意図、期待、目的、目標または見通しを説明する陳述、および他の非歴史的事実を記述する陳述も前向きな陳述に属する。これらの前向き陳述を含む議論は,本年度報告の“ビジネス”や“経営陣の財務状況や経営結果の検討·分析”などで見つけることができる。このような声明に対して、私たちは1995年の個人証券訴訟改革法の保護を要求する。本年度報告書の読者は、これらの前向き声明に過度に依存しないように戒め、これらの前向き声明は、本年度報告が米国証券取引委員会(米国証券取引委員会)に提出されたときにのみ発表される。これらの展望的陳述は主に私たちの業務に影響を与える未来の事件と未来の傾向に対する予想と予測に基づいており、リスクと不確定性の影響を受け、これらのリスクと不確定性は実際の結果と展望性陳述における予想とは大きく異なる可能性がある。これらのリスク·不確実性には、本年度報告の“リスク要因”や“経営陣の財務状況や経営結果の検討·分析”で議論されているリスク·不確定要因が含まれているが、これらに限定されない。本報告書の他の部分および米国証券取引委員会に提出された他の文書には、他の要因が含まれる可能性があり、これらの要因は、私たちの業務や財務パフォーマンスに悪影響を及ぼす可能性があります。しかも、私たちの運営環境は競争が激しく、変化が迅速だ。維権投資家、インフレ上昇と金利上昇の影響、潜在的な経済低迷、業界、世界経済状況と政府政策はすべて大きな不確定性が存在する。新しいリスク要素は時々出現し、私たちはすべてのリスク要素を予測することができず、すべての要素が私たちの業務に与える影響を評価することもできず、あるいは任意の要素或いは要素の組み合わせは実際の結果がいかなる展望性陳述に含まれる結果と大きく異なる程度を招く可能性がある。また、過去の財務または経営業績は必ずしも未来業績の信頼できる指標であるとは限らず、あなたは私たちの歴史的業績を利用して業績または未来の傾向を予測すべきではありません。私たちは展望的な陳述で予想されたどんな事件が起こるか、あるいは発生した場合、それらが私たちの運営結果と財務状況にどのような影響を与えるかを保証することはできない。法的に別の要求がない限り、私たちは、本年度報告書を提出するか、または参照によって本明細書に組み込まれた前向きな陳述を含む文書を参照することによって発生したイベントまたは状況を反映するために、私たちの前向きな陳述を更新または修正する義務がありません。
文脈で別段の要求がない限り、本年次報告書における「 MEI Pharma 」、「 MEI 」、「当社」、「当社」および「当社」への言及は、 MEI Pharma, Inc. を指します。
株式会社 MEI ファーマコーポレートロゴは MEI Pharma の登録サービスマークです。本年次報告書に記載されているその他のブランド名または商標は、それぞれの所有者の財産です。
4
PART I
プロジェクト1.ビジネス
概要
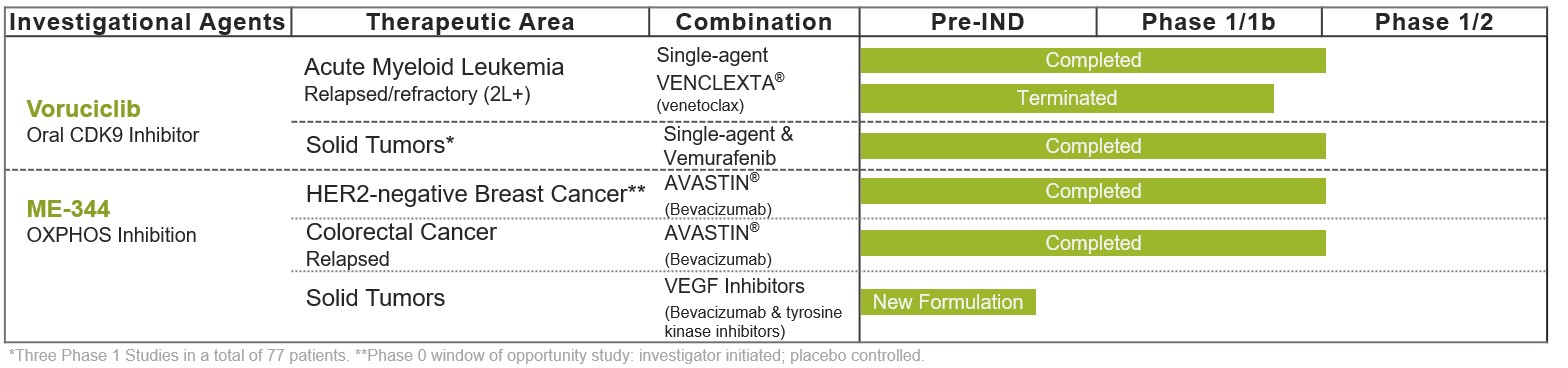
株式会社 MEI ファーマNasdaq : MEIP は、 創新的で差別化されたがん治療法を開発してきた製薬会社です弊社は 有望ながん剤を取得し、臨床開発、戦略的パートナーシップ、適切な場合のアウトライセンスまたは商業化を通じてプログラムの価値を創造することによってパイプラインを構築しました。 当社の腫瘍医薬品開発へのアプローチは、既知の耐性メカニズムを克服し、患者の利益の向上を提供するための明確な医療ニーズに対応するために、標準治療と組み合わせた医薬品候補を評価することです。当社の薬剤候補パイプラインには、経口サイクリン依存性キナーゼ 9 ( CDK 9 ) 阻害剤であるビタシクリブと、酸化性リン酸化経路を標的とする静脈内小分子ミトコンドリア阻害剤である ME 344 が含まれています。
戦略的選択肢
2024年7月22日、我々の取締役会(取締役会)は、潜在的な取引および適切であれば、我々の資産を株主として価値を最大化するために、我々の戦略的選択の評価を開始することを一貫して決定したと発表した。我々は2024年8月1日から兵力削減を開始し、我々の行動と戦略方向の変化に伴い、この行動は段階的に行われる。私たちはウォルシリーの臨床開発を中止しましたが、私たちの候補薬物資産に関連するいくつかの非臨床活動は私たちが継続して行われます。戦略選択審査の一部として、既存計画のアウトソーシング許可機会やM&A機会などの選択肢が考えられる可能性がある。私たちが現金を保存しようとしている意図と一致して、私たちの最高経営責任者であるDavid·M·ウルソと私たちのCEO Richard Ghalie万.D.は2024年8月1日に辞任した。エルソーもその日取締役会を離れた。我々は、ウルソさんとガリ博士との諮問協定を締結しており、協定に基づき、彼らは引き続き私たちの戦略的努力を支援していきます。取締役会長のチャールズ·V·バルト海3世も2024年7月22日に取締役会を辞任することを発表した。我々の取締役会はすでに現最高財務官ジャスティン·J·フィルを最高経営責任者に任命し、フレデリック·W·ドリスコールを取締役会長に任命している。
協力 協定
当社は、 2023 年 10 月 31 日に、アンソン · ファンド · マネジメント LP 及びケーブルカー · キャピタル LLC ( それぞれアンソン及びケーブルカー ) との協力契約 ( 以下、協力契約 ) を締結しました。これにより、その他の非財務関連事項に加え、下記に詳述する普通株式 1 株当たり 1.75 ドルの配当を形式とした株主への資本還元を規定しました。さらに、協力協定では、現在進行中の ME—344 フェーズ 10 億試験が特定の定義されたエンドポイントを満たすことができない場合、または理事会が第 2 コホートを進めないことを決定した場合、理事会が承認した場合、 933 万ドルを超えない潜在的な第 2 回資本リターンを想定していました。
協力協定の一環として、アンソンとケーブルカーは同意要請を取り下げ、慣習的な停止条項を遵守することに合意した。さらに、当社は、 2024 年 6 月 30 日に終了した会計年度の連結営業決算書において一般経費および管理経費に計上される、協力協定締結日時点におけるアンソンおよびケーブルカーとの契約に関連する手数料および費用を 110 万ドルで償還しました。
2024 年 4 月、取締役会は、資源の節約と戦略的投資の調整を図り、事業の走行路線を拡大するため、協力協定に基づく第 2 回資本返還の可能性を全会一致で進めないことを決定しました。
現金配当
2023 年 11 月 6 日、取締役会は、協力協定に基づき、 2023 年 11 月 17 日の営業終了時に記録株主に対して普通株式 1 株当たり 1.75 ドルの特別現金配当を宣言しました ( キャピタルリターン ) 。配当総額 1170 万ドルは、 2023 年 12 月 6 日に支払われ、当社は留保利益ではなく累積赤字であるため、連結株主資本計算書において追加資本金の削減として計上されました。
その他の活動
株主の承認を得て、当社インフィニティファーマシューティカルズ株式会社は、( インフィニティ ) 、および Meadow Merger Sub , Inc.当社の完全子会社 ( 合併サブ ) は、 2023 年 2 月に合併契約及び計画 ( 合併契約 ) を締結しました。2023 年 7 月 23 日に開催された特別株主総会において、この取引は株主からの承認を得ることができず、 2023 年 7 月 23 日にインフィニティに合併契約の終了通知を送付しました。
5
2022 年 12 月には、開発パートナーである京和キリン株式会社との共同決定により、臨床開発の取り組みを再編する予定です。株式会社 ( KKC ) は、当社のリード医薬品候補であるナゲレシブの日本国外での開発を中止します。この再編に関連して、当社は、第 1 相および第 10 相臨床プログラムの 2 つの臨床資産、すなわち、それぞれイタシクリブおよび ME — 344 に継続的な開発努力を注力しました。さらに、 2022 年 12 月に 28 人の従業員を削減し、 2023 年 6 月までに 26 人の従業員を削減しました。
医薬品候補開発プログラム
当社の薬剤候補パイプラインには、経口 CDK 9 阻害剤であるビタシクリブ、および静脈内小分子ミトコンドリア酸化性リン酸化阻害剤である ME — 344 が含まれます。各プログラムはいくつかの臨床試験を完了した。

Voruciclib:1期研究における有効なCDK 9阻害剤の経口投与
2024 年 7 月 22 日現在、進行中のすべての臨床試験は終了しました。ボルシクリブは選択的経口投与 CDK 9 阻害剤である。Voruciclib は最近、 b 細胞リンパ腫 2 ( BCL—2 ) 阻害剤ヴェネトクラックス ( Venclexta ® として市販 ) との併用による急性骨髄性白血病患者における用量とスケジュールを評価する第 1 相試験を完了しました。また、ボルシクリブは、 KRAS 阻害剤などの RAS シグナル伝達経路を標的とする治療との併用を含め、様々な固形腫瘍がんにおける潜在的な活性を探求するための前臨床試験でも評価されています。
Voruciclib 科学的概要 : 細胞周期のシグナル伝達
CDK 9 は、がんにおける 2 つの治療標的の調節を含む細胞周期の調節に重要な機能を有する。
MCL 1 と MYC を直接阻害することは歴史的に困難であったが、 CDK 9 は間接的にこれらの癌遺伝子を標的にする有望なアプローチである。
ボルシクリブ : MCL 1 の阻害
CDK 9 は、 MCL 1 の転写調節因子として知られている。MCL1 の過剰発現は多くの腫瘍タイプでしばしば観察され、腫瘍発生、予後不良および薬剤耐性と密接に関連している。AML では、 MCL 1 は患者の約半数で上調される。 再発難治性 ( R / R ) 疾患 これらの患者の予後不良と関連していますまた、高レベルの MCL 1 発現はヴェネトクラックス耐性と関連している。
2017 年 12 月に Nature Scientific Reports に掲載された「ベネシクリブ」の研究では、ベネシクリブと BCL—2 阻害剤ヴェネトクラックスを併用すると、細胞生存の 2 つのマスターレギュレータである MCL—1 と BCL—2 を阻害し、 DLBCL 細胞の攻撃的なサブセットにおいて相乗的抗腫瘍効果が得られたことが報告されました。
2020 年に発表された査読論文では、 AML の前臨床モデルにおける BCL—2 阻害剤ヴェネトクラックスによる CDK 9 阻害が相乗的に増加することが報告された。このデータは、ベネトクラックスと相乗作用し、 AML 細胞株と一次患者サンプルの両方でプログラム細胞死またはアポトーシスを誘導することを実証した。It Was
6
また、フェナシクリブは MCL 1 を下調し、フェナシクリブとベネトクラックスとの相乗効果に関与し、さらにフェナシクリブは MYC を下調し、ベネトクラックスとの相乗効果にも寄与することを実証しました。
その後、報告された前臨床試験と整合的に、再発性または難治性 ( R / R ) AML 患者におけるベネトクラックスとの併用および単剤としてのベネシクリブを評価する進行中の第 1 相試験のデータでも、 Mcl—1 タンパク質の予想される減少が示された。
本研究は、ベネトクラックスまたは他の BCL—2 阻害剤と併用して、 MCL 1 に関連する潜在的な耐性に対処するためのがん治療薬として魅力的な治療薬である可能性を示唆し、 AML におけるベネトシクリブの現在進行中の臨床評価を支持しています。
ボルシクリブ : MYC の阻害
多くのがんは、細胞の増殖と成長を調節する転写因子である MYC の過剰発現と関連している。CDK 9 は MYC 転写の調節因子であり、 MYC タンパク質リン酸化の調節因子である。米国がん研究協会年次総会 2021 で報告された前臨床モデルのデータによると、キサシクリブは :
提示された研究は、 MYC の活性に依存する血液がんおよび固形腫瘍の両方に対する魅力的な治療薬である可能性を示唆している。
臨床プログラム
最近の第 1 相臨床試験では、 R / R AML 患者における BCL—2 阻害剤であるベネトクラックスとの併用によるビネシクリブの用量とスケジュールを評価しました。本試験は、従来の標準療法に失敗した再発および難治性 b 細胞悪性腫瘍および AML 患者における単一療法としてのビタシクリブの用量およびスケジュールの評価から始まり、安全性、予備的有効性および最大許容用量を決定しました。本試験の主な目的は、ベネトクラックスと併用したベネトシクリブの単独療法またはベネトシクリブの安全性および生物学的有効量を決定することであった。本研究の二次目的は、ベネトクラックスとの併用によるベネトシクリブの単独療法またはベネトシクリブの予備的有効性、薬物動態、薬物動態、およびバイオマーカーの評価であった。
我々が2023年12月に米国血液学会(ASH)年次総会に提出したポスターで報告されているように,本研究のVoluciclib単一治療量増加/拡大段階では計40名の患者を募集し,完成している。多くの患者(n=21)はAMLであり、残りの患者(n=19)はb細胞悪性腫瘍である。組み入れられた40名の患者のうち、上位16名の患者は毎日50と100 mgを連続服用し、その後24名の患者は間欠的計画(28日間の周期で14日間連続治療)で100、150、200 mgを服用した。いずれの患者もこれまでの3つの治療レジメンの中央値(範囲1−9)を受けており,そのうち5名は造血幹細胞移植を受けていた。Voruciclibは28日間周期中に連続14日間投与し、投与量は200 mg(行列2)を超えず、耐性は良好で、用量制限毒性(DLT)の報告はなかった。最もよく見られる副作用(20%の患者)は下痢、吐き気、貧血と無力である。大多数の有害事象はレベル1−2であり,注意すべきことは,行列2のうち3−4の有害事象のみが下痢(n=1)と貧血(n=5)であることである。薬物動力学は投与量に比例し、平均半減期は約24時間であり、1日1回の投与を支持する。
さらに開発のために選択された間欠投与スケジュールでは、 DLT は観察されず、グレード 3 以上の薬物関連毒性はなく、血漿濃度が標的阻害に十分と考えられるレベルに達したため、最大許容用量に達する前に 200 mg で用量エスカレーションを停止した。AML 患者 21 例中 , 100mg 投与では 1 例が形態学的に白血病なし , 9 例が病態安定化を示し , 2 例で 3 か月以上持続した。B 細胞悪性腫よう 19 例中 , 4 例は腫ようサイズが減少した病態安定であった。骨髄性白血病細胞分化タンパク質 ( Mcl—1 ) および Ser 2 上での RNA Pol II リン酸化 ( RNA Pol II p—S 2 ) を評価した相関研究 ( RNA Pol II p—S 2 ) の初期結果は、 Mcl—1 および RNA Pol II p—S 2 に対するフェラシクリブの期待される標的薬力学的効果と一致する発現減少を示した。
試験の次の段階では、 R / R AML 患者に対する 50 mg 1 日隔 1 日 ~ 300 mg 1 日間、 28 日間の周期で 14 日間連続して 7 つのベネトクラックス標準用量と併用した用量を評価した。合計 41 人の R / R AML 患者 ( 年齢中央値 67 歳 ( 範囲 34 — 89 ) ) が、ベネトクラックスとの併用を評価する試験のこの用量増量段階に登録されました。これらの患者は一般的に重度の前治療を受けており、事前治療の数の中央値は 2 回 ( 範囲 1 — 7 ) であり、 18 例 ( 44% ) の患者で 3 回以上の事前治療があった。ほぼすべての患者 ( 39 / 41 ) は、以前の治療ラインでベネトクラックスで治療された。
7
さらに、 30 例 ( 73% ) の患者が、不良細胞遺伝学および分子変異により 2017 年の ELN リスクカテゴリーに属していたことが指摘された。
ベネトクラックスとの併用で 100 mg 以上投与した 32 人の患者のうち 10 人 ( 31% ) が疾患制御を達成した。3 人の患者が奏効を達成し、そのうちの 2 人は不完全な血液学的回復 ( CRi ) を伴って完全奏効を達成し、 1 人は形態学的白血病フリー状態を達成した。1 例では 6 か月 , 2 例では 9 か月持続 , 3 例では幹細胞移植に紹介された。また , 安定症は 90 日以上持続した 7 例 , 安定症は 3 か月未満であった 13 例。
ベネトクラックスと併用してベネシクリブを投与し、分析可能な血液サンプルを採取した 28 人の患者において、相関バイオマーカー試験の初期結果は、奏効患者における Mcl—1 のより大きな減少を含む、 Mcl—1 の減少が予想されることを示した。これは、フェナシクリブが Mcl—1 を阻害剤または CDK 9 として調節し、ベネトクラックスに関連する MCL1 の上調節に対処する可能性があるという仮説を支持した。また、評価対象患者の約 50% ( 11 / 21 ) において、ベネトクラックス投与後の骨髄芽細胞数の減少を含む抗白血病活性の追加的なエビデンスも示された。
標準用量のベネトクラックスと併用した最大 300mg のボルシクリブを 28 日間周期で 14 日間連続投与すると、用量制限毒性は観察されなかった。このスケジュールでベネトクラックスと併用したビタシクリブの最大許容用量は確立されていない。薬物関連有害事象による中断はなく、重複毒性のエビデンスは今日まで観察されていない。最も一般的 ( ≥ 5% の患者 ) のグレード 3 有害事象は AML に関連する骨髄抑制であった。非血液学グレード 3 の薬物関連有害事象を認めたのは 1 名の患者のみであった。アレア) 。
試験終了前、 3 人の患者が 21 歳以上 150 mg のビタシクリブを投与された。 28 日間の周期で連続して ベネトクラックスと併用して、ベネトクラックスを継続しながらフェナシクリブを中止した患者の 14 日目から 28 日目の間に 44% ( 8 / 18 ) の末梢芽細胞数のリバウンドに基づいて、投与強度を増加させ、患者の反応を最適化する可能性がある。
Voruciclibは以前にも複数の第一段階研究で70名以上の固形腫瘍患者で評価されていた。臨床データの総和、及び臨床前研究のデータは、ヴォルシリーが毎日150 mgの計画用量でその分子標的を抑制する能力があることを表明した。臨床研究では、ヴォルシリーとビモラフェニ(市場名Zelboraf)を併用して、BRAF変異を有する9名の末期/手術不能の悪性黒色腫患者に応用した。3例のBRAF/MEK初治療患者はすべて反応があった:2例は部分的に緩和し、1例は完全に緩和した。この研究では,ボルキュリーは1日150 mg,ビモラフェニ720 mgまたは960 mgであり,1日2回,28日が1サイクルであった。最もよく見られる副作用は無力、便秘、下痢、関節痛と頭痛である。レベル3疲労の一例は、ボルキュリーに関連する深刻な有害事象の報告がない用量制限である。その他の臨床研究は固形腫瘍患者におけるVoluciclibの投与量は850 mgに達し、潜在的な生物活性と不良事件概況が同類の薬物と大体一致する追加的な証拠を証明した。
ME—344 : 組合せポテンシャルを有するミトコンドリア阻害剤
2024 年 7 月 22 日に戦略的代替品の探査が発表された後、 ME—344 に関連する非臨床活動は継続される予定です。MEI—344 は、ミトコンドリアにおけるアデノシン三リン酸の産生に関与する基本的な代謝経路であるミトコンドリア OXPHOS を阻害する新規薬剤候補です。ATP は、分裂、増殖、成長を含む多くの代謝細胞プロセスを駆動するエネルギーを供給する。ATP 産生を阻害することにより、 ME—344 は非臨床モデルでがん細胞死を誘導することが示されており、臨床試験では抗腫瘍活性と関連している。 ME—344 は、ベバシズマブ ( アバスティン ® ) との併用を含む複数の臨床試験でも臨床活性が実証されています。
最近、 生物活性の向上 , 投与の利便性の向上 , 商業的機会の拡大を目的とした新製剤の開発により ME—344 を進めています。以前の ME—344 製剤をベバシズマブ ( アバスティン ® ) と併用して評価した 2 件の臨床試験で前向きなデータを観察した結果、この新しい製剤はプログラムの可能性を追求するための最適なアプローチであると考えています。
ME—344 科学的概要 : がん代謝
ATP の形で供給されるエネルギーは、細胞分裂と成長を支える腫瘍代謝に燃料を与えます。したがって、 腫瘍細胞はしばしば高い代謝率を示し腫瘍細胞の生存と増殖を支援しますこの代謝の増大は、 ATP の形でエネルギーの継続的な供給を必要とする。
血管内皮増殖因子阻害剤ベバシズマブなどの抗血管新生薬は、血管系を正常化し、 ATP の糖分解への依存性を減少させる可能性がある。結果として生じる糖分解の減少は、継続的な腫瘍増殖をサポートするエネルギーのためのミトコンドリア ATP 産生への依存の増加を引き起こす可能性がある。このような腫瘍可塑性の症例では、 ME—344 とベバシズマブの併用は代謝合成致死性を誘導し、新しい治療戦略を提供する可能性がある。具体的には、ベバシズマブのような抗血管新生薬が、 ME — 344 によって阻害される OXPHOS を介して糖分解を抑制し、腫瘍細胞をミトコンドリア呼吸に切り替える能力を活用することで、腫瘍の細胞分裂と増殖に必要な ATP へのアクセスを減少させる可能性がある。
8
このアプローチの初期臨床データを入手した ヒト表皮成長因子受容体 2 ( HER 2 ) 陰性乳がん患者 42 人を対象とした、 ME—344 とベバシズマブとの併用を評価する、研究者主導のマルチセンター、無作為化、対照、機会窓臨床試験を完了しました。ME—344 とベバシズマブとの併用に対するさらなる臨床的支持は、 2024 年 4 月に糖尿病患者に対する 10 億相試験から報告された。 標準治療の失敗後の再発転移性大腸がん。本研究では、 23 人の患者コホートにおいて、無進行生存率への影響を含む臨床活性が実証された。
難治性固形腫瘍患者における ME—344 の単一剤としての評価を行った以前の第 1 相臨床試験でも、抗腫瘍活性が実証され、有望な治療法としてのミトコンドリア阻害の可能性がさらに検証されました。
臨床プログラム
ME—344 は、単剤として、およびベバシズマブなどの抗血管新生薬と併用して、前臨床および臨床で評価されている。単剤として評価された場合、 ME—344 は第 10 億相試験で難治性固形腫瘍に対する活性の証拠を示し、前臨床試験では ME—344 で処理された腫瘍細胞は ATP の急速な喪失とがん細胞死をもたらした。単剤活性に加えて、 ME—344 は抗血管新生療法との併用でも大きな可能性を実証しています。
前臨床研究では、抗血管新生薬の 1 つの結果は、腫瘍の増殖を遅らせるメカニズムとして腫瘍の糖分解率の低下であることが示されている。しかし , 糖酵解の低下と ATP 産生の低下に直面すると , 腫瘍代謝はエネルギー産生のためのミトコンドリア代謝にシフトし , 腫瘍増殖の継続を支援することができた。抗血管新生薬の治療の存在下での腫瘍可塑性のこのような症例では、 ATP の代替代謝源としてミトコンドリアを ME—344 で同時に標的とすることは重要な開発機会を開く可能性がある。
この ME—344 の併用に対する支持は、 2016 年 6 月号の Cell Reports に初めて掲載されました。マドリードのスペイン国立がん研究センターとの共同研究による前臨床データでは、 VEGF の活性を阻害する薬剤と併用した場合の抗腫瘍活性の大幅な強化を含む、がん細胞における ME—344 のミトコンドリア特異的効果が実証されました。これらのデータは、ミトコンドリア代謝と糖分解代謝の両方の阻害による ME—344 と VEGF 阻害剤の併用による潜在的な抗がん効果を実証し、 HER 2 陰性乳がん患者における ME—344 とベバシズマブとの併用試験の開始の基礎となった。
早期 HER 2 陰性乳がん 42 人の女性を対象とした ME—344 とベバシズマブの併用を評価した多施設、研究者主導、ランダム化、対照臨床試験の結果は、 ME—344 と抗血管生成療法との併用に関するエビデンスを提供した。
試験の主な目的は、ベバシズマブ単独投与対照群と比較して、 0 日から 28 日までの核タンパク質 Ki 67 ( 発現は腫瘍細胞の増殖および成長と強く関連している ) の減少によって測定された ME—344 の生物活性の証拠を示すことでした。第二の目的は、 ME—344 の生物活性が血管正常化と相関するかどうかを決定することであった。データは、 ME—344 治療群で有意な生物活性を示しました。
ME—344 群で 2 件、ベバシズマブ単独療法群で 1 件のグレード 3 の高血圧の有害事象が報告された。
乳がん患者を評価した臨床試験に基づき、標準治療の失敗後の再発転移性大腸がん患者における ME—344 とベバシズマブ併用を評価する第 10 億相試験を開始しました。本試験は、 ME—344 + ベバシズマブを、それぞれ約 20 人の患者からなる最大 2 つのコホートで評価するように設計された。第 2 のコホートを登録するオプションは、コホート 1 が 4 ヶ月で少なくとも 20% の事前に定められた非進行閾値に達することを条件にしました。本試験の患者は、疾患の進行または耐容不全まで治療された。試験のプライマリエンドポイントは 16 週間の無進行生存期間であり、二次エンドポイントは全体 PFS 、奏効期間、全体生存期間および安全性であった。
ME—344 は 28 日間の各サイクルの 1 日目および 15 日目にベバシズマブと併用して、 1 日目および 15 日目に週 1 回投与された。コホート 1 は、再発 mCRC 患者 23 人を登録しました。患者は一般的に重度の前治療を受けており、治療前線数の中央値は 4 線 ( 範囲 1 — 8 ) であり、 18 例 ( 78% ) の患者で 3 線以上の前線があり、すべての患者はベバシズマブおよび標準化学療法を受けていた。2024 年 4 月に報告されたように、併用は概して耐容性が良好であり、重複毒性は観察されなかった。有害事象として 2 例 ( 9% ) が治療を中止しました : 試験薬に関連と考えられた疲労および無関係と考えられた敗血症。最も一般的 ( ≥ 10% の患者 ) 薬物関連有害事象 ( 全グレード / グレード ≥ 3 ) は、 8 例 ( 35% ) / 3 例 ( 13% ) の患者で疲労、 3 例 ( 13% ) / 2 例 ( 9% ) の患者で腹痛であった。
9
さらに、第 1 コホートでは、評価可能な患者 20 人中 5 人 ( 25% ) が 16 週間の治療を完了し、疾患進行の証拠もなく、臨床試験プロトコルで定められた 20% の事前に定められた閾値を上回ってコホート 2 に進むことが報告された。PFS 中央値は 1.9 ヶ月、 4 ヶ月 PFS 率は 31.2% 、全生存期間中央値は 6.7 ヶ月で、分析時点で 15 人の患者が検閲された。評価対象患者 20 人のうち 9 人 ( 45% ) が安定した疾患であった。コホート 1 は所定の PFS 閾値を超えましたが、第 2 コホートへの入学を開始しないことを決定しました。
難治性固形腫瘍患者に対する ME—344 のヒト初の単剤第 1 相臨床試験の結果が、 Cancer 2015 年 4 月 1 日号に掲載されました。その結果、 ME—344 を投与した評価可能な患者 21 人のうち 8 人 ( 38% ) が安定した疾患以上を達成し、 5 人を含む 5 人が治験に入る前の最後の治療の 2 倍以上の無増悪生存期間を経験したことが示された。さらに、これらの患者の 1 人 ( 小細胞肺癌の重度の前治療患者 ) は、部分奏効が確認され、 2 年間研究を継続しました。ME—344 は、 10 mg / kg 以下の用量で、延長期間毎週投与すると、一般的に耐容性が良好であった。治療関連の有害事象には吐き気、めまい、疲労が含まれた。15mg / kg および 20mg / kg の両用量で用量制限毒性が観察され、主にグレード 3 の末梢神経症から構成された。
当社は、ベバシズマブ (アバスティン ®) などの VEGF 阻害剤と併用して腫瘍における合成致死性を誘導する新規アプローチを進めるための新しい製剤の開発を通じて、 ME—344 の追求を継続しました。当社は、生物活性の向上、患者の投与の利便性の向上、商業機会の拡大を目的として、すでに新製剤の研究開発活動を開始しています。
Zandelisib: PI3Kδ 阻害剤概要
ザンデリシブは、 2020 年 4 月に締結されたグローバルライセンス · 開発 · 商業化契約に基づき、 KKC と共同で開発中の 1 日 1 回経口選択的 PI 3 Kδ 阻害剤です。
2022 年 3 月、当社と KKC は、 FDA との第 2 相会合の終了の結果を報告しました。 FDA は、単一アームの第 2 相 TIDAL 試験のデータに基づく提出を奨励しました。この会合において、 FDA は、第 2 相 TIDAL 試験のような単一アーム試験から生成されたデータは、怠慢性非ホジキンリンパ腫を評価する PI 3 Kδ 阻害剤のリスク / ベネフィットを適切に評価するには不十分であると述べた。当時、 FDA は、再発または難治性濾胞性リンパ腫または縁部リンパ腫患者を評価する無作為化第 3 相 COASTAL 試験の継続的な取り組みを強調しました。その後、 2022 年 4 月の FDA 腫瘍医薬品諮問委員会では、血液悪性腫瘍に対する PI 3 Kδ 阻害剤の将来の承認はランダム化データによって支持されるべきであると投票しました。
2022年11月、私たちはKKCと2022年3月の第2段階会議終了後の後続会議でFDAと面会した。今回の会議でFDAは第3段階海岸試験の設計と統計分析についてさらなる指導を提供した。11月の会議の後,両社は共同で,FDAの最近のガイドラインと一致した臨床試験は,行われている海岸試験の見直しを含めて,さらなる投資を支援する時間内に完了することや,十分な確実性のある規制要件の下で承認されることが可能であり,世界的な開発事業を継続することが合理的であることを証明した。そこで,我々はKKCと共同で日本以外の地域で不活性形態の非ホジキンリンパ腫を治療するZandelsibのグローバル開発を中止することにした。日本以外の地域でのzandelisibの開発停止はFDAの最新の規制指導に基づくビジネス決定であり,これまでに生じたzandelisibの臨床データとは無関係である。共同で日本以外の開発中止を決定した後,KKCとは第三段階海岸試験,第二段階潮汐試験,第二段階サンゴ試験を含む日本以外で行われているZandelsib臨床研究の閉鎖を開始した。
その後、 2023 年 5 月に KKC は、日本におけるナゲレシブの開発を中止することを決定しました。日本におけるネデレシブの販売中止は、 KKC による最新の医薬品庁規制ガイダンスに基づく事業決定であり、これまでに生成されたネデレシブの臨床データとは無関係です。
当社は、 2023 年 7 月 14 日に KKC との終了契約 ( 以下「終了契約」 ) を締結し、当事者間のすべての契約を終了し、グローバルでのフェネリシブの臨床開発を停止しました。2024 年度には、 KKC 商業化協定の思いやりある利用供給と廃止に伴う活動を完了しました。
KKC ライセンス · 開発 · 商業化契約
2020年4月、我々はKKC商業化協定を締結し、この協定に基づいて、米国でZandelisibおよびZandelisibを含む任意の医薬品、米国のすべての人間適応(米国許可)、およびKKCビジネス協定下の義務を履行するために、米国のすべての人間適応(米国許可)、およびKKC商業協定下の義務を履行するために、米国で開発および商業化された任意のZandelisibを含む任意の医薬品、米国のすべての人間適応(米国許可)、およびKKC商業協定下の義務を履行するための共通排他的かつ再許可可能な有料許可をKKCに付与した。我々が制御するいくつかの特許および独自技術許可に基づいて、zandelisibおよびzandelisibを含む任意の医薬品を開発および商業化することは、米国以外の国のすべてのヒト適応(前米国および元米国許可)に使用される。同様に、KKC商業化協定によれば、我々は、KKCが制御する特定の特許およびノウハウの下で、米国ですべての人間の適応のためにZandelisibを開発および商業化することができ、KKCが制御する特定の特許およびノウハウの下で、共通、独占的、再許可可能、印税免除、全額支払いの許可を得て、米国以外の地域での義務を履行し、10000万の初回払戻不能支払いを得ることができる。また日本ではKKCは
10
商業化契約には、規制および商業化に関するマイルストーン支払いに加え、日本におけるナデレシブの純販売に対するロイヤルティが含まれていました。2023 年 7 月 14 日の終了契約の履行以前は、 KKC は米国外におけるナゲレシブの開発および商業化に責任があり、特定の例外を除き、それに関連するすべての費用を単独で負っていました。また、米国外でのネデレシブの開発および商業化に必要な特定の医薬品を KKC に供給しました。KKC が可能な限り速やかに Ex—US の製造責任を引き受けることを理解しています。
上記のように、当社は、 2023 年 7 月 14 日に KKC と、 KKC 商業化契約およびその他の関係者間のすべての契約を相互に終了するため、終了契約を締結しました。Termi に従って国家協定 :
2023 年 6 月 30 日現在、 KKC 商業化契約に関連する繰延収益の総額は 6490 万ドルであり、そのうち 6450 万ドルが米国ライセンスに割り当てられ、 30 万ドルが開発サービスのパフォーマンス義務に割り当てられました。さらに議論された。 注釈 7 。ライセンス契約について, 2023 年 9 月 30 日に終了した 3 ヶ月間の終了契約の執行に関連して、米国ライセンスに関連する非現金長期繰延収益 6450 万ドルと、基礎となる比例業績活動の完了に関連する残りの非現金繰延収益 30 万ドルを認識しました。2023 年 9 月 30 日現在、 KKC 商業化契約に関連するすべての繰延収益が認識されています。
競争
当社の医薬品候補の市場は競争が激しくあります。他の多くの企業は、当社の新薬候補が開発されているのと同じ治療適応を目的とした前臨床または臨床開発の様々な段階にある製品または新薬候補を持っています。これらの潜在的な競合医薬品候補のいくつかは、当社の医薬品候補よりも開発が進んでおり、早期に市販される可能性があります。規制当局の承認を受ける製品の開発に成功した場合でも、競合他社の製品やその後規制当局の承認を受ける可能性のある製品と競争できない可能性があります。
競合他社には、製薬企業やバイオテクノロジー企業、大学や官民の研究機関などがあります。また、異なる関連分野の企業も大きな競争相手となります。腫瘍医薬品を開発している当社の競合他社の多くは、当社よりも資本資源が大きく、研究開発スタッフと設備が大きく、医薬品開発、規制、製造、マーケティング、商業化に関する経験が豊富です。彼らは、臨床試験に参加するサイトや適格な患者の募集、開発および / または商業化パートナーの誘致において当社と競合しています。また、当社の技術と競合する技術のライセンスも提供します。その結果、競合他社は、当社の技術や医薬品候補を時代遅れにしたり、競争力のないものにするような技術や製品をより容易に開発できる可能性があります。
知的財産権
当社は、譲渡または排他的ライセンスにより、現在の医薬品候補の各々に対する世界的な権利を所有します。当社の知的財産ポートフォリオには、米国特許発行約 38 件、外国特許発行 201 件、米国特許出願中 10 件、外国出願中 83 件が含まれています。
当社は、 Presage Biosciences , Inc. から、キラシクリブの開発、製造、商業化の世界的な独占権を取得しました。( プレセージ ) 。米国特許商標庁は、 2026 年から 2037 年の間に失効すると予測されている物質の組成、医薬品組成物、がん治療のための使用方法をカバーする 19 の米国特許を許可または発行しました。外国特許は約 90 件、米国暫定特許出願中 3 件、外国特許出願中約 60 件、関連化合物および関連使用方法について許可または発行されている。
当社は、 ME—344 を含むイソフラボノイド化合物ファミリーに関する特許および特許出願を、元過半数株主であるノボゲンから譲渡により取得しました。USPTO は、物質の組成として ME—344 をカバーする 12 の特許を発行しました。
11
薬剤組成物やがん治療のための使用方法約 61 の外国特許が付与または許可されています。ME—344 をカバーする物質請求項の組成を含む発行された米国特許は、特許期間延長を含まない 2025 年から 2031 年の間に失効すると予想されています。ME—344 および関連化合物またはその使用方法に関する米国特許出願 5 件、患者協力条約 1 件、外国特許出願 10 件があります。
当社は、 Pathway Therapeutics , Inc. から、フェネリシブおよびその他の関連化合物の世界的な権利を譲渡により取得しました。USPTO は、物質組成物、医薬品組成物、がん治療のための使用方法をカバーする 7 つの特許を発行している。特許期間延長を含まない 2031 年から 2032 年の間に有効期限が切れる見込みです。約 50 の外国特許が付与または許可されています。米国特許出願中 2 件、 PTC 出願中 1 件、外国の特許出願中約 11 件があります。
私たちの成功は、私たちの独自の技術、化合物、および情報を保護する能力、および第三者の固有の権利を侵害することなく運営する能力に大きく依存する。私たちは特許法、商業秘密法、著作権法、商標法、秘密、許可、その他の合意に基づいて、私たちの独自の権利を確立し、保護しています。私たちは私たちの重要な発明のために特許保護を求めて、私たちが決定した候補薬物、化学合成経路、そして薬物調合を含む。私たちは、私たちの任意の係属中の特許出願が発表されるか、または私たちの任意の特許が強制的に実行されるか、または薬物または他の商業的な意味を持つ製品または方法をカバーすることを保証することはできない。また、我々は、私たちが行っている業務運営に対して比較的低い価値を有すると考えられる特許および特許出願を決定するために、私たちの特許の組み合わせを定期的に審査して、放棄される可能性がある。どの特許と特許出願が保持されるべきか、どれが放棄すべきかを正確に決定することも保証されない。私たちのほとんどの他の既存特許の有効期限は始まり、私たちの未来の特許の大部分は(ある場合)非臨時特許出願の最初の有効出願日から20年以内に発効および終了されるだろう。薬物の任意のマーケティングおよび規制承認は、通常、関連する特許出願の提出から数年後に生じるので、私たちの候補薬物および技術の任意の特許によって提供される市場排他性は、20年よりも大幅に少ない可能性がある。
米国の特許出願の多くはUSPTOによって公表される前に秘密にされているため、2000年11月29日以降に提出されたすべての案件または2000年11月29日までに提出された論争のある案件については、提出日から18ヶ月以内に、上記特許及び出願に含まれる発明を行った最初の会社であることを確認することはできない。さらに、科学または特許文献に発表された発見は、実際の発見よりも遅れがちである。また,ウルグアイラウンド協議法の条項によると,1995年6月8日以降に提出された特許の有効期限は提出日から20年であり,臨時出願は除外されており,このような特許の最終発表にはどのくらいの時間がかかる可能性がある。これは、バイオ製薬部門の特許出願が発表されるのにかなりの時間を要することが多いので、Zandelisib、voruciclib、またはME−344治療用途の特許保護期間を短縮する可能性がある。しかし、いくつかの国では、特許期間が延長される可能性がある。
企業秘密やノウハウ、その他の専有技術情報およびビジネス情報を含む当社の技術の機密性を保護するため、当社は、すべてのコンサルタント、アドバイザー、コラボレーターに対し、機密とみなされる情報の使用または開示を禁止する契約を締結することを要求します。これらの契約はまた、当社のコンサルタント、アドバイザーおよび協力者に、当社の製品に関する作業に関連してこれらの者によって行われた開発、発見および発明のライセンスを当社に譲渡または交渉することを義務付けます。当社は、これらの契約によって防止された技術または開示を取得した者によって機密性が維持されることを確信できません。また、当社の所有情報または知的財産がこれらの契約によって保護されるか、他者が実質的に同等の所有情報または知的財産を独自に開発しないかを確信することはできません。
製薬業界は競争が激しく、ベネレシブ、ベネシクリブ、 ME—344 と競合する製品に関する特許が他の当事者によって申請され、発行されている可能性があります。これらの化合物および他の医薬品候補の使用は、現在および将来存在する他の当事者の特許または所有権を侵害するという主張を生じさせる可能性があります。不利な請求は、当社がかかる他の当事者に対して重大な責任を負担し、かかる他の当事者からのライセンスを要求する可能性があります。当社は、かかる特許または所有権の下で必要とされるライセンスが、当社にとって受け入れられる条件で利用可能であることを確信できません。当社は、かかるライセンスを取得しない場合、製品の市場投入が遅延したり、かかるライセンスを必要とする製品の開発、製造、販売が妨げられる場合があります。
研究と開発
当社の研究開発プログラムの目的は、米国などの主要市場において、 1 つ以上の用量形態の医薬品候補の規制承認を達成するのに十分なデータの生成です。医療ニーズを満たし、魅力的な属性を備えた臨床的および商業的プロファイルを開発するため、および / または他の当事者との開発および / または商業的関係を締結することを可能にするために。データは、臨床前試験および臨床試験プログラムによって生成されます。
12
当社の研究開発プログラムの重要な側面は、以下のより完全な特性化を提供することです。
政府の監督管理
米国規制要件
米国食品医薬品局および他の国の同等の規制機関は、医薬品の研究、開発、非臨床および臨床試験、表示、製造、品質管理、保管、承認、広告、プロモーション、マーケティング、流通、輸入および輸出、ならびに重要な報告および記録保持義務について実質的な要件を規制し、課しています。州政府はこれらの分野やその他の分野で義務を課すこともできる。これらの要件は広範で頻繁に変化する。
米国では、医薬品は、連邦食品医薬品化粧品法などの法律の下で FDA によって規制されています。米国で医薬品が販売される前に FDA が要求するプロセスには、一般的に以下のものがある。
試験 · 承認プロセスには、多大な時間、労力、財源が必要であり、当社の製品候補のマーケティング申請を最終的に提出できるかどうか、当社の開発努力が成功することを証明するか、当社の研究が肯定的な結果をもたらすか、または承認がタイムリーに付与されるかどうかは確信できません。
非臨床研究の結果および最初に指定された生産情報、提案された臨床試験案、研究参加者の情報は、新薬(IND)申請の一部としてFDAに提出され、この申請は米国でヒト臨床試験を開始する前に発効しなければならない。臨床試験は連邦法規と良好な臨床実践(GCP)の要求に基づいて行い、cGMPに適合した研究製品を使用しなければならない。GCPには他の要求のほかに,モニタリング,薬物責任追及,データ完全性に関する要求が含まれており,すべての研究対象がどの臨床試験に参加する際にも書面でインフォームドコンセントを提供しなければならない。最近,FDAは臨床研究に関するいくつかの新しいガイドラインを発表した。例えば、FDAは、臨床試験の質、デジタル健康技術の使用、コンピュータ化システム、およびデータ管理を含む当機関のGCPガイドラインを修正することを目的とした良好な臨床実践に関する最新のガイドラインを発表した。FDAは,分散臨床試験,臨床試験への電子記録の使用,システムと署名およびリスクに基づく臨床試験モニタリングに関する指導意見を発表した。最終ガイドラインを発表した後、FDAはさらにいくつかの臨床研究の多様な行動計画を要求する。
さらに、独立した IRb が各試験プロトコルのレビューと承認を行い、試験の実施を監督しなければならない。IND は、 FDA による受領から 30 日後に発効する。ただし、 FDA が 30 日以内に IND に記載されている試験の実施について懸念または疑問を提起し、臨床停止を課さない限り。FDA が臨床停止を課した場合、
13
臨床試験中、 IND スポンサーは、臨床試験を開始または継続する前に FDA の懸念を解決しなければならない。非臨床試験や試験の完了には数年かかる場合がありますが、そのような試験や試験に基づいて提出された IND が特定の期間内に有効になるという保証はありません。
ス ポン サー は 、 FDA および 適切な 場合には 世界の 保健 当局 に 特定の 報告 と 提出 を行 わなければならない 。 また 、 臨床 研究 者は 、 IR b または 倫理 委員会 に 特定の 報告 と 提出 を行 わなければならない 。 これ には 、 年 次 報告 、 研究 者の 財政 的 利益 、 重 篤 な 有害 事 象 および その他の 重要な 安全 性 情報 、 試験 修正 および 新しい 試験 プロト コル に関する 報告 が含まれ ます 。研究 および 研究 結果 の 説明 を含む 特定の 臨床 試験 に関する 情報 も 、 特定の 期間 内に 米国 国立 衛生 研究 所に 提出 され 、 その 公開 のために 公表 されなければならない 。clinicaltrials.govウェブサイト 。重 症 疾患 の 治 験 用 医薬品 の ス ポン サー は 、 アクセス 拡大 の 要請 に関する 公開 ポリシー も なければならない 。
米国に輸入される試験用医薬品や有効成分も FDA の規制の対象となります。さらに、米国外への試験用製品の輸出は、受入国の規制要件および FDCA に基づく米国の輸出要件の対象となります。
ヒト臨床試験は通常、重複する 3 つの連続段階で行われる。
臨床試験と同時に、企業は通常、追加の非臨床および毒性学研究を完了し、製品候補の化学、製造および制御に関する追加情報を開発する必要があります。
いくつかの臨床試験は、臨床試験スポンサーが組織した資格のある専門家による独立したグループ ( データモニタリング委員会 ) によって監督されます。このグループはデータをレビューし、試験の継続安全性について研究スポンサーに助言する。このグループは、臨床試験の継続的な妥当性と科学的メリットを評価するための中間データをレビューすることもできる。データモニタリング委員会は、安全性結果および試験の成功の可能性に応じて、臨床試験の停止、臨床試験の修正、または臨床試験の継続をスポンサーに助言することができる。
当社は、特定の期間内に当社の製品の臨床試験を成功裏に完了するかどうかは確信できません。さらに、 FDA 、 IRb または当社は、被験者または患者が許容できない安全性リスクにさらされていることや適用可能な規制要件への不遵守があることを含む様々な理由で、いつでも臨床試験を停止または終了することがあります。
非臨床·毒理学研究および臨床試験の結果,製造プロセス,品質管理方法,製品組成などに関する詳細な情報は,NDAの一部としてFDAに提出され,その期待用途に対して安全かつ有効であることを決定し,その製品の市場進出を承認し,商業流通を行うことを求めている。FDAが申請を受けると、申請を受ける前に、NDAを審査して、実質的な審査が可能になったかどうかを決定するために60日間の時間がある。FDAは申請を受け入れるのではなく、より多くの情報を提供することを要求するかもしれない。この場合、申請は追加情報と共に再提出されなければならない。提出された申請が受け入れられると、FDAは深い実質的な審査を開始する。FDAが“処方薬使用料法案”(PDUFA)に基づいて達成した目標によると、同機関の現在の目標は、標準審査の60日の提出日後10ヶ月以内に新分子実体申請の90%を審査することである。PDUFA日付は1つの目標にすぎないため,FDAはつねにそのPDUFA日付を満たすわけではない.FDAが提出に関する多くの追加情報を要求またはスポンサーが提供する場合、PDUFA日も延長することができる。
FDA は、特定の申請を諮問委員会に付託することがあります。諮問委員会は、申請が承認されるべきかどうか、どのような条件下で承認されるべきかを勧告する専門家パネルです。FDA は諮問委員会の勧告に拘束されませんが、決定する際にそのような勧告を慎重に検討しています。
14
FDA は、 NDA を承認する前に、製品が製造されている施設を検査し、スポンサー、臨床試験ベンダー、および製品候補が試験された臨床施設を検査することができ、 cGMP および GCP 準拠が満足のいく場合を除き、製品を承認しません。検査は、直接または遠隔で実施できます。適用される規制基準が満たされない場合、 FDA は、追加の非臨床または臨床試験またはデータまたは追加の CMC 情報を必要とする完全な応答レターをスポンサーに発行することができます。CRL が発行された場合、申請者は、手紙で特定されたすべての欠陥に対処してマーケティング申請を再提出するか、申請を取り下げるか、ヒアリングの機会を要求することができます。
FDAが承認要件を満たすと判断すると、製品の商業マーケティングを許可し、特定の適応の特定の処方情報を提供する承認書を発行する。承認の条件として、FDAはまた、製品の安全性または有効性を研究および/または監視することを含む、上場後の承諾および要求を要求する可能性がある。FDAはまた、候補製品の利点がリスクよりも大きいことを確実にするために、薬物ガイドラインおよびリスク評価および緩和戦略(REMS)、または製品が承認または承認された後の他の条件を要求する可能性がある。さらに、FDAが製品を承認したとしても、製品の承認適応または使用者を制限することができ、ブラックボックス警告を含む製品ラベルに禁忌、警告または予防措置を含むことを要求し、承認後の研究のような他の条件を適用するか、または商業化およびマーケティングに成功するために必要なラベル宣言を承認しない可能性がある。
NDA が承認された後でも、 FDA は追加の義務や制限 ( 表示変更、臨床上市後の要件など ) を課したり、製品が市場に出回った後に生じるデータ、または規制基準の遵守が維持されていない場合に基づいて、製品の承認を停止または撤回したり、追加の試験やラベルの改訂を要求したりすることができます。当社が提出する NDA が、 FDA によって完全または加速承認のためにタイムリーに承認されるかどうかは確信できません。また、そのような承認は、製品が販売される用途を制限する可能性がある。承認の拒否、承認の遅延、承認の停止または撤回、または指示された用途の制限は、当社の事業見通しに重大な悪影響を及ぼす可能性があります。
各 NDA には、 PDUFA およびその改正の要件に従って相当なユーザー料が付与されなければなりません。手数料の免除または減額は、特定の状況で利用できます。製品承認後、医薬品は年間プログラム料の対象となります。FDA は毎年 PDUFA のユーザー料を調整しています。中小企業によって提出された最初のヒト医薬品申請の申請料の免除のために書面による要請を提出することができますが、プログラム手数料の中小企業の免除はありません。オルファン製品として指定された製品候補は、アプリケーションにオルファン表示以外の表示が含まれない限り、アプリケーションユーザー料の対象となり、特定の基準を満たす場合はプログラム料が免除される場合があります。当社は、これらの手数料の対象となる製品の開発段階ではありませんが、将来発生する可能性のある重要な支出であり、 FDA への申請時に支払わなければなりません。
FDAの要求を満たすには一般的に数年の時間が必要だ。薬品のタイプ,複雑さ,新規性などによって,実際に要する時間は大きく異なる。政府の監督管理は製品ライフサイクル全体に高価で時間のかかる要求と制限を課し、かなり長い時間内に製品マーケティングを延期し、製品マーケティングを制限し、甚だしきに至ってはマーケティングを完全に阻止する可能性がある。非臨床或いは早期臨床試験の成功は後期臨床試験の成功を確保できない。非臨床と臨床活動から得られたデータは常に決定的ではなく、異なる解釈の影響を受ける可能性があり、これらの解釈は延期、制限或いは上場承認を阻止する可能性がある。1つの製品が発売承認されても,承認は特定の臨床適応に限られている。また、上場承認を得た後であっても、製品が以前に未知の問題が発見されたことで、その製品が制限され、市場から完全に撤退する可能性がある。
製品が承認された後,FDAは記録保存要求,患者がその製品を使用した不良副作用を報告する義務,広告や販売促進活動の制限を含む重要な規制要求を継続して実施する。品質管理と製造プロセスは引き続きcGMPに適合しなければならず、FDAは自己検査と遠隔規制を通じて定期検査施設を評価し、cGMPコンプライアンスを評価する。さらに、承認後の成分組成、製造プロセスまたは施設、製品ラベル、または他の態様の変更は、審査および承認のためにNDA付録をFDAに提出する必要がある場合がある。新たな適応には,より多くの臨床研究とNDA付録の提出が必要となる。商業分布の製品はまた各種の追加要求の制約を受けて、追跡、追跡とサプライチェーンの完全性に関する要求;及び薬品不足と薬品不足の予防に関連する要求を含む。
FDA の規制要件を遵守しない場合、 FDA による執行措置 ( 臨床停止、販売申請またはサプリメントの承認拒否、警告書、製品リコール、製品承認の停止または取り消し、流通を防止するための製品の押収、製品の製造または流通を禁止する差し止め命令の課し、民事および刑事罰則など ) が生じることがあります。コンプライアンスの維持にはコストがかかり、時間がかかります。当社は、当社または現在または将来のサプライヤーまたは第三者メーカーが FDA のすべての規制要件を遵守できることを確信しておらず、コンプライアンス違反の潜在的な結果は、当社の事業見通しに重大な悪影響を及ぼす可能性があります。
15
FDA の方針が変更され、当社の製品の規制承認を遅延、制限、または妨げる可能性のある追加の政府規制が制定され、追加のコンプライアンス措置を実施することを要求したり、承認後の当社の製品の製造、販売、または流通能力に影響を与える可能性があります。
また、当社の活動には、製品の開発および販売に影響を与える州の法規制の対象となる場合があります。また、安全な労働条件、臨床、実験室、製造慣行、環境保護、火災危険管理、有害物質または潜在的に有害物質の廃棄などの事項に関する多くの連邦、州、地方の法律の対象となります。当社は、現在または将来、かかる法令を遵守するために多大なコストが発生し、遵守しなかった場合、当社の事業見通しに重大な悪影響を及ぼす可能性があります。
FDCA には、重篤または生命を脅かす疾患の治療を目的とした薬剤の開発を促進し、レビューを迅速化するための規定が含まれています。これらの規定は、医薬品をファストトラック製品として指定するための手続を定めている。ファストトラック指定は、製品と研究されている特定の適応症の組み合わせに適用されます。ファストトラックに指定された製品は、通常、 FDA との相互作用の増加や申請のローリング提出など、開発と審査を迅速化するための追加プログラムの対象となります。
重篤または生命に危険な疾患を治療し、既存の治療方法よりも意義のある治療利益を提供することを目的とした製品も、加速承認を得る資格がある可能性がある。加速審査条例によると、薬物承認は代替終点に対する臨床効果の証拠に基づく可能性があり、この代替終点は合理的に臨床利益を予測する可能性がある。発売後の臨床研究を完成することを要求し、臨床治療効果を検証し、そして他の制限を加えて、安全な使用を確保する可能性がある承認が製品の承認を加速する日までに、FDAは、登録目標、研究案、マイルストーン、目標完了日を含む、承認後の研究の条件を具体的に説明しなければならない。FDAはまた,FDAが製品承認を加速する前に検証的な第4段階の研究を開始することを要求する可能性がある。必要な第4段階検証研究の進捗報告は、承認後180日毎にFDAに提出されなければならない必要な承認後の研究を行わないか,あるいは臨床的利益を確認することで,FDAが法定の加速に基づいて薬物や生物を市場から撤回することを可能にする必要な第4段階の検証的研究またはそのような研究が行われておらず、必要な最新の報告が提出されていない場合、スポンサーは処罰されるであろう。私は…近年、承認経路の加速はFDAと大衆の厳しい審査を受けている。したがって、FDAは、承認の加速においてより保守的である可能性があり、または、承認された場合、臨床的利益が確認されていない場合、またはリスク効果の評価が変化した場合、承認を撤回する傾向がある可能性がある。
利用可能な 3 つ目の潜在的な指定はブレークスルーセラピー指定である。ブレークスルーセラピーとは、重篤または生命を脅かす疾患または状態を単独でまたは 1 つ以上の他の製品と併用して治療することを目的とした製品であり、予備的な臨床エビデンスにより、 1 つ以上の臨床的に重要なエンドポイントにおいて既存の治療法よりも実質的な改善を示す可能性があることを示している製品です。ブレークスルー療法として指定された製品は、 FDA の集中的なガイダンスの対象となります。 FDA は、シニアマネージャーと経験豊富な審査スタッフを積極的に共同で学際的な審査に巻き込むというコミットメント、申請のローリング提出、学際的な審査の円滑化を行います。
最後に、製品が重篤な疾患の治療を意図しており、承認されれば、疾患の治療、診断、または予防の安全性または有効性を著しく改善する場合には、製品が優先審査の対象となり、 FDA の NDA 審査の目標は 6 ヶ月に短縮される。( FDA が申請の準備が整っているかどうかを決定する 2 ヶ月間の後 ) 、申請受理から 10 ヶ月の標準的な審査ではなく。当社のプログラムのいずれかの追加指定を求める場合、 FDA によって付与されることを保証することはできません。また、当社が受け取った、または受け取る可能性のある指定を維持できる保証はありません。
FDA の NDA の承認の後、スポンサーは、申請者の薬または薬の使用方法をカバーする請求を含む各特許を FDA にリストする必要があります。これらの特許は、 FDA の「 Approved Drug Products with Therapeutic Equivalence Evaluations 」リスト ( 一般に「オレンジブック」として知られている ) に掲載されています。オレンジブックに記載されている医薬品は、潜在的な競合他社が 505 ( b ) ( 2 ) NDA または略化された新薬出願を支持する参照医薬品として引用することができます。どの特許がオレンジブックに記載されなければならないかを明確にするため、 2021 年 1 月に議会は 2020 年のオレンジブック透明性法を可決し、 FDA の既存の慣行を FDCA に大きく成文化した。
A 505 ( b ) ( 2 ) NDA は、安全性および有効性の調査の完全な報告書を含む申請であるが、承認に必要な情報の少なくとも一部が、申請者によってまたはそのために実施されず、申請者が調査が行われた者から参照または使用権を得ていない調査から来ている場合である。この規制経路により、申請者は、既存の製品の安全性と有効性に関する FDA の事前の知見、または出版された文献に一部依存することができます。ANDA は、以前に承認された製品と同じ有効成分、製剤、強度、投与経路、表示、性能特性および使用目的を有するジェネリック医薬品の販売を規定しています。ANDA
16
申請者は一般的に、その製品が革新薬と同等の生体等価であるか、または同様の方法で機能し、しばしば参照リスト薬のために書かれた処方薬によって代替できることを科学的に実証する必要があります。
一般に、FDAは、市販薬のオレンジブックに記載されている特許が満了していることを参照しない限り、簡略化された新薬出願(ANDA)または505(B)(2)NDAを承認しない可能性があり、および/または出願人が特許使用方法の承認を求めていることを証明していない場合がある。しかしながら、505(B)(2)NDAまたはANDAスポンサーが、市販薬のオレンジブックを参照して記載された特許が無効であるか、または出願された医薬品の製造、使用、または販売によって侵害されないことを証明した場合、FDAは、これらの出願を承認する可能性がある。この後の認証を第4項認証と呼ぶ。ANDA又は505(B)(2)NDA出願人がNDA及び特許所有者に通知した後に第4項の証明を行った場合,NDA及び特許所有者は特許侵害訴訟を提起することができる。訴訟が提起された場合、FDAは、特許または出願全員が第4項の認証通知を受信し、特許満了後30ヶ月、各特許に関連する侵害事件が出願人に有利な裁決または和解を行うまで、または裁判所が命令する可能性のあるより短いまたはより長い期間まで、承認を発効させてはならない。
議会と米国連邦行政機関は、 505 ( b ) ( 2 ) NDA および ANDA の円滑化や米国市場に追加製品を導入することを含め、医薬品競争を増大させ、それによって医薬品価格を下げるための特定の措置を講じてきた。例えば、 FDA は医薬品の輸入を容易にするための規則とガイダンスを確定しました。議会はまた、 NDA 製品のスポンサーに、ジェネリックおよび 505 ( b ) ( 2 ) 製品を開発する事業者に商業的に合理的な市場ベースの条件で十分な量の医薬品を提供することを要求する法案を可決した。この法案には、ジェネリック医薬品の共有および個別の REMS の規定も含まれていた。
1984年の“薬品価格競争と特許期限回復法”によると、スポンサーはFDAがある薬物申請を許可してから一定の時間内に市場独占経営権を獲得することができる。例えば,以前FDAで承認されていなかった新化学物質を含む新薬は5年間の排他性を得ることが可能である。FDAが以前に同じ活性部分を含む他の新薬を承認していない場合、薬物は新しい化学実体であり、活性部分は薬物物質の治療活性を担当する分子またはイオンである。専門期間内に、FDAは、他の会社によって提出されたANDAまたは505(B)(2)NDAの審査を受け入れない可能性があり、同社が提出したANDAまたは505(B)(2)NDAは、以前に承認された活性部分を含む。ただし、ANDAまたは505(B)(2)NDAが第4項の証明を含む場合は、4年後に提出することができる。この排他性は絶対的ではない.例えば、完全なセキュリティプロトコルの提出または承認を遅延させることはないが、包括的セキュリティプロトコルを提出する出願人は、安全かつ有効であることを証明するために、すべての臨床前研究および十分かつ良好に制御された臨床試験を参照する権利を行うか、または得ることを要求されるであろう。
NDA の承認後、特許所有者は、 IND の出願から対応する NDA の出願までの経過時間の半分に NDA の出願から FDA の承認までの経過時間の半分に相当する期間、特許延長を最大 5 年間取得することができます。延長された製品の総特許寿命は、製品の承認日から 14 年を超えることはできません。特許延長期間は、出願者がデューデリジェンスを行わなかった場合でも短縮することができます。当社は、これらの法律の特許期間の延長または販売独占条項のいずれかを活用できるかどうか、またはそれらが受領した場合、承認された製品を競争から適切に保護するかどうか確信できません。
BPCA は、 2007 年の FDA 改正法によって再承認され、改正されました。BPCA の再承認により、 FDA が小児科書面要請で特定したように、小児科情報が有益である新規および現在市販されている医薬品の許容可能な小児科研究を実施する NDA 申請者に対して、 FDA に記載されている未満期の排他および未満期特許に、 6 ヶ月間の販売独占および特許保護が追加されます。データは、研究対象の小児集団において製品が有効であることを示す必要はありません。むしろ、臨床試験が小児書面要請におけるスポンサーと FDA の間の合意を公平に対処しているとみなされる場合、追加の保護が付与されます。
“小児科研究公平法”(PREA)もFDAAAの再許可と改正を得た。PREAの再認可要件の多くは、小児における薬物の安全性および有効性を保証するために、小児科評価を含む(放棄または延期しない限り)。このような小児科評価は、評価を必要とする各年齢群の適切な処方を使用して収集されたデータを含まなければならず、これらのデータは、すべての関連する小児科亜群において医薬製品が主張する適応の安全性および有効性を評価し、その安全かつ有効な各小児科亜群に対する薬剤の投与および投与をサポートするのに十分である。このような研究を完成させるスケジュールがある場合にのみ,小児科評価は遅らせることができる。FDAは、申請者が年齢層を製造するために必要な小児科製剤の合理的な試みが失敗したことを証明することができる場合を含む、いくつかの理由(一部または全部)のために小児科評価要件を免除することができる。孤児製品もPREA要求の影響を受けない。“食品·薬物管理局安全·革新法案”は2012年7月9日に署名されて法律となり、BPCAとPREAを永久的に更新·強化した。
17
2017 年の FDA 再認可法に基づき、 2020 年 8 月 18 日以降に成人がんの治療を目的とした、 FDA が小児がんの増殖または進行に実質的に関連すると判断した分子標的を標的とする製品候補について、元の申請を提出するスポンサーは、販売申請提出前に、 FDA 承認のための最初の小児研究計画を提出しなければならない。適切な小児製剤を用いて臨床的に有意義な小児研究データを生成するように設計された分子標的小児がん臨床研究からのレポート潜在的な小児ラベル通知します孤児製品はこの要件から免除されていませんが、 FDA はデータ提出の完全または部分的な免除または延期を付与することができます。
孤児医薬品法によれば、FDAは、まれな疾患や疾患を治療するための薬剤を孤児薬として指定することができる。米国では、まれな疾患または疾患は、通常、20万人に影響を与えない疾患や疾患である。また、FDAが製品を承認しており、FDAがFDAが承認した製品と同じであり、同じ適応に使用しようとしている場合、スポンサーは、孤児薬物名を得るために合理的な臨床的優位性仮説を提示しなければならない。孤児薬物の指定は、監督審査と承認過程においていかなる利点も伝達されず、規制審査と承認過程の持続時間を短縮することもない。しかし、指定孤児薬物は、一方が臨床研究費用に贈与資金を提供する機会、税収優遇、およびあるユーザー費用の減免などの財政的インセンティブを得る権利がある。しかし、2017年の減税と雇用法案では、税金優遇は限られている。孤児薬物の称号を有する製品がその後、FDAによるその称号を有する適応の最初の承認を得た場合、この製品は、限定された場合を除いて、孤児排他性、すなわちFDAが7年以内に同じ適応で同じ薬剤を販売することを許可することを許可する権利がある。例えば、FDAが同じ適応のための同じ製品である製品を承認した場合、以前の臨床的優位性仮定が証明された場合にのみ、指定された孤児製品は孤児薬物排他性を得ることができる。競合他社は,孤児製品に排他的な適応を有する異なる薬物,あるいは同一薬物を異なる適応に用いることも許可されている。
特に、孤児薬の排他的期間の正確な範囲は変更される可能性がある。具体的には、 2021 年の裁判判決、 Catalyst Pharms,Inc.Becera事件を訴える, 医薬品 Firdapse の孤児製品の排他的範囲に関する FDA の決定に異議を唱え、覆しました。この決定の下では、 Firdapse の孤児医薬品の排他性は、承認を受けた病気または状態だけでなく、孤児医薬品指定が付与された病気または状態全体に対する同じ医薬品の他の会社の申請の承認をブロックしました。しかし、 2023 年 1 月の連邦登録簿通知で、 FDA は、医薬品が承認された用途または適応症に孤児医薬品排他的の範囲を結びつける規制を適用し続ける意向であると述べた。孤児薬の排他的性の正確な範囲は、進化する領域である可能性が高い。
医薬品の適用範囲、価格設定、償還と医療改革
また、我々の製品の将来の販売は、上場が許可されれば、連邦医療保険や医療補助、商業保険、管理の医療機関を含む政府医療計画のような第三者支払者のカバー範囲や精算範囲にある程度依存する。これらの第三者決済者は価格に挑戦し、医療製品やサービスのカバー範囲や精算金額を制限することが増えている。承認された製品の保険や精算に大きな遅延がある可能性があり、保険範囲はFDAや他の国/地域規制機関がこの製品を承認する目的よりも限られている可能性がある。第三者決済者に補償を求めるのは時間がかかって高い。さらに、精算を受ける資格があるということは、どの製品もすべての場合に支払われることを意味するわけではありません。または支払いの費用率は、研究、開発、製造、販売、流通を含む私たちのコストをカバーします。米国では、第三者支払者が自分の精算政策を設定する際には通常Medicare保証政策と支払い制限に依存しているが、Medicare保証範囲と精算確定以外にも、彼らは独自の方法と承認の流れを持っている。
また,医療コストの抑制は連邦と州政府の優先順位となっており,薬品価格はこの努力の重点となってきた。アメリカ政府、州立法機関と外国政府はコスト制御計画の実施に深い興味を示し、これらの計画は価格制御、カバー範囲と精算に対する制限及び模造薬代替に対する要求を含む。価格制御とコスト制御措置、および既存の制御·措置を講じている司法管轄区域でより制限的な政策をとることで、我々の純収入と業績をさらに制限することができる。私たちの候補製品の第三者精算減少または第三者支払者は、私たちの候補製品をカバーしないことを決定することは、医師の候補製品への使用を減少させ、私たちの販売、運営結果、財務状況に実質的な悪影響を与える可能性があります。また、政府はメーカーがその販売する製品に価格を設定する方式に対してより厳格な審査を行い、国会で数回の調査を行い、連邦と州立法を提出し、製品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、政府の薬品の精算方法を改革することを提出し、公布した。米国の個別州も、価格または患者の精算制限、割引、ある製品への参入とマーケティングコスト開示の制限、および薬品価格透明措置を含む薬品価格を制御するための法規を立法し、実施しており、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。2022年8月16日、総裁·バイデンは“2022年インフレ削減法案”、略して“アイルランド共和軍”に署名した。他の点ではアイルランド共和軍は
18
メディケアプログラムや米国全土で販売されている交渉の上限価格やインフレ率を超える値上げに対する罰則など、医薬品の価格に影響を与える可能性のある複数の規定があります。
外国の規制要件
米国外では、当社の製品を販売する能力は、適切な規制当局からの販売承認の受領と承認後の適用可能な規制要件への遵守にも依存します。特定の要件と制限は国によって異なりますが、一般的に、外国の規制システムには、上記の FDA の規制に関連したものと類似したリスクが含まれています。
欧州連合(欧州連合)の監督管理制度の下で、マーケティング許可は集中型または分散型プログラム(DCP)に従って提出することができる。集中手続きの下で、欧州医薬品局(EMA)に提出された単一申請はEU委員会の承認を得て、EU全体での販売を許可する。あるカテゴリーの医療製品,例えば腫瘍学の治療のための新しい物質では,集中プログラムは強制的である。また,あるバイオテクノロジー手段により開発された医薬製品や,癌や他の特定の疾患や障害に対して開発された製品は,集中プログラムで許可されなければならない。集中手順は、私たちがバイオテクノロジープロセスによって開発した任意の製品または癌治療のための任意の製品に適用されるだろう。DCPは、条件を満たしていない、または集中プログラム許可を必要としない製品のために使用されます。特定の他の製品の場合、集中化手続きはオプションである。イギリスがEUを離脱して以来、イギリスは集中手続きから除外されてきた。申請者は単独でイギリスの薬品と保健製品規制機関(MHRA)にイギリスのマーケティング許可を申請しなければならない。現在、EU/イギリスが新医薬製品を相互承認する手続きはなく、英国にはEUが承認した製品を承認するための迅速な審査手続き(EU決定依存手続き)があるにもかかわらず、現在は2023年12月31日まで続く。その後、欧州環境管理局が下した決定を考慮した新たな国際承認枠組みが構築される。これは,2023年12月31日以降に受けた人用医療補助製品委員会(CHMP)の積極的な意見の申請に資格があることを意味する。
FDA の承認と同様に、 EU の規制当局の承認をタイムリーに取得できない可能性があります。さらに、米国と同様、製品の製造、販売、流通に関するものなどの承認後の規制要件は、 EU で承認されたすべての製品に適用され、そのような義務を遵守しない場合、製品の商業化を成功させる当社の能力に重大な悪影響を及ぼす可能性があります。
EUの臨床試験は2022年6月に実施された“欧州臨床試験条例”(CTR)によって管理されている。このCTRは会員国の規制機関がどのように臨床試験を制御するかを管理する。国家主管部門の許可を得ていない臨床試験と良好な倫理道徳の承認を経て、臨床試験を開始してはならない。この規定によると,臨床試験スポンサーは2022年1月31日から臨床試験情報システム(CTIS)を使用可能であるが,直ちに使用する義務はなく,3年間の過渡期と一致している。2022年1月31日から、EU加盟国と欧州経済圏(EEA)諸国の規制機関はCTISを使用することができる。英国のEU離脱に伴い,イギリスではCTRが実施されておらず,イギリスでは以前の臨床試験指令(CTRとほぼ同じ分野をカバーしているが,詳細度はCTISよりはるかに低い)に規定されている以前の法律の条項が適用され続け,イギリスが改正されるまで適用される。
したがって、 EU における臨床試験の規制と当社の製品に対する販売承認に関しては、著しい変化と不確実性があります。
製造
当社は、当社の医薬品候補を商業的に製造する設備や能力を有していません。当社は、 c GMP を含む規制要件に従って、既存および将来の臨床試験用候補の供給と商用規模の製造のために、契約メーカーに依存し続けると予想しています。契約製造業者は、自社技術、当社開発の技術、または第三者から取得またはライセンス供与した技術を利用することがあります。製造手順とサイトの FDA の承認は、商用流通の前に必要です。
人的資本管理
2024 年 6 月 30 日現在、従業員数は 28 名、そのうち 3 名が博士号を取得しています。M. D.全員がアメリカ合衆国に居住しています28 位のうち 従業員のうち 12 人が研究開発活動に従事し、 16 人が事業開発、財務、情報システム、施設、人事、管理支援に従事していました。 その他の人材資源は、必要に応じてコンサルタントまたは第三者のサービス組織として随時使用されます。当社のシニアマネジメントチームのメンバーはすべて、製薬、バイオテクノロジー、医療製品企業での経験があります。熟練した経験豊富な人材を引き付けることに成功していると信じていますが、必要な人材を引き付け、維持できるとは保証できません。
19
当社の従業員は、当社の継続的な成功の重要な要素です。戦略的目標を達成するために、トップ人材を引き付け、維持、育成するためのワークプレイスの創出に努めます。当社は、従業員が使命を推進できる尊重的でやりがいのあるインクルーシブな職場環境を作り出すことにより、人材資源の可能性を最大限に活用するよう努めます。当社は、継続的な雇用機会の創出、公正な賃金の支払い、労働者の安全衛生の保護などのコミットメントを含む哲学を堅持しています。
競争力のある給与と福利厚生を提供することで労働力に投資します。当社は、株式インセンティブ制度に基づくストックオプションの提供により、強いオーナーシップの育成に努めます。また、すべての適格な従業員に包括的かつローカルに関連する福利厚生を提供します。
当社は、あらゆるレベルの従業員に対する定期的なトレーニング、これらの目標をサポートする方針と慣行、および当社の価値観の力と従業員一人ひとりのユニークな特性を強化する社内およびコミュニティベースのさまざまなイベントやアクションを組み合わせて、当社の文化に焦点を当てています。
当社の従業員は、労働組合に代表されず、団体交渉契約の対象ではありません。業務停止を経験したことはありません。従業員との関係は良好です。経営陣は、従業員との関係は概ねポジティブだと考えています。
利用可能な情報
フォーム 10- k に 関 する 当社の 年 次 報告書 、 フォーム 10- Q に 関 する 四 半期 報告書 、 フォーム 8- k に 関 する 現在の 報告書 、 および 1934 年 証 券 取引 法 第 13 条 ( a ) または 15 条 ( d ) に 基づ いて SEC に 提出 または 提出 された これらの 報告書 の 修正 は 、 当社の ウェブサイト を通じて 無料で 入手 できます 。www.meipharma.comSEC に 電子 的に 提出 または 提供 された 後 、 合理 的に 実行 可能な 限り 速 やかに 。さらに 、 SEC は 、 SEC に 電子 的に 提出 された 発行 者 に関する レポート 、 代理 および 情報 ステ ート メント 、 および その他の 情報 を含む インターネット サイト を維持 しており 、 ED GAR の ページ (http://www.sec.gov.
第1 A項。リスク要因
当社の有価証券への投資は、高いリスクを含みます。当社の有価証券に関する投資決定を下す前に、以下に記載されているリスクを、本年次報告書およびその他の公表書類に記載されているその他の情報とともに慎重に検討してください。以下のいずれかが実際に発生した場合、当社の事業、業績、見通しまたは財務状況に重大な悪影響を及ぼす可能性があります。これにより、当社普通株式の取引価格が下落し、投資の全部または一部を失う可能性があります。また、以下に示すリスクだけが直面するものではありません。当社が現在知っていない、または現在重要でないとみなす追加のリスクは、当社の事業、業績、見通しまたは財務状況に影響を与える可能性があります。
戦略的選択肢の見直しに関連するリスク
当社は、潜在的な戦略的代替案をタイムリーに特定し、実施することができない場合、または全く成功しない場合があり、将来的に達成する戦略的取引は悪影響を及ぼす可能性があります。
2024年7月、株主価値最大化に重点を置いた戦略選択の全面的な探索が行われていることを発表した。我々の取締役会が株主価値を最大化すると考えている戦略的代替案を探索するために大量の時間と資源を投入する予定だ。経営陣は潜在的な戦略選択を識別し評価するために多くのエネルギーを投入しているにもかかわらず、この戦略審査過程が私たちのいかなる取引につながるか、あるいは魅力的な条項、タイムリー、あるいは特定の戦略取引を成功させることができない保証はないだろう。例えば、いくつかのタイプの戦略取引は、株主承認のような第三者の同意を必要とする可能性があり、これは、入手が困難であるか、またはコストが高い可能性がある。私たちはまだこの戦略審査過程を完成させるスケジュールを作っていません。私たちの取締役会も最終的な行動方針を承認していません。さらに、任意の特定の行動計画、業務スケジュールまたは取引、または一連の取引が実行され、成功し、または株主価値が増加することが保証されないか、または株主に任意の現金分配が行われる。
当社の戦略的代替案を継続的に評価するプロセスは、コストがかかり、時間がかかり、複雑であり、当社が多額の法的、会計、アドバイザリー手数料およびその他の費用を負担する可能性があります。また、このプロセスに関連して予期せぬ追加費用が発生する場合があります。このような費用は、当社の事業で使用可能な残された現金を減少させます。当社の戦略的取引を追求または完了する能力は、特定の従業員を維持する能力にも依存しています。
20
取引を特定し交渉し完了します当社の重要な残留人材の一部を維持できなければ、 1 つ以上の戦略的取引の探求と完了が中断される危険性があります。
さらに、当社が関与する戦略的取引における潜在的な取引先は、当社の資産および上場に最小限または全く価値を置く可能性があります。さらに、さらなる開発を停止したパイプライン中の 1 つ以上のプログラムなど、将来の医薬品候補の開発を再開した場合、将来の医薬品候補の開発および潜在的な商業化には、必要な前臨床試験および臨床試験の実施および規制当局の承認取得に関連する費用を賄うために、相当な追加現金が必要となります。その結果、当社を含む戦略的取引における潜在的な取引先は、将来の医薬品候補の開発を再開または継続するために追加的なリソースを費やさないことを選択し、そのような取引において、将来の医薬品候補にほとんど価値を与えないか全く価値を持たない可能性があります。
また、当社が実施する戦略的取引は、様々な悪影響を及ぼす可能性があり、予期せぬ結果をもたらし、当社が事業に悪影響を及ぼし、当社が事業で使用可能な残高が減少する取引を行う可能性があります。潜在的な取引は、市場状況、業界の動向、当社との潜在的な取引に対する第三者の関心、株主の承認の取得、および合理的な条件での当社との潜在的な取引における第三者への資金調達の利用可能性など、当社の制御を超えた多くの要因に依存します。特定の行動方針、事業取り決めまたは取引、または一連の取引が追求され、成功裏に達成され、株主価値の向上につながり、または期待される結果を達成することを保証することはできません。
新たな戦略的道筋を立てることができず、計画が適時に実行されなかった場合、株主の評判が損なわれ、有価証券の価値が悪影響を受ける可能性があります。また、戦略的選択肢の見直しや将来に関する不確実性の認識による推移により、株価の大幅な変動が生じる可能性があります。
当社の戦略的評価から、戦略的取引または一連の取引を成功裏に完了した場合であっても、当該取引の期待される利益の全部または一部を実現できなかった場合、当該利益の実現に予想よりも時間がかかる場合、統合の困難に直面したり、その他の運用および財務リスクにさらされる可能性があります。
潜在的な戦略的取引の期待される利益を実現する能力は、将来のビジネスパートナーとの統合能力、売却した場合の事業の一部に対する価値を得る能力、将来の株主価値を生み出す能力など、多くの要因に依存します。このプロセスは当社のビジネスに混乱をもたらし、期待される利益が期待される期間内に達成されない場合もあります。関連する課題を克服し、潜在的な取引の期待される利益を実現できない場合、当社の事業および財務状況に悪影響を及ぼす可能性があります。潜在的な戦略的取引の交渉と完了には、経営陣に相当な時間を要し、経営陣の注意をそらすと、事業が混乱する可能性があります。
このような取引の交渉および完了には、私たちが予想していたよりも多くの時間またはより多くの現金資源を必要とする可能性があり、短期および長期支出の増加、未知の債務開放、予想以上の買収または統合コスト、戦略取引に関連する融資、資産または営業権の減記または非日常的、減価または他の費用の発生、償却費用の増加、任意の買収または買収業務の運営および人員と私たちの運営および人員との合併の困難およびコストを含む、将来の運営を支援するために、他の運営および財務リスクに直面させる可能性がある。任意の買収または買収業務の重要なサプライヤーまたは顧客との関係は、管理層と所有権の変化、私たちの肝心な従業員を維持できない、あるいは任意の買収或いは買収業務、将来発生する可能性のある訴訟によって損なわれる。上記のいずれのリスクも、私たちの業務、財務状況、および見通しに重大な悪影響を及ぼす可能性がある。
戦略的取引が完了しない場合、取締役会は解散 · 清算を行うことを決定することがあります。このような場合、株主への配分可能な現金の額は、清算の時期や、コミットメントや偶発的負債のために確保する必要がある現金の額によって大きく異なります。
もし私たちが戦略的取引を成功させなかったら、私たちの取締役会は解散と清算を求めることを決定するかもしれない。この場合、私たちの株主に割り当てられる現金の数は、この決定を下すタイミングに大きく依存し、時間が経つにつれて、分配可能な現金の数は、私たちが運営に資金を提供し続けるにつれて減少するだろう。また、私たちの取締役会が解散と清算を承認し、提案すれば、私たちの株主も解散と清算を承認し、デラウェア州会社法によると、私たちの株主に任意の清算分配を行う前に、私たちの未返済債務と、未知の債務のための合理的な準備金を予約することを要求されます。この要求のため、私たちはこのような債務の返済を待つために資産の一部を保留する必要があるかもしれないが、そのような返済の時間はまだ確定されていない。しかも、私たちは解散と清算に関連した訴訟や他のクレームの影響を受けるかもしれない。解散と清算を求める場合、私たちの取締役会は私たちの顧問と協議し、これらの事項を評価して決定する必要があります
21
予約する合理的な金額ですしたがって、清算、解散、清算の場合、普通株式の保有者は投資額の全部または一部を失うことになります。
戦略的取引または解散の場合の株主にとっての価値は、当社が第三者に対する既存の契約上の義務および規制上のコミットメントを有利な条件でどの程度成功裏に履行できるかに依存する可能性があります。
私たちは現在特定の契約と管理義務と約束を受けている。私たちは戦略的代替方法を全面的に探索すると同時に、このような義務と約束を減らしたりキャンセルしたりするために、第三者との交渉を求めることができる。私たちが有利な条件でこのような義務や約束を交渉することができるかどうか、あるいは私たちがそのような義務を履行する能力は、私たちに有利な条項で戦略取引を行う能力に影響を与え、戦略取引において株主に与える価値に影響を与えるか、あるいは私たちが解散した場合に株主に分配する現金に使用することができるかもしれない。私たちはまたこのような交渉や私たちの任意の約束を終わらせることで巨額の費用を招くかもしれない。私たちは私たちの既存の契約や規制義務と約束を減少またはキャンセルすることに成功する保証はありませんし、私たちの株主が最大の潜在的価値を得ることができるスケジュールでこのような義務を履行できる保証もありません。
当社は、経営陣の注意をそらす可能性のある証券集団訴訟を含む訴訟に関与する場合があり、事業に害を及ぼす可能性があり、保険はすべての費用や損害をカバーするのに十分ではない場合があります。
過去には、証券集団訴訟を含む訴訟は、会社の売却やその他の戦略的取引の発表、またはネガティブな事象の発表など、特定の重要な事業取引に続いて行われることが多い。これらの出来事は SEC による調査にもつながる可能性があります。不正行為が発生していなくても、訴訟の対象となる場合があります。訴訟は通常費用がかかり、経営陣の注意とリソースをそらすため、当社の事業と現金資源、潜在的な戦略的取引を完了する当社の能力、またはそのような取引で株主が受け取る最終的な価値に悪影響を及ぼす可能性があります。
人員削減は、意図した結果を達成せず、重大な悪影響を及ぼす可能性があります。
2024年7月、私たちの戦略代替案の評価に合わせて、私たちの取締役会は、私たちの業務と戦略方向の変化に伴い、段階的に人員削減を継続することを承認しました。リストラは、機関知識や専門知識の喪失、予定従業員数を超える自然減員、余剰従業員の士気低下、予想されるリストラ効果を実現できないリスクなど、予期しない結果とコストを招く可能性がある。また、役職は廃止されていますが、私たちの運営に必要ないくつかの機能は依然として存在しており、退職従業員の職責や義務を残りの従業員に割り当てることに成功していない可能性があります。人員不足のため、人員削減はまた、私たちが新しい機会や措置を求めることを求めたり、阻止したり、追加的で予期しないコストを発生させて、潜在的な戦略的選択を含めて、これらの機会や計画を追求するために新しい人員を雇うことを要求する可能性もあります。もし私たちが減収による予想的な利益を達成できない場合、あるいは私たちが減収による重大な不利な結果を経験した場合、私たちの業務、財務状況、および経営業績は実質的な悪影響を受ける可能性がある。
私たちの財務状況と資本要求に関連するリスク
当社は創業以来、大きな損失を計上しており、当社は今後も損失を計上する可能性があると予想しています。
私たちは臨床段階の製薬会社です。最近まで、 CDK 9 阻害剤の選択的経口投与であるビタシクリブと、酸化性リン酸化経路を標的とした小分子ミトコンドリア阻害剤の静脈内投与である ME — 344 の開発に注力し、規制当局の承認を目指してきました。戦略的代替品の包括的な探査を行うことを決定したことに伴い、当社は、イタシクリブと ME—344 を含む臨床プログラムを中止しました。
創業以来、大きな営業損失を計上してきました。2024 年 6 月 30 日に終了した会計年度における純利益は 1780 万ドル、 2023 年 6 月 30 日に終了した会計年度における純損失は 3180 万ドルとなりました。2024 年 6 月 30 日現在、累積赤字は 38820 万ドルである。上記のすべての臨床プログラムの終了に伴い、研究開発費は減少しました。我々は、我々の戦略的代替案の評価プロセスに関連して、引き続きコストと支出を負担すると予想する。
今後、開発活動を再開する場合、研究開発コストが大幅に増加し、引き続き多額の費用と営業 · 純損失が発生すると予想されます。
当社の財務結果は、新薬候補または将来の新薬候補の開発を再開するかどうか、臨床試験の時期、将来の契約に基づく支払いの受領に応じて、年々大きく変動する可能性があります。
22
その他の研究開発 ( R & D ) 活動、 Presage とのライセンス契約および将来の類似の契約に基づいて支払われる支払金。
今後、開発活動を再開した場合、以下のように、当面も大きな損失を被るものと予想されます。
医薬品開発には多くのリスクや不確実性があるため、費用の増加の時期や金額、収益性が達成される時期やかどうかを正確に予測することはできません。FDA または外国の規制当局から、現在予想されているもの以上の研究を実施するよう要求された場合、または臨床試験の完了や医薬品候補の開発が遅れた場合、当社の費用が増加する可能性があります。
当社が創薬候補または将来の創薬候補の開発を再開することを決定した場合、追加的な資金が必要になり、必要に応じて資本を調達できない可能性があります。
臨床試験の実施、規制当局の承認の追求、アウトソーシング製造関係の確立、医薬品および医薬品候補の製造と商業化に成功することは高価です。創薬候補や将来の創薬候補の開発を再開する場合には、その開発を継続するための追加資金を調達する必要があります。
2024 年 7 月には、株主価値の最大化に焦点を当てた戦略的選択肢の包括的な探求に関連して、パイプライン中の臨床プログラムを中止しました。業務の合理化計画に伴い、人手削減を開始しました。
当社の臨床開発プログラムの中止、力の削減、戦略的代替案の包括的な探求を考慮した後、当社は、現在の無制限の現金および現金同等物および短期投資が、少なくとも今後 12 ヶ月間、現在予想されている事業計画の資金調達に十分であると予想しています。現在進行中のすべての臨床プログラムの終了に伴い、研究開発費は削減されました。我々は、我々の戦略的代替案の評価プロセスに関連して、引き続きコストと支出を負担すると予想する。今後、開発活動を再開すれば、研究開発コストが大幅に増加することが予想されます。この推計に基づいている仮定が間違っている可能性があり、現在予想するよりも早く資本資源を使用できる可能性があります。
私たちの未来の資金需要は多くの要素に依存するだろうが、これらに限定されない
今後の資本要件は、追加の補完的な事業、製品、技術への買収または投資の程度にも左右されます。十分な量の製品収益を生み出すことができるまで、公的または非公的株式の募集、デットファイナンス、企業提携およびライセンス契約からのマイルストーンおよびロイヤルティの支払い、ならびに現金および投資残高から得られる利子収入を通じて、将来の現金ニーズに資金を供給することを模索することがあります。我々は、追加資金が許容可能な条件で利用可能であるか、または全く利用可能であるか確信できず、追加資本を調達する我々の能力は、高いインフレ率や金利を含む潜在的な世界経済情勢の悪化、継続的な金融機関の混乱によって悪影響を受ける可能性がある。
23
現在進行中のロシア · ウクライナ紛争、中東紛争、中国 · 台湾間の緊張の高まりによるものを含む、米国及び世界中の信用 · 金融市場のボラティリティとボラティリティ。
当社の医薬品および潜在的な医薬品候補の今後の開発および商業化に関連するリスク
当社が創薬候補または将来の創薬候補の開発を再開した場合、臨床開発を完了し、規制当局の承認を得ることができず、商業化することができない場合、またはその実施に重大な遅延が生じた場合、当社の事業は重大な損害を及ぼします。
2024 年 7 月、戦略的代替案の包括的な探求に関連して、パイプライン中の臨床プログラムを中止しました。今後開発活動を再開した場合、臨床試験や規制承認の成功は確かではありません。規制当局は当社と異なるデータを解釈します。当社は、 FDA または同等の外国の規制当局からの規制承認を得るまでは、当社の医薬品候補を販売または宣伝することはできません。将来的に開発活動を再開した場合、シラシクリブまたは将来の医薬品候補に対する規制承認を受けることはありません。
当社の新薬候補または将来の新薬候補の開発を再開する場合には、そのような新薬候補の成功は、以下の多くの要因に依存します。
● 臨床試験への登録および完了、並びに前臨床試験の完了に成功すること。
● 臨床試験やその他の研究からの良好な有効性と許容可能な安全性データ
● 追加の規制承認の受領
● サードパーティベンダー、サプライヤー、メーカーなどの独占的な第三者への依存を管理すること。
● 当社のプロトコルおよび適用法に準拠し、結果として得られたデータの完全性を保護する方法で、 CRO またはその他の第三者およびコンサルタントが当社に対する職務を保持する場合。
● 特許、営業秘密、その他の知的財産権の保護および規制独占性の取得および維持
● 当社が第三者の有効な特許、営業秘密またはその他の知的財産権を侵害、流用、または侵害しないことを保証します。
● 単独または商業パートナーとの間で規制当局の承認を受けた医薬品候補の発売に成功すること
● 薬物および薬物候補者に対する第三者支払者や政府からの有利な償還を得て維持すること
● 他の薬物との競争
● 医薬品候補の規制当局の承認後の規制当局への市場投入後のコミットメントがある場合
● 規制当局の承認後も引き続き許容可能な安全性プロファイル
● 当社の医薬品および医薬品候補の評価および承認された医薬品の商業化のための臨床試験で使用するために必要となる可能性のある医薬品候補の製造または十分な供給の取得。
これらの要因の 1 つ以上をタイムリーに達成 · 維持しなければ、または全く達成 · 維持しなければ、医薬品または医薬品候補の規制当局の承認を取得し、および / または商業化に成功することができない可能性があります。これにより、当社の事業に重大な損害を与え、当社の事業を継続するための十分な収益とキャッシュフローを生み出すことができない可能性があります。
私たちの知的財産権に関するリスクは
当社の知的財産の価値は、特許保護の取得と維持、営業秘密の保存に一部依存しており、保証することはできません。
特許保護と営業秘密保護は当社の事業にとって重要であり、当社の将来は、米国内外の他者の所有権を侵害することなく、営業秘密保護を維持し、特許を取得し、運営する能力に一部依存します。訴訟またはその他の法的手続は、侵害の主張に対する防御、当社の特許の執行、または当社の営業秘密の保護のために必要である場合があります。このような訴訟は、多額のコストをもたらし、経営陣の注意をそらす可能性があります。
製薬 · バイオテクノロジー企業の特許立場は、非常に不確実であり、複雑な法的 · 事実上の問題を伴う。当社は、 2017 年に Presage からイソフラボン系化合物に関する特許および特許出願を取得し、 2011 年に Novogen から以前ライセンス供与していた ME—344 に関する特許発行済および特許出願中の両方を取得しました。さらに、ノボゲンは以前に多くの国で特許を出願していました。
24
ME—344 を含むイソフラボン化合物の使用に関して。最終的に、 2013 年 9 月に Pathway Therapeutics , Inc. から、ナゲレシブに関する特許および特許出願を取得しました。
特許出願は継続して許可されてはならず、許可された特許の保護範囲を縮小するために修正されてもよい。出願と特許はまた第三者の反対や挑戦を受ける可能性がある。もし私たちが私たちの候補薬または任意の未来の候補薬の開発を再開すれば、私たちのビジネス成功は、私たちの化合物および癌の治療、予防または治療における使用のための有効な特許保護を獲得し、維持する能力があるかどうかにある程度依存し、第三者の挑戦の下でこれらの技術の特許権を守ることに成功するだろう。米国の特許出願は、発表または発行前に秘密であり、科学または特許文献で発見された発表は、実際の発見に遅れていることが多いため、我々またはPreageが、上述した未解決の特許出願または発行特許がカバーされた発明を最初に行った会社であるか、またはそのような発明のために最初に特許出願を提出した会社であることを決定することはできない。さらに、バイオテクノロジーおよび製薬特許によって許容される特許請求の範囲の広さまたはその実行可能性は予測できない。私たちはどんな特許が発行されたら、私たちは潜在的な競争製品の影響から十分に保護されるだろうと確信できない。さらに、特許が発表されると、それらが私たちに商業的価値を持っているかどうか、あるいは競争相手を含む個人が私たちの特許に挑戦したり、アメリカや海外での私たちの特許地位を迂回したりすることに成功しないかどうかを決定することはできません。
ビジネスリスク
当社の従業員、独立請負業者、コンサルタント、商業パートナー、主任調査員、または CRO は、規制基準および要件の不遵守を含む不正行為またはその他の不適切な活動に従事し、当社の事業に重大な悪影響を及ぼす可能性があります。
私たちは従業員詐欺や他の不適切な行為の危険に直面している。従業員、独立請負業者、コンサルタント、商業パートナー、製造業者、調査者、またはCROの不正行為は、故意、無謀、不注意、またはFDA法規を遵守できなかったこと、適用された詐欺および乱用法律の遵守、FDAへの正確な情報の提供、連邦計画を正確に計算するために必要な価格設定情報、連邦調達規則または契約条項を遵守すること、財務情報またはデータを正確に報告すること、または許可されていない活動を開示することを含むことができる。このような不正行為はまた臨床試験過程で得られた情報の不適切な使用或いは虚偽陳述に関連する可能性があり、これは規制制裁と著者らの名声に深刻な損害を与える可能性がある。このような不正行為を常に識別し、阻止できるわけではなく、私たちがそのような活動を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、またはそのような法律や法規に準拠していないことによる政府の調査または他の行動または訴訟から私たちを保護することができないかもしれない。また、告発者は、政府がクレームに価値がないと考えて介入を拒否しても、このようなクレームに対する弁護費用を招くことを要求する可能性がある虚偽クレーム法案(FCA)を提起する可能性がある。また,FCA事件の判決は連邦衛生計画や政府契約から除外されるリスクを招く可能性があるため,通報者事件は巨額の和解を招くことが多い。もし私たちにこのような行動を提起し、私たちが自分の権利を弁護したり、維持することに成功しなかった場合、これらの行動は、巨額の罰金や他の制裁を加えることを含む、私たちの業務、財務状況、および運営結果に大きな影響を及ぼすかもしれない。
もしシステムが故障したら、私たちの業務と運営は影響を受けるだろう。
我々の内部コンピュータシステムおよび私たちのCROおよび他の請負業者およびコンサルタントのコンピュータシステムは、コンピュータウイルス、不正アクセス、自然災害、テロ、戦争、および電気通信および電気故障の破壊を受けやすい。このような事件が発生して我々の運営が中断されれば,我々の候補薬物開発が実質的に中断される可能性があり,これらの候補薬物が承認された商業化計画であれば。例えば、完成した、進行中、あるいは計画中の臨床試験における臨床試験データの損失は、私たちの監督管理の承認作業を遅延させ、データを回復または複製するコストを著しく増加させる可能性がある。もしどんな中断やセキュリティホールが私たちのデータやアプリケーションを紛失したり破損させたり、個人、機密、または独自の情報を適切に開示しない場合、私たちは責任と規制法執行行動を招く可能性があり、私たちの任意の候補薬物のさらなる開発が延期される可能性がある。
主要な従業員を維持し引き付けることができなければ、当社の取り組みは深刻に損なわれます。
当社の成功は、経営陣、開発、科学者の継続的な貢献にかかっています。このような人材については、競争に直面しており、研究開発に関連するタイミングやリスク、利用可能および予想される現金資源、株価の変動など、当社の事業に関連するリスクや不確実性が、主要人材およびその他の人材の採用および維持能力に影響を与える可能性があると考えています。最高経営責任者代行、最高財務責任者その他の主要従業員の業務喪失は、当社の事業および追加資本の創出または調達能力に悪影響を及ぼす可能性があります。
25
マイナスの米国および世界の経済情勢は、金融市場や協力者からの資金調達に依存する当社の事業戦略に課題をもたらす可能性があります。
金融市場を含む米国または世界経済におけるマイナスの状況は、当社の事業および現在および将来のベンダー、ライセンシーおよび協力者、および当社が事業を行っているまたは行う可能性のある他者の事業に悪影響を及ぼす可能性があります。これらの状態の持続期間と重症度は不確実です。悪景気が発生した場合、医薬品開発事業で前向きな成果が得られたとしても、事業を維持するための資金調達や、社内事業を推進するための適切な協力者を見つけることができなくなる可能性があります。
上場企業に関する法律、規則および規制は、コストがかかり、取締役および執行役員を引き付け、維持する能力に影響を及ぼす可能性があります。
SEC やナスダックが採択した規則を含む上場企業に影響を与える法規制は、当社にコストが増加する可能性があります。これらの法律、規則および規制により、取締役責任保険を含む特定の種類の保険の取得がより困難またはコストがかかる可能性があります。また、当社は、保険限度額および適用範囲の引き下げを受けることを余儀なくされる場合、または同じまたは類似の適用範囲を取得するために実質的に高いコストが発生する可能性があります。また、これらのイベントの影響により、取締役会、取締役会委員会、執行役員として勤務する適格な人材を引き付け、維持することがより困難になる可能性があります。これらの法律、規則および規制に対応するために発生する可能性のある追加費用の金額または時期を正確に見積もることはできません。
セキュリティ侵害やプライバシーの問題は、当社の情報が侵害され、当社の事業や評判が損なわれ、責任にさらされる可能性があります。
私たちの通常の業務プロセスでは、知的財産権、当社の独自の業務情報およびサプライヤーの情報、ならびに臨床試験参加者および従業員の個人識別情報を含む敏感なデータを収集して保存します。同様に、私たちの第三者提供者たちは私たちのいくつかの保護された敏感な健康データを持っている。このような情報の安全維持は私たちの運営と業務戦略に必須的だ。私たちは合理的なセキュリティ措置を取っているにもかかわらず、私たちの情報技術やインフラはネットワーク攻撃を受けやすく、あるいは従業員のミス、汚職、その他の中断によって破られやすいかもしれない。ネットワーク攻撃や他のセキュリティイベントの頻度,持続性,複雑性,強度は増加しており,広範な動機や専門知識を持つ複雑で組織的な団体や個人によって実施されている.我々は、これらのイベントの発生を防止するためのシステムおよび制御を開発し、維持しているにもかかわらず、脅威を識別し、緩和するプロセスもあるが、これらのシステム、制御、およびプロセスの開発および保守はコストが高く、技術変化およびセキュリティ対策を克服する努力がより複雑になり、監視および更新を継続する必要があり、このようなシステム、制御、およびプロセスは、違反や他のイベントの防止に成功できない可能性がある。このようなセキュリティイベントは、私たちのネットワークを危険にさらす可能性があり、そこに格納されている情報がアクセス、公開、暗号化、紛失、または盗まれる可能性があります。私たちは情報システムやネットワークを修復したり交換したりするために多くの資金と他の資源が必要かもしれない。さらに、私たちの責任保険は、セキュリティホール、ネットワーク攻撃、および他の関連セキュリティイベントに関連するクレームをカバーするのに十分ではない可能性があります。
プライバシーやデータ保護の立法や規制環境が発展し続けており,プライバシーやデータ保護問題がますます注目されており,1996年の“健康保険携帯性·責任法”の遵守や安全違反通知を要求する州法など,我々の業務に影響を与える可能性がある.欧州連合個人個人健康データの収集と使用も厳しいデータ保護法によって管理されている。既存の法律を除いて、2018年5月25日以来、“一般データ保護条例”(GDPR)はEUデータに義務を課し、データ保護規則違反行為に巨額の罰金を科している。GDPRは個人データの処理における私たちの責任と潜在的な責任を増加させ、GDPRと関連するEUデータ保護ルールを遵守するための追加的なメカニズムを実施することが求められている。法執行の不確実性とGDPRコンプライアンスの確保に関連するコストは非常に重く、私たちの業務、経営業績、将来性、財務状況に悪影響を及ぼす可能性がある。
我々は、欧州経済地域(EEA)加盟国またはイギリス住民の個人データの移転に関する法的問題を評価し続けている。欧州委員会は十分ではないアメリカや他の管轄区域だと思っている。その他の措置では、我々は、2021年に欧州委員会が発行する新しい標準契約条項を実施しています。データ輸出業者やデータ輸入業者がこれらの標準契約条項をどのように実行するか、欧州裁判所が最終的にこれらの条項が十分だと思うかどうかはまだわからない。アメリカ薬は事態の発展を観察し、適切なデータ転送機序に同意する。標準的な契約条項に加えて、適切かつ必要な場合には、EUから米国へのデータストリームを保護するために、患者の個人的な内容に依存することができます。現在、ヨーロッパ経済圏から個人データを移転する合法化解決策は、挑戦されたり、十分ではないと考えられている可能性があります。他の影響に加えて、増加したコンプライアンス負担に関連する追加コストを経験する可能性があり、私たちと私たちの顧客はヨーロッパ経済地域やイギリスの規制機関のリスクに直面する可能性があります。異なる基準をヨーロッパ経済区/イギリスからの個人資料の移転に適用した。欧州経済地域またはイギリスからのあるデータストリームのための特別なチェックを阻止または要求する。私たちはまた、私たちがデータを処理するのを助けるために、第三者と新しい契約交渉を要求されるかもしれない。私たちは不本意な場合や拒否することがあるかもしれない
26
欧州の臨床試験サイトおよび CRO が当社製品を使用する場合、 EEA または英国の個人データの処理について更なる変更が必要または望ましい場合がある場合があります。データ主体だ
また、カリフォルニアには、消費者のためのプライバシー権(法律で広く定義されている)を創造し、消費者または家庭の個人データを処理するエンティティにより多くのプライバシーおよびセキュリティ義務を課す“カリフォルニア消費者プライバシー法”(CCPA)がある。CCPAは私たちの業務活動に重大な影響を与える可能性があり、巨額のコンプライアンスコストの支払いを要求し、それによって業務、経営業績、将来性と財務状況に不利な影響を与える。カリフォルニア州プライバシー権法案(CPRA)が許可したCCPA改正案には、2023年1月1日から追加のプライバシー要件が適用される。同様に,バージニア州,ユタ州,コネチカット州,コロラド州などの他州の全面州消費者プライバシー法も2023年に施行される。これらの新しい州プライバシー措置は、他の州立法機関がより全面的なプライバシー法を制定し始めたことを反映しているかもしれない。これは、米国での業務のためにより複雑なプライバシー規制構造を作ることになる。また、連邦レベルのプライバシー立法と規則制定作業は、米国でのプライバシー義務を増加させる可能性がある。
したがって、パートナーまたは第三者プロバイダーにおける当社のデータの侵害を含む情報へのアクセス、開示またはその他の損失、および世界中で存在し、増加しているプライバシー法の違反は、個人情報のプライバシーを保護する法律に基づく法的請求または訴訟および責任をもたらし、当社の業務を混乱させ、当社の評判を損なう可能性があり、当社のビジネスに悪影響を及ぼす可能性があります。
もし私たちが環境、健康、安全の法律法規を守らなければ、罰金や処罰を受けたり、私たちの業務を損なう可能性のあるコストが発生するかもしれません。
当社は、実験室の手順、有害物質および廃棄物の取扱い、使用、保管、処理および廃棄物を管理するものを含む、多くの環境、健康および安全法規制の対象としています。当社の業務は、随時および将来的に、化学物質や生物材料を含む有害 · 可燃性物質の使用を含み、有害廃棄物を生成する可能性があります。これらの材料や廃棄物の処理を第三者と契約したとしても、これらの材料に起因する汚染や怪我のリスクを完全に排除することはできません。当社の有害物質の使用または廃棄に起因する汚染または傷害が発生した場合、当社は結果として生じる損害について責任を負う可能性があり、その責任は当社の資源を超えることがあります。また、かかる法律や規制を遵守しなかった場合、民事または刑事罰金および罰金に関連する多額のコストが発生する可能性があります。
当社は、有害物質の使用によって従業員が傷害した際に発生する費用や経費をカバーするために、労働者補償保険を維持していますが、この保険は潜在的な責任に対する適切な補償を提供していない場合があります。ただし、当社は、当社に対して主張される可能性のある環境責任または有毒不法行為の請求に対する保険を維持しません。
また、現在または未来の環境、健康、安全法律法規を遵守するためには、巨額のコストが生じる可能性がある。現在または未来の環境法律法規は私たちの研究、開発、または生産努力を損なうかもしれない。しかも、このような法律法規を遵守しないことは巨額の罰金、処罰、または他の制裁につながる可能性がある。
私たちまたは私たちが依存している第三者は自然災害の悪影響を受ける可能性があり、私たちの業務の連続性と災害復旧計画は深刻な災害から私たちを十分に保護できないかもしれません。
私たちがコントロールできない事件は、自然災害と突発的な公衆衛生事件を含めて、私たちの運営を深刻に混乱させ、私たちの業務、運営業績、将来性、あるいは財務状況に重大な悪影響を及ぼす可能性があります。自然災害や新冠肺炎などの突発的な公衆衛生事件、停電、または他の事件が発生した場合、第三者施設のような私たちの重要なインフラを破損したり、他の方法で運営や旅行を中断したりすることを含む臨床試験を阻止することは、困難かもしれませんし、場合によっては、長い間私たちの業務を継続することはできません。深刻な災害や同様の事件が発生した場合、我々の既存の災害復旧および業務連続計画は十分ではないことが証明される可能性がある。私たちの災害復旧と業務連続計画の限られた性質のため、私たちは大量の費用を発生する可能性があり、これは私たちの業務、運営業績、将来性、あるいは財務状況に重大な悪影響を及ぼす可能性があります。
営業損失の控除可能性の制限は、事業および財務状況に悪影響を及ぼす可能性があります。
営業赤字の経歴があります。2017 年 12 月、米国政府は、減税雇用法 ( 税法 ) と呼ばれる包括的な税制法を制定しました。税法は、純営業損失の控除を当年度課税所得の 80% に制限しています。営業損失控除の制限、その他の税務方針の変更により、追加課税の対象となり、業績や財務状況に悪影響を及ぼす可能性があります。
証券市場および株式投資に関するリスク
現在、資本市場の混乱と経済の不確実性の中で事業を展開しています。
米国の資本市場 現在、世界的な COVID—19 の流行、高インフレと政府対応、潜在的な景気後退、公表された地域銀行の破綻に伴う極端なボラティリティと混乱を経験しています。
27
セクター、ウクライナ戦争、来る米国大統領選挙、および他の世界的なイベント。過去の資本市場の混乱は、資本市場の一部に流動性の欠如をもたらしました。今後の市場の混乱および / または流動性の欠如は、当社の事業、財務状況、営業結果およびキャッシュフローに悪影響を及ぼすものと予想されます。また、不利な経済状況により、当社の資金調達コストが増加したり、資本市場へのアクセスが制限されたり、継続的な事業資金調達が必要になった場合に貸し手が信用を供給しないという決定が生じると予想されます。これらのイベントは資本投資の考慮事項を制限し、能力を制限し続ける可能性があります。さらなる臨床開発に資金を供給し、潜在的な戦略的代替案を特定し実施する能力を制限し、業績に重大な悪影響を及ぼします。
当社がナスダック · キャピタル · マーケットの上場継続基準を遵守しない場合、当社は上場廃止され、普通株式の価格、資本市場へのアクセス能力、財務状況に悪影響を及ぼす可能性があります。
私たちの普通株は現在ナスダックで発売されています。コードはMEIPです。ナスダック資本市場での私たちの普通株の上場を維持するためには、1株当たり1.00ドルの最低終値を維持することを含むいくつかの上場要求を満たさなければならない。私たちは引き続き戦略代替案を探索することに伴い、私たちは著者らの普通株の入札価格及び上場要求に符合するかどうかを積極的に監視するつもりである。もし私たちが継続上場の基準を遵守できず、ナスダック資本市場が私たちの証券取引所から撤退した場合、私たちと私たちの株主は、私たちの普通株の流動性と市場価格を下げること、私たちの普通株を保有または買収したい投資家の数が減少することを含む重大な負の結果に直面する可能性があり、これは私たちの株式融資能力にマイナス影響を与える可能性がある;私たちのニュースやアナリストの報告数の減少、そして私たちの将来のより多くの証券の発行やより多くの融資を得る能力を制限する。また、ナスダックからの退市は私たちの名声にマイナスの影響を与え、私たちの業務に影響を与える可能性がある。
当社の事業は、アンソン · アドバイザーズの今後の活動活動の結果として悪影響を受ける可能性があります。ケーブルカーキャピタル LLC やその他の活動家投資家です
アンソン · アドバイザーズ株式会社当社の発行済普通株式の約 16.4% を保有し、ケーブルカーキャピタル LLC は発行済普通株式の約 9.2% を保有しており、両社は事業運営および取締役会に影響を与えようとしており、今後もそうすることを期待しています。
2023 年 7 月、株式会社アンソン · アドバイザーズ。ケーブルカーキャピタル LLC は、当社の普通株式の発行済株式の過半数を少なくとも保有する株主の同意を得るために、とりわけ取締役会の全メンバーを解任および交代するための同意勧誘を開始しました。 当社は、 2023 年 9 月 18 日に、同意を取り消し、同意募集を拒否するよう株主に促す最終同意取り消し声明書を提出しました。
同意要請とその対応は、経営陣の大きな混乱と追加資本支出をもたらしました。株式会社アンソンアドバイザーの継続的追求または更なる活動。ケーブルカーキャピタル LLC 、またはその他の活動家株主によって、さらなる気晴らしとコストをもたらし、当社の事業または営業結果に重大な悪影響を及ぼす可能性があります。
当社の普通株式の取引価格は、非常に変動し、価値が下落する可能性があり、集団訴訟により多額のコストが発生する可能性があります。
当社の普通株式の取引価格は、以下のものを含むが、これらに限定されない当社のコントロールを超えた様々な要因に応じて非常に変動する可能性があります。
28
株式市場、特にバイオテクノロジーや生命科学会社の市場は、価格や出来高の大幅な変動を経験しており、これらの変動は、これらの市場で取引されている会社の経営業績に関係なく、あるいは比例しないことが多い。また、米国、ヨーロッパ、または世界経済状況の変化、特に現在の世界的な事件を背景に、収益成長を達成する能力に影響を与える可能性がある。不利な経済的変化は私たちがコントロールできず、私たちの業務や私たちの運営結果に実質的な悪影響を及ぼすかもしれない。これらの広範な市場と業界要素は、私たちの発展と経営業績にかかわらず、私たちの普通株の市場価格に重大な影響を与えるかもしれない。過去には、ある会社の証券市場価格が変動した後、同社に対して証券集団訴訟が提起されることが多かった。私たちにこのような訴訟を起こすと、巨額の費用が発生し、経営陣の注意力や資源を分散させる可能性があります。
当社の普通株式 ( 発行された普通株式を含む ) の将来の売却は、当社の普通株式の市場価格を下落させ、株主に対して希釈が生じる可能性があります。
私たち普通株の市場価格は、公開市場で私たちの普通株を大量に売却することによって低下する可能性があり、発行された株式証や株式オプションを行使する際、その後の任意のこのような株の売却を含む可能性がある。2024年6月30日まで、私たちは行使可能な発行された株式承認証があり、1株6.80ドルの使用価格で102,513株の普通株を購入することができ、これらの株式承認証は2027年10月私たちはまた1,357,213株の普通株を購入する未償還オプションを持っている それは.私たちは将来的に1つ以上の追加株式取引を通じて追加資本を求めるかもしれないが、そのような取引は市場条件の影響を受け、どのような取引も完了する保証はないだろう。もし私たちが未来に株を売却すれば、私たちがこれらの未来の株を売る価格は違い、これらの違いは大きいかもしれない。これらの未来株を以前の株主投資価格よりはるかに低い価格で売却すれば、株主は深刻な希釈を経験するだろう。
下記に記載されている場合または戦略的取引に関連する場合を除き、当社は普通株式に対する現金配当を支払うつもりはなく、支払っていません。当社の株主は、当社の普通株式の価値が上昇して株式を売却しない限り、株式のリターンを受けることはできません。
キャピタルリターン以外、 w当社は、普通株式に対する現金配当を支払ったり宣言したりすることはなく、将来の収益を事業の発展と拡大に充当するために保持する予定です。当社は、戦略的取引に関連するもの以外は、当社の普通株式に対する現金配当を当面の将来に支払う見通しはありません。そのため、配当を必要とする戦略的取引が成功したり、普通株式の価値が上昇して株式を売却したりしない限り、株主は投資収益を得ることはできません。
当社は、未払いのワラントおよびオプションの行使による純収益の使用について幅広い裁量権を有します。
当社は、発行中のワラント及びオプションの行使において、当社への純収益の使用について幅広い裁量権を有し、当社の株式投資家は、これらの収益の適用について取締役会及び経営陣の判断に依存します。当社は、ワラントおよびオプションの行使による純利益のかなりの一部を、一般的な企業目的および臨床試験プログラムの進行に使用する予定ですが、これらの純利益を特定の目的に配分していません。
当社は、普通株式の保有者に悪影響を及ぼす可能性のあるブランク小切手優先株を発行する権限を有しています。
当社の修正および改定された設立証明書により、当社は、普通株式の保有者による投票または行動なしに、普通株式よりも優先権を有する潜在的に優先株式をブランクチェック発行することができます。一種の優先株の発行により、当社普通株式の保有者に分配可能な利益および資産の量が減少したり、議決権を含む当該保有者の権利および権限に悪影響を及ぼす可能性があります。このような発行により、当社株式の市場価格を下落させたり、経営陣の変更が困難になる場合があります。
当社の改正および再開された設立証明書および第 6 回改正および再開された細則に含まれる買収防止条項、ならびにデラウェア州の法律の条項は、買収試みを損なう可能性があります。
当社の改正 · 再定式設立証明書及び第 6 回改正 · 再定式定款には、株主が最善の利益であると考える未承諾の買収提案を阻止する規定が含まれています。また、デラウェア州法に基づく買収防止条項の対象となり、経営陣の変更を遅らせまたは防止します。これらの規定を合わせると、経営者の解任が困難になり、当社の有価証券の市場価格に対するプレミアムを支払う可能性のある取引を妨げる可能性があります。これらの規定は以下の通り。
29
当社の第 6 修正および再定款は、法律で認められる最大限の範囲において、当社の名義で提起されたデリバティブ訴訟、当社の取締役、役員、その他の従業員または株主に対する信託義務違反の訴訟、およびその他の類似の訴訟をデラウェア州のチャンセリー裁判所にのみ提起することができ、デラウェア州外で提起された場合は、訴訟を起こした株主は、当該株主の弁護士による訴訟の送達に同意したものとみなされます。これは、当社の取締役、役員、その他の従業員または株主に対する訴訟を妨げる効果をもたらす可能性があります。
私たちの第六の改正及び再記載された会社定款規定は、私たちが書面で代替裁判所を選択することに同意しない限り、デラウェア州衡平裁判所は、法的に許容される最大範囲内で、(I)私たちを代表して提起された任意の派生訴訟又は訴訟を提起する株主となり、(Ii)私たちの任意の取締役役員又は他の従業員が、私たち又は私たちの株主の信頼された責任に対するクレームに違反する任意の訴訟、(Iii)デラウェア州汎用会社法の任意の規定に基づいてクレームを提起する任意の訴訟を提起する。又は(Iv)内部事務原則によって管轄されるクレームを主張するいかなる訴訟も、デラウェア州以外で提起された場合、訴訟を提起した株主は、当該株主の弁護士に法的手続書類を送達することに同意したとみなされるが、各事件において、衡平裁判所に管轄権がない場合は、当該訴訟の審理場所は、デラウェア州内に位置する別の州裁判所であり、デラウェア州内に位置する州裁判所がない場合は、デラウェア州連邦地域裁判所でなければならず、すべての事件において、被告として指定された不可欠な当事者が管轄権を有する裁判所の管轄を受けなければならない。
当社の資本株式の持分を購入または取得または保有する人または団体は、これらの規定に通知し、同意したものとみなされます。
上記にかかわらず、第 6 回修正および再定された細則の裁判所選択規定は、連邦証券法によって生じる責任または義務または米国連邦地方裁判所が唯一かつ排他的裁判所となるその他の請求を執行するために提起された訴訟には適用されません。
このフォーラム規定の選択は、当社または当社の取締役、役員、その他の従業員または株主との紛争に有利であると判断する司法フォーラムに株主が請求を提起する能力を制限し、そのような請求に関する訴訟を妨げる可能性がある。また、裁判所が、当社の第 6 条改正および再定式細則に含まれるフォーラム条項の選択が訴訟において適用できないまたは執行できないと判断した場合、他の法域での訴訟の解決に関連する追加費用が発生し、当社の事業、業績および財務状況を損なう可能性があります。
当社の執行役員および取締役は、株式を売却することがあり、これらの売却は当社の株価に悪影響を及ぼす可能性があります。
当社の執行役員および取締役による当社の株式の売却、またはそのような売却が行われる可能性があるとの認識は、当社の普通株式の市場価格を下落させたり、 1934 年証券取引法 ( 改正 ) の規則 10 b 5 — 1 に基づく取引計画の一部または外部として、将来の株式の売却による資金を調達することが困難になる可能性があります。
項目1 B。未解決従業員意見
ない。
プロジェクト1 C。ネットワーク·セキュリティ
当社は、事業の成功に対するサイバーセキュリティの重要性を認識するとともに、サイバーセキュリティリスクを継続的に評価し、急速かつ絶え間なく変化する環境に直面して対応を進化させる必要性を認識しています。したがって、既知および進化するサイバーセキュリティ脅威から事業、記録、情報を保護することを目指します。
リスクマネジメントと戦略
当社は、サイバーセキュリティ脅威による重大なリスクを評価、特定、管理するためのポリシーとプロセスを確立し、これらのプロセスをリスク管理システムおよびプロセス全体に統合しています。当社は、当社の情報システムまたはこれらのシステム内に存在する情報の機密性、完全性または可用性に悪影響を及ぼす可能性のある、当社の情報システム上または経由で発生する潜在的な不正な事件を含む、サイバーセキュリティ脅威による重大なリスクを定期的に評価します。
30
当社は、サイバーセキュリティの脅威を特定するための定期的なリスクアセスメントを実施するとともに、そのようなサイバーセキュリティの脅威に対して脆弱な情報システムに影響を及ぼす可能性のある事業慣行の重大な変更が生じた場合のアセスメントを実施します。これらのリスクアセスメントには、合理的に予見可能な内部および外部リスクの特定、そのようなリスクから生じる可能性および潜在的な損害、およびそのようなリスクを管理するための既存のポリシー、手順、システムおよびセーフガードが十分であることが含まれます。
これらのリスクアセスメントの後、当社は、特定されたリスクを最小限に抑えるために合理的なセーフガードを再設計、実施、維持し、既存のセーフガードにおける特定されたギャップに合理的に対処し、セーフガードの有効性を定期的に監視します。サイバーセキュリティリスクの評価、モニタリング、管理の主な責任は、最高経営責任者代理、最高財務責任者に報告し、リスク評価と緩和プロセスを管理する情報技術担当バイスプレジデントにあります。
リスク管理システム全体の一環として、情報技術部門と協力して、セーフガードを監視 · テストし、これらのセーフガードに関する従業員のトレーニングを行っています。トレーニングや社内コミュニケーションを通じて、あらゆるレベルや部門のスタッフがサイバーセキュリティポリシーを認識しています。
必要に応じて、リスクアセスメントプロセスに関連してコンサルタントやその他の第三者を雇用します。これらのサービスプロバイダーは、適切な場合には、当社の重要なシステム、情報、製品、サービス、および当社のより広範なエンタープライズ IT 環境に対する重大なサイバーセキュリティリスクを特定するために、当社のセキュリティ管理の評価、テスト、またはその他の側面を支援するとともに、当社のサイバーセキュリティポリシーおよび手順の設計および実施を支援します。
当社の事業や財務状況を著しく損なうサイバーセキュリティの課題は発生していません。サイバーセキュリティの脅威によるリスクに関する詳細については、フォーム 10—k の年次報告書の項目 1A 「リスク要因」を参照してください。
サイバーセキュリティ·ガバナンス
取締役会は、サイバーセキュリティリスクをリスク監視機能の一部として捉え、サイバーセキュリティおよびその他の情報技術リスクの監視を監査委員会に委任しています。監査委員会は、経営陣によるサイバーセキュリティリスク管理プログラムの実施を監督し、戦略的リスクエクスポージャーのモニタリングと評価を担当します。一方、経営陣は、当社が直面する重大なリスクに関する日々の業務を担当します。最高経営責任者代行、最高財務責任者、情報技術担当バイスプレジデントを含む経営陣は、最近のサイバーセキュリティインシデントおよび関連対応を含むサイバーセキュリティリスクおよび活動について、監査委員会に定期的にブリーフィングを行っています。
監査委員会は、サイバーセキュリティリスクに関する経営陣からの年次報告を受けます。また、重要なサイバーセキュリティインシデントや影響力の低いインシデントについては、必要に応じて監査委員会に最新情報を提供します。
監査委員会は、サイバーセキュリティ関連を含む監査委員会の活動について取締役会全体に報告します。また、取締役会全体では、取締役会および経営陣の裁量により、サイバーリスク管理プログラムに関する経営陣からのブリーフィングも行われます。取締役会は、上場企業に影響を与えるトピックに関する取締役会の継続教育の一環として、外部専門家からサイバーセキュリティトピックに関するプレゼンテーションを受けることができます。
当社の最高経営責任者代行、 CFO 、情報技術担当バイスプレジデントは、サイバーセキュリティの脅威による重大なリスクを評価し管理する責任を有し、公開企業環境における情報技術機能を含むオペレーションを監督する数十年の経験を有しています。このチームは、サイバーセキュリティリスク管理プログラム全体の主な責任を持ち、必要に応じて外部サイバーセキュリティコンサルタントを監督します。
当社のマネジメントチームは、当社が雇用した外部コンサルタントからのブリーフィング、政府、公的または民間のソースから得られた脅威インテリジェンスおよびその他の情報、 IT 環境に展開されたセキュリティツールによって生成されたアラートおよびレポートなど、さまざまな手段を通じて、サイバーセキュリティリスクおよびインシデントの防止、検出、緩和、修復のためのサイバーセキュリティリスク管理の取り組みを監督します。サイバーセキュリティリスク管理プログラムには、現在および新興のサイバーセキュリティ脅威を防止、検出、分析するためのツールと活動、脅威やインシデントに対処するための計画と戦略も含まれます。
項目2.財産
当社は、カリフォルニア州サンディエゴに約 45,100 平方フィートのオフィススペースを 2024 年 9 月 30 日に満了するリースで占めています。
項目3.法的訴訟
当社は、現在、当社の事業または財務状況に重大な悪影響を及ぼすと思われる重大な法的手続の当事者ではありません。
31
プロジェクト4.鉱山安全情報開示
該当しない。
パート II
項目 5 。登記者の普通株式市場、関連株主事項及び株式証券の発行者購入
当社の普通株式は、 Nasdaq Capital Market に MEIP の記号で上場しています。
所持者
2024 年 9 月 13 日現在、発行済普通株式 6,66 2,857 株、普通株式保有者 321 社が存在しています。この数字は株主記録から得られたものであり、各種ディーラー、清算代理店、銀行、ブローカーその他の受託者の名義で株式を保有する普通株式の実質所有者は含まれていません。
当社の普通株式の発行済ワラントその他の行使可能または転換可能な有価証券については 注 10 株主資本 そして 注 11 株式報酬 アンダ 第 8 号連結財務諸表及び補足資料 本年度報告で。
配当をする
2023 年 11 月 6 日、取締役会は、協力協定に基づき、 2023 年 11 月 17 日の営業終了時に記録株主に対して普通株 1 株当たり 1.75 ドルの特別現金配当を宣言しました。配当総額 1170 万ドルは、 2023 年 12 月 6 日に支払われ、当社は留保利益ではなく累積赤字であるため、連結株主資本計算書において追加資本金の削減として計上されました。当社は、戦略的取引に必要な場合を除き、当面の将来において追加的な現金配当を支払う見通しではなく、現在、利用可能なすべての資金と将来の利益 ( もしあれば ) を事業支援のために保持する予定です。当社の配当方針に関する将来の決定は、取締役会の裁量によって行われます。
株式補償計画に基づいて発行された証券
以下の表は、 2024 年 6 月 30 日現在、株主承認済株式報酬計画および株主承認済未株式報酬計画の情報を示しています。
計画種別 |
|
証券数量 |
|
|
加重平均 |
|
|
証券数量 |
|
|||
セキュリティが承認した株式報酬計画 |
|
|
1,270,950 |
|
|
$ |
32.50 |
|
|
|
465,633 |
|
株式補償計画がセキュリティで承認されていない |
|
|
86,263 |
|
|
|
18.25 |
|
|
|
130,737 |
|
総額 |
|
|
1,357,213 |
|
|
$ |
31.60 |
|
|
|
596,370 |
|
32
項目 6 。【予約】
第7項:経営陣の財務状況と経営成果の検討と分析。
以下の議論と分析は、 項目 8 。連結財務諸表及び補足データ 本年次報告書に記載されています。営業結果は、必ずしも将来発生する可能性のある結果を示すものではありません。
この議論と分析には、多くのリスク、不確実性および仮定を含む将来の見通しに関する記述が含まれています。実際の業績は、「将来見通しに関する記述およびリスク要因に関する注意事項」に記載されているものを含むがこれらに限定されない多くの要因の結果として、将来見通しに関する記述で予想されるものと大きく異なる可能性があります。 第1 A項。リスク要因 この年次報告書に記載されています。本年次報告書に含まれるすべての将来の見通しに関する記述は、当社が本年次報告書を提出する時点で入手可能な情報に基づいており、法律で要求される場合を除き、当社は将来の見通しに関する記述を公表または修正する義務を負いません。
概要
株式会社 MEI ファーマNasdaq : MEIP は、 創新的で差別化されたがん治療法を開発してきた製薬会社です弊社は 有望ながん剤を取得し、臨床開発、戦略的パートナーシップ、適切な場合のアウトライセンスまたは商業化を通じてプログラムの価値を創造することによってパイプラインを構築しました。 当社の腫瘍医薬品開発へのアプローチは、既知の耐性メカニズムを克服し、患者の利益の向上を提供するための明確な医療ニーズに対応するために、標準治療と組み合わせた医薬品候補を評価することです。
臨床開発プログラム
当社の薬剤候補パイプラインには、経口サイクリン依存性キナーゼ 9 ( CDK 9 ) 阻害剤であるビタシクリブと、酸化性リン酸化経路を標的とする静脈内小分子ミトコンドリア阻害剤である ME 344 が含まれています。
事業の詳細については、本年次報告書のセクションをご覧ください。 プロジェクト1.ビジネス上です。
最新の発展動向
戦略的代替案評価の通知
2024年7月22日、取締役会は、潜在的な取引および秩序的な業務終了を含む、我々の戦略的選択の評価を開始することを決定し、適切であれば、私たちの資産が株主のために価値を最大化することを決定したと発表した。我々は2024年8月1日から兵力削減を開始し、我々の行動と戦略方向の変化に伴い、この行動は段階的に行われる。われわれはすでにヴォルシリの臨床開発を中止しているが,梅の候補薬物資産に関連するいくつかの非臨床活動は継続して行われる。戦略選択審査の一部として、既存計画のアウトソーシング許可機会やM&A機会などの選択肢が考えられる可能性がある。私たちが現金を保存しようとしている意図と一致して、私たちのCEO兼最高経営責任者David·M·ウルソと私たちの最高医療官リチャード·ガリ医学博士は2024年8月1日に辞任した。エルソーもその日取締役会を離れた。我々は、ウルソさんとガリ博士との諮問協定を締結しており、協定に基づき、彼らは引き続き私たちの戦略的努力を支援していきます。取締役会長のチャールズ·V·バルト海3世も2024年7月22日に取締役会を辞任することを発表した。我々の取締役会はすでに現最高財務官ジャスティン·J·フィルを最高経営責任者に任命し、フレデリック·W·ドリスコールを取締役会長に任命している。
協力 協定
当社は、 2023 年 10 月 31 日に、アンソン · ファンド · マネジメント LP 及びケーブルカー · キャピタル LLC ( それぞれアンソン及びケーブルカー ) との協力契約 ( 以下、協力契約 ) を締結しました。この協力契約は、その他の非財務関連事項の中でも、下記に記載されるように、普通株式 1 株当たり 1.75 ドルの配当を形式とした株主への資本還元を規定しています。さらに、協力協定では、現在進行中の ME—344 フェーズ 10 億試験が特定の定義されたエンドポイントを満たすことができない場合、または理事会が第 2 コホートを進めないことを決定した場合、理事会が承認した場合、 933 万米ドルを超えない潜在的な第 2 回資本還元 ( 第 2 回資本還元 ) を想定していました。
2024 年 4 月、取締役会は、資源の節約と戦略的投資の調整を図り、事業の走行路線を拡大するため、協力協定に基づく第 2 回資本返還の可能性を全会一致で進めないことを決定しました。
協力協定の一環として、アンソンとケーブルカーは同意要請を取り下げ、慣習的な停止条項を遵守することに合意した。さらに、アンソンとケーブルカーのエンゲージメントに関連する手数料および費用を補償しました。
33
2024 年 6 月 30 日を末日とする会計年度連結営業決算書に一般経費および管理経費に計上される 110 万ドルを協力協定締結日時点で当社との間で締結しました。
現金配当
2023 年 11 月 6 日、取締役会は、協力協定に基づき、 2023 年 11 月 17 日の営業終了時に記録株主に対して普通株 1 株当たり 1.75 ドルの特別現金配当を宣言しました。配当総額 1170 万ドルは、 2023 年 12 月 6 日に支払われ、当社は留保利益ではなく累積赤字であるため、連結株主資本計算書において追加資本金の削減として計上されました。
株式取引
棚登録表
当社は、下記に記載されている「ベビーシェルフ制限」の対象となる通常株式、優先株式、ワラント権利およびユニットを随時 1 億円まで売却することを許可する棚卸登録ステートメント ( 2024 年 2 月棚卸登録ステートメント ) を有しています。2024 年 2 月シェルフ登録ステートメントは 2024 年 2 月 20 日に提出され、 2024 年 2 月 28 日に発効すると宣言された。
市場での株式提供
2024 年 2 月 20 日、 Jones Trading Institutional Services LLC と資本オンデマンド販売契約を締結しました。これにより、合計募集価格が最大 2500 万ドル ( ATM プログラム ) の株式を発売および販売することができます。当社は、本登録ステートメントに登録された有価証券を、公募本額の 7500 万ドル未満 ( ベビーシェルフ制限 ) のままである限り、 12 ヶ月間の公募本額の 3 分の 1 を超える有価証券を、いかなる場合においても初回公募において売却しません。2024 年 1 月 2 日 ( 証券取引委員会の適用規則の下で公募開始時の当社の公開フロートの決定に使用された日 ) の時点で、当社の公開フロートの 3 分の 1 は約 990 万ドルに相当しています。2024 年 6 月 30 日現在、当社の ATm プログラムに基づく株式の発行 · 売却は行っていません。
権利協定
当社取締役会は、 2023 年 10 月 1 日、当社と Computershare, Inc. との権利契約 ( 権利契約 ) を承認 · 採択しました。権利代理人として ( 権利契約で定義されている ) 。権利契約に基づき、取締役会は、当社の普通株式の発行済株当たり、額面金額 0.00000002 ドル ( それぞれ、普通株式、総称して、普通株式 ) の優先株式購入権 ( それぞれ、権利 ) 1 株の配当を宣言しました。権利は、 2023 年 10 月 12 日の営業終了時点で記録株主に分配されます。また、 2023 年 10 月 12 日以降に発行された各普通株式とともに、 1 つの権利が発行されますが、配分日 ( 権利契約に定義されるもの ) 前 ( または権利の償還または満了の早い日 ) 、および特定の状況では配分日以降です。
株式承認証
2023 年 5 月に、当社普通株式 802,949 株の買取令状の発行が満了しました。ワラントは 1 株当たり 50.80 ドルで完全に付与され、行使可能でした。ワラントの条件により、当社の買収の場合には、ワラントを現金で決済する必要があったため、満了前に公正価値で計量し、連結貸借対照表に負債として計上する必要がありました。2022 年 6 月 30 日現在、ワラントの価値は 160 万ドルであった。満了前に、ワラントは 2022 年 12 月 31 日時点で 0 ドルに再評価されました。適正価値の変動は、連結営業計算書にその他の利益 ( 費用 ) の構成要素として計上されています。2023 年 5 月に失効した。
2024 年 6 月 30 日現在、当社普通株式 102,513 株の購入令状を発行しており、これらはすべて 2023 年度に Torreya Partners LLC に発行されています。ワラントは完全付与され、 1 株当たり 6.80 ドルで行使可能であり、 2027 年 10 月に失効します。2024 年 6 月 30 日と 2023 年の間には令状が行使されなかった。
肝心な会計見積もり
重要な会計方針は、当社の財務状況と事業の結果を表現する上で最も重要であり、経営陣の困難で主観的または複雑な判断を必要とし、しばしば本質的に不確実であり、その後の期間に変化する可能性がある事項の効果について推定する必要性の結果です。特定の会計見積もりは、財務諸表に対する重要性と、見積もりに影響を与える将来の事象が経営陣の現在の判断と大きく異なる可能性があるため、特に敏感です。以下の重要な会計方針は、連結財務諸表の作成に使用される最も重要な見積もりおよび判断を含んでいると考えています。
以下に記載されている場合を除き、以下に記載された重要な会計見積もりや、以下に記載された重要な会計方針から重大な変更はありません。 付記2.主要会計政策の概要.
34
長期資産 ( 財産 · 設備、無形資産 ) の減損
権威的な長期資産減値や処置指針に基づいて、事件や環境変化が帳簿額面が回収できない可能性があることを示す証拠がある場合、吾らは会計基準編纂(ASC)第360テーマに基づいて、物件、工場および設備(ASC 360)が長期資産(物件、設備および使用権資産を含む)の潜在的減値を評価する。1つの資産(または1組の資産)が予想される未割引キャッシュフローがその資産の帳簿価値よりも少ない場合、減価損失を確認する。いずれの必要な減価損失も、資産の帳簿価値がその公正価値を超えた金額で計量され、関連資産の帳簿価値減値に計上され、運営実績に計上される。私たちの長期資産、未来の価値、および残存利用可能な寿命を評価する際に使用される仮定および推定は複雑であり、しばしば主観的である。それらは各種の要素の影響を受ける可能性があり、業界と経済傾向などの外部要素、及び著者らの業務戦略、内部予測と臨床試験結果の変化などの内部要素を含む。例えば、私たちの時価が低下し続け、私たちの企業の公正な価値が減少していることを示すと決定された場合、私たちが買収した有限寿命の技術無形資産のために将来の減価費用を記録する必要があるかもしれない。
減価償却費は、将来の純利益を大幅に減少させ、バランスシート上の資産価値を下げる可能性があります。主な仮定には、将来のキャッシュ · フロー、営業利益率、設備投資、ターミナル成長率、割引率が含まれますが、これらに限定されません。また、分析の一部として時価総額も考慮しています。2024 年 6 月 30 日に終了した会計年度において、長期資産減損費用は 1 億 990 万ドルを計上しました。2023 年 6 月 30 日に終了した会計年度においては、同様の費用はありませんでした。無形資産および関連減損の詳細は 注 3 — バランスシート詳細 そして 注 9 — リース連結財務諸表および関連注釈に記載されています。
収益
当社は、 ASC トピック 606 「顧客との契約からの収益」 ( ASC 606 ) の範囲内で、 5 段階の収益認識モデルを適用しています。このモデルでは、我々は( i ) 契約を特定し、 ( ii ) 契約における履行義務を特定し、 ( iii ) 取引価格を決定し、 ( iv ) 契約における履行義務に取引価格を配分し、 ( v ) 会社が履行義務を履行した場合またはその際に収益を認識する。履行義務は、明確な商品またはサービスを譲渡する契約上の約束であり、 ASC 60 6 の会計単位です。契約の取引価格は、相対的な独立販売価格に基づいて、各別個の履行義務に配分され、適用される履行義務が満たされたときに収益として認識されます。
私たちが手配した条項には、前払いおよび許可料、研究開発サービス、マイルストーンおよびその他の支払い、決定された目標およびいくつかの臨床前、臨床、監督、および販売に基づく活動、および商業化製品販売のための特許権使用料が含まれている。このような合意の下での義務が履行されるまで、収入確認を今後一定期間延期する必要があるかもしれない。私たちは最も可能な金額法を使用して、イベントのマイルストーンと他の支払いまたは支払いに基づく可変対価格を推定する。このようなイベントが発生する高度な不確実性を考慮して、イベントに基づくマイルストーンおよび他の支払いまたは支払いは、これらの支払いに関連する任意の不確実性が解決されるまで十分に制限されてきた。販売に基づくマイルストーン及び特許権使用料支払いの収入は、販売発生又は関連履行義務が履行された又は部分的に履行された遅い時間に確認される。意外な状況が解決され、他の状況が変化するにつれて、各報告期間内に取引価格を再評価していきます。
収益認識は、必要とされる可変の対価見積もりにより不確実性があります。これらの見積もりには、研究開発サービスの取り決めの下での義務を果たすために必要な努力のレベルが含まれます。これらの金額は、サービス取り決めの開始時に推定され、各報告期間で再評価されます。これを実現するために、経営陣の経験、関連する社内データレポート、および規制当局の承認に頼っています。記録された変数の考慮は、計算に使用される経営陣による推定入力に直接感応します。推計値の変更は将来的に計上されます。
2023 年 6 月 30 日を末日とする会計年度における KKC とのナゲレシブ開発の中止に対応して、各業績義務を完了するための見積もりを更新しました。その結果、これまでに発生した見積もりの総費用の比率と、それに応じて繰延収益の減少に基づいて、完了に向けた進捗が向上しました。また、未開始および今後開始されない業績義務に対する払い戻し不可の支払いに関する収益を認識しました。2024 年度において、 KKC 商業化協定について、 繰延収益は全て認識され すべての復旧作業が完了しました
研究開発コスト
研究開発費用は、研究、臨床試験の実施、医薬品の開発 · 製造のために第三者契約者に支払われる費用を含みます。第三者契約者との関連費用を含む臨床試験費用は、研究開発費用の重要な構成要素であり、研究開発費用は、実施された作業に基づいて支出されます。経費額を決定する際には、契約構成要素の完了、被験者の登録、試験の完了、その他の事象に基づいて、経営陣は総費用の見積もりに依存しています。購入に関連して発生したコストまたは
35
初期段階の製品または商業的に実行可能で使用の準備ができていない製品、または代替的な将来の使用がない製品のプロセス中の研究開発のライセンスについては、発生した期間に費用が課金されます。
連結財務諸表の作成プロセスの一環として、ベンダー、臨床研究機関、コンサルタントとの契約上の義務、臨床試験の実施に関連する臨床施設契約に起因する費用の見積もりを求めています。これらの契約の財務条件は異なり、当該契約の下で資材またはサービスが提供される期間と一致しない支払フローが生じる可能性があります。
当社の目的は、臨床試験費用を、サービスの実施および努力の期間に計上することにより、連結財務諸表に適切な費用を反映することです。これらの費用は、患者の進行や試験の様々な側面のタイミングで測定した臨床試験の進捗状況に応じて計上します。経営陣は、財務モデルと、臨床試験の進捗状況について関係者および外部サービスプロバイダーとの協議を通じて、発生見積もりを決定します。
臨床試験では、実際の結果と推定値が異なる場合は、臨床費用の認識を調整します。各貸借対照表日時点での発生費用は、当時知られた事実 · 状況に基づいて見積もっています。当社の臨床試験の発生額は、 CRO やその他のサードパーティベンダーによる正確な報告に部分的に依存しています。実施されたサービスの現状およびタイミングに対する当社の理解は、実施されたサービスの実際の状況およびタイミングに対して異なる可能性があり、当社の見積もりが変更される可能性があります。
経営成果
2024 年 6 月 30 日期と 2023 年 6 月 30 日期との比較
以下の表は、当社の営業成果の特定の構成要素 ( 千単位 ) を要約しています。
|
|
6 月 30 日を末日とする会計年度について、 |
|
|
|
|
||||||||||
|
|
2024 |
|
|
2023 |
|
|
$Change |
|
|
変更率 |
|
||||
売上高 |
|
$ |
65,297 |
|
|
$ |
48,816 |
|
|
$ |
16,481 |
|
|
|
33.8 |
% |
研究 · 開発 |
|
|
16,561 |
|
|
|
52,450 |
|
|
|
(35,889 |
) |
|
|
(68.4 |
)% |
一般と行政 |
|
|
23,295 |
|
|
|
33,130 |
|
|
|
(9,835 |
) |
|
|
(29.7 |
)% |
長期資産減価準備 |
|
|
10,899 |
|
|
|
— |
|
|
|
10,899 |
|
|
|
100.0 |
% |
その他の純収入 |
|
|
3,236 |
|
|
|
4,926 |
|
|
|
(1,690 |
) |
|
|
(34.3 |
)% |
収入: 2024 年 6 月 30 日に終了した会計年度の売上高は、 2023 年 6 月 30 日に終了した会計年度の 4880 万ドルから 6530 万ドルとなりました。収益の増加は、以下に関連するすべての残存繰延収益の認識によるものです。 2023 年 7 月に終了した KKC 商業化契約を、終了した KKC 商業化契約によるコスト分担関連で認識された収益の減少により相殺しました。
研究と開発: 以下の表は、各年の研究開発費の構成 ( 千単位 ) を示しています。
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
ヴァンゲリシブ |
|
$ |
435 |
|
|
$ |
25,900 |
|
カルシチリブ |
|
|
3,413 |
|
|
|
2,335 |
|
ME-344 |
|
|
4,724 |
|
|
|
1,137 |
|
他にも |
|
|
7,989 |
|
|
|
23,078 |
|
研究開発費総額 |
|
$ |
16,561 |
|
|
$ |
52,450 |
|
ゼネリシブ関連の費用は、主に 2023 年度中にプログラムが中止され、 2024 年度には巻き戻し活動に関連したコストが削減された結果、 2550 万ドル減少しました。臨床コストの上昇により、製造コストの削減によって部分的に相殺されたため、フェノシクリブのコストは 110 万ドル増加した。ME—344 関連費用は、第 10 相試験に関連する臨床コストと臨床および非臨床試験をサポートするための ME—344 の製造コストが増加したことにより、 360 万ドル増加しました。その他の研究開発費は、主に人件費が 1410 万ドル減少したことにより、 1510 万ドル減少しました。これには、 2023 年度の従業員削減による 1 回限りの従業員解雇手当の 260 万ドル減少と、非現金株式報酬の 40 万ドル減少が含まれます。
一般と行政: 2024 年 6 月 30 日に終了した会計年度における一般管理費は、 2023 年 6 月 30 日に終了した会計年度における 3310 万ドルから 980 万ドル減少した 2330 万ドルとなりました。正味の減少は、主に人件費の 550 万ドル削減によるものです。これには、当社の削減およびその他の終了による 170 万ドルが含まれます。
36
関連する給付に加え、現金以外の株式ベースの報酬の 90 万ドル削減、外部プロフェッショナルサービスの 170 万ドル削減、企業間接費の 150 万ドル削減、弁護士費用の 20 万ドル削減も行われました。
長期資産減価準備: 当社の長期資産の減損額 1090 万ドルは、使用権資産に計上された 1040 万ドルの損失で構成されています。 注 9 。リースサービス, 家具や固定器具に販売することに合意した 50 万ドルの損失を認識しました 注 3 — バランスシート詳細会計基準法典化 360 に従って記録された — プロパティ。プラント · 設備. 2023 年 6 月 30 日に終了した会計年度においては、同様の取引はありませんでした。
その他の純収入 : その他の純利益は、 2023 年 6 月 30 日に終了した会計年度における 490 万ドルから 170 万ドル減の 320 万ドルとなりました。当社は、 2023 年 6 月 30 日に終了した会計年度において、保証債務の公正価値の変化により、 160 万ドルの非現金利益を計上しました。2023 年 5 月に失効した。
新会計公告
参照してください付記2.主要会計政策の概要、連結財務諸表に含まれる 項目 8 。連結財務諸表及び補足データ この年次報告書の。
流動性と資本資源
設立以来、累計38820ドルの損失を計上しており、将来的には運営損失と運営に負のキャッシュフローが生じることが予想される。2024年6月30日現在、私たちは3,830ドルの現金、現金等価物、短期投資を持っています。2024年7月22日、取締役会は、潜在的な取引および秩序的な業務終了を含む、我々の戦略的選択の評価を開始することを決定し、適切であれば、私たちの資産が株主のために価値を最大化することを決定したと発表した。戦略代替案を探索するとともに,2024年8月1日に有効な減量を開始し,ボルシリの臨床開発を中止した。この発表により,臨床研究·開発活動の中止に伴い,われわれの研究·開発費は大幅に減少することが予想される。臨床試験終了コストやいくつかの行われている非臨床活動の完成に関する研究·開発費用が生じ続ける。私たちの現金残高は、私たちの短期投資を含めて、少なくとも今後12ヶ月の運営に資金を提供するのに十分だと信じています。
これまでのところ、当社は主に株式ファイナンスとライセンス契約を通じて現金を調達し、事業資金を調達してきましたが、医薬品候補の開発を再開するには、株式証券の売却、デットファイナンス、ライセンス契約、または将来のある時点で戦略的パートナーシップの締結を通じて、 1 つ以上の資本取引が必要になります。今後も追加資本を調達し続けることができることは保証されません。
当社の現金の源泉と用途
2024 年 6 月 30 日に終了した会計年度における営業活動における純現金使用額は、純利益 1780 万ドルと営業活動における純現金使用額 8430 万ドルから構成され、非現金項目 1600 万ドルが一部相殺されました。2023 年 6 月 30 日に終了した会計年度における営業活動における純現金使用額 5250 万ドルは、当社の純損失 3180 万ドルと営業活動における純現金使用額 2490 万ドルから構成され、一部は非現金項目 430 万ドルによって相殺されました。
2024 年 6 月 30 日に終了した会計年度における投資活動による純現金は、 2023 年 6 月 30 日に終了した会計年度における 5370 万ドルから 4910 万ドルとなりました。投資活動による純キャッシュの減少は、 2024 年 6 月 30 日に終了した会計年度における継続事業の資金調達に利用された短期投資の満期額が減少したことにより、短期投資の購入が減少したことによるものです。
2024 年 6 月 30 日に終了した会計年度における資金調達活動に使用された純現金は、 2023 年 6 月 30 日に終了した会計年度における資金調達活動に使用された現金 4 万ドルに対して、 1 億 1,190 万ドルとなりました。前年比の増加は、主に協力協定に基づき合意された配当金 1170 万ドルと、 ATm の発行費用約 20 万ドルの支払によるものです。2023 年度における資金調達活動に使用された現金は、制限付き株式の譲渡に関連する源泉徴収税の支払に関連しています。
資本資源要件
2024 年 6 月 18 日、カリフォルニア州サンディエゴの 11455 El Camino Real 、 Suite 200 および Suite 250 のオフィスについて、家主とリース終了契約を締結しました。契約に基づき、リースは 2024 年 11 月 30 日の満了予定ではなく、 2024 年 9 月 30 日に満了します。当社は、本契約に基づく残りの家賃約 20 万ドルの前払い ( 総称して「終了金額」 ) に加えて、総額約 1110 万ドルの終了手数料を家主に支払いました。2024 年 6 月 30 日までに、終了金額が支払われ、契約に基づくこれ以上の財政的義務はありませんでした。
37
当社は、 2024 年 6 月 30 日現在、以下のような潜在的な購入債務を有しており、その発生時期および / または発生の可能性は不明ですが、これらの請求が将来発生した場合、当社の財務状況、業績およびキャッシュフローに重大な影響を及ぼす可能性があります。
私たちの将来の資本需要は多くの要素に依存します
第 7 項 A 。市場リスクに関する定量的 · 質的開示
当社は、小規模な報告会社として、本項で要求されるその他の情報を提供する必要はありません。
38
項目 8 。連結財務諸表及び補足データ
美医薬株式会社
連結財務諸表索引
|
|
|
|
|
独立公認会計士事務所報告( |
|
|
40 |
|
独立公認会計士事務所報告( |
|
|
42 |
|
|
|
43 |
|
|
|
|
44 |
|
|
|
|
45 |
|
|
|
|
46 |
|
|
|
|
47 |
|
39
独立公認会計士事務所報告
MEI ファーマ株式会社の株主および取締役会へ
財務諸表のいくつかの見方
MEI Pharma 株式会社の連結貸借対照表を監査しました。及び子会社 ( 以下「当社」といいます。 ) 、 2024 年 6 月 30 日現在の連結事業 · 株主資本 · キャッシュフロー計算書、および関連注釈 ( 以下「財務諸表」といいます。 )当社の意見では、財務諸表は、米国で一般的に認められている会計原則に従って、 2024 年 6 月 30 日現在の当社の財務状況、および 2024 年 6 月 30 日を末日とする年度の事業結果およびキャッシュフローを、すべての重要な点において公正に提示しています。
意見の基礎
これらの財務諸表は、当社経営陣の責任です。当社の責任は、当社の監査に基づき、当社の財務諸表について意見を表明することです。当社は、米国公営企業会計監督委員会に登録された公的会計事務所であり、米国連邦証券法および証券取引委員会および PCAOb の適用される規則および規制に従って、当社に対して独立していることが求められています。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に報告する重要な監査事項は、当期における財務諸表の監査に起因し、監査委員会に報告された、または報告される必要がある事項であり、 ( 1 ) 財務諸表に重要な会計または開示に関する事項であり、 ( 2 ) 当社の判断が特に困難で、主観的または複雑なものである事項です。重要な監査事項の公表は、財務諸表全体に対する当社の意見をいかなる形でも変更するものではなく、以下に重要な監査事項を公表することにより、重要な監査事項またはそれに関連する会計または開示について別個の意見を提供するものではありません。
リース — リースの修正 — 財務諸表注記 1 、注記 2 、注記 9 を参照
重要な監査事項の説明
連結財務諸表の注記 1 、注記 2 、および注記 9 に記載されているように、当社は、 2024 年 6 月 18 日に、 AAt Torrey Plaza, LLC との既存のリース契約を 2024 年 9 月 30 日に有効に終了することに合意しました (本契約は、当初は 2029 年 11 月 30 日に終了する予定でした) 。早期解約の対価として、当社は約 1110 万ドルの解約手数料を支払い、残りの月額家賃を前払いすることに合意しました。当社は、本契約を既存のリースの変更とみなすべきであると判断した。
リース変更に関連する手続きの実施が重要な監査事項を構成すると判断した主な考慮事項は、契約がリース変更または終了をもたらすかどうかを判断する際に、監査人の判断と主観性が適度であったことです。
40
監査で重要な監査事項をどのように処理するか
リース債務及び ROU 資産の会計処理及び再測定に関する監査手続は、以下のとおりです。
/s/徳勤法律事務所
カリフォルニア州サンディエゴ
2024年9月19日
2024年以来、私たちは会社の監査役を務めてきた。
41
独立公認会計士事務所報告
株主 · 取締役会
美医薬株式会社
カリフォルニア州サンディエゴ
連結財務諸表に対するいくつかの見方
MEI Pharma 株式会社の連結貸借対照表を監査しました。(the当社 ) は、 2023 年 6 月 30 日時点の連結事業 · 株主資本 · キャッシュフロー計算書、および関連注釈 ( 連結財務諸表と総称する。当社の意見では、連結財務諸表は、米国で一般的に認められている会計原則に従って、 2023 年 6 月 30 日時点の当社の財務状況、およびその期間の事業結果およびキャッシュフローを、すべての重要な点において公正に提示しています。
意見の基礎
これらの連結財務諸表は、会社の経営陣の責任です。当社の責任は、当社の監査に基づき、当社の連結財務諸表について意見を表明することです。当社は、米国公営企業会計監督委員会に登録された公的会計事務所であり、米国連邦証券法および証券取引委員会および PCAOb の適用される規則および規制に従って、当社に対して独立していることが求められています。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、連結財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、連結財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれる。これらの手続きは、連結財務諸表中の金額および開示に関する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、合併財務諸表の全体列報の評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/S/BDOアメリカ,P.C.
2011 年から 2023 年まで監査役を務めました。
カリフォルニア州サンディエゴ
2023 年 9 月 26 日
42
美医薬株式会社
合併貸借対照表
(In数千 ( 名額金額を除く )
|
|
六月三十日 |
|
|
六月三十日 |
|
||
|
|
2024 |
|
|
2023 |
|
||
|
|
|
|
|
|
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金 · 現金同等物 |
|
$ |
|
|
$ |
|
||
短期投資 |
|
|
|
|
|
|
||
未開票売掛金 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
経営的リース使用権資産 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
負債を計算すべきである |
|
|
|
|
|
|
||
繰延収入 |
|
|
|
|
|
|
||
リース負債を経営する |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
繰延収益、長期 |
|
|
|
|
|
|
||
長期経営賃貸負債 |
|
|
|
|
|
|
||
負債総額 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
株主権益: |
|
|
|
|
|
|
||
優先株、$ |
|
|
|
|
|
|
||
普通株、$ |
|
|
|
|
|
|
||
追加実収資本 |
|
|
|
|
|
|
||
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
連結財務諸表の付記を参照。
43
美医薬株式会社
連結業務報告書
(千単位で、1株当たりを除く)
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
収入: |
|
|
|
|
|
|
||
顧客からの収益 |
|
$ |
|
|
$ |
|
||
コラボレーション契約による収益 |
|
|
|
|
|
|
||
総収入 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
運営費用: |
|
|
|
|
|
|
||
研究 · 開発 |
|
|
|
|
|
|
||
一般と行政 |
|
|
|
|
|
|
||
長期資産減価準備 |
|
|
|
|
|
|
||
総運営費 |
|
|
|
|
|
|
||
営業収入(赤字) |
|
|
|
|
|
( |
) |
|
その他の収入(支出): |
|
|
|
|
|
|
||
株式証負債の公正価値変動を認める |
|
|
|
|
|
|
||
利子と配当収入 |
|
|
|
|
|
|
||
その他の費用、純額 |
|
|
( |
) |
|
|
( |
) |
その他の収入合計,純額 |
|
|
|
|
|
|
||
純収益(赤字) |
|
$ |
|
|
$ |
( |
) |
|
|
|
|
|
|
|
|
||
1 株当たり純利益 ( 損失 ) — 基本および希釈 |
|
$ |
|
|
$ |
( |
) |
|
|
|
|
|
|
|
|
||
純利益 ( 損失 ) の計算に使用される加重平均株式 |
|
|
|
|
|
|
||
連結財務諸表の付記を参照。
44
美医薬株式会社
合併株主権益報告書
(単位:千)
|
|
ごく普通である |
|
|
その他の内容 |
|
|
積算 |
|
|
総額 |
|
||||
2022年6月30日の残高 |
|
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
制限付き株式普通株式の発行 |
|
|
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
|
株式承認証を発行する |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式ベースの給与費用 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
2023年6月30日の残高 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
純収入 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
発表された現金配当金(ドル |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
株式ベースの給与費用 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
2024年6月30日の残高 |
|
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
連結財務諸表の付記を参照。
45
美医薬株式会社
統合現金フロー表
(単位:千)
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
経営活動のキャッシュフロー: |
|
|
|
|
|
|
||
純収益(赤字) |
|
$ |
|
|
$ |
( |
) |
|
純収益(損失)と業務活動で使用される現金純額を調整する: |
|
|
|
|
|
|
||
株式証負債の公正価値変動を認める |
|
|
|
|
|
( |
) |
|
株式ベースの報酬 |
|
|
|
|
|
|
||
株式承認証を発行する |
|
|
|
|
|
|
||
長期資産減価準備 |
|
|
|
|
|
|
||
非現金レンタル費用 |
|
|
|
|
|
|
||
減価償却費用 |
|
|
|
|
|
|
||
財産と設備処分損失 |
|
|
|
|
|
|
||
営業資産 · 負債の変動 |
|
|
|
|
|
|
||
未開票売掛金 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
( |
) |
|
売掛金 |
|
|
( |
) |
|
|
( |
) |
負債を計算すべきである |
|
|
( |
) |
|
|
|
|
繰延収入 |
|
|
( |
) |
|
|
( |
) |
リース負債を経営する |
|
|
( |
) |
|
|
( |
) |
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
||
投資活動によるキャッシュフロー: |
|
|
|
|
|
|
||
短期投資を購入する |
|
|
( |
) |
|
|
( |
) |
短期投資満期収益 |
|
|
|
|
|
|
||
財産と設備を購入する |
|
|
( |
) |
|
|
( |
) |
投資活動が提供する現金純額 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
資金調達活動のキャッシュフロー: |
|
|
|
|
|
|
||
制限付き株式の譲渡に伴う源泉徴収税の支払 |
|
|
|
|
|
( |
) |
|
現金配当の支払 |
|
|
( |
) |
|
|
|
|
融資コストを支払う |
|
|
( |
) |
|
|
|
|
資金調達活動に使用された純現金 |
|
|
( |
) |
|
|
( |
) |
現金および現金等価物の純増加 |
|
|
( |
) |
|
|
|
|
年初現金および現金等価物 |
|
|
|
|
|
|
||
年末現金および現金等価物 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
キャッシュフロー情報の追加: |
|
|
|
|
|
|
||
営業リース事業と引き換えに取得した使用権資産 |
|
$ |
|
|
$ |
|
||
リース時の使用権資産及び関連リース負債の再計量 |
|
$ |
( |
) |
|
$ |
|
|
リースに伴う直接費用に対する使用権資産の再計量 |
|
$ |
|
|
$ |
|
||
連結財務諸表の付記を参照。
46
美医薬株式会社
連結財務諸表への注記
注1.ビジネス記述および陳述の基礎
業務説明
美医薬会社(ナスダックコード:MEIP)は製薬会社であり、新型と差別化された癌療法を開発してきた。私たちは将来性のある抗癌薬を買収し、適切な開発、戦略的パートナー関係と対外許可或いは商業化を通じてプロジェクトの中で価値を創造し、私たちのルートを構築した。著者らは腫瘍学薬物開発の方法はずっと標準看護療法と結合して著者らの候補薬物を評価し、既知の薬剤耐性機序を克服し、そして明確な医療需要を満たし、患者の利益を改善する。我々が開発している薬剤としては,経口細胞周期蛋白依存性キナーゼ9(CDK 9)阻害剤voruciclibと,酸化リン酸化経路に対する小分子ミトコンドリア阻害剤ME−344の静注がある。
列報と合併の基礎
我々は、米国公認会計原則(米国公認会計原則)と米国証券取引委員会(米国証券取引委員会)の10-k表年次報告に関する規則と規定に基づいて連結財務諸表を作成する。添付されている合併財務諸表には、米医薬会社と我々の完全子会社Meadow Merge Sub,Inc.の口座が含まれている。我々はすべての合併における会社間口座および取引を廃止した。
同社は連結財務諸表が発表された日から後続事件を評価した。
時事
戦略的選択肢
2024年7月22日、我々の取締役会(取締役会)は、潜在的な取引および適切であれば、我々の資産を株主として価値を最大化するために、我々の戦略的選択の評価を開始することを一貫して決定したと発表した。我々は2024年8月1日から兵力削減を開始し、我々の行動と戦略方向の変化に伴い、この行動は段階的に行われる。われわれはすでにヴォルシリの臨床開発を中止しているが,梅の候補薬物資産に関連するいくつかの非臨床活動は継続して行われる。戦略選択審査の一部として、既存計画のアウトソーシング許可機会やM&A機会などの選択肢が考えられる可能性がある。
私たちが現金を保存しようとしている意図と一致して、私たちのCEOで最高経営責任者のDavid·M·ウルソと私たちのCEO Richard Ghalie万.D.は2024年8月1日に辞任した。エルソーもその日取締役会を離れた。我々は、ウルソさんとガリ博士との諮問協定を締結しており、協定に基づき、彼らは引き続き私たちの戦略的努力を支援していきます。取締役会長のチャールズ·V·バルト海3世も2024年7月22日に取締役会を辞任することを発表した。我々の取締役会はすでに現最高財務官ジャスティン·J·フィルを最高経営責任者に任命し、フレデリック·W·ドリスコールを取締役会長に任命している。
協力 協定
2023年10月31日、株主に配当金の形で資本#ドルを返還することが規定されている安信基金管理有限責任会社とケーブルカー資本有限責任会社(それぞれ安盛とケーブルカー)との協力協定(提携協定)を締結することを発表した
協力協定の一部として,安盛とケーブルカーは彼らの同意を撤回し,慣用的なポーズ条項を遵守することに同意した。また、協力契約日までに、安生とケーブルカーが私たちと契約した費用と支出を返済しました。金額は#ドルです
2024年4月、取締役会は協力協定に基づいて潜在的な第二次資本返還を行わず、資源節約と戦略投資を調整し、我々の運営滑走路を拡大することを一致して決定した。
現金配当
2023年11月6日、取締役会は“協力協定”に基づき、特別現金配当金#ドルを発表した
47
無限合併
2023年2月、私たちInfinity製薬会社(Infinity)と私たちの完全子会社Meadow Merge Sub,Inc.(Merge Sub)は合併合意と計画(Merge Agreement)を達成した。統合プロトコルでは,Merge SubはInfinityと統合してInfinityに組み込み,Infinityは吾らの完全子会社(取引を統合と呼ぶ)として生存エンティティとし,それぞれ吾らおよびInfinity株主の承認を得る必要があることを規定している.2023年7月23日、我々は株主特別会議を開催しましたが、当時私たちの株主は提案された取引を承認していませんでした。その後、私たちは無限に手紙を送り、合併協定第7.2(C)節により合併協定を終了し、2023年7月23日から発効しました。
KKCはプロトコルを終了します
2022年11月、Kyowa麒麟株式会社(KKC)とzandelisibに関連する第2段階会議2022年3月終了後の後続会議で米国食品医薬品局(FDA)と会議を開催した。今回の会議でFDAはCOSTRATE試験の設計と統計分析についてさらなる指導を提供した。11月の会議の後,両社は共同で,FDAの最近のガイドラインと一致した臨床試験は,行われている海岸試験の見直しを含めて,さらなる投資を支援する時間内に完了することや,十分な確実性のある規制要件の下で承認されることが可能であり,世界的な開発事業を継続することが合理的であることを証明した。そこで,我々はKKCと共同で日本以外の地域で不活性形態の非ホジキンリンパ腫を治療するZandelsibのグローバル開発を中止することにした。
日本以外の地域でのzandelisibの開発中止はFDA規制指導に基づくビジネス決定であり,これまでに生じたzandelisibの臨床データとは無関係である。KKCは当時日本で何らかの臨床試験を継続していたにもかかわらず,2023年5月にKKCは医薬品·医療機器庁(PMDA)との面会後に日本でのZandelsibの開発を中止することを決定し,さらなる投資を支援する期間内に当該機関の指導に応じたランダム研究を行ってマーケティング申請を支援することは不可能である可能性があると結論した。
KKCはZandelisibの日本での開発停止と,先の共同決定により日本以外のZandelisib開発を停止することを決定したため,双方は2023年7月14日に終了協定を締結し,2020年4月に署名したグローバルライセンス,開発,商業化協定を共同で終了した.
流動性
私たちはすでに蓄積しています$
これまで、私たちは主に株式融資と許可協定を通じて現金を獲得し、私たちの運営に資金を提供してきましたが、私たちの候補薬を開発し続けるためには、株式証券の売却、債務融資、許可協定、未来のいつか戦略的パートナー関係を達成するためには、1つ以上の資本取引が必要になります。私たちが将来もっと多くの資本を集め続けることができるという保証はない。
付記2.主要会計政策の概要
予算の使用
公認会計原則に従って財務諸表を作成することは、連結財務諸表中に報告された金額及び連結財務諸表の付記における開示に影響を与えるために、管理層に推定及び仮定を要求する。私たちは、影響報告金額(資産、負債、収入、および費用を含む)および関連開示の推定値を使用する。実際の結果はこのような推定とは大きく異なるかもしれない。
48
現金と現金等価物
現金および現金等価物には、現金および購入時の元の満期日が3ヶ月以下の高流動性投資が含まれる。現金は金融機関に保存されており、残高が連邦保険の限度額を超える場合がある。私たちはこのような残高と関連したいかなる損失も経験したことがない。
私たちは、私たちの主要金融機関の信用品質を定期的に評価することで、私たちの現金と現金等価物に関連する信用リスクを最小限に抑えることを試みた。私たちのポートフォリオは私たちの投資政策によって維持されており、この政策は資本の保存、資金の保障、リスク制限の開放を目的としている。FDIC保険の金融機関における現金預金は連邦保険の限度額を超えていますが、これらの預金を持っている預金機関の財務状況により、重大な信用リスクに直面しないと考えられます。私たちはそのような口座で何の損失も経験したことがない。
短期投資
短期投資とは購入日から三ヶ月以上ですが一年満期未満の有価証券のことです。2024年6月30日と2023年6月30日まで、私たちの短期投資は$
公正価値計量
公正価値は、計量日市場参加者間の秩序ある取引において、資産または負債が元金または最も有利な市場で負債を移転するために徴収または支払いされる交換価格として定義される。公正価値を計量するための推定技術は,観察可能な投入を最大限に利用し,観察不可能な投入を最大限に減少させなければならない。公正価値を計量するために使用可能な3つの投入レベルに基づく公正価値レベルは、以下のようになる:最初の2つは観察可能であり、最後の1つは観察不可能である
財産と設備
財産及び設備をコストに応じて列記し、資産の推定耐用年数内に減価償却する(一般へ
リース事業
私たちはASCテーマ842でレンタルを計算しましたリース事業(主題842)。主題842の範囲内で決定されたリース期間が1年を超える賃貸は、私たちの合併貸借対照表で使用権資産および賃貸負債であることが確認された。レンタル負債及びそれに対応するROU資産は、期待される残りレンタル期間のリース支払い現在値に基づいて入金される。レンタル期間には、行使する任意の更新選択権と終了選択権を合理的に決定することが含まれています。支払いの初期直接費用や受信された報酬などの項目については、使用権資産を何らかの調整する必要がある場合がある。レンタル支払いの現在値は、もしその金利が確定しやすい場合、レンタルに隠された金利を使用することによって決定されます。そうでなければ、私たちは私たちの増加した借入金金利を使用します。逓増借款金利は、私たちが担保に基づいて借金する際に支払う金利に基づいて決定され、借入金金額は、似たような期限や経済環境下での賃貸支払いに相当する。現在値を計算する賃貸契約に隠されている金利は通常容易には確定できない。そのため、増額借金金利を見積もるには顕著な経営陣の判断力が必要である。
レンタル経営の経営リース費用はレンタル期間内にレンタル支払い総額で直線法で確認します。私たちは実際の便宜策を選択して、私たちの不動産賃貸の賃貸と非賃貸部分を分けない。私たちの非賃貸部分は主に物件メンテナンスに関連しており、この部分は将来の結果によって変化するため、発生時に運営賃貸費用で確認されています。
49
2024年6月18日、私たちは大家さんと賃貸終了契約(合意)を締結し、この合意に基づいて、2024年9月30日に既存のオフィススペースのレンタルを終了することに同意しました。参照してください付記3.貸借対照表の詳細 そして 注 9 。リースサービスその協定は私たちの連結財務諸表に及ぼす影響。
収入確認
取引先からの収入
ASC主題606によると、取引先と契約した収入(主題606)、約束された商品またはサービスの制御権が私たちの顧客に転送されると、私たちは、収入を確認し、金額は、これらの商品またはサービスの対価格と交換する権利が期待されることを反映している。顧客と締結された強制実行可能な契約については、まず契約中の異なる履行義務または会計単位を決定する。履行義務は,契約中に独自の商品やサービスを顧客に移転することを承諾する承諾である.
ライセンス技術権利のような商業的手配に応じて受信された支払いには、手配開始時に払い戻しできない費用、プロトコルで指定された特定の成果のマイルストーン支払い、および製品販売の使用料が含まれる場合がある。マイルストーン支払いを含む手配開始時には、マイルストーンが実現可能かどうかを判断し、最も可能な方法を用いて取引価格に含まれる金額を推定する。大きな収入逆転が起こらない可能性が高い場合、推定金額は取引価格に含まれる。規制承認のような、我々または被許可者の制御範囲内でのマイルストーン支払いではなく、これらの承認を受けるまで取引価格に含まれません。各報告期間の終了時に、開発マイルストーンを実現する可能性と任意の関連制限を再評価し、必要に応じて全体の取引価格の推定を調整する。
私たちは複数の義務履行で構成された計画を達成することができる。このような計画は私たちが成果を渡すことができる任意の組み合わせを含むことができる。1つの契約に複数の約束の交付可能な成果が含まれている場合、約束された交付可能な成果が異なるかどうか、契約の背景で異なることができるかどうかを決定するために判断を適用する。これらの基準を満たさなければ、約束された交付可能な成果は総合履行義務として入金される。複数の異なる履行義務がある手配については,我々50-50の発展サービス費用シェアに関する可変対価格を関連する履行義務に直接割り当て,その相対的に独立した販売価格に応じて履行義務に残りの対価格を割り当てる.
独立販売価格とは、私たちが約束した商品やサービスを個別に顧客に売る価格のことです。直接観察できない場合、私たちは通常、それぞれの異なる履行義務の独立販売価格を推定する。具体的には,具体的な履行義務を履行する我々の努力に関する可変対価格はこれらの履行義務に完全に割り当てられる.取引価格の他の構成要素は相対的に独立した販売価格に基づいて割り当てられており、管理層はこれを大きく判断している。我々が開発した仮説は,ライセンスに関する契約義務の独立販売価格を決定する必要があり,その中には,予測収入,開発スケジュール,人員コストの販売率,割引率,および技術,法規,ビジネスが成功する確率が含まれている可能性がある.我々は,履行義務履行の期待コストに適切な利益率を加えることで,開発履行義務の独立販売価格を試算した。
許可が明確な履行義務である場合には,許可が被許可者に譲渡され,被許可者が許可を使用して利益を得ることができる場合には,許可に割り当てられた収入は返却不可能な前払い費用からのものであることを確認する。他の異なるまたは組合せ義務とバンドルされたライセンスについては,履行義務が時間の経過とともに履行されているか,ある時点で履行されているかを決定するために,履行義務の性質を評価する判断を用い,時間の経過とともに収入を確認するために進展を測定する適切な方法を決定する.履行義務が時間の経過とともに履行された場合、各報告期間内に進捗測定基準を評価し、必要に応じて業績測定基準と関連収入確認を調整する。私たちは時々KKCの要求に応じてKKCに追加のサービスを提供して、費用は全額返金されました。これらのサービスのコストは,合併経営報告書で研究·開発費用として確認されている。
完了進捗を測る方法の選択は判断し,提供される製品やサービスの性質に基づいている必要がある.収入はコスト発生時に比例して入金される。私たちは通常、コストが発生したときに発生する制御権が顧客に移行することを最もよく説明しているので、コストに対する進捗メトリックを使用します。進捗コスト比計測では、完了進捗の程度は、これまでに発生した費用と義務履行時の推定費用総額との比率(特集606次の入力方法)に基づいて測定される。著者らは判断を用いて研究開発業績義務を達成する期待総コストを推定し、その中に下請け業者のコスト、労働力、材料、その他の直接コストと間接コストの分配を含む。我々は,各報告期間ごとにこれらのコスト推定数と進捗を評価し,必要に応じて進捗と関連収入確認の測定基準を調整した。
50
売上高または使用量に基づく特許権使用料を含む手配については、(I)関連販売が発生した場合、または(Ii)特許使用料の一部または全部が履行されたか、または部分的に履行義務が履行された場合に、遅い者を基準として収入を確認する。これまで、ライセンス契約から販売または使用に基づく印税収入は確認されていません。
我々とKKCとの許可,開発,商業化プロトコル(KKC商業化プロトコル)については,我々の半コスト分担手配に関する開発サービスを提供し,収入は時間とともに確認された.また、私たちはKKCの要求に応じてKKCにサービスを提供し、費用は全額返金されました。このような直通サービスの精算記録を収入としています
KKC商業化プロトコルに関する収入(千単位)を確認した
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
収入確認時間: |
|
|
|
|
|
|
||
時間とともに実行されるサービス |
|
$ |
|
|
$ |
|
||
ある時点でサービスを伝達する |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
契約残高
売掛金は前払い費用および他の流動資産に含まれ、契約負債は私たちの合併貸借対照表の長期繰延収入および繰延収入に含まれる。私たちの特別テーマ606項目の下での契約負債は、開発サービス履行義務に割り当てられた予備前払い額に関する。
As Of 2024 年 6 月 30 日、 2023 年 6 月 30 日私たちはあった
|
|
2024年6月30日 |
|
|
2023年6月30日 |
|
|
2022年6月30日 |
|
|||
未開票売掛金 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
契約負債には繰延収入と |
|
$ |
|
|
$ |
|
|
$ |
|
|||
契約負債の期初と期末金額は,主にKKC商業化プロトコルで開発サービスを譲渡する総合履行義務に関係しており,合意下の研究計画に基づいて我々の契約で単独で負担する履行義務であり,本報告で述べた期間の入金は以下のとおりである
|
|
2024年6月30日 |
|
|
2023年6月30日 |
|
||
期初残高 |
|
$ |
|
|
$ |
|
||
収入を確認した |
|
|
|
|
|
|
||
履行義務を果たして確認した収入 |
|
|
( |
) |
|
|
( |
) |
業績予想値の変化から確認した収入 |
|
|
|
|
|
( |
) |
|
業績義務を履行しなくなったことで確認された収入 |
|
|
|
|
|
( |
) |
|
期末残高 |
|
$ |
|
|
$ |
|
||
収入確認、領収書発行、現金入金のスケジュールは、売掛金と未開票売掛金(契約資産)と繰延収入(契約負債)を招く。私たちは合意した契約条項に従ってお客様に領収書を発行します。通常は定期的に領収書を発行するか、契約マイルストーンに達した時に領収書を発行します。収入確認後に領収書が発行される可能性があり、領収書を発行していない売掛金が発生します。私たちは収入を確認する前に顧客の前払いを受けて、契約債務を発生させるかもしれない。総合貸借対照表が提出した未開債権および繰延収入はKKC商業化協定と関係がある。
協力者からの収入
はい契約開始時に、協力スケジュールが特別テーマ808の範囲内にあるかどうかを評価して、このような手配が双方が展開する共同業務活動に関連するかどうかを決定する。これらの締約国は、活動の積極的な参加者であり、重大なリスクとリターンに直面しており、このような活動の商業成功に依存する。この評価は手配中のすべての当事者の責任に基づいて行われる。複数の計算単位を含む主題808の範囲内の協調スケジュールの場合、最初に、どの計算単位が主題808の範囲内にあり、どの要素が主題606の範囲内にあるかを決定する。主題808に従って示される協調スケジュール内の計算単位の場合、適切な識別方法は、権威と類比することによって決定され、一貫して適用される
51
会計計算文学です。主題606に従って入金された連携スケジュールの要素については、上述したように収入が確認される。受信された対価格は、主題606収入確認基準の要件を満たしておらず、添付の総合貸借対照表では繰延収入と記載されており、このような金額がいつ確認されたかについての我々の最適な推定に基づいて、当期または長期繰延収入に分類される。
研究と開発
研究·開発コストは,第三者請負業者への研究,臨床試験および薬物材料の開発·製造のコストを含む発生時に費用を計上した。臨床試験コストは、第三者請負業者に関連するコストを含み、研究開発費用の重要な構成部分である。私たちは行った仕事に基づいて研究開発コストを計算する。費用の額を決定する際に、管理層は、完了した契約構成要素、被験者の登録、試験の完了、および他のイベントの総コストに基づく推定値に依存する。購入が可能かもしれない早期製品の研究および開発に関連するコスト、または製品が商業的に実行可能でなく使用可能であるか、または将来他の用途のない製品を購入することに関連して、発生した間に費用を計上する。
連結財務諸表の作成プロセスの一環として、ベンダー、臨床研究機関、コンサルタントとの契約上の義務、臨床試験の実施に関連する臨床施設契約に起因する費用の見積もりを求めています。これらの契約の財務条件は異なり、当該契約の下で資材またはサービスが提供される期間と一致しない支払フローが生じる可能性があります。
当社の目的は、臨床試験費用を、サービスの実施および努力の期間に計上することにより、連結財務諸表に適切な費用を反映することです。これらの費用は、患者の進行や試験の様々な側面のタイミングで測定した臨床試験の進捗状況に応じて計上します。経営陣は、財務モデルと、臨床試験の進捗状況について関係者および外部サービスプロバイダーとの協議を通じて、発生見積もりを決定します。
臨床試験では、実際の結果と推定値が異なる場合は、臨床費用の認識を調整します。各貸借対照表日時点での発生費用は、当時知られた事実 · 状況に基づいて見積もっています。当社の臨床試験の発生額は、 CRO やその他のサードパーティベンダーによる正確な報告に部分的に依存しています。実施されたサービスの現状およびタイミングに対する当社の理解は、実施されたサービスの実際の状況およびタイミングに対して異なる可能性があり、当社の見積もりが変更される可能性があります。
株式ベースの報酬
従業員及び取締役に付与された株式オプション及び制限株式単位(RSU)の株式ベース報酬支出は、総合経営報告書において推定金額に基づいて確認される。株式オプションのコストは、付与日に株式オプションの推定公正価値に基づいてBlack-Scholes推定モデルを用いて計測され、この推定モデルは、期待変動率、無リスク金利、期待付与期限、および対象株式の配当収益率を含む様々な仮定に組み込まれている。予想変動率は,期待オプション期間内の我々株の履歴変動率と他の適切な要因から計算される.私たちは合理的な基礎を提供して期待期間を推定するために、合理的な基礎を提供するために、簡略化された方法を使用して、株式購入および類似ツールの予想期間を計算する。無リスク金利は,適切な期限の連続複合無リスク金利から計算される。私たちは予測可能な未来にそうするつもりがないので、配当収益率はゼロだと仮定する。RSUについては,付与日の終値を用いて付与日の公正価値を推定した。株式オプションとRSUの見積公正価値は必要なサービス期間内に償却し,発生時の実際の没収に応じて調整する。必要なサービス期間は一般的に私たちの株式奨励が付与される時間だ。
利子と配当収入
現金と投資残高の利息は稼いだ時に確認します。配当収入は、配当を受ける権利が確定した後に確認される。
所得税
私たちの所得税支出は当期と繰延所得税支出または収益を含む。当期所得税支出又は福祉とは、今年度支払うべき又は払戻可能と予想される所得税金額をいう。繰延所得税資産または負債は、税金控除と損失繰越、および既存の資産と負債の帳簿金額とそのそれぞれの税務ベースとの間の差によって生じる将来の税務結果によって確認することができる。経営陣が繰延税金資産の一部または全部が現金化できない可能性が高いと考えた場合、繰延税金資産減価準備を行う。2024年6月30日と2023年6月30日までに、繰延純資産を十分に保持するための推定準備を確立しました。税率変動は,この等変動期間を実施した収入に反映される。私たちの所有権の変化は将来課税収入を相殺するために利用できる純営業損失繰越額を制限するかもしれません。
52
財務会計基準委員会(FASB)は所得税に関する特別テーマで確認敷居と計量属性基準を規定し、納税申告書で採用された或いは予想される納税頭寸を確認及び計量するために使用されている。これらのメリットを確認するためには、税務機関が審査した後、税収状況がより持続可能でなければならない
1株当たり純収益
1株当たり基本および償却純収益(損失)は、期限内に発行された普通株の加重平均から任意の買い戻しまたは没収可能な株式を減算して計算する。いくつありますか
2024年6月30日と2023年6月30日までの財政年度の1株当たり償却純収益(損失)を計算したところ、潜在的希薄化証券の加重平均行使価格は、2024年6月30日と2023年6月30日までの財政年度の加重平均株価をそれぞれ上回っているため、2024年6月30日と2023年6月30日までの財政年度では、1株当たり純収益(損失)を希釈するのとほぼ同じである。
次の表に、その逆希釈作用により1株当たり純利益(損失)計算から除外された潜在的希薄化株(単位:千):
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
株式オプション |
|
|
|
|
|
|
||
株式承認証 |
|
|
|
|
|
|
||
総反希薄株 |
|
|
|
|
|
|
||
市場情報を細分化するn
私たちは
最近の会計公告
最近採用された
FASBは2016年6月、改訂された会計基準更新第2016-13号、金融商品-信用損失(主題326):金融商品信用損失計測(ASU 2016-13)を発表した。ASU 2016-13年の改訂要求(その中に含まれる)は、余剰コストベースで計量された金融資産は予想通りに受け取るべき純額を列記すべきであるが、以前の米国公認会計原則は損失が発生する可能性が高いまで確認を遅延させる。ASU 2016−13年の改正案は2022年12月15日以降の財政年度に発効し,これらの財政年度内の移行期間を含めて早期採用を許可している。ASU 2016−13年度の採用は、我々の総合財務諸表や関連開示に実質的な影響を与えていない。
最近発行された
指定された発効日から、財務会計基準委員会または他の基準策定機関は、時々新しい会計公告を発表する。私たちは、以下の基準に加えて、最近発表された基準および発表されたが発効していないいかなる基準の影響も、採択された総合財務諸表に実質的な影響を与えないと信じている。
FASBは、2023年11月、米国会計基準委員会第2023-07号、支部報告(主題280)を発表した:報告可能な支部開示の改善について、公共エンティティに、年度および中期に基づいて重大な支部費用および他の支部プロジェクトを開示し、現在毎年開示されている報告可能な分部損益および資産に関するすべての情報を中期的に提供することを要求する。さらに、それは公共実体に首席運営意思決定者の肩書と地位を開示することを要求する。本ASUは、パブリックエンティティがその運用部門をどのように識別するか、それらをまとめて、または量子化閾値を適用して、その報告すべき部門を決定するかを変更しない。新基準は,2023年12月15日以降に開始される財政年度と,2024年12月15日以降に開始される財政年度内の移行期間に適用され,早期採用が許可される。公共エンティティは、財務諸表に記載されている以前のすべての期間に、本ASUにおける修正案を遡及適用しなければならない。私たちは、このASUは私たちの開示に影響を与えるだけであり、私たちの運営結果、キャッシュフロー、財務状況に影響を与えないと予想している。
53
FASBは2023年12月、税率調整および支払いに重点を置いた所得税(主題740):所得税開示の改善を米国会計基準委員会第2023-09号に発表した。ASU第2023-09号は、公共企業実体(PBE)に毎年、使用パーセンテージと貨幣金額の表形式の為替レート台帳を開示し、それを特定のカテゴリに細分化し、いくつかの入金項目が指定された閾値を超えた場合、性質と管轄権によってこれらの項目をさらに細分化することを要求する。また、すべての実体は、納付された所得税、受信した返金後の純額、および司法管轄区に区分された返金を受けた純額を開示しなければならず、金額が所得税の支払総額の少なくとも5%を占める場合は、受け取った返金を差し引かなければならない。PBEでは,新基準は2024年12月15日以降の年度期間に発効し,早期採用を許可した。1つのエンティティは、本ASUにおける改訂を前向きに適用することができ、2025年12月31日までの改訂開示を提供し、前期間のASU前開示を継続して提供することができ、すべての届出期間の改訂開示を提供することによって、適用改訂をたどることができる。私たちは、このASUは私たちの開示に影響を与えるだけであり、私たちの運営結果、キャッシュフロー、財務状況に影響を与えないと予想している。
付記3.貸借対照表の詳細
前払い資産と他の流動資産
プリペイドおよびその他の流動資産は以下の数千件で構成されました。
|
|
2024年6月30日 |
|
|
2023年6月30日 |
|
||
臨床費用を前払いする |
|
$ |
|
|
$ |
|
||
他にも |
|
|
|
|
|
|
||
前払い資産とその他の流動資産総額 |
|
$ |
|
|
$ |
|
||
財産と設備
財産と設備は、以下数千件で構成されていた。
|
|
2024年6月30日 |
|
|
2023年6月30日 |
|
||
家具と固定装置 |
|
$ |
|
|
$ |
|
||
装備 |
|
|
|
|
|
|
||
賃借権改善 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
減算:減価償却累計(1) |
|
|
( |
) |
|
|
( |
) |
財産と設備、純額 |
|
$ |
|
|
$ |
|
||
_____
(1)
2024年6月30日と2023年6月30日までの財政年度の財産·設備減価償却費用は連結キャッシュフロー表に記載されている。
合意の影響(中で述べたとおり)注 9 。リースサービス)
^ a b c d e f g h i f g h i f g 注 9 。リースサービス, 私たちは家具と固定装置を#ドルで大家さんに売ることに同意した
54
負債を計算すべきである
計算すべき負債には、千単位の以下の負債が含まれる
|
|
|
|
|
|
|
||
|
|
2024年6月30日 |
|
|
2023年6月30日 |
|
||
臨床前と臨床試験費用を計算しなければならない |
|
$ |
|
|
$ |
|
||
報酬と福祉に計上すべきである(1) |
|
|
|
|
|
|
||
法律と専門サービスに応じて |
|
|
|
|
|
|
||
KKC への未払い戻し |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
負債総額を計算すべきである |
|
$ |
|
|
$ |
|
||
________
(1)
付記4.公正価値計量
現金等価物、短期投資と売掛金などの金融商品の満期日が短いため、その帳簿額面は関連する公正価値に近い。私たちは余分な現金を金融商品に投資しており、これらのツールは通貨市場基金やアメリカ政府証券などの現金に変換しやすい。現金等価物および短期投資は、公正価値階層構造によって定義された第1レベルに分類される。
2018年5月、2023年5月に満期となる私募普通株に関する権証を発行しました。株式承認証の条項によると、当社が買収され、吾らは現金で株式証を決済することを要求されるため、株式承認証は公正な価値で計量し、総合貸借対照表の中で負債として申告しなければならない。著者らはBlack-Scholes推定モデルを用いて株式証発行時の公正価値を記録し、そして各報告日に株式証の公正価値を再推定し、総合経営報告書に公正価値の任意の変化を記録しなければならない。評価には公正価値計量に重大な意義があり観察できない仮定を用いる必要があるため、権利証の推定値は公正価値レベルの第三級とされている。株式証負債推定公正価値を特定するための資料は、推定日の関連株の推定公正価値、引受権証の推定年期、無リスク金利、期待配当金及び関連株の予想変動率を含む。権証負債の公正価値計量に使用される重大で観察できない投入は権証の変動率と推定期限である。一般に,対象株式や推定年間の公正価値の増加や減少は,公正価値計測と方向的に類似した影響をもたらす.3級株式証負債の公正価値変動は、2023年6月30日現在の財政年度の総合経営報告書に反映されている。2023年6月30日までの財政年度中にいくつありますか
株式証券負債の公正価値を計算するために,期末に以下の仮定を採用した2023 年 6 月 30 日:
リスクフリー金利 |
|
|
% |
|
予想寿命(年) |
|
|
|
|
予想ボラティリティ |
|
|
% |
|
配当率 |
|
|
% |
|
加重平均は日公正価値を付与する |
|
$ |
|
以下の表は,本財政年度までの3級株式証負債の推定公正価値変動について概説した2023年6月30日(千):
2022年6月30日までの残高 |
|
$ |
|
|
分類株式証負債の推定公正価値変動 |
|
|
( |
) |
2023年6月30日までの残高 |
|
$ |
|
注5.一度従業員の退職給付
2022年12月,日本以外の地域でのZandelisibの開発中止を共同決定するために,われわれの臨床開発を再調整し,われわれの組織を簡素化し,われわれの2つの早期臨床段階資産であるvoruciclibとME−344を臨床開発を継続させることを発表した。したがって、私たちの取締役会は互い違いリストラ(効果的なリストラ)を承認した。2023年6月30日までの事業年度には、以下の一次従業員福祉を記録しました$
55
開発費および一般と行政費用は,それぞれ終了した
2024年8月私たちとの戦略的選択肢公告,詳細は参照注1.業務記述と届出根拠私たちは効果的な削減を始めた(2024年計画)。経営陣の2025年の契約ボーナスを含めて、発生する費用総額は$を超えないと予想されます
以下の表は、 1 回限りの解雇給付に関する活動をまとめたものです。 2024 年 6 月 30 日発生負債に含める ( 千単位 ) :
|
|
一回限りの解雇給付 |
|
|
2022年6月30日の残高 |
|
$ |
|
|
再編成すべきである |
|
|
|
|
現金払い |
|
|
( |
) |
2023年6月30日の残高 |
|
|
|
|
累計リストラの増加 |
|
|
|
|
現金払い |
|
|
( |
) |
2024年6月30日の残高 |
|
$ |
|
|
付記6.支払の引受及び又は事項
私たちはすでに様々なコンサルタントや第三者と契約を締結し、私たちのリードする薬物化合物の臨床前研究と開発および臨床試験を助けてくれた。契約はいつでも終了することができますが、終了日までに発生した任意の時間または費用をプロバイダに返済する義務があります。私たちはまた、特定の状況で雇用を終了された場合、解散費を支払い、株式ベースの報酬の付与を加速することを規定している既存の従業員と雇用協定を締結した。
訴訟を起こす
私たちは時々様々な訴訟、法的手続き、あるいは正常な業務過程で提起されたクレームに巻き込まれるかもしれない。経営陣は、2024年6月30日まで、私たちに対するクレームや訴訟が解決されておらず、これらのクレームまたは訴訟は、単独または全体的に、その業務、流動性、財務状況、または運営結果に実質的な影響を与えると信じている。しかし、訴訟は内在的不確実性の影響を受け、これらまたは他の事項では時々不利な結果が生じる可能性があり、私たちの業務を損なう可能性がある。
賠償する
我々が改訂·再記述した組織定款大綱と定款細則によると,我々は我々の上級管理者や取締役がこのような職務を担当している間に発生したいくつかの事件や事件に対して賠償義務を負うが,一定の制限を受けなければならない.今までクレームはありませんでしたが、将来のクレームのために支払われた任意の金額の一部を回収させることができる取締役と上級管理職責任保険証を持っています。
Preage許可プロトコル
中で議論したように 注8.その他のライセンス契約私たちは、いくつかの開発、規制、およびビジネスマイルストーンを実現する際に将来のお金を支払う必要があり、純売上高に基づく潜在的な将来の特許使用料を必要とする可能性がある先見性のある許可協定の締約国である。2024年6月30日まで私たちはあった
注釈 7 。ライセンス契約について
KKC ライセンス · 開発 · 商業化契約
2020年4月、私たちはKKC商業化協定を締結し、この協定に基づいて、特定の特許および独自技術の下で共通の独占的で再許可可能で有料の許可をKKCに付与した制御されているZandelisibおよびZandelisibを含む任意の医薬品は、米国のすべてのヒト適応(米国許可)、および独占(特定の保留された権利制約を受けて、KKC商業化協定の義務を履行する)、再許可、有料、私たちが制御するいくつかの特許および独自技術の下での許可、Zandelisibおよび任意のものを開発および商業化するために、我々によって開発および商業化される
56
医薬品 Zandelisibを含む製品は,米国以外のすべてのヒト適応(前米国と前米国許可証)に適用される。KKCは、KKCが制御する特定の特許およびノウハウに基づいて、米国のすべての人間の適応に適用されるzandelisibを開発および商業化するために、共通独占的、再許可可能な許可を付与し、KKCが制御する特定の特許および独自技術に基づいて、KKCによる商業化協定による米国以外の地域での義務を履行するために、共同独占的、再許可可能、印税免除、全額支払いの許可を付与している。KKCは私たちに$の頭金を支払った
終了協定に署名する前に、KKCはZandelisibの米国以外の地域での開発と商業化を担当し、いくつかの例外を除いて、それに関連するすべての費用を個別に担当する。KKCが可能な状況で前米国地域の生産責任をできるだけ早く負担することが条件であるZandelisibの前米国地域での開発と商業化に必要ないくつかの薬物供給もKKCに提供した。
我々は、主題808および主題606に基づいてKKC商業化プロトコルを評価し、米国の許可、米国の許可、およびサービス(開発サービス)の開発を含む義務を決定した。KKC商業化プロトコルは、我々もKKCも開発および商業化活動の積極的な参加者であり、活動の商業的成功に依存する重大なリスクとリターンに直面しているため、複数の課金単位を含むテーマ808に適合した協力スケジュールであると判断した。米国の許可は、主題808の範囲における課金単位であり、主題606における配信コンテンツではなく、前の米国の許可および開発サービスの履行義務は、主題606の範囲に属する。
中で議論したように注1.業務記述と届出根拠我々は、KKCと共同で、米国におけるzandelisibの開発を停止することを決定した。2023年度には、KKC商業化プロトコルの取引総価格の評価を$として更新した
私たちは取引価格を各帳簿単位に分配する。具体的には,具体的な履行義務を履行する我々の努力に関する可変対価格はこれらの履行義務に完全に割り当てられる.取引価格の他の構成要素は相対的に独立した販売価格に基づいて割り当てられており、管理層はこれを大きく判断している。リスク調整された推定キャッシュフロー正味現在値と開発サービス履行義務の推定独立販売価格を用いて,収益法を用いて発生するコストと適切な利益率を推定することにより,ライセンスの推定独立販売価格を作成した。
これは1ドルです
注8.その他のライセンス契約
Preage許可プロトコル
2017年9月,許可側としてPreage Biosciences,Inc.(Preage)とライセンス契約を締結した。ライセンス契約の条項によると、Preageは、開発、製造および商業化の臨床段階、経口および選択的CDK阻害剤、および関連化合物の世界的独占的権利を付与してくれた。代わりに$を払いました
57
百済神州協力
2018年10月、私たちは百済神州(百済神州)と臨床協力を行い、ザンデリシーブと百済神州のザヌブルチニ(市場名Brukinsa)によるb細胞悪性腫瘍患者の治療の安全性と有効性を評価した。臨床協力協定の条項に基づき,b細胞悪性腫瘍患者のzandelsibとzanubrutinibの併用評価を含む10回の治験を修正した。研究費用は各当事者が平均的に分担し、私たちはzandelisibを提供することに同意し、百済神州はzanubrutinibを提供することに同意する。百済神州の精算費用を私たちの研究開発費の減少と記録しています。我々はZandelisibの全商業権を保持し,百済神州はZanubrutinibの全商業権を保持している.Zandelisib計画の日本国外での終了に伴い,この臨床協力は2023年9月28日に終了した。2024年と2023年6月30日に終了した財政年度において、連結業務報告書に研究·開発費用減少額として記録されている費用支払額は約$
注 9 。リースサービス
2020年7月に賃貸契約を締結しました
レンタル終了
2024年6月18日(合意日)、吾らは所有者と賃貸終了協定(合意)を締結し、この合意に基づき、2024年9月30日に当社の既存オフィススペースのレンタルを終了することで合意した。元の予定期限は
その協定は元の契約に対する賃貸契約の修正として記録されている。このプロトコルの結果として,残りのROU資産とリース負債を約$減少させた
私たちが発生する直接コストは約$です
改訂賃貸契約された経営賃貸費用総額は以下の通り(千計)
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
リースコストを経営する |
|
$ |
|
|
$ |
|
||
可変リースコスト |
|
|
|
|
|
|
||
運営費に含まれる総レンタルコスト |
|
$ |
|
|
$ |
|
||
58
当社の経営リースに関する補足キャッシュフロー情報は以下の通りです(千で計算)
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
計量に含まれる金額のための現金 |
|
|
|
|
|
|
||
レンタル経営からの経営キャッシュフロー |
|
$ |
|
|
$ |
|
||
2024年6月30日まで、私たちは
付記10.株主権益
株式取引
棚登録表
私たちは時々最高$を販売することを可能にする棚登録声明(2024年2月の自己登録声明)を持っています
市場での株式提供
2024年2月20日、Jones Trading Institution Services LLCとオンデマンド増資販売契約を締結し、この合意により、総発行価格を$まで発売することができます
権利協定
開ける
株式承認証
2023 年 5 月発行中の買取令状
2024年6月30日まで購入する未払いの令状があります
株本説明
私たちの法定株式総額は
59
ごく普通である 在庫品
普通株保有者には権利がある
優先して優先する 在庫品
私たちの取締役会は最大の発行権を持っています
注11.株式ベースの報酬
私たちは株式ベースの報酬計画を使用して従業員に長期的な業績激励を提供する。このようなインセンティブは主に株式オプションとRSUを含む。2008年12月、私たちは時々改訂され、再確認された美薬株式会社2008年株式総合持分補償計画(総合計画)を採択した
2021年5月には2021年誘導計画(Inductive Plan)を採択しました
すべての株式報酬の株式ベースの報酬支出総額には、千単位で以下が含まれている
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
研究 · 開発 |
|
$ |
|
|
$ |
|
||
一般と行政 |
|
|
|
|
|
|
||
株式ベースの総報酬 |
|
$ |
|
|
$ |
|
||
株式オプション
従業員に株式オプションを付与する
60
当社のストックオプション活動と関連データの概要は以下の通りです。
|
|
量 |
|
|
加重平均 |
|
|
加重平均 |
|
|
骨材 |
|
||||
2023年6月30日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
授与する |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
没収される |
|
|
( |
) |
|
$ |
|
|
|
|
|
|
|
|||
2024年6月30日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2024 年 6 月 30 日に着用予定。 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2024 年 6 月 30 日現在、発行済オプションの総本質的価値は、原生オプションの行使価格と当社普通株式のクローズ価格の差額として算出されています。 $
未投資ストックオプションに係る未認識補償費用合計 $
当社は、ストックオプションの付与日の公正価値を推定するために、ブラック · ショールズ評価モデルを使用します。これらの公正価値の計算には、
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
リスクフリー金利 |
|
|
% |
|
|
% |
||
予想寿命(年) |
|
|
|
|
|
|
||
波動率 |
|
|
% |
|
|
% |
||
配当率 |
|
|
% |
|
|
% |
||
加重平均は日公正価値を付与する |
|
$ |
|
|
$ |
|
||
制限株式単位(RSU)
各RSUは受信する権利を表すか、または受信する権利がある
注釈 12 。所得税
税引前損失は、以下の法域 ( 数千単位 ) で構成されます。
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
国内 |
|
$ |
|
|
$ |
( |
) |
|
外国 |
|
|
|
|
|
|
||
税引前利益 ( 損益 ) |
|
$ |
|
|
$ |
( |
) |
|
61
米国連邦法定税率で計算された所得税と所得税費用の調整は以下の通りです ( 千単位 ) 。
|
|
6 月 30 日を末日とする会計年度について、 |
|
|||||||||||||
|
|
2024 |
|
|
2023 |
|
||||||||||
|
|
$ |
|
|
% |
|
|
$ |
|
|
% |
|
||||
アメリカの法定税率で税金の割引を受けます |
|
$ |
|
|
|
% |
|
$ |
|
|
|
% |
||||
州税 |
|
|
|
|
|
% |
|
|
|
|
|
% |
||||
株式証法的責任費用 |
|
|
|
|
|
% |
|
|
|
|
|
% |
||||
持分補償 |
|
|
|
|
|
% |
|
|
( |
) |
|
|
% |
|||
評価免除額を変更する |
|
|
( |
) |
|
|
( |
)% |
|
|
( |
) |
|
|
( |
)% |
第 162 条 ( m ) 制限 |
|
|
|
|
|
% |
|
|
|
|
|
% |
||||
他にも |
|
|
|
|
|
% |
|
|
( |
) |
|
|
% |
|||
|
|
$ |
|
|
|
% |
|
$ |
|
|
|
% |
||||
繰延税金債務と資産は、以下のとおり ( 千単位 ) 構成されます。
|
|
六月三十日 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
繰延税金資産(負債): |
|
|
|
|
|
|
||
繰延収入 |
|
$ |
|
|
$ |
|
||
固定資産と無形資産 |
|
|
|
|
|
|
||
R&Dコスト資本化 |
|
|
|
|
|
|
||
株式ベースの支払い |
|
|
|
|
|
|
||
税額損失繰り越し |
|
|
|
|
|
|
||
使用権資産 |
|
|
( |
) |
|
|
( |
) |
リース負債 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
繰延税金資産総額 |
|
|
|
|
|
|
||
繰延税金資産の評価準備 |
|
|
( |
) |
|
|
( |
) |
繰延税金資産と負債純額 |
|
$ |
|
|
$ |
|
||
私たちは繰延税金資産の回収可能性と必要な推定額を評価する。将来の納税申告書で減税を実現する不確実性のため、2024年6月30日と2023年6月30日までの繰延税項純資産について推定手当を記録した。繰延税金資産がより顕在化する可能性があることが決定された場合、推定免税額は減少する。
連邦と州の純営業損失は約300億ドルになりました$
国税法第382条と同様の州法により発生または将来発生する可能性のある所有権変更により、純営業損失の繰越能力を利用することが大きく制限される可能性がある。2021年12月31日までに、私たちは1回または複数回の所有権変更が発生したかどうかを分析し、確かに2回このような所有権変更が発生したかどうかを決定する研究を完了した。我々は2023年には正式な研究を行っていないが,2021年以降は大きな所有権変化は生じていないと考えられる。所有権変更は確かに私たちが毎年使用できる純運営損失金額を制限していますが、私たちのすべての純運営損失は満期までに使用できる予定です。
私たちの以前の所得税申告書は主要な税務管轄区に選ばれて審査されていませんでしたが、各種申告の訴訟時効は開放されています。連邦と州の目的で、潜在審査を受ける最初の申請はそれぞれ2020年と2019年だ。閉鎖された納税年度に関する純営業損失を利用すれば、赤字が発生した納税年度は純営業赤字額に応じて調整される。
2024年6月30日現在の不確定税収状況のため、連結財務諸表上のいかなる税収割引も減少していません また、 2024 年度末までにこの結果を著しく変えるような状況はありません。所得税関連の罰金や利息が発生した場合、追加所得税費用として計上します。
62
項目9.会計·財務開示面の変更と会計士との相違
ない。
第9条。 制御とプログラム
情報開示制御とプログラムの評価
開示制御プログラムは、会社の制御プログラム及び他のプログラムであり、会社が取引法に基づいて提出又は提出された報告において開示を要求する情報が、米国証券取引委員会規則及び表に指定された時間帯に記録、処理、まとめ及び報告されることを確保することを目的としている。開示制御および手続きは、必要な開示に関する決定をタイムリーに行うために、会社が取引法に基づいて提出または提出された報告書に開示を要求する情報が蓄積され、会社管理層(その主要幹部および主要財務官を含む)または同様の機能を果たす者に伝達されることを保証するための制御および手順を含むが、これらに限定されない。本年度報告がカバーする期間が終了するまで、すなわち2024年6月30日まで、我々の経営陣は、我々の最高経営責任者及び最高財務責任者の参加の下で、2024年6月30日現在、取引法第13 a−15(E)及び15 d−15(E)条に規定された規則に適合する当社の開示制御及び手続の有効性を評価した。この評価に基づき、我々の最高経営責任者および最高財務官は、その日までに、我々の開示制御および手続きが有効であると結論した。
経営陣財務報告内部統制年次報告書
我々の経営陣は、財務報告書の十分な内部統制の確立と維持を担当している(取引法第13 a-15(F)及び15 d-15(F)条で定義されている)。財務報告内部統制は、米国公認の会計原則に基づいて財務報告の信頼性及び外部目的のための総合財務諸表の作成に合理的な保証を提供するために、我々の経営陣(我々の主要行政官及び首席財務官を含む)の監督及び参加の下で設計されたプログラムである。経営陣は、トレデビル委員会の内部統制である総合枠組み(2013年)協賛組織委員会が提出した基準に基づき、財務報告の内部統制の有効性を評価した。この評価に基づき、我々の経営陣は、2024年6月30日現在、財務報告に対する内部統制がこれらの基準に基づいて有効であると結論した。
本年次報告書には、財務報告に関する内部統制に関する登録会計士の証明報告書は含まれていません。経営陣の報告書は、本年次報告書において経営陣の報告書のみを提供することを許可する証券取引委員会の規則に従って、当社の登録公認会計事務所による証明の対象ではありません。
財務報告の内部統制の変化
2024 年 6 月 30 日に終了した四半期中に発生した財務報告に関する内部統制 ( 取引法による規則 13 a—15 ( f ) および 15 d—15 ( f ) に定義される ) の変更は、財務報告に関する内部統制に重大な影響を与えたか、または重大な影響を与える合理的な可能性のあるものはありませんでした。
内部統制の内在的限界
私たちの経営陣は、私たちの代理CEOやCEOを含めて、私たちの開示制御や手続き、または財務報告に対する私たちの内部統制がすべてのエラーやすべての詐欺を防止または発見できることを期待していません。設計および動作がどんなに良好であっても、絶対的な保証ではなく、合理的な保証を提供することしかできず、制御システムの目標が実現されることを確保する制御システム。すべての制御システムに固有の限界があるため,どの制御評価も社内のすべての制御問題や不正イベント(あれば)が検出されていることを絶対に保証することはできない.これらの固有の限界は、意思決定過程における判断が誤っている可能性があり、簡単なエラーまたはエラーによって故障が発生する可能性があるという現実を含む。さらに、ある人の個人的な行動、2人以上の結託、または制御の管理を凌駕することによって制御を回避することができる。任意の制御システムの設計も、将来のイベント可能性のいくつかの仮定に部分的に基づいており、どの設計もすべての潜在的な未来の条件でその目標を成功的に達成することが保証されていない。時間の経過とともに,制御が条件の変化により不十分になったり,政策やプログラムへの遵守度が悪化したりする可能性がある.費用対効果を有する制御システムの固有の制限により、エラーまたは詐欺によるエラー陳述が発生し、発見されない可能性がある。
プロジェクト9 B。その他の情報
63
項目 9 C 。ディー検査を妨げる外国法域に関するクローズ
該当しない。
64
第三部
プロジェクト10.取締役、上級管理者、および企業管理
役員.取締役
本年次報告書 ( Form 10—k ) の提出日時点における取締役の氏名、年齢及び特定の経歴を以下に示します。
名前.名前 |
|
年齢 |
|
ポジション保持 |
|
任期満了 |
ニコラス·R·グローバー博士です |
|
55 |
|
ディレクター |
|
2025 年度株主総会 |
フレデリック·W·ドリスコール |
|
73 |
|
ディレクター |
|
2025 年度株主総会 |
トーマス·C·レイノルズ医学博士 |
|
65 |
|
ディレクター |
|
2026 年度株主総会 |
タヘール · ダトゥー |
|
33 |
|
ディレクター |
|
2027 年度株主総会 |
ジェームズ · フリン |
|
44 |
|
ディレクター |
|
2027 年度株主総会 |
スティーブン · D 。木材 |
|
41 |
|
ディレクター |
|
2027 年度株主総会 |
フレデリック · W 。Driscoll 、 73 歳、椅子
ドリスコールさんは2018年2月から美医薬役員を務め、2024年7月22日に取締役会議長に任命された。彼は現在生物技術会社Cue Biophma、臨床段階生物製薬会社Cellectar Biosciences、Inc.と商業段階生物製薬会社Calliditas Treeuticsの取締役会メンバーである。2022年9月から2023年5月までInvivyd,Inc.の臨時首席財務官を務めた。2022年3月から6月まで、彼はリードする末期バイオテクノロジー会社Renovacor,Inc.の首席財務官を務めた。2013年から2017年にかけて、商業段階バイオ製薬会社Flexion Treateutics,Inc.の首席財務官を務め、2021年6月に再加入し、Pacira BioScienceに売却されるまで首席財務官を務めた。Flexionに加入する前、彼は2009年から2013年までNovavax,Inc.の首席財務官を務めた。Driscollさんは、2008年から2009年まで、Genelabs Technologies,Inc.のCEOを務め、2007年から2008年まで、同社のCEOを務めています。2000年から2006年までOxiGENE,Inc.のCEOも務めた。Driscollさんはまた、OxiGENEの監査委員会の議長およびCynapsus Treateutics,Inc.の監査委員会のメンバーを務めています。Driscollさんは、ベントレー大学の会計および金融学士号を所有しています。
ニコラス · R 。グローバー、 Ph. D 、55 歳監督
2013年6月以来、グローバー博士は美医薬の役員メンバーだった。彼は現在バイオテクノロジー産業の顧問だ。これまで2014年7月から2020年5月までの間にセラ腫瘍学社(ナスダック:SRRA)の総裁兼CEOを務めており、癌患者の標的治療の推進に注力している薬物開発会社である。セラに加入する前、2010年11月に腫瘍学薬物開発会社YM Biosciencesの総裁兼最高経営責任者を務め、2013年2月に吉利徳科学社に買収された。これまで、グローバー博士はVivena Biotech社の最高経営責任者兼最高経営責任者であり、バイオ製薬会社であり、モノクロナルに基づく癌治療技術の発見と開発に取り組んでいた。グローバー博士は生命科学リスク投資会社MDS Capitalの投資マネージャーを務めた後、同社に入社した。グローバー博士は理科学士号を持っています。(栄誉)イギリス東英吉利大学化学修士カナダブリティッシュコロンビア大学化学学士号、カナダサイモン·フレイザー大学化学博士号。
トーマス · C 。レイノルズ万. D.,博士、65 歳、監督
レイノルズ博士は2013年2月以来、美の取締役の一員だった。総裁は2013年12月からTwo Padles Consulting LLCに就職し、バイオテクノロジーと製薬会社にコンサルティングサービスを提供している。2014年3月から2021年4月まで、レイノルズ博士は免疫腫瘍学会社延齢球治療会社(ナスダック:TRIL;トロント証券取引所コード:TR)の独立ナスダック取締役を務めた。これまでバイオテクノロジー会社シアトル遺伝子社で首席医療官を務め,2007年3月から2013年2月まで退職してきた。シアトル遺伝学期間中、彼は統合された臨床開発、監督と医療事務組織の構築と指導を担当し、その顕著な表現はAdcetrisの開発と承認である。2002年から2007年まで、レイノルズ博士はZymoGenetics(2010年に百時美施貴宝に買収された)に勤め、最近副総裁を務め、医療事務を担当し、Recothromの臨床開発と監督申告を担当している。これまでは標的遺伝会社臨床事務副主任総裁であり,それ以前はSomatix Treatment社であった(1997年にCell Genesysに買収された)。レイノルズ博士はスタンフォード大学で生物物理学博士と博士号を取得し、ダートマス学院で化学学士号を取得した。
タヒール · ダトゥー ( 33 歳 ) 監督
2023 年 10 月から MEI Pharma の取締役を務めています。田田氏は、 Anson Advisors 、 Inc. で様々な役職を歴任しました。( アンソン ) 2016 年からグローバル投資ポートフォリオを持つヘッジファンドで、直近では 2023 年 1 月からプリンシパル兼ポートフォリオマネージャー、 2019 年 1 月から 2022 年 12 月までポートフォリオマネージャー、 2016 年 4 月から 2019 年 12 月までアナリストを務めました。アンソン在職中は、主に北米のスモールキャップ株式に注力してきました。
65
特別状況とテーマ別投資ですAnson 入社前は、国際金融サービス会社である Bank of Montreal ( NYSE / TSX : BMO ) の資本市場子会社である BMO Capital Markets で 2013 年から 2015 年まで投資銀行員を務めました。DATOU 氏は B. A. を取得しました。マギル大学経済学と金融学を専攻しました
ジェームズ · フリン 44 歳監督
フリンは2023年10月以来、美の役員の一員だった。フリンは現在、2021年に設立された投資コンサルタント会社Nerium Capital LLCの取締役社長兼ポートフォリオマネージャー。Nerium Capital LLCはNerium Partners LPの一般パートナーであり,医療に専念する投資パートナーシップ企業である。これまで、フリンは2017年10月から2018年2月まで国際金融サービス会社Citadel LLCの投資会社兼部門Aptigon Capitalで治療学アナリストを務めていた。これまで、Flynnさんは、2008年から2017年までの間に医療ポートフォリオマネージャーを担当するなど、投資管理会社Amici Capital,LLCで2003から2017年の間に様々な役割を果たしています。彼のキャリアの初期では、フリンさんは、2002年から2003年まで、投資管理会社Putnam Investments LLCのクレジット研究/高収益部門で働いていました。フリンさんは2022年12月から臨床段階バイオ製薬会社ARCA Bioharma,Inc.(ナスダックコード:ABIO)の取締役会メンバーを務め、2024年3月から稀な代謝疾患に集中するバイオ製薬会社Synlogic,Inc.(ナスダックコード:SYBX)の取締役会メンバーを務め、2024年1月から革新特殊成分会社RiceBran Technologiesの取締役会メンバーを務め、2022年7月以来Axiom Health,Inc.(Axiom Health,Inc.)の取締役会メンバーを務める。2020年8月以来、Axiomの顧問を務めてきた。フリンはS.B.を獲得したマサチューセッツ工科大学管理科学学位、金融を専攻し、経済科学を専攻する。フリンさんはフランチャイズ金融アナリスト(CFA)特許所有者である。
スティーブン · ウッド 41 歳監督
2023 年 10 月から MEI ファーマの取締役を務めています。Wood 氏 ( CFA ) は、 GreenWood Investors , LLC の創設者兼最高投資責任者です。2010 年に投資アドバイザリー会社を設立しました2023 年 5 月からは、イタリアに上場する国際航空宇宙 · 防衛企業である Leonardo SpA の取締役を務め、 2019 年 5 月からは、イベリアの上場物流会社である CTt—Correios De Portugal の取締役を務めています。2010 年に GreenWood Investors を設立する前は、 2009 年から 2013 年まで Carr Securities のリサーチアナリストを務めました。以前は、 RBC キャピタルマーケットのシンジケート · アンド · レバレッジ · ファイナンス · グループで投資銀行アナリストを務めました。ケロッグ · キャピタル · グループの特別状況チームでキャリアをスタートしました。ウッド氏は、チャータード · ファイナンシャル · アナリストのチャーターホルダーです。2005 年、トゥーレーン大学で経済学、政治経済学、国際関係学科で 3 つの学位を取得した。
取締役会および委員会に関する情報
取締役会は、 MEI ファーマのコーポレートガバナンス全体について責任を負います。2024 年 6 月 30 日に終了した会計年度において、取締役会のメンバーの大部分は、本年次報告書の時点において、ナスダック証券市場の規則の意味において独立していました。
取締役会は、 MEI ファーマの財務業務を監督する監査委員会、報酬方針、計画およびプログラムを監督する報酬委員会、および年次総会で株主により選出される取締役の指名、欠員補充および新設取締役会の指名 · ガバナンス委員会を設置しました。MEI ファーマのガバナンスに関するすべての事項を評価 · 監視し、 MEI ファーマの法規制上の義務の遵守を監督します。本年次報告書の時点での委員のスケジュールは以下の通りです。
取締役会のメンバー |
監査委員会 |
報酬委員会 |
指名 · ガバナンス委員会 |
タヒエル · ダトゥー * |
|
|
|
フレデリック·W·ドリスコール |
|
|
|
ジェームズ · フリン |
|
|
|
ニック · グローバー博士。 |
|
|
|
トーマス · C 。レイノルズ、 MD 、 PhD |
|
|
|
スティーブン · D 。木材 |
|
|
|
* — 取締役会の独立メンバーではないこと
 = 委員
= 委員
 = 委員長
= 委員長
 = 金融専門家
= 金融専門家
66
監査委員会
取締役会の監査委員会は、改正された 1934 年証券取引法 ( 取引法 ) の第 3 条 ( a ) ( 58 ) ( A ) に基づいて設置されました。監査委員会の職務は以下のとおりです。
Driscoll 氏は、 2019 年 8 月 29 日から監査委員会委員長を務めています。監査委員会の他のメンバーは、 Glover 博士と Flynn 氏です。Driscoll 氏は、取締役会により、 SEC が定義する監査委員会の財務専門家として決定されました。
取締役会は、監査委員会の各メンバーが、ナスダックおよび SEC の規則に従って定義されるように独立であると決定しました。当社は、監査委員会憲章を採択し、ウェブサイトに掲載しています。 Www.meipharma.com. 監査委員会は、 2024 年 6 月 30 日に終了した会計年度において 5 回開催されました。
報酬委員会
報酬委員会は、取締役会に代わって、取締役会の責任を果たすため、次の事項を遂行します。
また、報酬委員会は、特定の年度における適用される役員および従業員の特定の目標に焦点を当て、様々な報酬構成要素の適切な水準と組み合わせに関する最高経営責任者の勧告に相談し、検討します。取締役会は、報酬委員会の書面による憲章を採択しました。 Www.meipharma.com. グローバー博士は、 2021 年 12 月 16 日から報酬委員会の議長を務めています。補償委員会の他のメンバーは、レイノルズ博士とウッド氏です。取締役会は、適用されるナスダックおよび SEC の規則に従って、報酬委員会の各メンバーが独立であると決定しました。報酬委員会は、 2024 年 6 月 30 日に終了した会計年度において 4 回開催されました。
67
指名と統治委員会
指名 · ガバナンス委員会は、取締役会を支援する責任があります。
レイノルズ博士は、 2023 年 1 月から指名 · ガバナンス委員会の議長を務めています。指名 · ガバナンス委員会の他のメンバーは、フリン氏とダトゥー氏です。MEI ファーマの指名 · ガバナンス委員会憲章は、ウェブサイトに掲載されています。 www.meipharma.com. 取締役会は、 Reynolds 氏と Flynn 氏は、適用される Nasdaq および SEC の規則に従って指名およびガバナンス委員会の独立したメンバーであり、 Datoo 氏は、適用される Nasdaq および SEC の規則に従って独立したとはみなされないと決定しました。2024 年 6 月 30 日に終了した会計年度には、指名委員会が 5 回開催されました。
来年度の株主総会において取締役会の指名検討のために独立取締役候補を提案したい株主は、候補者の氏名、履歴書、および履歴書を、株式会社 MEI Pharma 秘書 Justin J. File に提出することにより、その候補者を提案することができます。9920 Pacific Heights Blvd , Suite 150 , サンディエゴ , カリフォルニア州 92121 。事務局長が受領したすべての株主指名については、 MEI 定款の事前通知規定に準拠しており、指名 · ガバナンス委員会が他の手段により特定した個人と同じ検討のために指名 · ガバナンス委員会に提出されます。
取締役候補者の最低資格は定めていませんが、指名 · ガバナンス委員会は、候補者の履歴書を審査し、以下の基準を含む様々な要因に基づいて、各候補者の独立性、多様性、スキル、専門知識を評価します。
これらの要素を適用するには指名と管理委員会のメンバーが指名と管理委員会が監査委員会に提案する時に判断する必要があり、定量的な方法で測定することはできない。また、指名·統治委員会は、取締役会候補の多様性を多くの要因の一つとして考慮しており、これには技能や経験の多様性、地理、性別、年齢、族の多様性が含まれている可能性がある。しかし、指名と統治委員会は取締役会候補を決定する際に多様性を考慮するための正式な政策についていない。指名と管理委員会と取締役会は一般的に各メンバーの医療保健、生命科学とその他の領域における広範な商業経験と独立した商業判断力を重視する。具体的には、製薬業界、金融分野での彼のビジネス経験と監査委員会の財務の専門家としての彼の地位に基づいて、Driscollさんは取締役会に入る資格があります。グローバー博士の腫瘍学分野でのビジネス経験と薬物開発経験から、取締役会に入る資格がある。レイノルズ博士は,彼の医療経験や臨床開発,監督,医療事務の経験に基づいて,取締役会に入る資格がある。フリンさんは、製薬業における彼の業務経験と事業開発経験に基づき、取締役会に入る資格を持っている。Datooさんは、彼のビジネス開発経験に基づき、取締役会のメンバーに就任する資格があります。さんウッドの業務発展経験によると、彼は取締役会のメンバーになる資格がある。
68
さらに、指名 · ガバナンス委員会は、 MEI の法的 · 規制上の義務の遵守を監督し、以下を定期的にレビューします。
役員は自主独立している
取締役会は、ナスダック上場基準に定められた独立性の要素に従って、各取締役の独立性を決定しています。取締役会では、各取締役から要請された情報に基づき、 Driscoll 氏、 Glover 氏、 Reynolds 氏、 Flynn 氏および Wood 氏が MEI Pharma と実質的な関係なく、現在施行されている Nasdaq の取締役独立性基準の意味において独立していると判断しました。ダトゥー氏は、現在適用されているナスダックの取締役独立性基準の意味において独立とはみなされません。上記の判断において、取締役会は、ナスダックの独立性基準に定める客観的テストと、取締役の責任遂行における取締役の独立した判断の行使を妨げる関係がないことを判断するために必要な各取締役に関する主観的措置の両方を考慮しました。
取締役会の指導構造
Driscoll 氏は、 2024 年 7 月から取締役会長を務めています。取締役会は、同じ人が最高経営責任者と取締役会長の両方を務めるべきか、または役割が分離されるべきかを取り扱う方針を持っていません。当取締役会は、当時の MEI に適切なリーダーシップ体制であると考えられるものに基づいて、柔軟な判断を下すべきと考えています。取締役会は、現時点で MEI にとって現在のリーダーシップ構造が適切であると考えています。
リスク規制における取締役会の役割
リスクは、年間を通じて取締役会と委員会の審議に不可欠な部分です。取締役会は、リスク管理プロセスの究極の監督責任を負いますが、取締役会の様々な委員会もリスク管理の責任を負います。特に、監査委員会は、内部統制を含む財務リスクに焦点を当て、経営陣からの財務リスク評価報告書を受けています。補償プログラムに関連するリスクは、補償委員会によって審査されます。指名 · ガバナンス委員会は、後継者計画や法的コンプライアンスを含むガバナンスリスクの監督を行います。取締役会は、これらの委員会から、重要なリスクと経営陣の対応について、定期的な更新を通じて助言されます。
取締役会の多様性
以下の表は、取締役会の構成に関する特定の情報を示します。表に記載されている各カテゴリーは、ナスダック上場規則 56 0 5 ( f ) において付属されている意味を持っています。
取締役会ダイバーシティマトリックス ( 2024 年 8 月 31 日現在 ) |
||||
役員総数 |
6 |
|||
|
女性は |
男性 |
非バイナリ |
性別は明かさなかった |
第1部:性別同意 |
|
|
|
|
役員.取締役 |
— |
6 |
— |
— |
第2部:人口統計的背景 |
|
|
|
|
アフリカ系アメリカ人や黒人 |
— |
— |
— |
— |
アラスカ原住民あるいは原住民 |
— |
— |
— |
— |
インド人 · 南アジア人 |
— |
1 |
— |
— |
スペイン系やラテン系 |
— |
— |
— |
— |
ハワイ先住民や太平洋島民 |
— |
— |
— |
— |
白 |
— |
5 |
— |
— |
2つ以上の人種や民族 |
— |
— |
— |
— |
LGBTQ+ |
— |
— |
— |
— |
人口統計の背景は明らかにされていない |
— |
— |
— |
— |
69
取締役会ダイバーシティマトリックス ( 2023 年 8 月 31 日現在 ) |
||||
役員総数 |
8 |
|||
|
女性は |
男性 |
非バイナリ |
性別は明かさなかった |
第1部:性別同意 |
|
|
|
|
役員.取締役 |
1 |
7 |
— |
— |
第2部:人口統計的背景 |
|
|
|
|
アフリカ系アメリカ人や黒人 |
— |
— |
— |
— |
アラスカ原住民あるいは原住民 |
— |
— |
— |
— |
アジア人 |
— |
1 |
— |
— |
スペイン系やラテン系 |
— |
— |
— |
— |
ハワイ先住民や太平洋島民 |
— |
— |
— |
— |
白 |
1 |
6 |
— |
— |
2つ以上の人種や民族 |
— |
— |
— |
— |
LGBTQ+ |
— |
— |
— |
— |
人口統計の背景は明らかにされていない |
— |
— |
— |
— |
反ヘッジ · プレッジポリシー
当社のインサイダー取引方針に基づき、 MEI のすべての取締役、役員、従業員およびコンサルタントは、 MEI の有価証券のヘッジに関する制限の対象となります。これらの制限は、 MEI が所有する有価証券について、当社が補償報酬として当該有価証券を付与したかどうかにかかわらず、適用されます。当社のインサイダー取引方針は、 MEI の有価証券の空売りや当社の有価証券に関する上場オプション取引を行うことを禁止しています。また、インサイダー取引方針では、当該者が当社の有価証券をマージン口座に保有したり、融資の担保として MEI の有価証券を質押したり、当社の有価証券に関する常任注文を行うことは認められていますが、推奨されません。
取締役会との株主コミュニケーション
当社の株主は、取締役以外の役員を含む取締役会に対し、当該人または株式会社メイファーマの管理者宛に書面による連絡を送付することにより、連絡を取ることができます。連絡先 : 秘書、 9920 Pacific Heights Blvd 、Suite 150 , San Diego , CA , 92121 。すべての通信は、事務局長によって編集され、宛先に提出されます。取締役会がこのプロセスを変更した場合、改訂されたプロセスは当社のウェブサイトに掲載されます。
役員の委任
当社の改正 · 改定の設立証明書及び改正 · 改定の定款では、取締役の数は取締役会の決議によって定めるが、 2 人から 9 人までの間と規定しています。現在は 6 人の取締役がいます。
当社の改正 · 改定の設立証明書及び改正 · 改定の定款に基づき、取締役は、取締役が解任、退職、またはより早く退任しない限り、年次株主総会において 3 年間の任期で選出されます。理事会は、任期に関して 3 つのクラスに分かれており、 1 つのクラスの任期は毎年満了します。この機密取締役会の規定は、第三者が MEI の株式を入札したり、 MEI Pharma の支配権を取得しようとすることを妨げる可能性があります。また、取締役会の方針に同意しない株主が取締役会の過半数の解任を 2 年間延期することもできる。
取締役はいつでも辞任することができる。辞任は、通知の受領時に有効となります。取締役の選出に投票権を有する株主の決議により、理由により取締役の任免をすることができる。取締役会の辞任、解任又は増員による欠員については、現役取締役の過半数の決議により、又は残留取締役の一人によって補充することができ、その任命された取締役は、欠員が発生した取締役会の満期間の残りの期間を務める。
取締役会 · 株主総会への取締役の出席
平成 25 年 6 月 30 日を末日とする会計年度において、取締役会は計 24 回開催され、各取締役は取締役会の総会議数及び取締役会各委員会の総会議数の 75% 以上に出席しました。
全取締役は、年次株主総会に出席します。その後、 2023 年 12 月に開催された年次株主総会には全取締役が出席しました。
道徳的規則
当社は、取締役および従業員 ( 執行役員および財務責任者を含む ) に適用される事業倫理方針を採択し、当社のウェブサイトに掲載しています (Www.meipharma.com投資家のガバナンス文書 ( Investors — Governance Documents )また、当社は、 (i) 当社の最高経営責任者および最高財務責任者に適用されるポリシーの変更の性質、および (ii) これらの特定された個人のいずれかに付与されるポリシーの規定からの暗黙の免除を含む免除の性質、付与された当該個人の氏名、および、当社の最高経営責任者および最高財務責任者に適用されるポリシーの変更の性質を速やかに開示する予定です。
70
免除と免除の日付を将来のウェブサイトに掲載します。本明細書に明記されている場合を除き、当社のウェブサイトに含まれる情報は、本明細書に参照することにより組み込まれず、フォーム 10—k の本年次報告書の一部とみなされません。
行政員
当社の執行役員は、取締役会の裁量によって任命され、務めます。本年次報告書の提出時点における MEI ファーマの執行役員に関する氏名および特定の履歴を以下に示します。
ジャスティン · J · ファイル ( 54 歳 ) 最高経営責任者代行、最高財務責任者、秘書
フィル·さんは2024年8月1日以来、当社の最高経営責任者を務め、2023年8月1日から当社の最高財務責任者を務めてきました。フェールさんは、会計や金融面で30年以上の経験を持ち、上場企業や民間企業で働いています。彼は過去17年間、生命科学業界を含む様々な業界で働いてきた幅広い経験を持っている。フィル·さんは2015年から2023年までイヴォーフェム生物科学のチーフ財務官兼会社秘書を務め、女性向けの非ホルモン避妊薬としてPhexxiを開発·商業化した。Evofem期間中、彼は逆合併を通じて会社の上場を助け、会社の財務と会計、情報技術と投資家の関係を監督することを担当した。これまで、フィルさんは、財務および会計監督コンサルティングサービスを実行するためのバイオテクノロジー会社を提供し、その前に、彼は、分子診断会社Sequenom,Inc.で会計業務および報告をリードしていた。また、彼はSequenom診断子会社の財務責任者を務めた。産業に参入する前に、フィルさんは約10年間公共会計部門で働き、主にArthur Andersen LLPで働いていた。フィッシャー·さんは、中央ワシントン大学を卒業し、会計および工商管理理学の学士号を取得した。彼は公認会計士(非在職)。
プロジェクト11.役員報酬
報酬問題の検討と分析
この報酬の議論と分析は、要約報酬表で特定された指定された役員に対する報酬戦略、方針、プログラムおよび慣行について説明します。2024 年度の執行役員には David m が任命されます。Urso 、最高経営責任者兼ゼネラル · カウンセル、 Justin J. File 、最高財務責任者兼秘書、 Richard G 。ガリーワン · D 、本報酬討論および分析において、当社の指定執行役員として総称する最高医療責任者。
報酬理念と目標
執行役員の業績は、企業目標の達成能力に大きな影響を与えると考えています。したがって、当社は、役員報酬プログラムの設計と管理を非常に重視しています。このプログラムは、最高レベルで業績を上げ、当社の成長と成功に貢献する有能な個人を誘致し、動機づけ、維持することにより、株主価値を高めることを目的としています。当社の役員報酬プログラムは、個人および企業の業績に結びついた報酬機会を提供するように設計されています。
当社の全体的な報酬哲学は、執行役員に年間基本給与を支払い、現金および株式インセンティブを通じて、特定の主要な業績目標が達成または上回った場合により高い報酬を提供する機会を提供することです。2024 年度の報酬戦略の主な原則は以下の通りです。
報酬委員会のプロセス
報酬委員会は取締役会を代表して取締役会の職責を履行し、私たちの報酬政策、計画、計画を監督し、幹部と取締役に支払う報酬を適宜審査し、決定する。この任務を達成するために、報酬委員会は、(I)長期戦略目標および報酬計画の企業業績目標および目的を検討し、承認し、強化すること、(Ii)役員の個人業績を審査すること、(Iii)株式報酬スケジュール、新規雇用従業員の持分奨励に関する時間および定価、役員および非執行従業員および役員の昇進および年間贈与に関する政策を策定すること、(Iv)地域および業界範囲の報酬慣行および傾向を審査し、当社の業界比企業における当社の役員報酬計画の適切性、充足性および競争力を評価すること。(V)行政者の任意の雇用協定、解散費協定、制御権変更保障および任意の他の報酬スケジュールを検討および承認する条項、(Vi)報酬リスク評価を行うこと、および(Vii)株主フィードバックおよび報酬発言権投票結果を考慮すること。
71
我々最高経営者の報酬については、報酬委員会は、関連する業績目標や目的に応じて、報酬委員会の政策、および長期奨励的報酬、株主報酬、および最近の役員報酬に関する株主相談投票結果に基づいて、最高経営者の業績を評価する。報酬委員会の審査及び承認(又は適用される場合、取締役会が最終決定及び承認を行うことを提案する)は、当社の他の行政者の個人及び会社が目標及び目標を表現することを提案する。報酬委員会は最高経営責任者が私たちの他の執行官の報酬について提案した提案を審議する。報酬委員会はまた、この報酬議論および分析部分について取締役会に提案し、この部分を私たちの任意の10-k表年次報告、登録声明、依頼書、または情報声明に含めることを提案します。
報酬委員会は、少なくとも年に 1 回、または委員が必要または適当と判断する頻度で会合します。報酬委員会は、その憲章に基づき、報酬コンサルタント、法律顧問、または報酬委員会の職務および責任の遂行を支援するために報酬委員会が決定するその他のアドバイザーを、顧問の独立性に関与する SEC およびナスダックが規定する要因を考慮した後にのみ、独自の裁量で保持または取得する権限を有します。
役員報酬の設定
報酬委員会は、執行役員報酬決定プロセス全体の構成要素としてピアグループ分析を考慮していますが、執行役員報酬を特定のベンチマークレベルまたは他の会社の執行役員報酬水準と比較したパーセンテージに設定しようとしていません。報酬委員会は、そのような競争データのレビューと個人の業績の評価に基づいて、各役員の報酬のミックスを決定します。当社の報酬に対するアプローチは、市場外観ではなく、内部目標と株主価値の両方に結びついた短期報酬と長期報酬の典型的なミックスに基づいているため、役員による過度のリスクテイクを奨励するものではないと考えています。
2024 年度の同等企業グループは、経営陣と F のインプットを受け、報酬委員会で承認された類似の上場医薬品開発会社 20 社で構成されました。W 。クック補償コンサルタント。ピアグループは、市販製品からの実質的な収益が一般的ではなく、腫瘍学医薬品開発企業に重点を置く、市場資本が大きく類似している医薬品開発企業 ( 2023 年 6 月のピアデータの審査時点のピア市場資本中央値は 11100 万ドル ) で構成されています。
エグリアバイオセラプティクス |
クロノスバイオ |
バイオアトラ |
リープセラピュティクス |
カーディフ腫瘍学 |
分子テンプレート |
CEL—SCI 株式会社 |
Oncternal Therapeutics |
CytomX Therapeutics |
ピエリス製薬会社 |
ESSA 製薬 |
リゲル製薬 |
フュージョンファーマ |
表面腫瘍学 |
G1 セラピュティクス |
シロス製薬会社 |
糖模倣薬 |
株式会社ウロゲンファーマ |
カリオファーム · セラピュティクス |
ヴェラステム |
報酬委員会は、当社のベース報酬、現金インセンティブ、エクイティプログラムは、定義された企業目標と目的の達成に報酬を与えると考えています。これは、特に業界の競争的性質を考慮して、既存の役員を維持し、新しい役員を採用できる競争力のあるプログラムを確保するために不可欠です。
ピアデータは、 2024 年度の役員報酬の設定の文脈として使用されました。報酬委員会は目標ベンチマークを設定していませんが、 2024 年度の直接報酬総額は、 CEO およびその他の役員全員の中央値を下回っており、 2024 年度の新 CEO としての Urso 氏の報酬総額は、前 CEO の Dr. Gold 氏の 2023 年度の報酬総額よりもかなり低かった。さらに、 Urso 氏は、 2023 年度の持分報酬に含まれていたため、 2024 年度の持分報酬は提供されませんでした。2023 年度のオプション価値には、 2022 年 7 月の COO 兼ゼネラルカウンセラーとしての 2023 年度の定期賞と、 2023 年 6 月の CEO への昇進を認める第 2 回の助成金、 2024 年度の CEO エクイティ賞が含まれます。
株主投票の役割
2023 年 12 月に開催された年次株主総会において、約 94% の株主が議決したことで、任命された執行役員に対する報酬について諮問法で承認されました。報酬委員会は、報酬理念や報酬プログラムの構成要素を評価する際に、株主、報酬コンサルタント、代理アドバイザーからのインプットを考慮し、企業目標の達成レベルや同業者の報酬データをさらに考慮し、報酬決定が市場慣行と広く整合的であるようにしています。
72
補償要素
各役員の報酬は、 ( i ) 基本給与、 ( ii ) 業績に基づく現金インセンティブ、および ( iii ) 株式に基づく報酬の 3 つの重要な要素があります。これらの役員報酬の要素は、執行役員の利益と株主の利益を一致させることを目的としています。
基本給
基本給与は、執行役員がその責任を果たした上で一定額の報酬を提供します。執行役員入社時や昇進時の基本給与を設定します。執行役員基本給与は、報酬コンサルタントとの協議を経て、報酬委員会が第 1 四半期に毎年見直し、決定しています。補償委員会は、 2024 年度中に Urso 氏と File 氏の給与を増額しなかった。ガリー博士の給与は 2024 年度に 5% 引き上げられました。
パフォーマンスベースの現金インセンティブ
報酬委員会は、執行役員に対する現金報酬の総額を、企業目標の達成に有意義な金額を割り当てることは、執行役員の利益と株主の利益と一致すると考えています。報酬委員会は、執行役員ごとに、基本給与のパーセンテージで表される年間インセンティブボーナスの目標を設定しています。2024 年度のボーナスの基本給与の割合は、年度の初めに Urso 氏が 50% 、 Ghalie 博士と File 氏が 40% に設定されました。企業の目標と目的は、一般的に臨床および運営活動を前進させ、株主収益を向上させるための重要なパス活動または戦略的イニシアチブです。
目標の定義と期間終了時のスコアリングの両方において可能な限り客観的であったが、スコアリング目標には成果の質を認識するための主観的な要素が含まれていた。
以下は、報酬委員会の報酬総額決定の指針となった 2024 年度の主な企業目標について説明します。
説明する |
ヴォルシリー |
1)臨床試験コホート登録目標 |
2)FDA ブリーフィングブック提出議定書改正案 |
3)前臨床 · 臨床データパッケージの完成 |
ME-344 |
4)臨床試験コホート登録目標 |
5)前臨床 · 臨床データパッケージの完成 |
金融 |
6)会計年度末の最低現金残高に十分な資金を維持する。 |
報酬委員会は、上記目標の達成に基づき、目標の 91.5% を達成したと判断しました。指名された執行役員には、個人調整なしで目標のボーナスの 91.5% が支給されました。
株式ベースの報酬
報酬委員会は、長期的な価値創造は株式と株に基づく報酬によって我々の役員表現を奨励する所有権文化によって実現されていると考えている。このような株主価値創出に対する潜在的な見返りもまた私たちが戦略を維持するための鍵だ。私たちが改訂と再予約した美医薬株式会社2008年総合株式補償計画(2008株式計画)によると、私たちは奨励性と非制限株式オプション、株式付加権、制限株、制限株式単位及び業績株と単位を付与することができる。株式オプションは10年後に満期となり、行使価格は付与時の公平な市場価値に等しく、通常は1年後に25%が付与され、その後次の36ヶ月以内に月等額で分割払いされ、3ヶ月の終了後の行使期限がある。2024年度の近地天体へのすべての株式奨励は株式オプションであり、自然に業績に基づいているため、付与後の株価が上昇しない限り、何の価値もない。
定期的な年間持分付与周期は本年度開始時に発生し,2024年度開始時に首席医療官Ghalie博士に7.01ドルの発行価格で30,000株の我々普通株を購入するオプションを付与し,付与日の終値である。このオプション奨励金額の授与日の公正価値は同業者会社の中央値の半分以下であり、梅幹部の将来の相対的重要性に対する評価、彼らを維持する必要性及び彼らの職位の市場データに基づいている。CEOを務める場合には2023年6月(2023年度)に奨励金が設けられるため、Ursoさんは2024年度にオプションの奨励を受けることができない。Filesさんは、2023年6月(2023年度)に彼が奨励を受けたため、オプションのインセンティブを得ない2024年度になる。私たちがオプションを付与したのは、彼らが付与後に株価が上昇するという自然な業績要求を持っているからだ。本年度報告を提出した日までに,2024年までと期間に付与されたすべてのオプションは現在負の値の状態にあり,我々の現在の株価計算では何の価値も提供しない.
73
役員特典 · 特典
当社は、有給休暇、健康保険、会社資金による HSA 口座、会社スポンサーによる 401 ( k ) プランを含む、指定された役員を含む従業員に福利厚生プログラムを提供しています。当社の執行役員には、一般的に退職給付や補足給付は受けず、上記の給付制度に他の正社員と同様に参加しています。
管理契約の解雇と変更
Ursoさん、Ghalie博士とさんの各雇用契約は、適用従業員が我々を解雇した場合に支払われる特定の散逸料を規定していますが、他の理由や適用従業員による十分な理由で解雇されています、これらの条項は、それぞれの雇用契約に定義されています。上記の雇用終了後、吾らは、(I)適用従業員に当該従業員の基本給12ヶ月(当該従業員の雇用終了時に有効)に相当する金を代通知金とし、(Ii)適用従業員の引受権の付与を加速し、当該従業員に同じ数の普通株式株式を付与するが、当該従業員が吾等の追加12ヶ月間雇用を継続しているように、当該等引受権の規定を受けなければならない。このような支払いや追加の選択権付与は、吾等及びその付属会社を受益者とする慣行債権解除の実行を条件として、吾等が規定する形で行われる。代通知金は、行政上実行可能な場合には、できるだけ早く法律で規定された解除協定の最長審査及び撤回期限(ある場合)後又は吾等の一任適宜決定された早い日後に適用従業員に一度に支払うことができるが、いずれの場合も適用従業員の雇用終了後60日を超えてはならない。上記の規定により2023年6月30日に雇用が終了すると、Ursoさん、Ghalie博士、Mr Filesがそれぞれ614,000元、503,165元、450,000元の12か月間の基本賃金を取得する権利があり、91.5%の目標で280,905元、184,158元、164,700元の2024財政年度ボーナスが支払われることになります。具体的には、Ursoさん39,582株、Ghalie博士20,385株、さんFiles 13,326株の12ヶ月間のオプションを得る権利があります。すべての3つの近地天体について、2024年6月30日にオプション付与加速の内在的価値はゼロになるであろう。なぜなら、すべてのオプションが水中にあるからである。2008年に規定された美医薬統制権が変更される場合には、理事会報酬委員会が別途決定しない限り、Ursoさん、Ghalie博士、さんFilesが付与されるすべての株式購入は、コントロール変更の日から加速され、完全に行使可能になります。すべての3つの近地天体にとって、制御権が変化した場合、2024年6月30日現在、付与されていない株式オプションの内在的価値はない。
Urso 氏と Ghalie 博士の CEO と CMO としての雇用は、 2024 年 8 月 1 日に原因なく当社によって終了しました。Urso 氏と Dr. Ghalie 氏の解雇は、それぞれ 2023 年 6 月 2 日および 2024 年 1 月 16 日の雇用契約に基づき、 12 ヶ月間の基本給与と、今後 12 ヶ月間に付与される株式オプションの部分の加速付与、業績および取締役会の裁量に基づく 2025 年度のボーナスを支給しました。さらに、今後 12 ヶ月間に付与される株式数を反映して、 Urso 氏に 61,646 件のオプション、 Ghalie 博士に 18,861 件のオプションがそれぞれ加速されました。Urso 氏と Ghalie 博士の付与オプションは、当初の任期を超えることなく、 1 年間のサービス分離後に行使することができる。
税務·会計面の考慮
特定の報酬要素が当社に及ぼす税金および会計上の影響は、執行役員に対する報酬パッケージを評価および推奨する際に報酬委員会にとって重要な考慮事項です。一般的に、報酬委員会は、株主へのリターンを最大化するために役員を引き付け、維持し、報酬を与える効果的な報酬プログラムを創設するという目的と、そのような報酬の適切な税務および会計結果の必要性のバランスを取ることを目指しています。
報酬委員会は、税務上の影響を考慮することに加えて、異なる持分報酬の規模と形態を決定する際に、持分報酬に関連して認識される費用の影響を含む、その決定の会計上の影響を考慮します。
CEO報酬比率
SEC の規則では、当社の代表取締役社長兼最高経営責任者であるデイビッド · ウルソ ( David Urso ) の 2024 年度の最高経営責任者の年間報酬総額、最高経営責任者を除く全従業員の年間報酬総額の中央値、およびその相互に対する比率 ( CEO 報酬比率 ) を開示することを求めています。当社の最高経営責任者の年間報酬総額および全従業員の年間報酬総額の中央値は、要約報酬表に適用される SEC 規則に従って計算されます。2024 年度の金額は以下のとおりです。
74
報酬従業員中央値の決定にあたっては、 2024 年 6 月 30 日を決定日として選びました。現在、最高経営責任者を除く従業員数は 27 名です。会計年度全体に勤務していない従業員の報酬を年次化しました。当社の従業員報酬中央値の決定および CEO 給与比率の計算において、当社は SEC 規則で認められている免除のいずれかを使用しておらず、重要な仮定、調整または推計に頼っていません。
上記の CEO 給与比率は、 SEC の規則に沿った方法で決定された 2024 年度の合理的な見積もりであると考えています。報酬中央値の従業員を特定し、その従業員の年間報酬総額に基づいて CEO 報酬比率を計算するための SEC の規則は、企業がさまざまな方法論を採用し、特定の免除を適用し、報酬方針を反映した特定の仮定、調整または推定を行うことを許可しています。したがって、 CEO の給与比率は、給与比率の計算に異なる方法論、仮定、調整または推計を使用した他の企業が報告した給与比率と比較できない可能性があります。
報酬委員会報告
当社の報酬委員会は、規制 S—k の項目 402 ( b ) によって要求され、この代理ステートメントに含まれる報酬の議論と分析を経営陣とレビューし、議論しました。このような検討と議論を踏まえ、報酬委員会は、本年次報告書の提出日時点で、取締役会報酬委員会のメンバーによる報酬議論と分析を含めるよう、取締役会に勧告しました。
ニコラス · R 博士。グロバー
トーマス·C·レイノルズ博士
スティーブン · ウッド氏
本セクションは資料を勧誘するものではなく、 SEC に提出されたものとみなされず、取引法または証券法に基づく当社の提出書類に参照によって組み込まれることはありません。ただし、フォーム 10—k の年次報告書は、本契約の日付の前後に行われても、そのような提出書類の一般的な組み込み言語にかかわらず、提供されるとみなされる場合を除きます。
75
役員報酬
執行役員
2024 年 6 月 30 日に終了した会計年度における執行役員については、以下のとおりです。
報酬総額表
以下は、 2024 年 6 月 30 日期および 2023 年 6 月 30 日期における役員報酬を表しています。
名称と主要ポスト |
|
財政年度 |
|
給料(元) |
|
|
株式賞 ( $ ) ( 1 ) |
|
|
オプション賞 ( $ ) ( 2 ) |
|
|
非持分インセンティブプラン報酬 ( $ ) ( 3 ) ( 4 ) ( 5 ) ( 6 ) |
|
|
他のすべての補償(ドル) |
|
|
合計 ( $ ) (6) |
|
||||||
デイヴィッド · M 。ウルソ (7) |
|
2024 |
|
$ |
614,000 |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
280,905 |
|
|
$ |
— |
|
|
$ |
894,905 |
|
社長と最高経営責任者 |
|
2023 |
|
$ |
541,185 |
|
|
$ |
— |
|
|
$ |
1,352,600 |
|
|
$ |
207,273 |
|
|
$ |
— |
|
|
$ |
2,101,058 |
|
リチャード G 。ガリー (9) |
|
2024 |
|
$ |
503,165 |
|
|
$ |
— |
|
|
$ |
159,800 |
|
|
$ |
184,158 |
|
|
$ |
— |
|
|
$ |
847,123 |
|
首席医療官 |
|
2023 |
|
$ |
479,205 |
|
|
$ |
— |
|
|
$ |
218,900 |
|
|
$ |
148,554 |
|
|
$ |
— |
|
|
$ |
846,659 |
|
ジャスティン J. ファイル (8) |
|
2024 |
|
$ |
450,000 |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
164,700 |
|
|
$ |
— |
|
|
$ |
614,700 |
|
最高財務責任者 |
|
2023 |
|
$ |
25,673 |
|
|
$ |
— |
|
|
$ |
295,600 |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
321,273 |
|
雇用協定
当社は、指定された各執行役員と、それぞれの雇用条件を定めた書面による雇用契約を締結しました。
デイヴィッド M との雇用契約。Urso と MEI Pharma
2023 年 5 月 31 日、 MEI 取締役会は、 2023 年 6 月 2 日付で、ウルソ氏を MEI の社長兼最高経営責任者に任命しました。また、 2023 年 6 月 8 日から 8 月 1 日まで MEI 取締役会にも選出されました。
76
2024.ウルソ氏は、 MEI の 2025 年の年次株主総会で任期満了、またはそれ以前の辞任または解任まで、取締役会のメンバーを務めました。
ウルソ氏社長兼最高経営責任者の就任に伴い、ウルソ氏と MEI は、 2018 年 7 月 12 日付の修正第 1 号により改正された 2014 年 3 月 6 日付の MEI とウルソ氏との間の既存の雇用契約に代わる、 2023 年 6 月 2 日付の新規雇用契約 ( CEO 雇用契約 ) を締結しました。CEO 雇用契約では、年俸 61 万 4 千ドル、年俸の 50% のボーナスの機会を目標に規定していました。Urso 氏は、 MEI の健康、退職、経費償還およびその他の給付計画に参加する資格がありました。
CEO雇用協定は、2023年6月2日に、Meiの株式補償計画に基づいて、Mei普通株のいくつかの株式を購入する選択権を付与し、授出日Meiが発行した株式の2.5%に相当し、4年間以内に帰属、制御権変更のすべての帰属及びCEO雇用協定及び他の高級管理者に付与された他の条項及び条件に一致する他の条項及び条件(CEO初期付与)に相当することを規定している。最高経営責任者が初歩的に授与した執行価格は、日ナスダックの1株当たりの米株の終値に等しい。さらに行政総裁は、合併完了日に株式オプションを付与することを規定しており、合併完了日および授出日(合併終了日)に記載されているウルソさんが米国または連属会社に雇用されているか、またはそのサービスを提供することになっているのは、合併完了日(合併発効日の直後に計算)に等しい米で発行されている株式の2.5%から、行政総裁が初歩的に授受した美の株式の数を差し引くことになっている。ただし、梅さんの持分補償計画(行政総裁令第二次発行)の規定によると、例年に見られるウルソカの株式購入額に含まれる株式の総数は200,000株を超えてはならない。最高経営責任者が2回目に授与した行権価格は、授出日(合併終了日)の米株1株当たりのナスダックの終値に等しい。最高経営責任者は、最高経営責任者が最初に付与したのと同じ帰属条項を2回目に付与する。
株式補償計画の1人当たり株式制限により、2023年の合併完了日にCEOが2回目に付与した全オプションを付与できない場合、2024年1月2日に完了日に付与できない株式数のオプション(Top Off Grant)が付与され、2024年1月2日に米の株式補償計画がTop Off Grantに使用できる十分な株式がない場合には、Meiが株式補償計画に基づいて確かに十分な株式を有する最初の後続日にこのような付与を付与することが前提となる。Top Off Grantを取得するためには、さんUrsoは、美またはその関連会社に適用される付与日に雇用されるか、またはそのサービスを提供する必要があります。Top Offが付与した行使用価格は、Top Off付与日のナスダック株1株当たりの終値に等しく、Top Off付与は最高経営責任者が最初に付与したものと同じ帰属条項を持つことになる。合併が完了していない場合は、CEOの雇用契約の条項および条件に応じてさんCEOをUrsoに2回目の助成金を提供する場合もあります(適用されるようなTop Off Grant)。米の取締役会は2023年5月31日、CEOの初期贈与、CEOの第2贈与、Top Off Grant(場合によっては)を承認し、それぞれの授与日に発効した。
2024 年以降、ウルソ氏は MEI の他の上級役員と同様の条件で株式報酬を受け取ることができます。MEI は、 CEO 雇用契約および付属契約の交渉に関連して、 Urso 氏の弁護士費用を最大 7,500 ドルまで支払う。
理由なく“行政総裁雇用契約”によると、密生さんが理由なく雇い止めやUrsoさんの辞任を理由に辞職した場合、Ursoさんは以下の解散料給付を受ける資格があり、有効なクレーム解消書に署名したことを前提とする:(I)基本賃金12か月分の一括払い;(Ii)コブラ医療継続保険を選択した場合、Meiはメガネ蛇保険料を12ヶ月間支給する;(Iii)年間年間ボーナスを比率で支払う、(Iv)さんUrsoの付与を速めた場合には、当該部分買取権を行使しない場合は、当該部分買付権は、契約終了後に引き続きMeiで12ヶ月間雇用された場合に付与されるべき株式購入者の数に相当する。また、メイ氏が支配権変更のために取引の他方の要求を理由なく中止した場合、Ursoさんの雇用を理由なく中止したり、支配権変更後2年以内に、Ursoさんの雇用が理由なく終了したり、不当な理由でUrsoさんが辞任したりした場合、Ursoさんの購入権不行使はその終了日に完全に帰属して行使可能となり、有効な授権書が署名されたことを前提に、行政総裁の登用契約も定められている。
Urso 氏の死亡または障害により雇用が終了した場合、 Urso 氏の発行済株式オプションの一部の付与は、終了後 12 ヶ月間 MEI に雇用され続けていた場合に付与されたオプションの数に等しいものとし、障害の場合に有効な解雇を実行することを条件とします。
Urso 氏は、 2014 年 4 月 7 日付の従業員所有情報および発明契約の対象となり続けました。
リチャード · G の雇用契約。ガリー & メイファーマ
2021 年 5 月 3 日付で最高医療責任者 ( チーフメディカルオフィサー ) に就任したことに関連して、 2016 年 2 月 17 日付の就職状 ( 改定後、「 Ghalie 雇用状」 ) の修正を締結しました。Ghalie 雇用レターでは、年俸 463,000 ドルと普通株式 75,000 株を購入するためのストックオプション賞が提供されました。2021 年 7 月 1 日付で、ガリー雇用状の条件に基づき、ガリー博士は年次現金ボーナスを受ける資格がありました。
77
取締役会報酬委員会によって定められたマイルストーン達成に基づいて、基本給与の最大 40% を支給します。
1ヶ月前に通知してくれれば、Ghalie博士は十分な理由がない限り、いつでも彼の雇用関係を終了することができます(Ghalie招聘書で定義されているように)。Ghalie博士は雇用を中止する十分な理由を持つことができ、方法は十分な理由を招いた事件発生後60(60)日以内に私たちに通知することである(私たちは通知を受けてから30(30)日以内に治癒できなかった原因事件)。私たちは(ガリ招聘書で定義されているように)理由があるかどうかにかかわらず、ガリ招聘書をいつでも終わらせる権利がある。もし私たちがGhalie博士の雇用を理由なく中止したり、Ghalie博士が雇用を中止する十分な理由があれば、Ghalie博士は(I)その基本給12(12)ヶ月に相当する一括払いを得る権利があり、(Ii)彼に付与されたオプションを加速させ、Ghalie博士は同じ数のオプションを付与され、彼が私たちに雇用され続けるように、12ヶ月以上雇用されるだろうが、彼の遺言執行とクレーム解除は撤回されないだろう。Ghalieの招聘書には秘密条項が含まれている。
ジャスティン · J · ファイルと MEI ファーマの雇用契約
ファイルの最高財務責任者への任命に関連して、ファイルの氏と MEI は 2023 年 6 月 12 日付で雇用契約 ( CFO 雇用契約 ) を締結しました。CFO 雇用契約では、年俸 45 万ドル、年俸の 40% のボーナスの機会を目標としています。ファイル氏は、 MEI の健康、退職、経費償還およびその他の給付計画に参加する資格があります。
CFO 雇用契約は、 2023 年 6 月 12 日付で、 MEI の出資補償計画に基づき、 MEI の発行済株式の 0.8% に相当する MEI の普通株式の数の購入オプションを付与し、 4 年間、支配権の変更に全額付与することを規定しています。CFO 雇用契約およびその他の上級役員への助成金と整合的なその他の利用規約。CFO Initial Grant の行使価格は、付与日の MEI 株式 1 株あたりのナスダック取引先価格に等しいものとします。2024 年以降、ファイル氏は MEI の他の上級役員と同様の条件で株式報酬を受ける資格があります。
CFO雇用契約によれば、FILEさんの雇用がMEIによって理由なく終了した場合、またはFILEさんが有効なクレーム解除契約を結んだ場合、FILEさんが効果的なクレーム解除プロトコルを締結した場合、FILEさんは、以下の解散料給付を受ける資格がある:(I)基本賃金12カ月分の一括払い、(Ii)メガネ蛇医療継続保険を選択した場合、MEIは、12ヶ月間の毎月のメガネ蛇保険料、(Iii)年度終了年度の年間ボーナスを比例支払い、および(Iv)最終契約後にMei 12ヶ月で継続雇用された場合に付与されるべき株式購入金額に相当する部分Filesさんの未行使持分の付与を加速する。CFO雇用契約は、支配権変更の3ヶ月以内に、メイが取引の他方の要求を変更し、FILEさんの採用を理由なく終了したり、コントロール権変更後2年以内に、FILEさんの採用がMEIによって理由なく終了したり、FILEさんが有効な解除授権書に署名しなければ、FILEさんが有効な解除授権書に署名しなければ、その行使しない株式購入権は終了日に完全に帰属して行使できることを規定している。
ファイルの死亡または障害により雇用が終了した場合、ファイルの未払いストックオプションの一部の付与は、終了後 12 ヶ月間 MEI に雇用され続けていた場合に付与されたオプションの数に等しいものと加速されます。
我々が2024年7月22日に戦略的代替案を求めることを発表したことについて、フェールさんとメイさんはその雇用協定を改正し、2024年8月1日から発効する。その改訂によれば、FILEさんは、取締役会の委任を受けて追加署名行政総裁を務め、その年間基本給を550,000ドルに増加させ、その目標年次ボーナス機会を基本給の50%に増加させます。また、(I)取締役会が決定した特定金額を超える現金残高が(I)管理権変更の終了日(計量日)末までの2024年12月31日現在又は(I)取締役会が決定した特定金額を超えた場合には、さんが出席料を取得する資格がある。成功費用は、当社の計量日が指定金額を超えた期末現金残高の10%に相当し、(I)2025年6月30日または(Ii)当社は理由なく雇用関係を終了しますが、成功費用支払日FILEさんが当社に雇用されるまでは一度の現金支払いで支払うことになります。
78
2024 年 6 月 30 日に終了する会計年度における計画に基づく賞の授与
|
|
|
|
非持分インセンティブプランの報酬の見積もり ( 1 ) |
|
その他全株価償還株式数単位 |
|
その他のオプション賞原有価証券オプション数 |
|
|
オプション賞の行使価格または基準価格 |
|
|
付与日株式 · オプション賞の公正価値 |
|
|||||||
名前.名前 |
|
授与日 |
|
目標.目標 |
|
|
極大値 |
|
|
|
|
|
|
|
|
|
|
|
||||
デヴィッド·ウルソ |
|
適用されない |
|
$ |
307,000 |
|
|
適用されない |
|
— |
|
— |
|
|
— |
|
|
— |
|
|||
リチャード G 。ガリーワン · D. |
|
2023年9月29日 |
|
$ |
201,266 |
|
|
適用されない |
|
— |
|
|
30,000 |
|
|
$ |
7.01 |
|
|
$ |
159,800 |
|
ジャスティン J. ファイル |
|
適用されない |
|
$ |
180,000 |
|
|
適用されない |
|
— |
|
— |
|
|
— |
|
|
— |
|
|||
( 1 ) 取締役会は、単一のボーナスの目標を設定し、報酬概要表に記載されているように、ボーナスの支給を目標水準の 91.5% にすることを決定しました。
2024 年 6 月 30 日の優秀株式賞
以下の表は、 2024 年 6 月 30 日に当社の指定役員が保有するすべてのストックオプションおよび RSU の情報を示しています。
|
|
オプション大賞 |
|
株式大賞 |
|
|||||||||||||||||
|
|
未行使オプションの有価証券数 ( 行使可能 ) |
|
|
未行使オプションの有価証券数 ( 未行使 ) |
|
|
|
|
オプションの行使価格 |
|
|
オプションが満期になる |
|
未帰属株式または株式単位数 |
|
未帰属株式または株式単位の時価 |
|
||||
名前.名前 |
|
(#) |
|
|
(#) |
|
|
脚注 |
|
( $/ 株 ) |
|
|
日取り |
|
(#) |
|
($) |
|
||||
デヴィッド·ウルソ |
|
|
41,643 |
|
|
|
124,928 |
|
|
(1), (17) |
|
$ |
7.50 |
|
|
6/2/2033 |
|
— |
|
$ |
— |
|
|
|
|
25,156 |
|
|
|
27,344 |
|
|
(2), (17) |
|
$ |
10.80 |
|
|
7/5/2032 |
|
— |
|
$ |
— |
|
|
|
|
21,875 |
|
|
|
8,125 |
|
|
(3), (17) |
|
$ |
59.00 |
|
|
7/1/2031 |
|
— |
|
$ |
— |
|
|
|
|
25,704 |
|
|
|
546 |
|
|
(4), (17) |
|
$ |
69.80 |
|
|
7/2/2030 |
|
— |
|
$ |
— |
|
|
|
|
17,500 |
|
|
— |
|
|
(5) |
|
$ |
50.40 |
|
|
7/1/2029 |
|
— |
|
$ |
— |
|
|
|
|
|
11,000 |
|
|
— |
|
|
(6) |
|
$ |
85.60 |
|
|
7/12/2028 |
|
— |
|
$ |
— |
|
|
|
|
|
6,500 |
|
|
— |
|
|
(7) |
|
$ |
86.60 |
|
|
6/22/2028 |
|
— |
|
$ |
— |
|
|
|
|
|
6,500 |
|
|
— |
|
|
(8) |
|
$ |
56.60 |
|
|
7/6/2027 |
|
— |
|
$ |
— |
|
|
|
|
|
6,500 |
|
|
— |
|
|
(9) |
|
$ |
27.20 |
|
|
7/28/2026 |
|
— |
|
$ |
— |
|
|
|
|
|
6,375 |
|
|
— |
|
|
(10) |
|
$ |
31.40 |
|
|
7/27/2025 |
|
— |
|
$ |
— |
|
|
リチャード·G·ガリ |
|
— |
|
|
|
30,000 |
|
|
(16), (17) |
|
$ |
7.01 |
|
|
9/29/2033 |
|
— |
|
$ |
— |
|
|
|
|
|
13,425 |
|
|
|
14,575 |
|
|
(2), (17) |
|
$ |
10.80 |
|
|
7/5/2032 |
|
— |
|
$ |
— |
|
|
|
|
11,671 |
|
|
|
4,329 |
|
|
(3), (17) |
|
$ |
59.00 |
|
|
7/1/2031 |
|
— |
|
$ |
— |
|
|
|
|
2,892 |
|
|
|
858 |
|
|
(13), (17) |
|
$ |
71.00 |
|
|
5/3/2031 |
|
— |
|
$ |
— |
|
|
|
|
7,344 |
|
|
|
156 |
|
|
(4), (17) |
|
$ |
69.80 |
|
|
7/2/2030 |
|
— |
|
$ |
— |
|
|
|
|
7,500 |
|
|
— |
|
|
(5) |
|
$ |
50.40 |
|
|
7/1/2029 |
|
— |
|
$ |
— |
|
|
|
|
|
6,500 |
|
|
— |
|
|
(6) |
|
$ |
85.60 |
|
|
7/12/2028 |
|
— |
|
$ |
— |
|
|
|
|
|
3,250 |
|
|
— |
|
|
(14) |
|
$ |
57.60 |
|
|
7/7/2027 |
|
— |
|
$ |
— |
|
|
|
|
|
1,250 |
|
|
— |
|
|
(12) |
|
$ |
27.60 |
|
|
7/13/2026 |
|
— |
|
$ |
— |
|
|
|
|
|
6,500 |
|
|
— |
|
|
(11) |
|
$ |
24.20 |
|
|
3/6/2026 |
|
— |
|
$ |
— |
|
|
ジャスティン J. ファイル |
|
|
13,326 |
|
|
|
39,976 |
|
|
(15) |
|
$ |
7.35 |
|
|
6/12/2033 |
|
— |
|
$ |
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
79
オプションの行使とストックベスト
Urso 氏、 Ghalie 氏および File 氏は、 2024 年 6 月 30 日に終了した会計年度中に株式オプションを行使しませんでした。2023 年 6 月 30 日に終了した会計年度において 1,000 RSU が Ghalie 博士に付与されました。
報酬と業績
以下は、取引法に基づいて公布された規制 S—k の項目 402 ( v ) に基づき要求される報酬対業績開示です。項目 402 ( v ) の要求に従って、我々は以下のものを含めた。
注 :第 402 ( v ) ( 8 ) 項に基づき、 MEI は、中小報告会社として、第 402 ( v ) 条で要求される情報を 5 年間ではなく 3 年間提供しており、 402 ( v ) ( 2 ) ( iv ) または 402 ( v ) ( 5 ) 条で要求される開示を提供する必要はありません。または 402 ( v ) ( 2 ) ( vi ) によって要求される当社の選択された措置の開示、または 402 ( v ) ( 6 ) に基づいて提供される表リスト。
現在の給与プログラムを考えると、当社の NEO の SCt と CAP の金額の唯一の違いは、出資報酬の価値です。 SCt の目的では、当年中に付与された出資報酬の付与日の公正価値に基づいており、 CAP の目的では、年末時点で未投資または付与された出資報酬の公正価値の年比変化に基づいています。年中に没収された。
80
この開示は、項目 402 ( v ) に従って作成されており、 NEOs が株式報酬から実現した価値を必ずしも反映するものではありません。役員報酬プログラムの目的と役員報酬と業績を整合させる方法については、上記の報酬の議論と分析を参照してください。
給与と業績を結びつけるための最も重要な指標。 第 402 項 ( v ) の要求に従い、以下は、 2024 年度の CAP と業績を結びつける最も重要な指標です。2024 年の執行役員報酬と業績を結びつけるために、 2024 年 6 月 30 日時点の連結バランスシートにおける総現金 ( 現金、現金同等物および短期投資の総額 ) は、株価に加えて唯一の財務業績指標でした。
報酬決定を行う際に考慮されるその他の財務以外の業績要因には、臨床マイルストーン、個人の業績、責任範囲、市場内での賃金競争力の年次評価が含まれます。
報酬と業績対照表.第 402 項 ( v ) に従い、 2010 年のドッド · フランク · ウォール街改革 · 消費者保護法に基づき SEC が採択した規則に基づき、当社は、 2022 年度、 2023 年度および 2024 年度の最高経営責任者 ( 当社の最高経営責任者または PEO ) および PEO 以外の NEO の平均について表式開示を提供します。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
株主の総リターンに基づく100ドルの初期固定投資価値 |
|
|
|
|
|
|
|
||||||||||||
財政年度 |
|
現在の PEO 合計の概要報酬表 |
|
|
現在の PEO に実際に支払われた報酬 |
|
|
元 PEO 合計の概要報酬表 |
|
|
元 PEO に実際に支払われた補償 |
|
|
非 PEO の平均要約報酬表合計 |
|
|
非 PEO に実際に支払われた平均報酬 |
|
|
MEI 総株主リターン |
|
株主総数 |
|
|
MEI 純利益 |
|
|
会社選択の指標 : 現金総額 ( 百万ドル )(5) |
|
||||||||||
(a) |
|
(b) |
|
|
(c) |
|
|
(b) |
|
|
(c) |
|
|
(d) |
|
|
(e) |
|
|
(f) |
|
|
|
|
(h) |
|
|
(i) |
|
||||||||||
2024 |
|
$ |
894,905 |
|
|
$ |
233,569 |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
730,912 |
|
|
$ |
563,489 |
|
|
$ |
7 |
|
$ |
88 |
|
|
$ |
18 |
|
|
$ |
38 |
|
2023 |
|
$ |
2,101,058 |
|
|
$ |
1,689,893 |
|
|
$ |
2,446,640 |
|
|
$ |
1,853,678 |
|
|
$ |
772,486 |
|
|
$ |
640,229 |
|
|
$ |
12 |
|
$ |
79 |
|
|
$ |
(32 |
) |
|
$ |
101 |
|
2022 |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
2,528,609 |
|
|
$ |
268,643 |
|
|
$ |
1,260,180 |
|
|
$ |
250,830 |
|
|
$ |
21 |
|
$ |
73 |
|
|
$ |
(54 |
) |
|
$ |
153 |
|
財政年度 |
|
ポリオキシエチレン |
|
近地軌道近地天体 |
2024 |
|
デイヴィッド · M 。ウルソ ( 現在の ) |
|
ジャスティン · J · ファイルとリチャード · G 。ガリー |
2023 |
|
デイヴィッド · M 。ウルソ ( 現在の ) |
|
ブライアン · G 。ドラズバとリチャード · Gガリー |
2022 |
|
ダニエル·P.Gold |
|
ブライアン · G 。Drazba, Richard G.ガリーとデイヴィッド m 。ウルス |
81
|
現行政主任(URSO)(一) |
|
|||||||
財政年度 |
2022 |
|
2023 |
|
2024 |
|
|||
SCT合計 |
$ |
1,744,152 |
|
$ |
2,101,058 |
|
$ |
894,905 |
|
*SCTレポートの株式およびオプションで年間報酬を対象としている |
|
(1,078,500 |
) |
|
(1,352,600 |
) |
|
— |
|
*本年度に付与された未帰属株式およびオプション報酬の公正価値 |
|
167,280 |
|
|
1,064,015 |
|
|
— |
|
未帰属株式とオプション奨励の公正価値の前年度比の変化 |
|
(508,767 |
) |
|
(70,339 |
) |
|
(501,428 |
) |
*帰属年度に付与された株式およびオプション報酬の公正価値 |
|
— |
|
|
— |
|
|
— |
|
株式とオプション奨励の公正価値の前年度と比較した変化 |
|
(127,938 |
) |
|
(52,241 |
) |
|
(159,908 |
) |
*年間で没収された株式およびオプション報酬を対象とした公正価値 |
|
— |
|
|
— |
|
|
— |
|
実際に支払われた賠償金 |
$ |
196,227 |
|
$ |
1,689,893 |
|
$ |
233,569 |
|
|
|
|
|
|
|
|
|||
|
前行政事務主任(金)(一) |
|
|||||||
財政年度 |
2022 |
|
2023 |
|
2024 |
|
|||
SCT合計 |
$ |
2,528,609 |
|
$ |
2,446,640 |
|
$ |
— |
|
*SCTレポートの株式およびオプションで年間報酬を対象としている |
|
(1,536,800 |
) |
|
(584,700 |
) |
|
— |
|
*本年度に付与された未帰属株式およびオプション報酬の公正価値 |
|
238,374 |
|
|
— |
|
|
— |
|
未帰属株式とオプション奨励の公正価値の前年度比の変化 |
|
(747,241 |
) |
|
— |
|
|
— |
|
*帰属年度に付与された株式およびオプション報酬の公正価値 |
|
— |
|
|
188,782 |
|
|
— |
|
株式とオプション奨励の公正価値の前年度と比較した変化 |
|
(214,299 |
) |
|
(129,123 |
) |
|
— |
|
*年間で没収された株式およびオプション報酬を対象とした公正価値 |
|
— |
|
|
(67,921 |
) |
|
— |
|
実際に支払われた賠償金 |
$ |
268,643 |
|
$ |
1,853,678 |
|
$ |
— |
|
|
|
|
|
|
|
|
|||
|
平均非 PEO ( 金 ) ( i ) |
|
|||||||
財政年度 |
2022 |
|
2023 |
|
2024 |
|
|||
SCt Total |
$ |
1,260,180 |
|
$ |
772,486 |
|
$ |
730,912 |
|
対象年度の SCt で報告された株式 · オプション賞金額 |
|
(671,067 |
) |
|
(177,850 |
) |
|
(79,900 |
) |
対象年度における未出資株式およびオプション賞の公正価値 |
|
104,085 |
|
|
101,680 |
|
|
43,649 |
|
発行済未投資株式およびオプション賞の公正価値の前年度からの推移 |
|
(349,416 |
) |
|
(31,805 |
) |
|
(100,239 |
) |
対象年度における株式およびオプション賞の公正価値 |
|
— |
|
|
— |
|
|
— |
|
対象年度における株式 · オプション賞の公正価値の変動について |
|
(92,952 |
) |
|
(24,282 |
) |
|
(30,933 |
) |
対象年度中に没収された株式 · オプション賞の公正価値 |
|
— |
|
|
— |
|
|
— |
|
実際に支払われた賠償金 |
$ |
250,830 |
|
$ |
640,229 |
|
$ |
563,489 |
|
|
|
|
|
|
|
|
|||
(i)CAP の計算に使用されるオプション報酬の公正価値は、 FASb 718 に従って Black—Scholes オプション価格モデルを使用して決定されました。 |
|
||||||||
CAP と TSR の関係.以下のチャートは、 PEO と非 PEO の平均 NEO CAP と、当社の TSR とピアグループ TSR の関係を反映しています。

82
CAP と GAAP 純利益 ( 損失 ) の関係.以下のチャートは、 PEO と非 PEO の平均 NEO CAP と GAAP 純利益 ( 損失 ) の関係を反映しています。

CAP と総現金の関係 ( 選択した指標 ) 。 以下のチャートは、 PEO CAP と非 PEO の平均 NEO CAP と当社の総現金の関係を反映しています。

役員の報酬
以下の表は、 2024 年 6 月 30 日に終了した会計年度における取締役会を務めた社外取締役に支払われた報酬の詳細を示します。
|
|
現金で獲得または支払われた手数料 ( $) (1) |
|
|
オプションアワード ( $) (2) |
|
|
合計(ドル) |
|
|||
名前.名前 |
|
|
|
|
|
|
|
|
|
|||
チャールズ V · バルト 3 世 (3) |
|
$ |
96,433 |
|
|
$ |
51,600 |
|
|
$ |
148,033 |
|
フレデリック · W 。ドリスコール (4) |
|
|
65,600 |
|
|
|
51,600 |
|
|
|
117,200 |
|
ニコラス · R 。グロバー、 Ph. D.( 5 ) |
|
|
71,183 |
|
|
|
51,600 |
|
|
|
122,783 |
|
トーマス · C 。レイノルズ万. D.,博士課程( 6 ) |
|
|
63,683 |
|
|
|
51,600 |
|
|
|
115,283 |
|
ダニエル · P · ゴールド ( 7 ) |
|
|
15,200 |
|
|
|
51,600 |
|
|
|
66,800 |
|
タマール D 。ハウソン (8) |
|
|
19,367 |
|
|
|
51,600 |
|
|
|
70,967 |
|
スージャー·R·カンゴ(9) |
|
|
19,367 |
|
|
|
51,600 |
|
|
|
70,967 |
|
タヒエル · ダトゥー (10) |
|
|
68,060 |
|
|
|
— |
|
|
|
68,060 |
|
ジェームズ · フリン (11) |
|
|
37,067 |
|
|
|
77,000 |
|
|
|
114,067 |
|
スティーブン · ウッド (12) |
|
|
35,400 |
|
|
|
77,000 |
|
|
|
112,400 |
|
83
( 1 ) 2024 年 6 月 30 日を末日とする会計年度において、社外取締役はそれぞれ年間 45,600 ドルの現金留保を受けました。監査委員会 : 20,000 ドル、報酬委員会 : 15,000 ドル、指名 · ガバナンス委員会 : 10,000 ドル、戦略委員会 : 10,000 ドルである。委員長として報酬を受けていない委員は、監査委員会 : 1 万ドル、報酬委員会 : 7,500 ドル、指名 · ガバナンス委員会 : 5,000 ドル、戦略委員会 : 7,000 ドルとして追加報酬を受け取った。この金額は、会計年度未満の勤務期間に対して比例配分されます。
賠償協定
私たちは私たちのすべての役員と幹部と賠償協定を締結した。いくつかの例外を除いて、賠償協定は、被補償者が、私たちまたは私たちの要求に応じて別のエンティティに提供される地位またはサービスの地位、または私たちに別のエンティティにサービスを提供することを要求する地位、または私たちまたは私たちにサービスを提供する別のエンティティの地位または私たちまたは私たちに別のエンティティにサービスを提供することを要求する場合によって、または私たちに別のエンティティにサービスを提供することを要求する場合に、補償された人が、かつてまたは現在、または一方として列挙されている可能性のある訴訟によって引き起こされたり、支払われたすべての費用について補償を行うことが規定されている。当社または当社の権利による訴訟に加えて、当社または当社の要求に応じて当社または別のエンティティにサービスを提供する場合、または当社または別のエンティティにサービスを提供し、損害を受けた者が損害を受けているか、または脅かされている当事者である場合、賠償協定は、損害を受けた者も被賠償者が招いたまたは支払うすべての責任によって賠償を受けることができると規定している。賠償協定はまた、場合によっては、賠償者が賠償を受けることができるクレームによって発生した費用は事前に支払うことができると規定している。
各補償者の権利は、当社の改正および再定式された設立証明書および当社の改正および再定式された細則 ( 時々改正される ) に基づき、デラウェア州法に基づいて規定されるその他の権利に加えてあります。
84
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
次の表は、2024年9月13日現在の私たちの普通株式の実益所有権の情報(以下、他の説明を除く):(I)既知の実益が私たちの普通株式の5%以上を持っている人、(Ii)私たちの指名された役員と取締役、および(Iii)私たちの役員と取締役をグループとして示しています。米国証券取引委員会の規則と規定に基づいて受益権属を決定する。一人の実益が所有する株式数とその人の所有権百分率とを計算する際に、オプション、株式承認証又は制限株式単位に制限された普通株は、2024年9月13日又はその日から六十(60)日以内に行使可能又は転換可能な普通株を発行済み株式とみなす。しかし、他の人の所有権率を計算することについては、このような株は発行された株とはみなされない。以下に説明する受益所有権パーセンテージは、上記発行済み普通株数の調整に加えて、2024年9月13日現在の6662,857株発行普通株に基づく。
実益所有者の氏名又は名称及び住所 |
|
受益所有権の金額及び性質 |
|
|
実益所有株式の割合 |
|
|
||
安信基金管理有限公司(1) |
|
|
1,093,188 |
|
|
|
16.40 |
|
% |
ケーブルカーキャピタル LLC ( 2 ) |
|
|
611,440 |
|
|
|
9.20 |
|
% |
ヴァンガード · グループ ( 3 ) |
|
|
389,807 |
|
|
|
5.85 |
|
% |
役員および指名された行政員 |
|
|
|
|
|
|
|
||
ジャスティン J. ファイル ( 4 ) |
|
|
18,878 |
|
|
* |
|
|
|
フレデリック · W 。ドリスコール (5) |
|
|
26,916 |
|
|
* |
|
|
|
ニコラス · R 。グロバー、 Ph. D.( 6 ) |
|
|
28,375 |
|
|
* |
|
|
|
トーマス · C 。レイノルズ万. D.,博士課程( 7 ) |
|
|
28,875 |
|
|
* |
|
|
|
タヒエル · ダトゥー (8) |
|
|
- |
|
|
* |
|
|
|
ジェームズ · フリン (9) |
|
|
17,378 |
|
|
* |
|
|
|
スティーブン · ウッド (10) |
|
|
86,570 |
|
|
|
1.30 |
|
% |
グループとしての現役取締役 · 執行役員全員 ( 7 名 ) |
|
3.05 |
|
% |
|||||
85
延滞金第16条報告
1934 年の証券取引法第 16 条 ( a ) 項の改正により、当社の取締役および特定の役員は、当社の株式の保有および取引について SEC に報告することを要求しています。当社の記録およびその他の情報に基づき、 2024 年度において、第 16 条 ( a ) の対象となった当社の取締役および役員は、以下のものを除くすべての適用可能な提出要件を満たしたと考えています。誤った管理エラーにより、取締役会各メンバー — カンゴ · スジェイ、トーマス · レイノルズ、タンナー · ハウスソン、ダニエル · ゴールド、ニコラス · グローバー、Frederick Driscoll と Charles Baltic III とチーフメディカルオフィサーの Richard Ghalie は、 2023 年 9 月 29 日に発行された株式助成金を報告するために、 2023 年 10 月 12 日に遅延フォーム 4 を提出しました。
第13項:特定の関係及び関連取引、並びに取締役独立性
2024 年 6 月 30 日に終了した 2 年間において、規制 S—k の第 404 項に従って開示する必要のある関係者取引はなかった。
プロジェクト14.チーフ会計士費用とサービス
監査委員会は、 MEI の 2025 年 6 月 30 日期財務諸表の監査を行うために、独立した登録会計事務所としてデロイト & トゥーシュ LLP ( デロイト ) を選定しました。取締役会は、デロイトの指名について、企業慣行として、株主に承認を提出しています。
年次総会にはデロイトの代表者が出席する予定です。デロイトの代表者は、会議で声明を行う機会があり、適切な質問に回答することが期待されます。
独立公認会計士事務所に支払う費用
当社の独立した登録公認会計事務所は、 Deloitte & Touche LLP 監査役事務所 ID : 34 です。
BDO USA, P. C. (BDO)2011 年 1 月 18 日から 2023 年 6 月 30 日に終了する会計年度まで、その後の中間期は 2023 年 9 月 30 日に終了する会計年度まで、当社の独立公認会計事務所を務めました。2023 年 12 月 19 日、監査委員会は、 2023 年 12 月 26 日付で独立した登録公認会計事務所をデロイトに変更することを承認しました。
以下の表は、 2024 年 6 月 30 日を末日とする会計年度における当社の主たる会計事務所であるデロイトと、 2023 年 6 月 30 日を末日とする会計年度における当社の旧主たる会計事務所である BDO の手数料の合計を表しています。
|
|
徳勤 |
|
|
BDO |
|
||
|
|
2024年6月30日 |
|
|
2023年6月30日 |
|
||
課金(1) |
|
$ |
528,525 |
|
|
$ |
806,100 |
|
監査関連費用 |
|
|
— |
|
|
|
— |
|
税金(2) |
|
|
— |
|
|
|
76,580 |
|
他のすべての費用 |
|
|
— |
|
|
|
— |
|
総費用 |
|
$ |
528,525 |
|
|
$ |
882,680 |
|
承認前の政策と手順
監査委員会は、独立監査人が実施するすべての監査および非監査業務を事前承認するための方針および手続を採択しています。この方針は、独立監査役が提供するすべての業務について、監査委員会による独立監査役の委任範囲の承認の一環として、またはケースバイケースで事前に承認することを要求しています。
86
第4部
項目15.物証、財務諸表付表
連結財務諸表を参照してください。 項目 8 。連結財務諸表及び補足データ 第 2 部で。
2.財務諸表の添付表
財務諸表のスケジュールは、必要ではないため、または連結財務諸表または本フォーム 10—k の年次報告書に含まれるその注記に含まれているため省略されています。
3.展示品
展示品索引
|
|
|
|
参照により組み込まれる |
||||||
展示品 番号をつける |
|
説明する |
|
スケジュール / 表 |
|
書類番号. |
|
展示品 |
|
提出日 |
2.1 |
|
|
8-K |
|
000-50484 |
|
2.1 |
|
2023年2月23日 |
|
3.1 |
|
|
8-K |
|
000-50484 |
|
3.1 |
|
2023年4月14日 |
|
3.2 |
|
|
8-K |
|
001-41827 |
|
3.1 |
|
2023年12月22日 |
|
3.3 |
|
|
8-K |
|
000-50484 |
|
3.1 |
|
2011 年 05 月 11 日 |
|
3.4 |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2011 年 03 月 18 日 |
|
3.6 |
|
|
8-K |
|
000-50484 |
|
3.1 |
|
2023 年 10 月 3 日 |
|
4.1 |
|
|
S-1 |
|
333-109129 |
|
4.1 |
|
2023年10月31日 |
|
4.2 |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2018 年 05 月 16 日 |
|
4.3 |
|
|
10-K |
|
000-50484 |
|
4.3 |
|
2019 年 9 月 9 日 |
|
4.4 |
|
|
10-K |
|
000-50484 |
|
4.4 |
|
2023 年 9 月 26 日 |
|
4.5 |
|
2023 年 10 月 1 日付の MEI Pharma 株式会社間の権利契約Computershare Inc. (as権利代理人 ) |
|
8-K |
|
000-50484 |
|
4.1 |
|
2023 年 10 月 3 日 |
10.1† |
|
|
10-Q |
|
001-41827 |
|
10.1 |
|
2024年5月9日 |
|
10.2† |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2017 年 4 月 3 日 |
|
10.3† |
|
|
10-K |
|
000-50484 |
|
10.5 |
|
2021年9月2日 |
|
10.4† |
|
2021 年 4 月 29 日付の MEI Pharma , Inc. 間の 2016 年 2 月 17 日付の雇用書簡に対する 2021 — 1 の修正。リチャード G 。ガリー |
|
10-K |
|
000-50484 |
|
10.6 |
|
2021年9月2日 |
10.5† |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2011 年 08 月 29 日 |
|
10.6** |
|
2017 年 9 月 5 日付の MEI Pharma 株式会社間のライセンス契約。Presage Biosciences, Inc. |
|
10-Q |
|
000-50484 |
|
10.1 |
|
2017 年 11 月 8 日 |
87
10.7 |
|
Mei Pharma,Inc.,スイス信用証券(米国)有限責任会社とStifel,Nicolaus&Company,Inc.が2020年11月10日に調印した市場株式発行販売協定。 |
|
8-K |
|
000-50484 |
|
1.1 |
|
2020年11月10日 |
10.8 |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2018 年 05 月 16 日 |
|
10.9** |
|
許可、開発、商業化協定は、2018年10月31日に、当社がKyowa Hakko麒麟株式会社(現Kyowa麒麟社と呼ぶ)と締結します |
|
10-Q |
|
000-50484 |
|
10.1 |
|
2019 年 2 月 7 日 |
10.10+ |
|
当社がKyowa麒麟株式会社(前身はKyowa Hakko麒麟Co.,Ltd.)と締結した許可、開発、商業化協定は、2020年4月13日となっている |
|
10-K |
|
000-50484 |
|
10.12 |
|
2021年9月2日 |
10.11† |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2021年12月23日 |
|
10.12† |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2022 年 7 月 7 日 |
|
10.13† |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2023年6月2日 |
|
10.14† |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2023年6月13日 |
|
10.15† |
|
|
8-K |
|
000-50484 |
|
10.2 |
|
2023年6月13日 |
|
10.16† |
|
|
8-K |
|
000-50484 |
|
10.3 |
|
2023年6月13日 |
|
10.17 |
|
Mei Pharma,Inc.とKyowa Kirin Co.,Ltd.(前身はKyowa Hakko麒麟Co.,Ltd.)の間の終了プロトコル日付:2023年7月14日 |
|
8-K |
|
000-50484 |
|
10.1 |
|
2023年7月19日 |
10.18 |
|
Mei Pharma,Inc.Infinity PharmPharmticals,Inc.への解約状,日付は2023年7月23日 |
|
8-K |
|
000-50484 |
|
10.1 |
|
2023年7月24日 |
10.19† |
|
|
8-K |
|
000-50484 |
|
10.1 |
|
2023年7月27日 |
|
10.20 |
|
|
10-K |
|
000-50484 |
|
10.22 |
|
2023 年 9 月 26 日 |
|
10.21 |
|
|
8-K |
|
001-41827 |
|
10.1 |
|
2023年11月1日 |
|
10.22† |
|
|
10-Q |
|
001-41827 |
|
10.4 |
|
2024年2月13日 |
|
10.24*゚+ |
|
|
|
|
|
|
|
|
|
|
23.1* |
|
|
|
|
|
|
|
|
|
|
23.2* |
|
|
|
|
|
|
|
|
|
|
31.1* |
|
2002年サバンズ-オキシリー法第302節に基づいて成立した1934年“証券取引法”第13 a-14(A)及び15 d-14(A)条に基づいて首席執行及び財務幹事証明書が発行された。 |
|
|
|
|
|
|
|
|
32.1* |
|
|
|
|
|
|
|
|
|
88
|
|
アメリカ合衆国法典第 18 編第 63 章 ( 18 U. S.C. 1350 ) 。 |
|
|
|
|
|
|
|
|
97* |
|
MEI クラウバックポリシー |
|
|
|
|
|
|
|
|
101 INS |
|
連結されたXBRLインスタンス文書−インスタンス文書は、XBRLタグがイントラネットXBRL文書に埋め込まれているので、相互作用データファイルには表示されない。 |
|
|
|
|
|
|
|
|
104 |
|
表紙インタラクティブデータファイル — 表紙インタラクティブデータファイルは、その XBRL タグが XBRL ドキュメント内に埋め込まれているため、インタラクティブデータファイルには表示されません。 |
|
|
|
|
|
|
|
|
* |
|
同封アーカイブ |
** |
|
本資料の一部は、証券取引委員会に提出された機密保護要請に基づき編集されました。 |
+ |
|
この資料の一部は、規制 S—k のアイテム 601 ( a ) ( 6 ) およびアイテム 601 ( b ) ( 10 ) に従って省略されています。なぜなら、そのような情報は ( i ) 重要ではなく、 ( ii ) 登録者が個人または機密として扱うタイプです。 |
† |
|
各マークされた展示物は、登録者の取締役または執行役員が参加または参加した経営契約または補償計画、契約または取り決めです。 |
項目16.表格10-Kの概要
該当しない。
89
署名
1934 年証券取引法第 13 条または第 15 条 ( d ) の要件に従い、登録者は、 2024 年 9 月 19 日に、正当に承認された下記署名者によって、登録者に代わって報告書に署名させました。
|
|
|
美医薬株式会社 |
||
|
|
|
投稿者: |
|
/ s / Justin J. ファイル |
|
|
ジャスティン J. ファイル |
|
|
最高経営責任者代行、 |
本報告は、1934年の証券取引法の要求に基づき、以下の者によって登録者として指定日に署名された。
|
サイン |
|
|
投稿者: |
|
/ s / Justin J. ファイル |
|
|
|
ジャスティン J. ファイル 最高経営責任者代行、最高財務責任者、秘書 ( 執行役員、財務経理責任者 ) 2024年9月19日 |
|
|
|
|
|
投稿者: |
|
/ s / トーマス C 。レイノルズ |
|
|
|
トーマス·C·レイノルズ ディレクター 2024年9月19日 |
|
|
|
|
|
投稿者: |
|
/ s / ニコラス R 。グロバー |
|
|
|
ニコラス·R·グローバー ディレクター 2024年9月19日 |
|
|
|
|
|
投稿者: |
|
/ s / スティーブン · ウッド |
|
|
|
スティーブン · ウッド ディレクター 2024年9月19日 |
|
|
|
|
|
投稿者: |
|
/ s / フレデリック W 。ドリスコル |
|
|
|
フレデリック·W·ドリスコール ディレクター 2024年9月19日 |
|
|
|
|
|
投稿者: |
|
/ s / ジェームズ · フリン |
|
|
|
ジェームズ · フリン ディレクター 2024年9月19日 |
|
|
|
|
|
投稿者: |
|
/ s / タヒエル · ダトゥ |
|
|
|
タヘール · ダトゥー ディレクター 2024年9月19日 |
|
90