
用首创性的小分子药物转变癌症和肝病的治疗 展板99.3

前瞻性声明 本演示内容涉及Galecto公司(“Galecto”或“公司”)的战略、未来计划、业务和前景等前瞻性声明,但不限于关于Galecto化合物和潜在机会(包括BRm-1420)的开发、Galecto临床试验结果的预期时间和报告以及Galecto的现金运营时间。 这些声明涉及重大风险和不确定性。 本演示内容中的所有陈述均属于前瞻性声明,除历史事实陈述外。 「预期」、「相信」、「继续」、「可能」、「估计」、「期望」、「打算」、「可能」、「规划」、「潜在」、「预测」、「项目」、「目标」、「应该」、「将」等表达旨在识别前瞻性声明,尽管并非所有前瞻性声明都包含这些识别词。 对于此类声明,Galecto宣称受1995年《私人证券诉讼改革法》的保护。 公司实际上可能无法实现这些前瞻性声明中披露的计划、意图或期望,您不应过分依赖这些前瞻性声明。 实际结果或事件可能与这些前瞻性声明中披露的计划、意图和期望大不相同。 导致实际结果与此类声明不同的因素包括但不限于:药物开发成本高昂、耗时、不确定并易受变化、中断、延迟或终止;招募临床试验患者具有竞争性和挑战性,Galecto计划的临床试验发布时间可能会因此延迟;研究、开发和监管审查和反馈的时间和结果都是不确定的;Galecto需要筹集额外资本来推进所有项目;Galecto未来亏损的数额不确定,可能导致我们的股价波动或下跌;头条数据可能无法准确反映特定研究或试验的完整结果;临床试验和其他研究结果可有不同解释,未必具有预测未来结果的作用;Galecto的临床试验可能无法充分证明其任何药物候选的安全性和功效;Galecto的药物候选可能无法继续研发或获批上市;临床试验和其他研究可能未能按预期的时间或方式进行,甚至不进行;临床和非临床数据庞大且详细,监管机构可能对数据的重要性有不同解读或权衡,并可能得出与Galecto或他人不同的结论,要求提供额外信息,提出额外建议或更改其指引或要求;与开发、寻求药物注册批准和商业化相关的风险,包括监管、制造、供应和市场问题以及药物供应的问题。 其他可能导致结果与Galecto前瞻性声明所述或暗示的不符的因素在其美国证券交易委员会(SEC)的文件中披露,包括其最近一份年度报告(2024年3月8日提交给SEC的10-k表)的“风险因素”部分。 此外,本演示中包含的前瞻性声明代表本演示日期时公司的观点。 公司预计随后的事件和发展将导致其观点发生变化。 但是,虽然公司可能选择在将来某个时间更新这些前瞻性声明,但它明确声明没有义务这样做。
正在努力创造一个让患有癌症和严重肝病的患者能获得有效治疗方案的世界

Galecto在战略审查后增强了管线,截至2024年6月30日现金余额约为2290万美元,资金用于持续进行试验和收购项目,预计可支持至2026年。完成战略审查确定核心资产和方向。经过深入的战略审查过程,Galecto已决定专注于癌症和肝病,现有临床阶段资产GB1211的管线得到强化,同时通过收购AML的BRm-1420带来了新颖性和突破潜力,在AML的临床前模型中具有卓越活性,经过审查多个资产辅助评估,Leerink协助加强了管线,专注于肿瘤学和肝病的创新平台,瞄准核心疾病过程的先驱,ENL-YEATS和galectin-3为基础的药理学,首个高度特异的口服小分子抑制剂,所有项目均解决:以明确未满足的医疗需求为特征的疾病,市场机遇达数十亿美元,早期数据支持药物活性,ENL-YEATS抑制剂:作用机制估计可覆盖30%以上的AML人群,在AML模型中表现出快速持久的抗肿瘤活性,Galectin-3抑制剂:显示了靶标参与,积极的生物标志物数据,证据显示肿瘤微环境转化,肝硬化方面的重要临床数据。
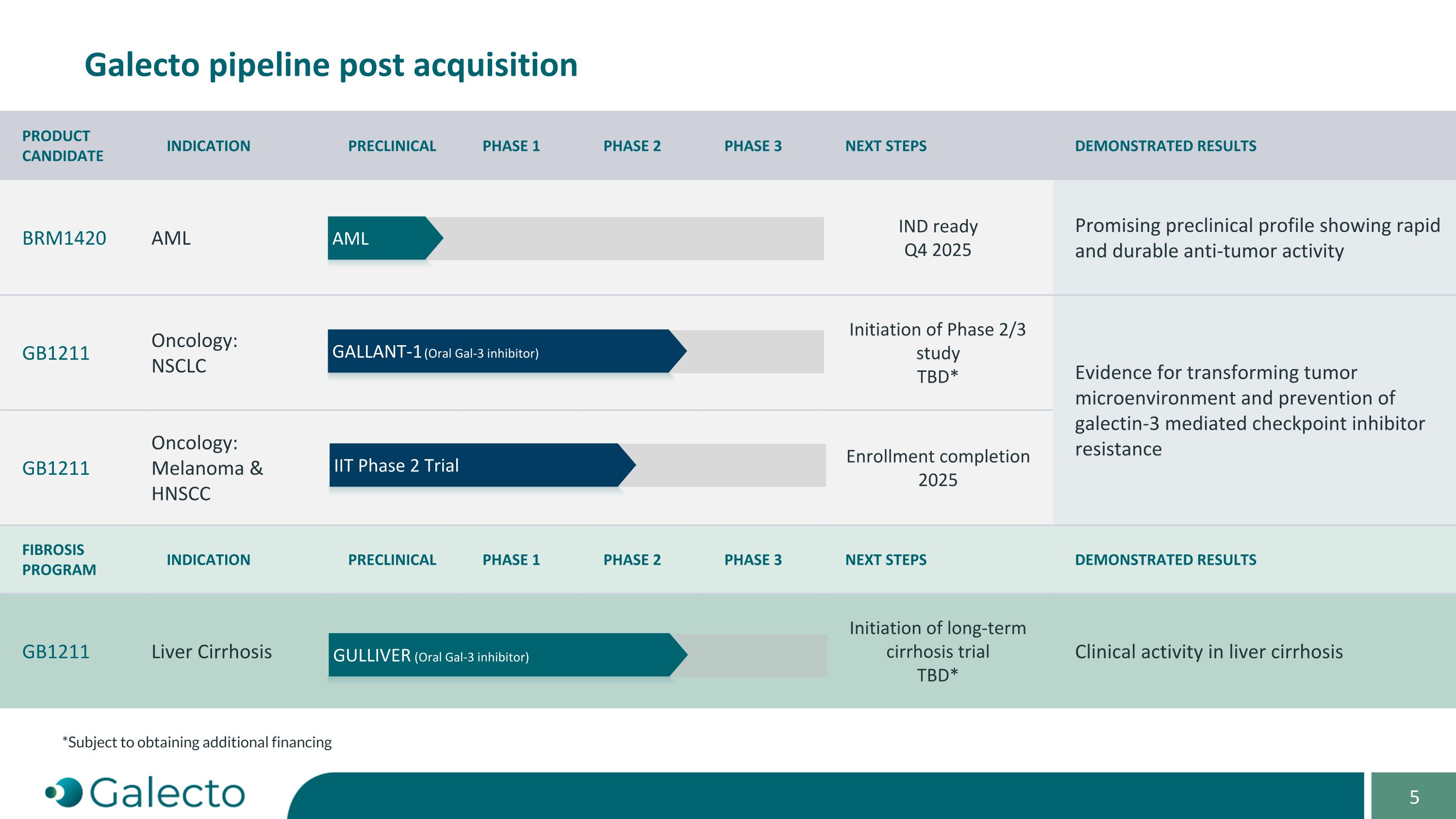
产品候选人适应症临床前阶段1阶段2阶段3下一步骤表现结果BRM1420 AML IND准备 2025年第四季度表现出快速和持久的抗肿瘤活性GB1211 肿瘤学: NSCLC 第2/3期研究启动待定*证据显示转变肿瘤微环境和预防galectin-3介导的检查点抑制剂抵抗GB1211 肿瘤学:黑色素瘤及头颈部鳞状细胞癌 招募完成2025纤维化计划适应症临床前阶段1阶段2阶段3下一步骤表现结果GB1211 肝硬化 长期肝硬化试验启动待定*在肝硬化患者中的临床活性 Galecto 收购后的流水线发帖高士-1 (口服Gal-3抑制剂) AML IIt 第2期试验 *需获得额外融资 巨人 (口服Gal-3抑制剂)

经验丰富的管理团队和董事会首席执行官加勒特·温斯洛·汉斯 夏比亚·马特·克罗姆米勒·洛瑞·菲尔姆尼EVP,策略和首席商业官首席财务官卡尔·戈德菲舍万.D.主席湾城资本合伙人ImClone前首席财务官杰森·达拉斯万.D.前CEO Aimmune阿米特·芒什,MBA首席执行官Orna Therapeutics前CEO Arena安妮·普雷纳万.D.,博士Imbria风险合作伙伴SV Health Investors大卫·夏皮罗万.D.,FRCP,FFPm退休CMO Intercept前CMO Idun4汉斯夏比亚万.D.,博士CEO galecto 董事会 1被Eli Lilly收购 2被雀巢收购 3被辉瑞GC收购 2

BRm-1420 ENL-YEATS / FLT3抑制剂,用于AML

BRm-1420 - 从Bridge Medicines MoA收购的新资产,预计可覆盖30%以上的AML人群和潜在的高风险遗传驱动因子 理想地定位于治疗既抑制FLT3又抗menin的患者 与前线疗法的最佳组合伙伴 在MLLr AML (KMT2A)的严格模型中表现出较FLT3和menin抑制剂更优越的体内治疗窗口 出色的心血管安全性(无QTc)和毒理学特性 与正在开发的标准治疗分子和化合物协同 与AML多种遗传亚型的治疗药物相比,显示出卓越的潜在领先地位,并与标准治疗和目前已知的管线机会不同 初步临床数据预计2026年出现;建立了监管途径
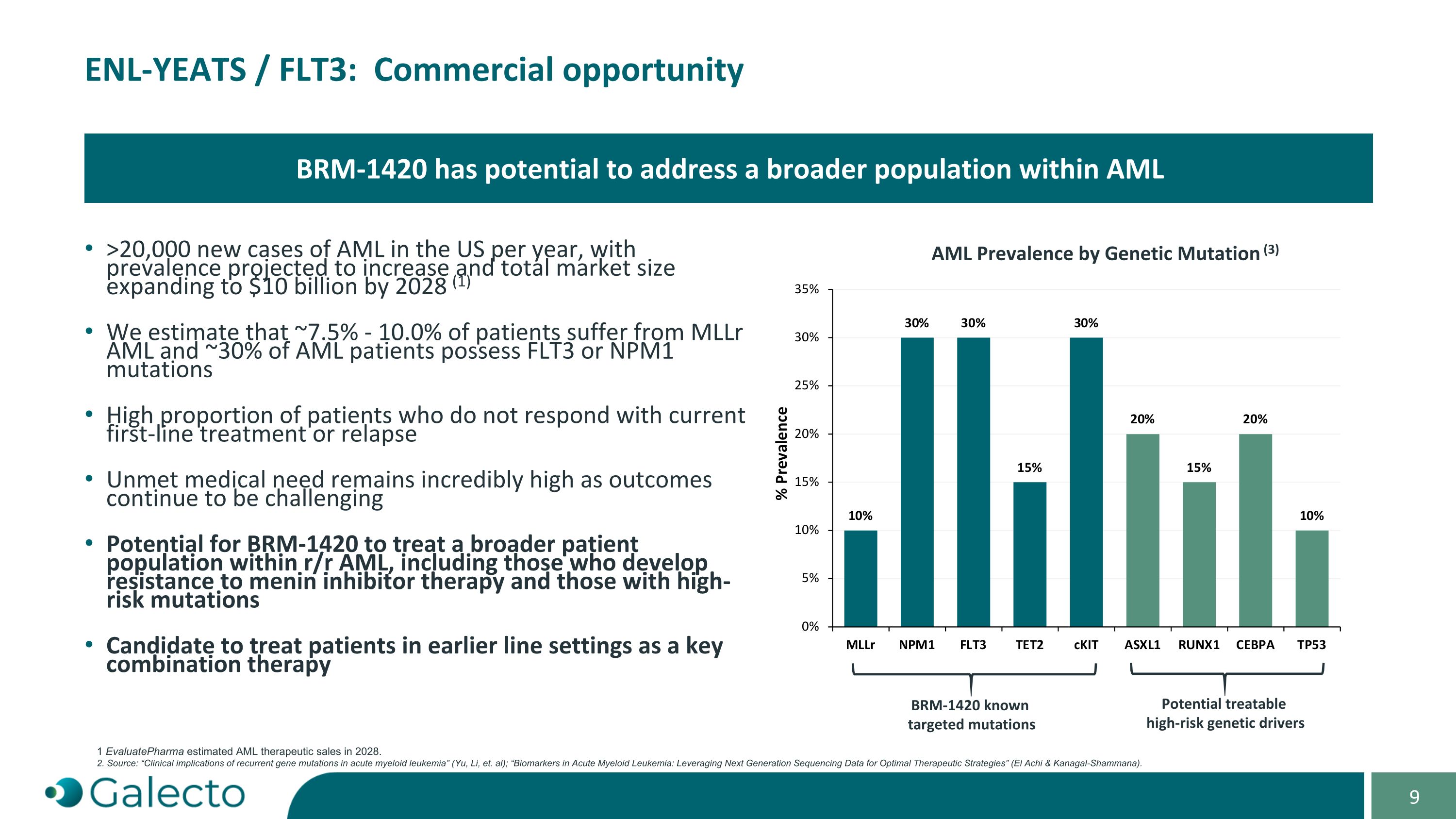
ENL-YEATS / FLT3:商业机会 美国每年AML新病例超过20,000例,预计患病率将增加,2028年总市场规模将扩大至100亿美元(1)我们估计约有7.5% - 10.0%的患者患有MLLr AML,约30%的AML患者具有FLT3或NPM1突变,其中大部分患者对目前的一线治疗没有反应或复发 未满足的医疗需求仍然非常高,因为治疗效果仍然具有挑战性BRm-1420有望治疗更广泛的r/r AML患者,包括那些对美内蛋白抑制剂治疗产生抗药性和那些具有高风险突变的患者 有望作为关键联合疗法治疗早期阶段的患者BRm-1420有潜力解决AML中更广泛的人群 AML按遗传突变的患病率(3)BRm-1420已知靶向突变 潜在可治疗的高风险遗传驱动因子 1 EvaluatePharma估计2028年AML治疗销售额。2. 资料来源:“急性髓样白血病复发性基因突变的临床意义”(Yu,Li等);“急性髓样白血病生物标志物:利用下一代测序数据优化治疗策略”(El Achi & Kanagal-Shammana)。
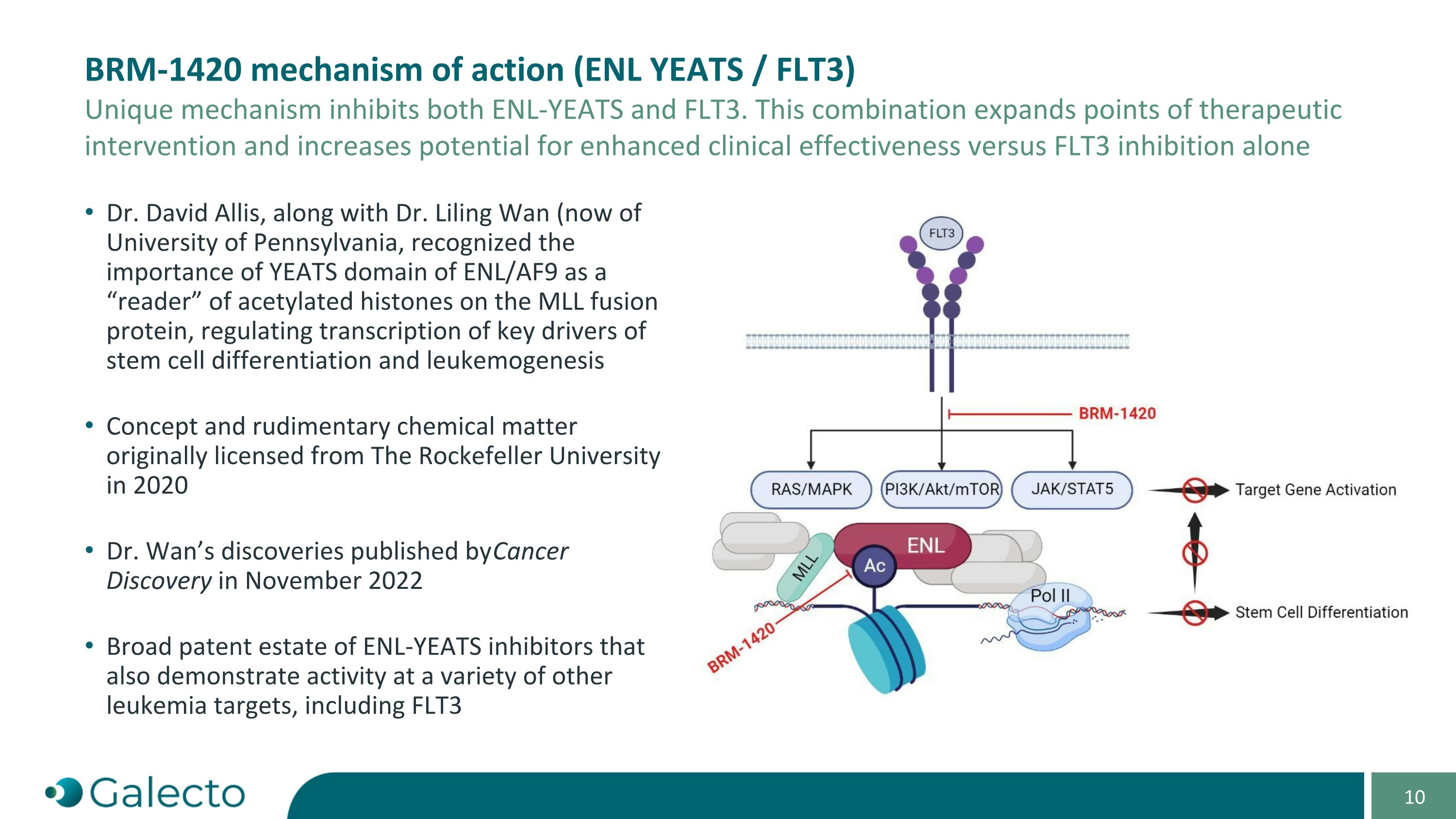
BRm-1420的作用机制(ENL YEATS / FLT3) 这种独特的机制抑制了ENL-YEATS和FLT3。这种组合扩展了治疗干预点,并增加了与单独抑制FLT3相比的临床疗效增强的潜力。 David Allis博士与Liling Wan博士(现任宾夕法尼亚大学)共同认识到ENL/AF9的YEATS结构域作为“阅读器”可激酶在MLL融合蛋白上的乙酰化组蛋白,调节了干细胞分化和白血病发生关键驱动基因的转录。概念和基础化学物质最初于2020年从洛克菲勒大学获得许可。万莉玲博士的发现于2022年11月在《癌症发现》上发表。ENL-YEATS抑制剂的广泛专利组合还表现出在各种其他白血病靶点(包括FLT3)上的活性。
药物前期研究数据和潜在的临床意义 迅速持久的抗肿瘤活性,存活率高于对照组 耐受性优于对照组 对白血病发生和维持的关键基因驱动因子(HOXA9、MEIS1、MYC)产生明显影响 外周血、骨髓和脾脏中爆发细胞的显著减少/消除 立即细胞周期停滞,爆炸细胞分化和凋亡 前期研究数据显示,可能具有迅速起效、完全持久的疗效,疗效可能优于竞争对手,以及更好的安全性/耐受性概况
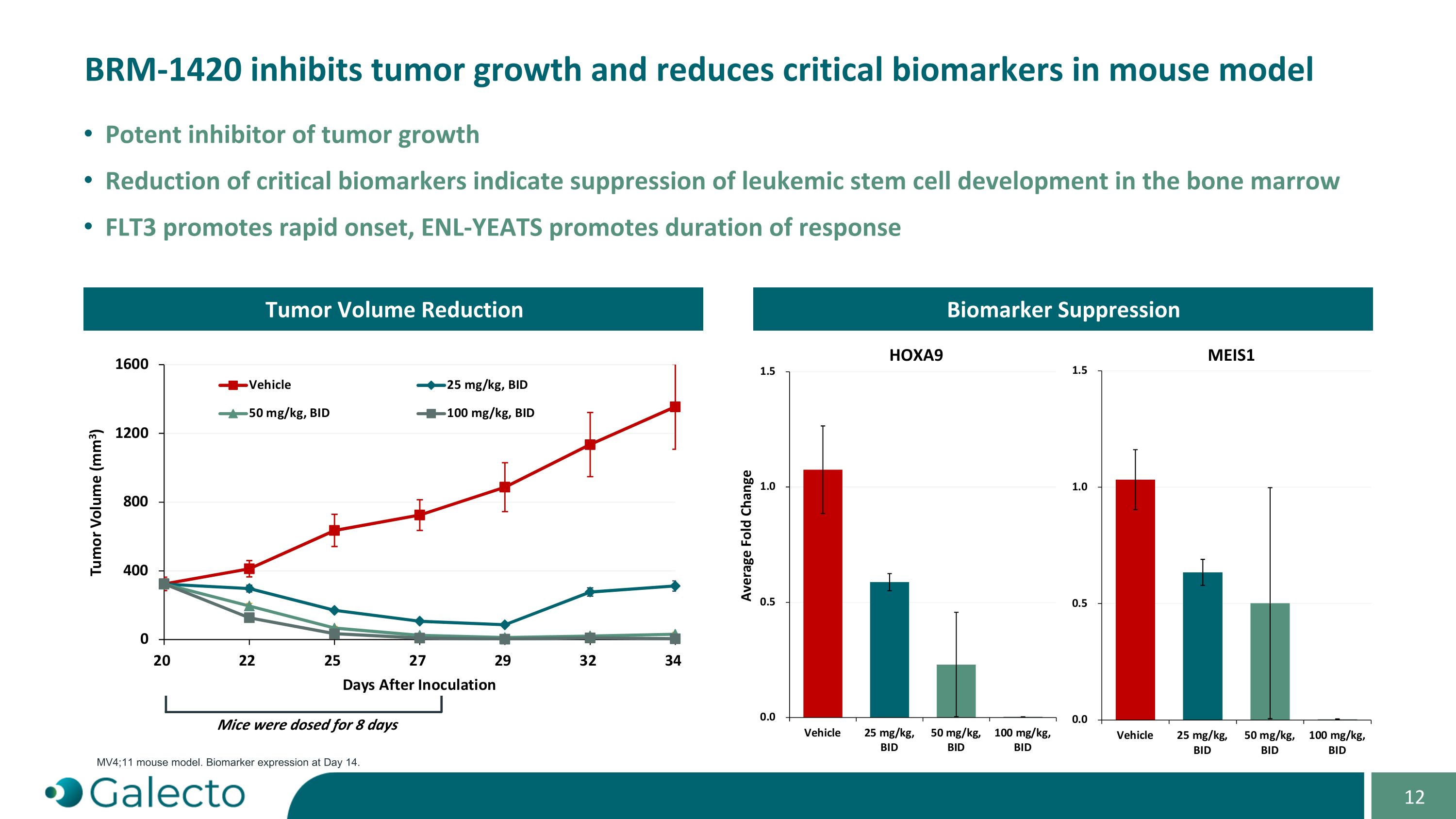
BRm-1420抑制肿瘤生长并降低小鼠模型中的关键生物标志物。对肿瘤生长的有效抑制。降低关键生物标志物表明对骨髓中白血病干细胞发育的抑制。FLT3促进快速发作,ENL-YEATS促进应答持续时间。肿瘤成交量减少小鼠接受8天的剂量MV4;11小鼠模型。第14天生物标志物表达。生物标志物抑制HOXA9 MEIS1平均倍数变化。
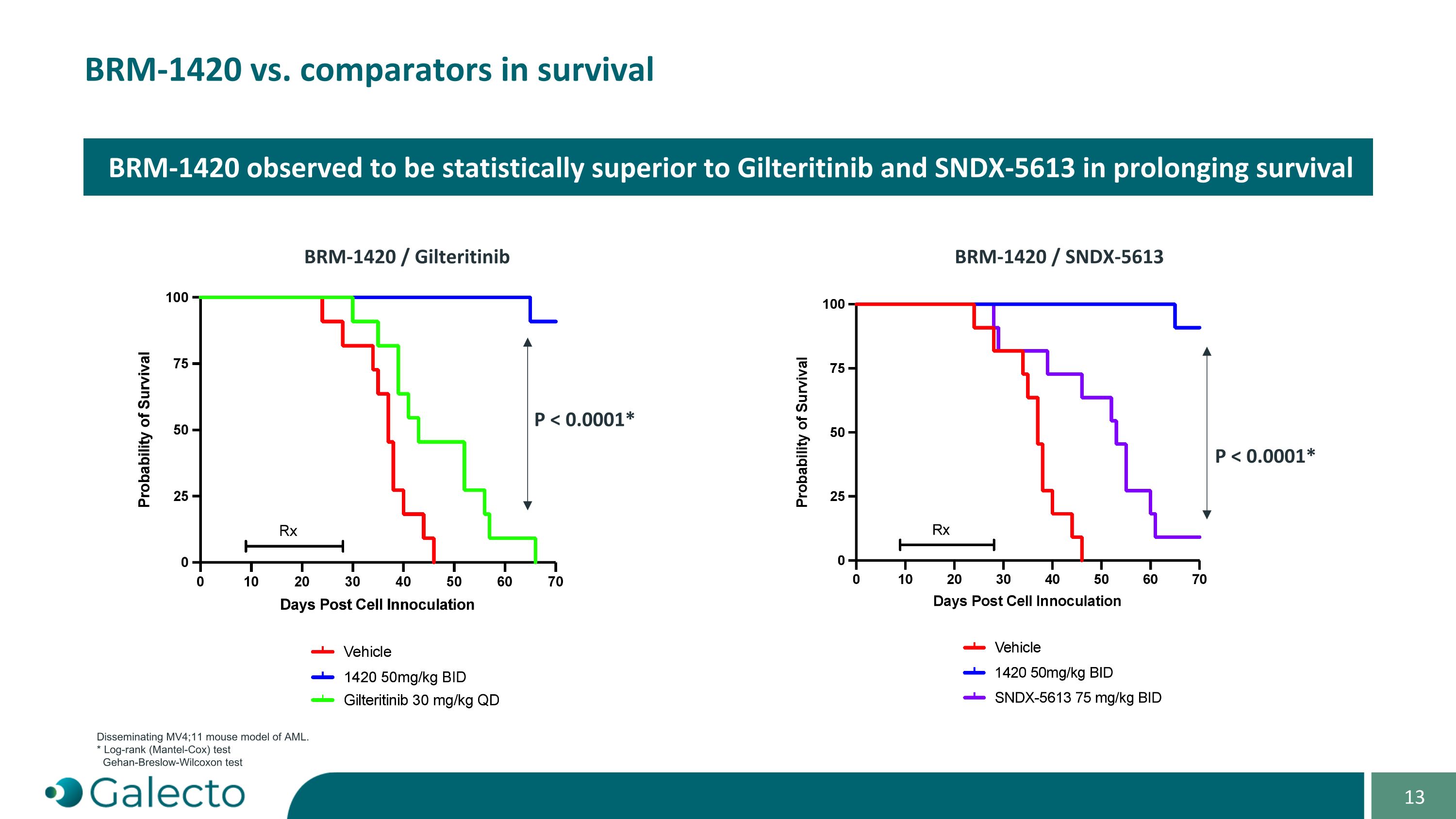
在AML的MV4;11小鼠模型中,BRm-1420与比较药物在生存方面进行比较。* 对比(Log-rank)检验 Gehan-Breslow-Wilcoxon检验观察到BRm-1420在延长生存方面在统计学上优于Gilteritinib和SNDX-5613 BRm-1420 / Gilteritinib BRm-1420 / SNDX-5613 P < 0.0001* P < 0.0001*
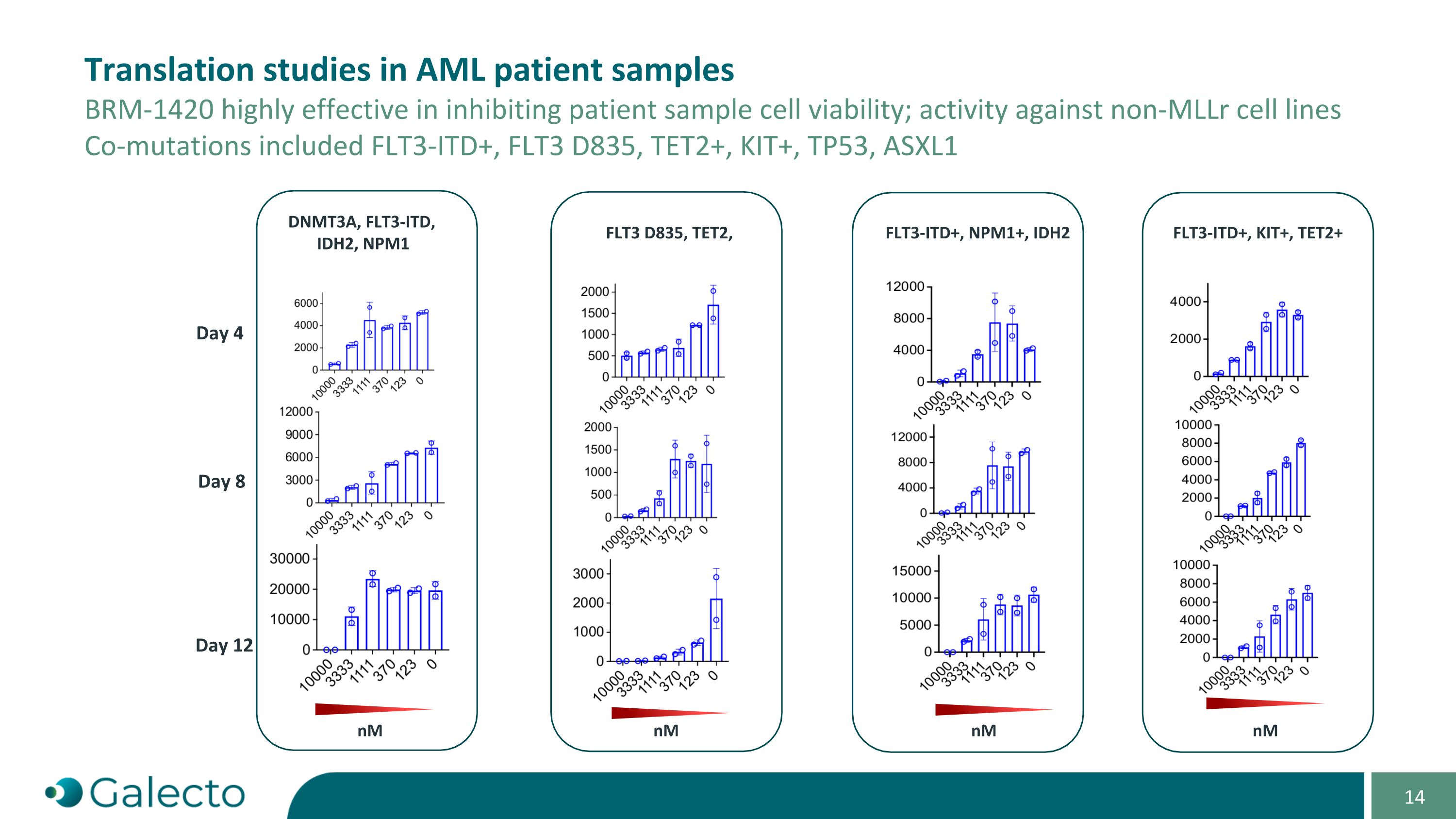
AML患者样本中的翻译研究 BRm-1420在抑制患者样本的细胞存活能力方面非常有效;对非MLLr细胞系的活性 共同突变包括FLT3-ITD+,FLT3 D835,TET2+,KIT+,TP53,ASXL1,DNMT3A,FLT3-ITD,IDH2,NPM1 第4天 第8天 第12天 FLT3 D835,TET2,FLT3-ITD+,NPM1+,IDH2 FLT3-ITD+,KIT+,TET2+ nm nm nm nM
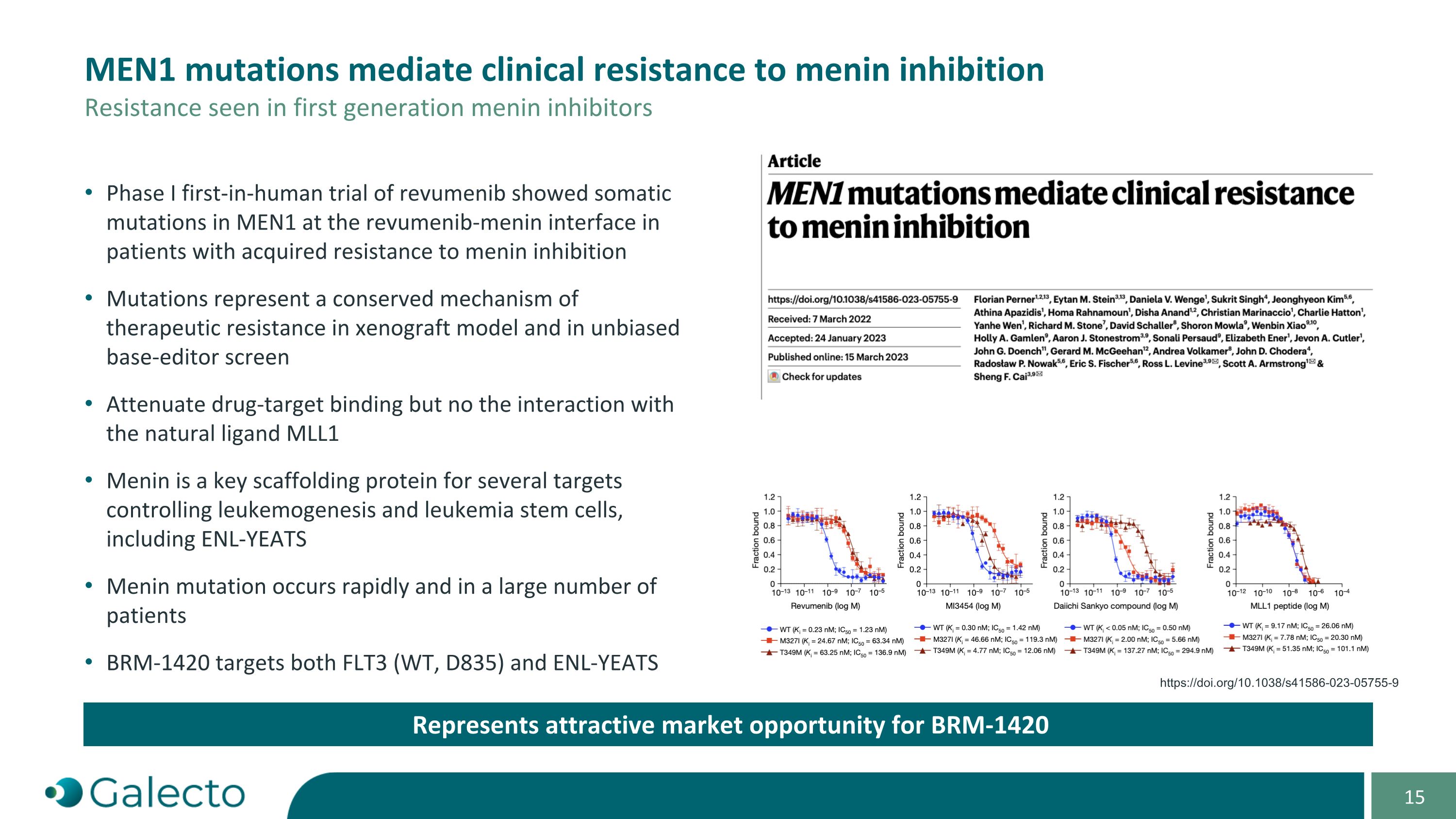
MEN1突变介导对menin抑制的临床支撑位 第一代menin抑制剂中观察到的支撑位代表了BRm-1420的有吸引力的市场机会 revumenib的I期首次进行人体试验显示,在获得对menin抑制的耐受性的患者中,MEN1基因发生体细胞突变位于revumenib-menin界面上支撑位进化的治疗性阻力机制表示在移植癌模型中及在非偏见的碱基编辑器筛选中突变减弱药物靶标结合,但没有影响与天然配体MLL1的相互作用 Menin是控制白血病发生和白血病干细胞的几个靶标的关键支架蛋白,包括ENL-YEATS Menin突变迅速发生,并且发生在大量患者中 BRm-1420的靶标包括FLT3(Wt,D835)和ENL-YEATS https://doi.org/10.1038/s41586-023-05755-9
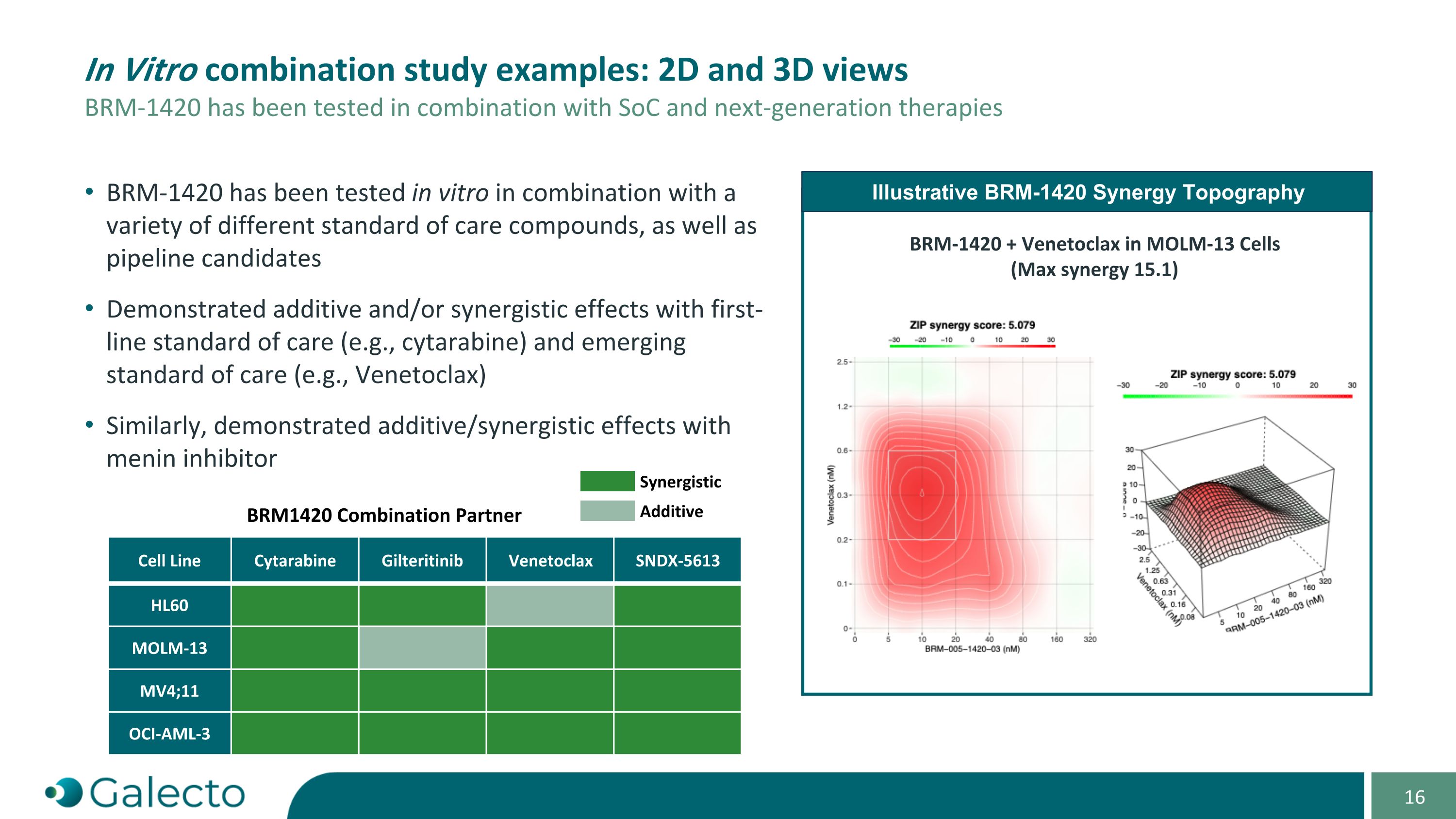
体外组合研究示例:2D和3D视图 BRm-1420已在与SoC和下一代疗法的组合中进行了测试 BRm-1420协同作用拓扑图 BRm-1420 + Venetoclax在MOLm-13细胞中(最大协同作用15.1) BRm-1420已在体外与各种不同的常规治疗化合物以及流水线候选药物的组合中进行了测试 展示出与一线常规治疗(例如,紫杉醇)和新兴常规治疗(例如,Venetoclax)的相加和/或协同效应 同样,展示出与menin抑制剂相加/协同效应 电芯系紫杉醇 吉列替尼 Venetoclax SNDX-5613 HL60 MOLm-13 MV4;11 OCI-AML-3 BRM1420组合伙伴 协同 添加

BRm-1420毒理学总结 在大鼠和狗中均耐受良好,无QTc风险。当前标准护理和在研化合物中已遇到安全/Pk风险。FLT3抑制剂吉雷替尼的常见副作用包括腹泻、贫血、疲劳和肝功能酶升高;警告包括QT延长。Syndax的麦角铬蛋白抑制剂对耐受性(QT延长)和药物相互作用(CYP3A4抑制剂)存在问题。在狗心血管研究中,未观察到BRm-1420对QTc的显著延长,剂量最高可达每千克100毫克。大鼠和狗的14天试验中未见死亡、靶器官毒性或临床化学指标变化。在临床环境中,白细胞计数、红细胞比积和血红蛋白有轻微且可控的影响。尤其在AML的标准护理中,对骨髓/血细胞计数的影响通常更为严重。观察到网织红细胞减少,但可在临床环境中轻松监测并可逆转。网织红细胞的影响可能归因于对AF9的抑制,并间接反映了靶向作用。在狗研究中,研究运营商认为每千克200毫克是最大耐受剂量,根据反复呕吐、软到液体便和体重下降。

GB1211口服型Galectin-3抑制剂用于癌症
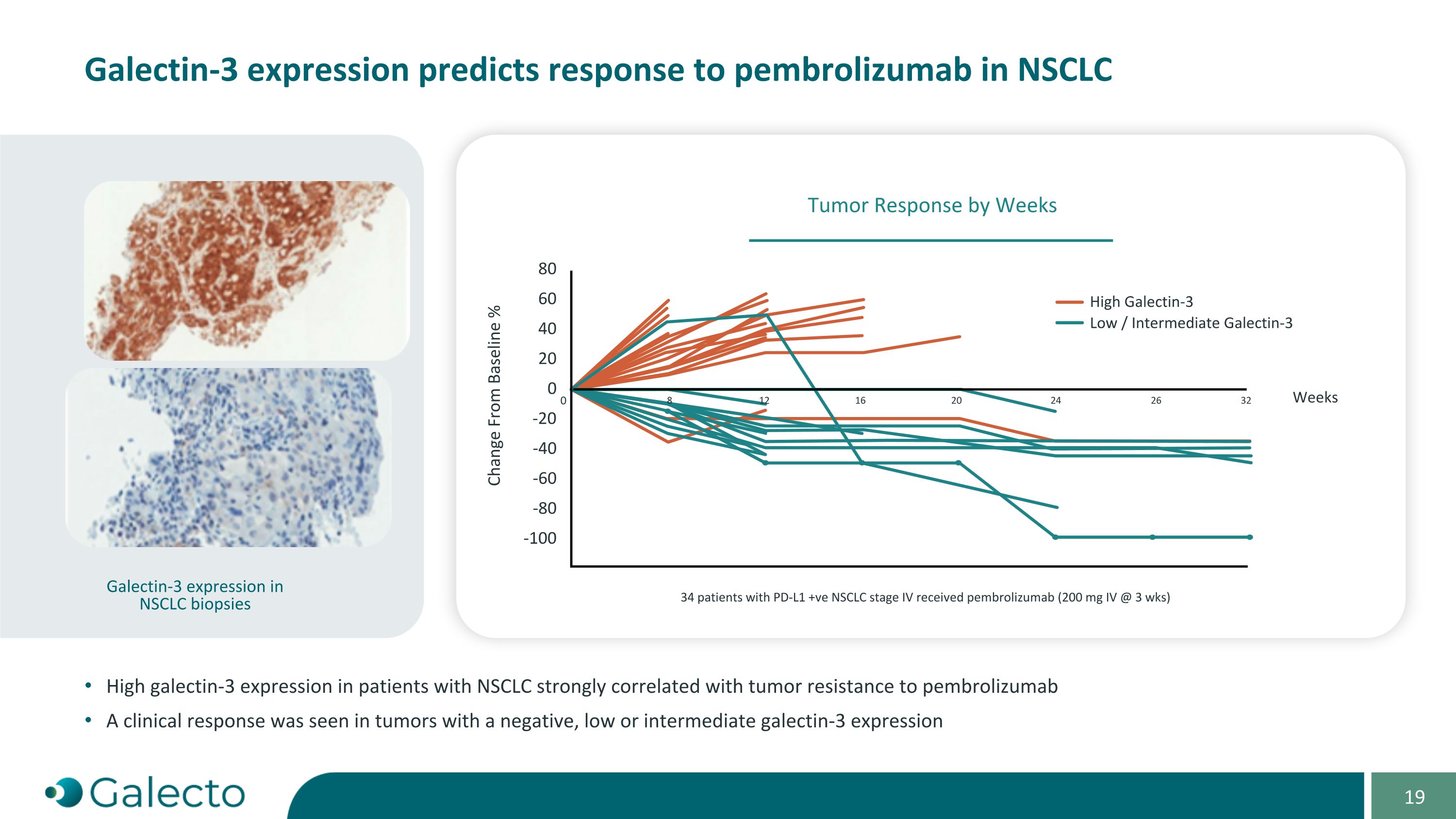
Galectin-3表达预测对NSCLC的Pembrolizumab响应。在NSCLC患者中,高Galectin-3表达与肿瘤对Pembrolizumab的抵抗有很强的相关性。在表达为阴性、低或中间水平的肿瘤中观察到临床反应。NSCLC活检中的Galectin-3表达,34名PD-L1阳性NSCLC第四期患者接受了Pembrolizumab(每3周200 mg静脉注射)。-20 80 60 40 20 与基线变化% 0 0 8 12 16 20 24 26 32 高Galectin-3 低/中Galectin-3周 -40 -60 -80 -100 按周肿瘤反应
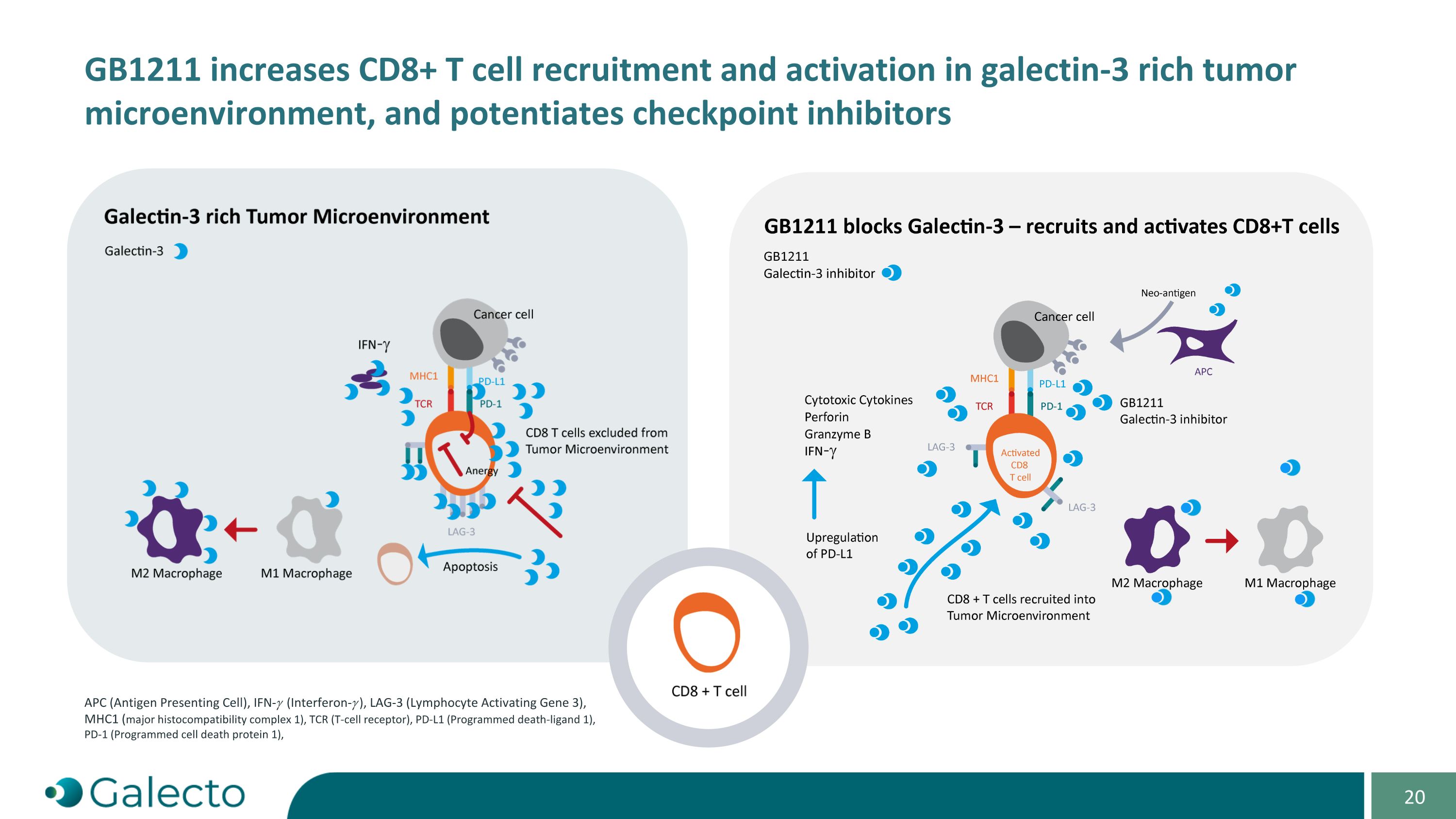
GB1211增加CD8+T细胞在富含galectin-3的肿瘤微环境中的招募和激活,并增强APC(抗原呈递细胞),IFN-𝛾(干扰素-𝛾),LAG-3(淋巴细胞激活基因3),MHC1(主要组织相容性复合体1),TCR(T细胞受体),PD-L1(程序化死亡配体1),PD-1(程序化细胞死亡蛋白1)的检查点抑制剂作用。
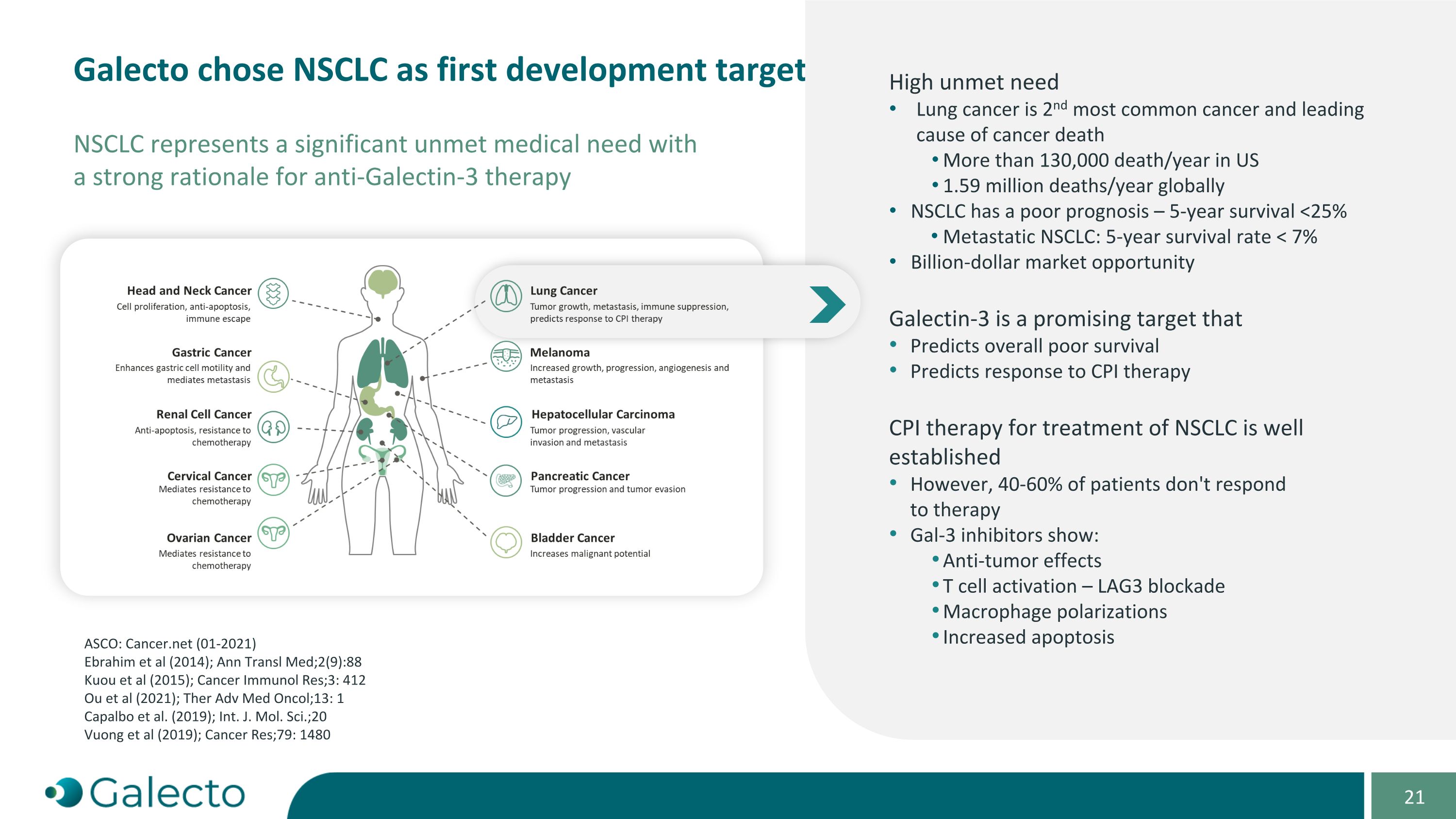
galecto选择NSCLC作为首个开发目标 NSCLC代表了一个迫切需要医疗干预的重大疾病,具有抗galectin-3疗法强有力的理据 ASCO: Cancer.net (01-2021) Ebrahim等(2014); Ann Transl Med;2(9):88 Kuou等(2015); Cancer Immunol Res;3: 412 Ou等(2021); Ther Adv Med Oncol;13: 1 Capalbo等(2019); Int. J. Mol. Sci.;20 Vuong等(2019); Cancer Res;79: 1480 NSCLC存在严重未被满足的需求 肺癌是第二常见癌症,也是癌症死因的主要原因 美国每年有超过130,000人死于此病,全球每年有159万人死亡 NSCLC的预后很差 - 5年生存率<25% 转移性NSCLC: 5年生存率<7% 百亿美元的市场机遇 Galectin-3是一个有前景的靶标, 可预测整体差的生存预后 也可预测对CPI疗法的反应 对NSCLC的CPI疗法已经被广泛应用 但是40-60%的患者对疗法没有反应 Gal-3抑制剂表现出: 抗肿瘤效果 T细胞激活-LAG3阻断 巨噬细胞极化 增加细胞凋亡

GALLANt-1 - A/C部分:atezolizumab + GB1211 开放标签研究,调查GB1211与atezolizumab联合一线治疗非小细胞肺癌患者的安全性和有效性。该研究是与Roche合作进行的患者人群:表达PD-L1的晚期或转移性非小细胞肺癌的至少50%肿瘤细胞一线治疗的主要终点:安全性和耐受性,肿瘤缩小;次要终点包括Pk测量,ORR(RECIST)探索性研究:GB1211对药效动力学标记和生物标志物的影响,GB1211 100毫克 每日两次 + atezo 同时化疗不允许 哨兵组 GB1211 200毫克 每日两次 + atezo 筛选基线
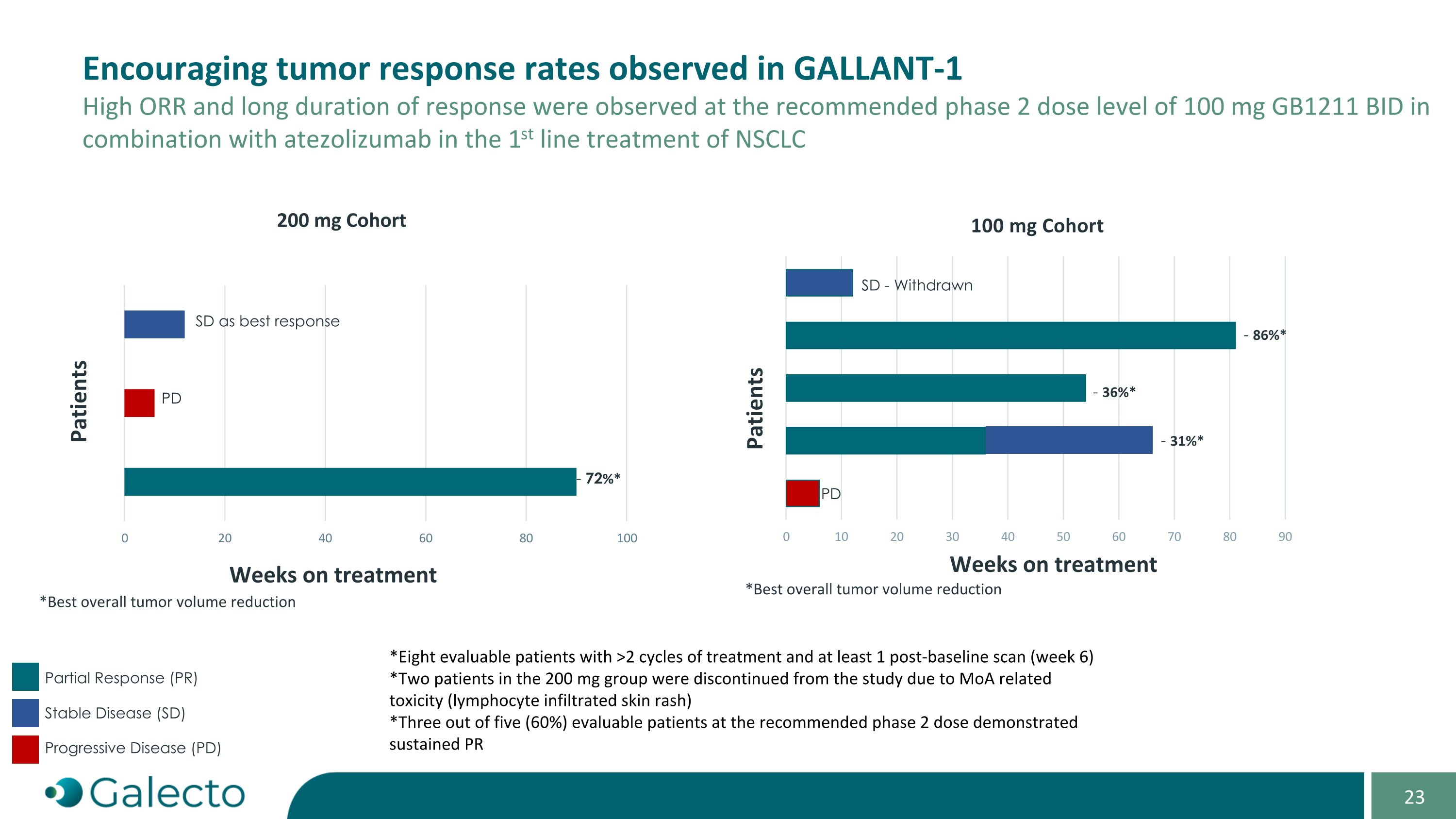
观察到在GALLANt-1中鼓舞人心的肿瘤反应率。 在尿酸氨基转肽酶抑制剂GB1211每日100mg开多剂量与atezolizumab相结合治疗NSCLC DP的第一线治疗中观察到高ORR和长期反应持续时间 * 通过至少1次基线后(第6周)扫描和至少2个周期治疗的八位可评价患者 * 200mg组的两名患者由于MoA相关毒性(淋巴细胞浸润性皮疹)而退出研究 * 在推荐的第2期剂量中5名可评价患者中的3名(60%)显示出持续PR SD作为最佳反应 PD SD - 退出 - 36%* - 31%* - 86%* PD - 72%* 治疗周数 患者 患者 *200mg队列治疗周数 *最佳整体肿瘤体积减少 * 部分缓解(PR) 稳定疾病(SD) 进展性疾病(PD)

200毫克剂量引起的限制剂皮肤反应表明淋巴细胞活化,从而支持GB1211与atezolizumab联合的作用机制。GALLANt-1研究中纳入的患者不适合化疗-CPI联合用药,尽管ECOG 0-1的表现状态,研究人群可能代表了难治患者群体的一部分,而100毫克GB1211的开多剂量在atezolizumab基础上看起来安全且耐受良好。长期治疗的患者没有安全顾虑,基于剂量缩放建模,100毫克的剂量似乎足够,反应似乎超出了atezolizumab单药预期疗效,R2PD的ORR为60%,而预期为30%。反应持续时间和PFS看起来已经超出了预期,所有有反应的患者接受治疗时间超过1年。截至2024年9月30日,在试验的延长期内有两名患者正在接受GB1211+atezo治疗。机密结论-GALLANt-1 GB1211似乎在与atezolizumab单药联合中表现出良好的耐受性和令人鼓舞的疗效。

GB1211 口服凝集素-3抑制剂 用于肝硬化
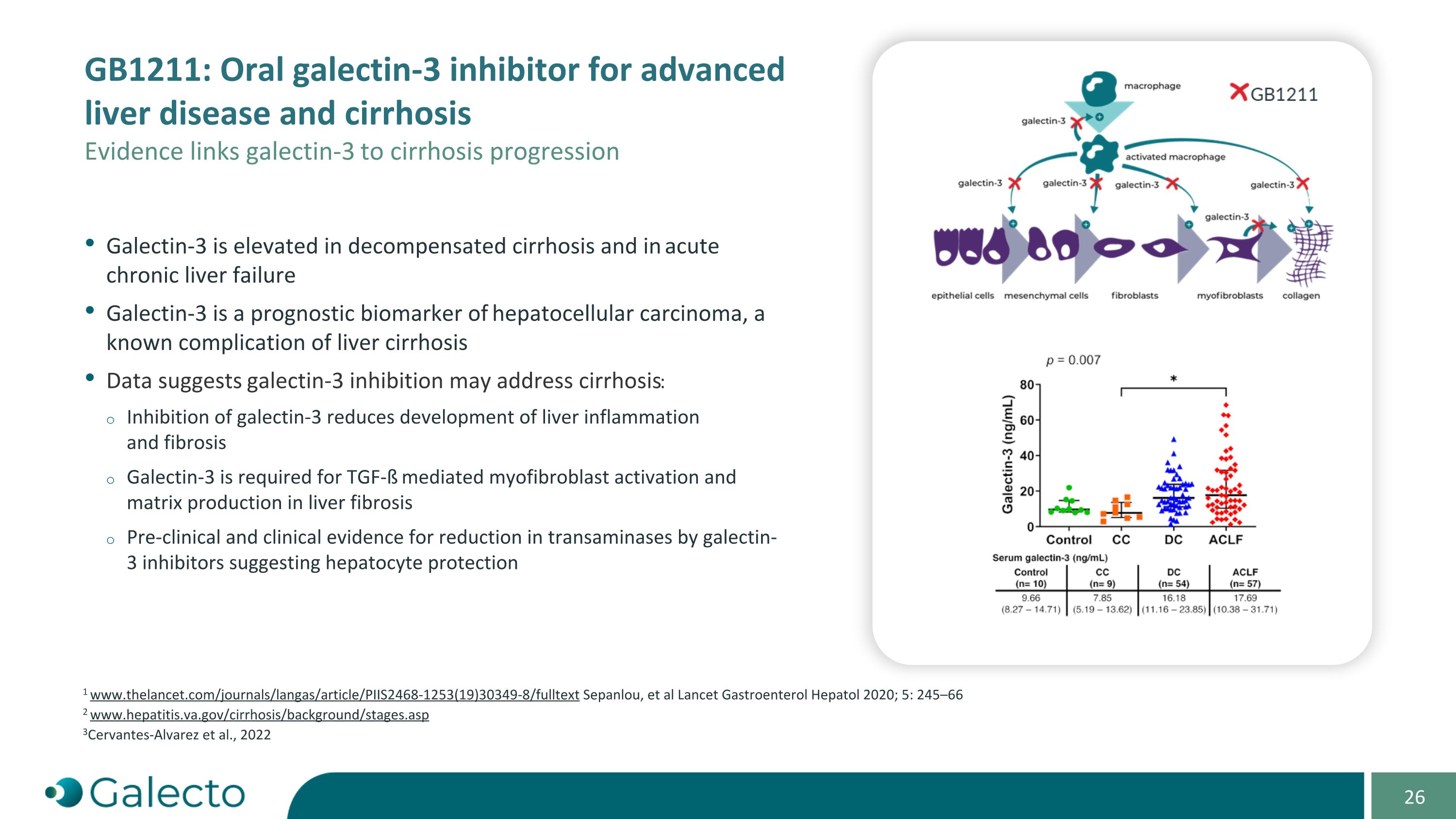
GB1211:口服爱文思控股益生菌治疗先进的肝病和肝硬化 证据将爱文思控股与肝硬化进展联系起来。爱文思控股在失代偿性肝硬化和急性慢性肝衰竭中升高。爱文思控股是肝细胞癌的预后生物标志物,是肝硬化已知的并发症。数据表明,抑制爱文思控股可能有助于治疗肝硬化:抑制爱文思控股可减少肝脏炎症和纤维化的发展。肝硬化需要TGF-ß介导的肝纤维化细胞激活和基质生成。临床前和临床证据表明,爱文思控股抑制剂可以减少转胺酶,提示对肝细胞的保护。1 www.thelancet.com/journals/langas/article/PIIS2468-1253(19)30349-8/fulltext Sepanlou等,Lancet Gastroenterol Hepatol 2020;5:245-66 2 www.hepatitis.va.gov/cirrhosis/background/stages.asp 3Cervantes-Alvarez等,2022

GULLIVER-2 – 第2部分 在Child-Pugh b患者中通过随机、双盲、安慰剂对照的为期12周的研究 买盘,每天两次; CAP,受控衰减参数; Pk,药代动力学; VCTE,振动受控瞬时弹性成像 第1部分: 单剂量肝功能不全研究 (Child-Pugh B) 第3部分: 单剂量肝功能不全研究 (Child-Pugh C) GB1211 100mg 买盘 (n=15) 安慰剂 买盘 (n=15) Pk样本取样日期:第1天,第7天,第21天,第42天,第63天,第84天 生物化学检验日期:第1天,第7天,第42天,随访第96天 第2部分: 重复剂量肝功能不全研究 (Child-Pugh B) 主要终点:安全性和耐受性 Pk 探索性终点 生物化学检验 肝纤维化 (VCTE) 脂肪变性 (CAP) 探索性生物标志物
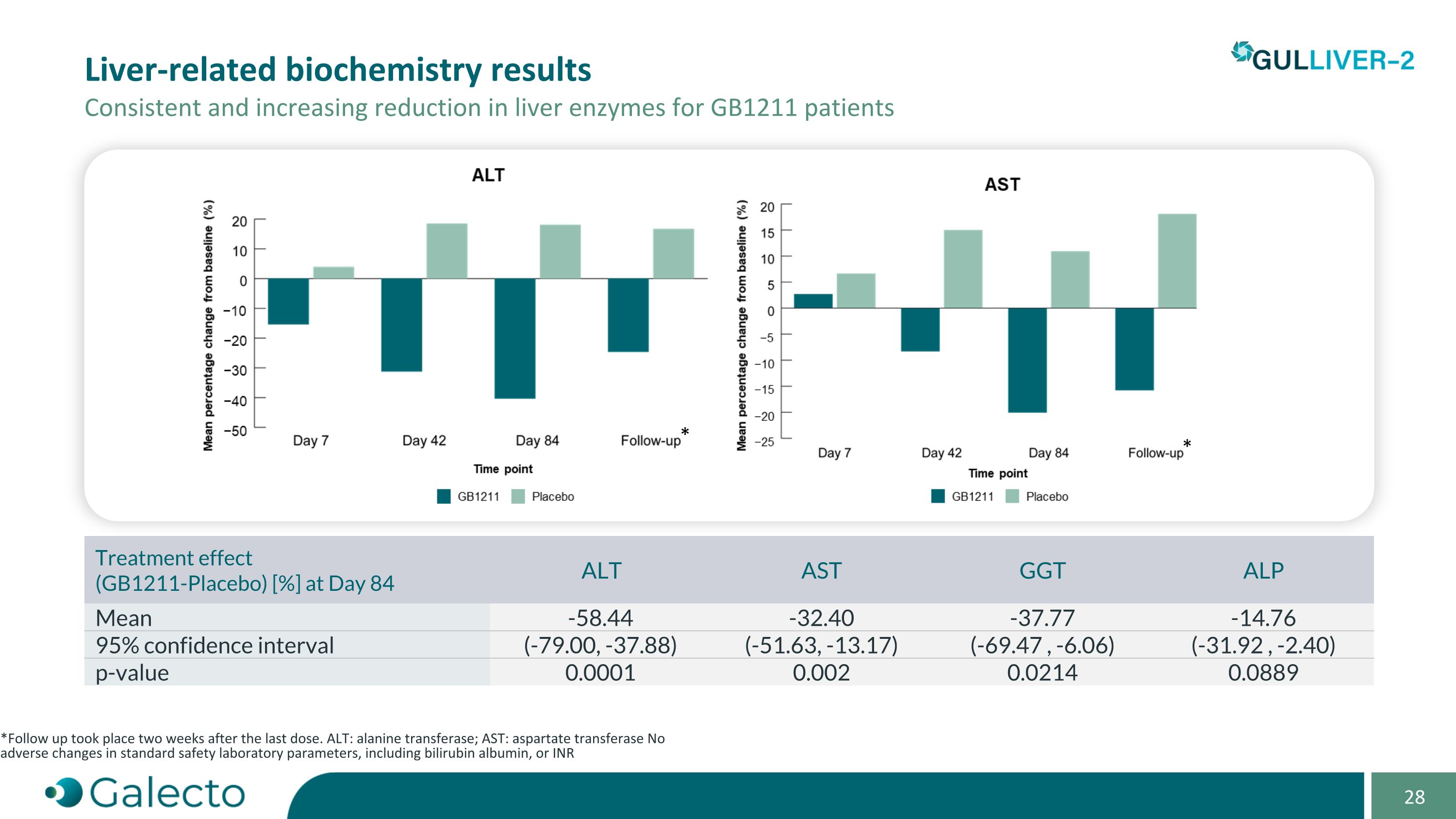
与GB1211患者相关的肝生化学结果 肝酶持续逐渐降低 * 最后一次剂量后两周进行了随访。 ALT:丙氨酸转移酶; AST:天冬氨酸转移酶 标准安全实验室参数未发生不良变化,包括胆红素白蛋白或INR * * 治疗效果(GB1211-安慰剂)[%] 第84天 ALT AST GGt ALP 平均值 -58.44 -32.40 -37.77 -14.76 95%置信区间(-79.00,-37.88)(-51.63,-13.17)(-69.47,-6.06)(-31.92,-2.40)p值 0.0001 0.002 0.0214 0.0889
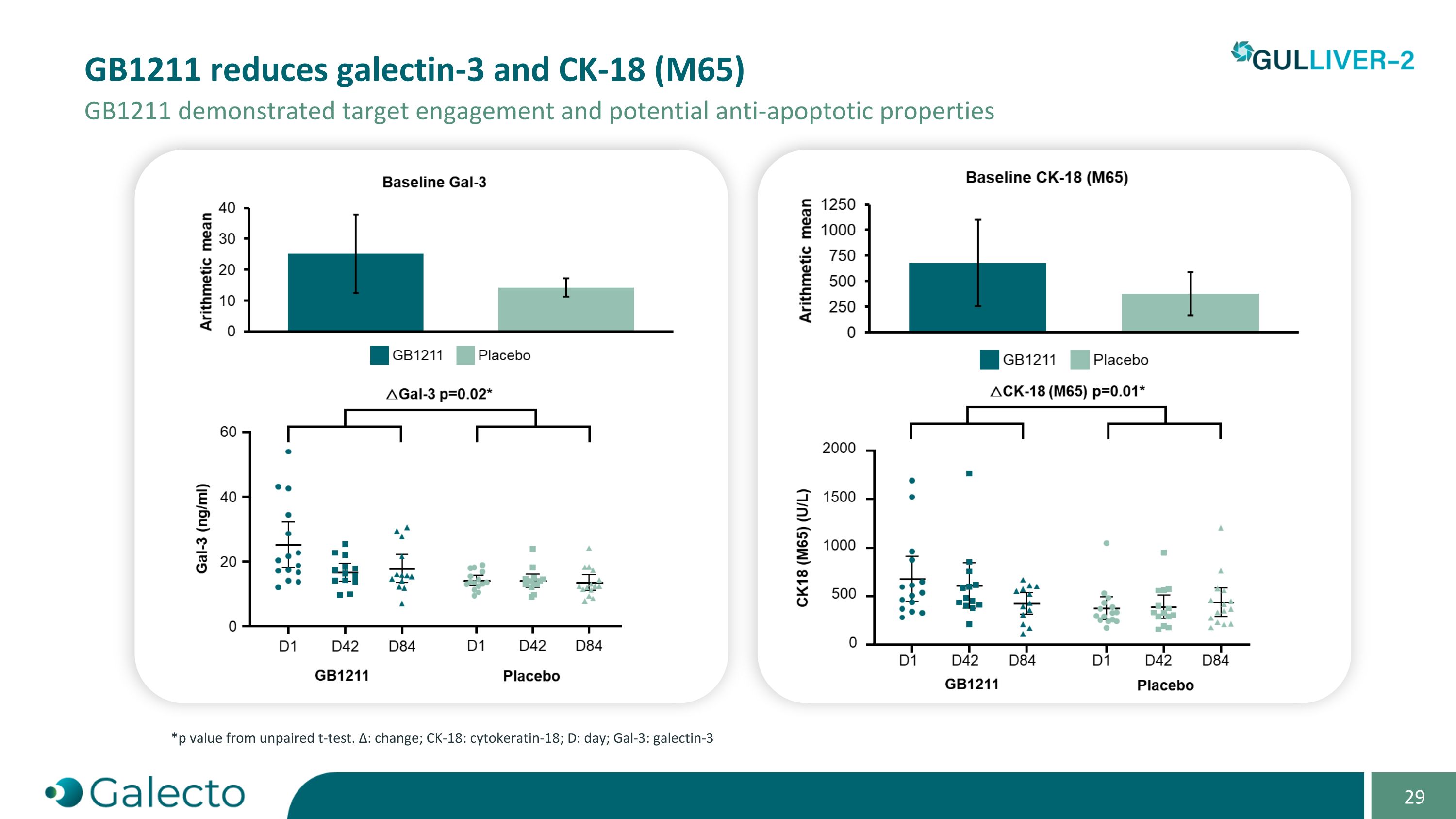
GB1211减少了Galectin-3和Ck-18(M65),GB1211展示了靶点结合和潜在的抗凋亡特性 *p值来自非配对t检验。Δ:变化;Ck-18:细胞角蛋白-18;D:天;Gal-3:Galectin-3
GULLIVER-2 - 阶段一顶线结果 在代偿性肝硬化患者人群中的研究结果令人鼓舞。结果强烈支持在严重肝病中进行2/3期研究,肝病中的Galectin-3,一种碳水化合物结合蛋白显示通过TGF-ß受体驱动纤维化,在代偿性肝硬化、酒精性肝炎和ACLF中升高。GB1211是Galectin-3的有效、选择性、口服抑制剂。耐受良好GB1211在患者中没有发现药物相关不良事件。可预测的Pk(药代动力学)剖面与在肝功能受损患者中重复给药的选择一致。临床Galectin-3的减少证明了靶向效应,ALt、ASt和GGt中一致且具统计显著性的降低,与肝生化学、肝硬度和脂肪生成的协同变化观察到了。数据表明GB1211改善了肝脏炎症并减少了肝损伤。

概括

galecto在进行战略审查后增强了管道,截至2024年6月30日,现金余额约为2290万美元,资金用于正在进行的试验并通过2026年进入的项目。 完成战略审查确定核心资产和方向。 在一项全面的战略审查流程后,galecto已决定专注于癌症和肝病,利用其现有的临床阶段资产GB1211。 管道得到了BRm-1420用于AML的收购的支持,这带来了新颖性和突破潜力。在Leerink的协助下,通过对多项资产的审查,确定了在AML预临床模型中表现优异的资产。加强的管道专注于肿瘤和肝病创新平台以针对核心疾病过程,是ENL-YEATS和galectin-3阶段的先驱者基于药理学首个高度特异的口服小分子抑制剂。 所有计划均解决:以明显未满足的医疗需求为特征的疾病数十亿美元的市场机会初步数据支持药物活性ENL-YEATS抑制剂:MoA估计覆盖AML人口30%以上在AML模型中具有快速持久的抗肿瘤活性。 Galectin-3抑制剂:靶向参与显示积极的生物标志数据实质证明肝硬化肿瘤微环境转变中的临床数据。