
用首創性的小分子藥物轉變癌症和肝病的治療 展板99.3

前瞻性聲明 本演示內容涉及Galecto公司(「Galecto」或「公司」)的戰略、未來計劃、業務和前景等前瞻性聲明,但不限於關於Galecto化合物和潛在機會(包括BRm-1420)的開發、Galecto臨床試驗結果的預期時間和報告以及Galecto的現金運營時間。 這些聲明涉及重大風險和不確定性。 本演示內容中的所有陳述均屬於前瞻性聲明,除歷史事實陳述外。 「預期」、「相信」、「繼續」、「可能」、「估計」、「期望」、「打算」、「可能」、「規劃」、「潛在」、「預測」、「項目」、「目標」、「應該」、「將」等表達旨在識別前瞻性聲明,儘管並非所有前瞻性聲明都包含這些識別詞。 對於此類聲明,Galecto宣稱受1995年《私人證券訴訟改革法》的保護。 公司實際上可能無法實現這些前瞻性聲明中披露的計劃、意圖或期望,您不應過分依賴這些前瞻性聲明。 實際結果或事件可能與這些前瞻性聲明中披露的計劃、意圖和期望大不相同。 導致實際結果與此類聲明不同的因素包括但不限於:藥物開發成本高昂、耗時、不確定並易受變化、中斷、延遲或終止;招募臨床試驗患者具有競爭性和挑戰性,Galecto計劃的臨床試驗發佈時間可能會因此延遲;研究、開發和監管審查和反饋的時間和結果都是不確定的;Galecto需要籌集額外資本來推進所有項目;Galecto未來虧損的數額不確定,可能導致我們的股價波動或下跌;頭條數據可能無法準確反映特定研究或試驗的完整結果;臨床試驗和其他研究結果可有不同解釋,未必具有預測未來結果的作用;Galecto的臨床試驗可能無法充分證明其任何藥物候選的安全性和功效;Galecto的藥物候選可能無法繼續研發或獲批上市;臨床試驗和其他研究可能未能按預期的時間或方式進行,甚至不進行;臨床和非臨床數據龐大且詳細,監管機構可能對數據的重要性有不同解讀或權衡,並可能得出與Galecto或他人不同的結論,要求提供額外信息,提出額外建議或更改其指引或要求;與開發、尋求藥物註冊批准和商業化相關的風險,包括監管、製造、供應和市場問題以及藥物供應的問題。 其他可能導致結果與Galecto前瞻性聲明所述或暗示的不符的因素在其美國證券交易委員會(SEC)的文件中披露,包括其最近一份年度報告(2024年3月8日提交給SEC的10-k表)的「風險因素」部分。 此外,本演示中包含的前瞻性聲明代表本演示日期時公司的觀點。 公司預計隨後的事件和發展將導致其觀點發生變化。 但是,雖然公司可能選擇在將來某個時間更新這些前瞻性聲明,但它明確聲明沒有義務這樣做。
正在努力創造一個讓患有癌症和嚴重肝病的患者能獲得有效治療方案的世界

Galecto在戰略審查後增強了管線,截至2024年6月30日現金餘額約爲2290萬美元,資金用於持續進行試驗和收購項目,預計可支持至2026年。完成戰略審查確定核心資產和方向。經過深入的戰略審查過程,Galecto已決定專注於癌症和肝病,現有臨床階段資產GB1211的管線得到強化,同時通過收購AML的BRm-1420帶來了新穎性和突破潛力,在AML的臨床前模型中具有卓越活性,經過審查多個資產輔助評估,Leerink協助加強了管線,專注於腫瘤學和肝病的創新平台,瞄準核心疾病過程的先驅,ENL-YEATS和galectin-3爲基礎的藥理學,首個高度特異的口服小分子抑制劑,所有項目均解決:以明確未滿足的醫療需求爲特徵的疾病,市場機遇達數十億美元,早期數據支持藥物活性,ENL-YEATS抑制劑:作用機制估計可覆蓋30%以上的AML人群,在AML模型中表現出快速持久的抗腫瘤活性,Galectin-3抑制劑:顯示了靶標參與,積極的生物標誌物數據,證據顯示腫瘤微環境轉化,肝硬化方面的重要臨床數據。
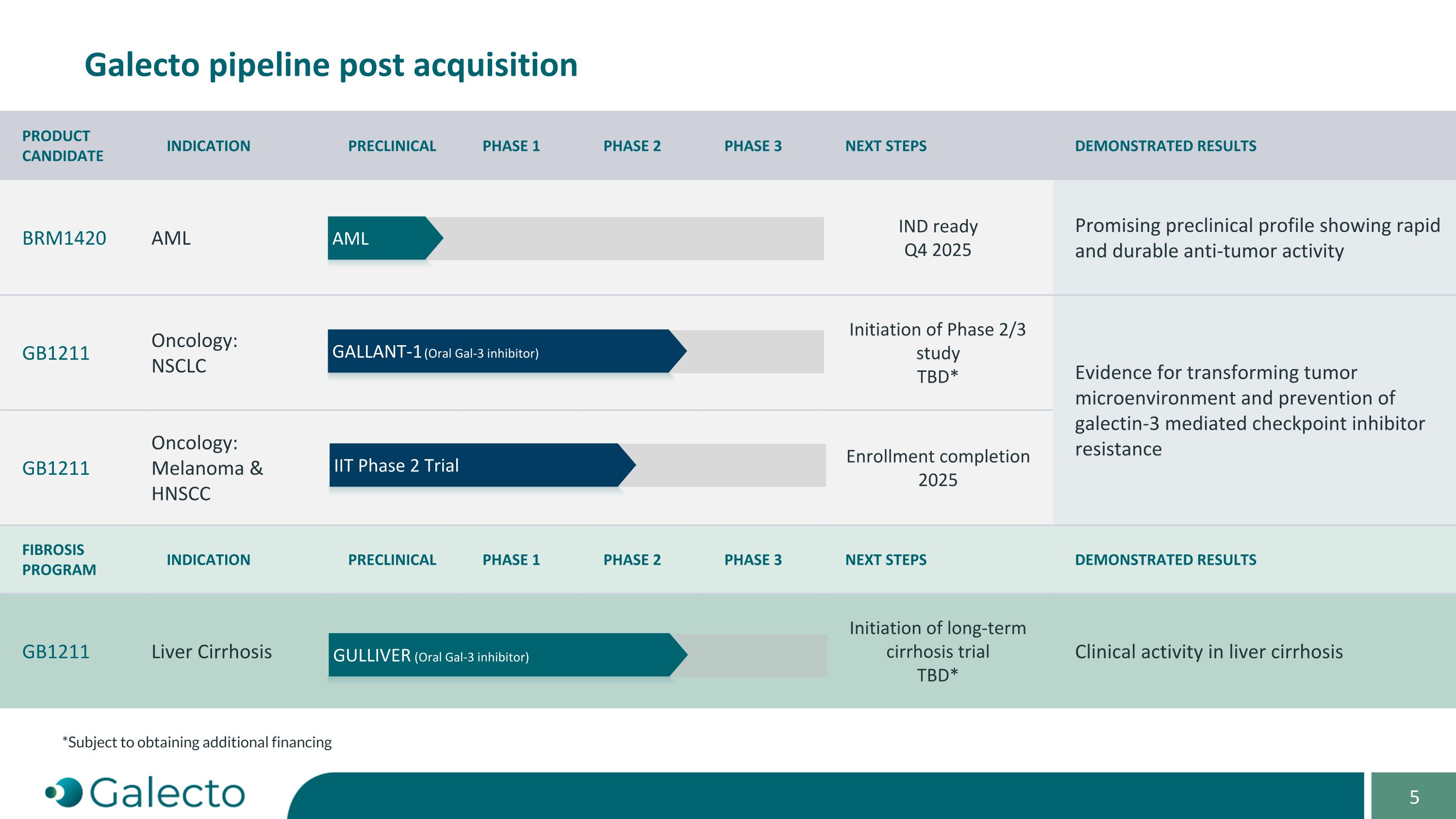
產品候選人適應症臨床前階段1階段2階段3下一步驟表現結果BRM1420 AML IND準備 2025年第四季度表現出快速和持久的抗腫瘤活性GB1211 腫瘤學: NSCLC 第2/3期研究啓動待定*證據顯示轉變腫瘤微環境和預防galectin-3介導的檢查點抑制劑抵抗GB1211 腫瘤學:黑色素瘤及頭頸部鱗狀細胞癌 招募完成2025纖維化計劃適應症臨床前階段1階段2階段3下一步驟表現結果GB1211 肝硬化 長期肝硬化試驗啓動待定*在肝硬化患者中的臨床活性 Galecto 收購後的流水線發帖高士-1 (口服Gal-3抑制劑) AML IIt 第2期試驗 *需獲得額外融資 巨人 (口服Gal-3抑制劑)

經驗豐富的管理團隊和董事會首席執行官加勒特·溫斯洛·漢斯 夏比亞·馬特·克羅姆米勒·洛瑞·菲爾姆尼EVP,策略和首席商業官首席財務官卡爾·戈德菲舍萬.D.主席灣城資本合夥人ImClone前首席財務官傑森·達拉斯萬.D.前CEO Aimmune阿米特·芒什,MBA首席執行官Orna Therapeutics前CEO Arena安妮·普雷納萬.D.,博士Imbria風險合作伙伴SV Health Investors大衛·夏皮羅萬.D.,FRCP,FFPm退休CMO Intercept前CMO Idun4漢斯夏比亞萬.D.,博士CEO galecto 董事會 1被Eli Lilly收購 2被雀巢收購 3被輝瑞GC收購 2

BRm-1420 ENL-YEATS / FLT3抑制劑,用於AML

BRm-1420 - 從Bridge Medicines MoA收購的新資產,預計可覆蓋30%以上的AML人群和潛在的高風險遺傳驅動因子 理想地定位於治療既抑制FLT3又抗menin的患者 與前線療法的最佳組合夥伴 在MLLr AML (KMT2A)的嚴格模型中表現出較FLT3和menin抑制劑更優越的體內治療窗口 出色的心血管安全性(無QTc)和毒理學特性 與正在開發的標準治療分子和化合物協同 與AML多種遺傳亞型的治療藥物相比,顯示出卓越的潛在領先地位,並與標準治療和目前已知的管線機會不同 初步臨床數據預計2026年出現;建立了監管途徑
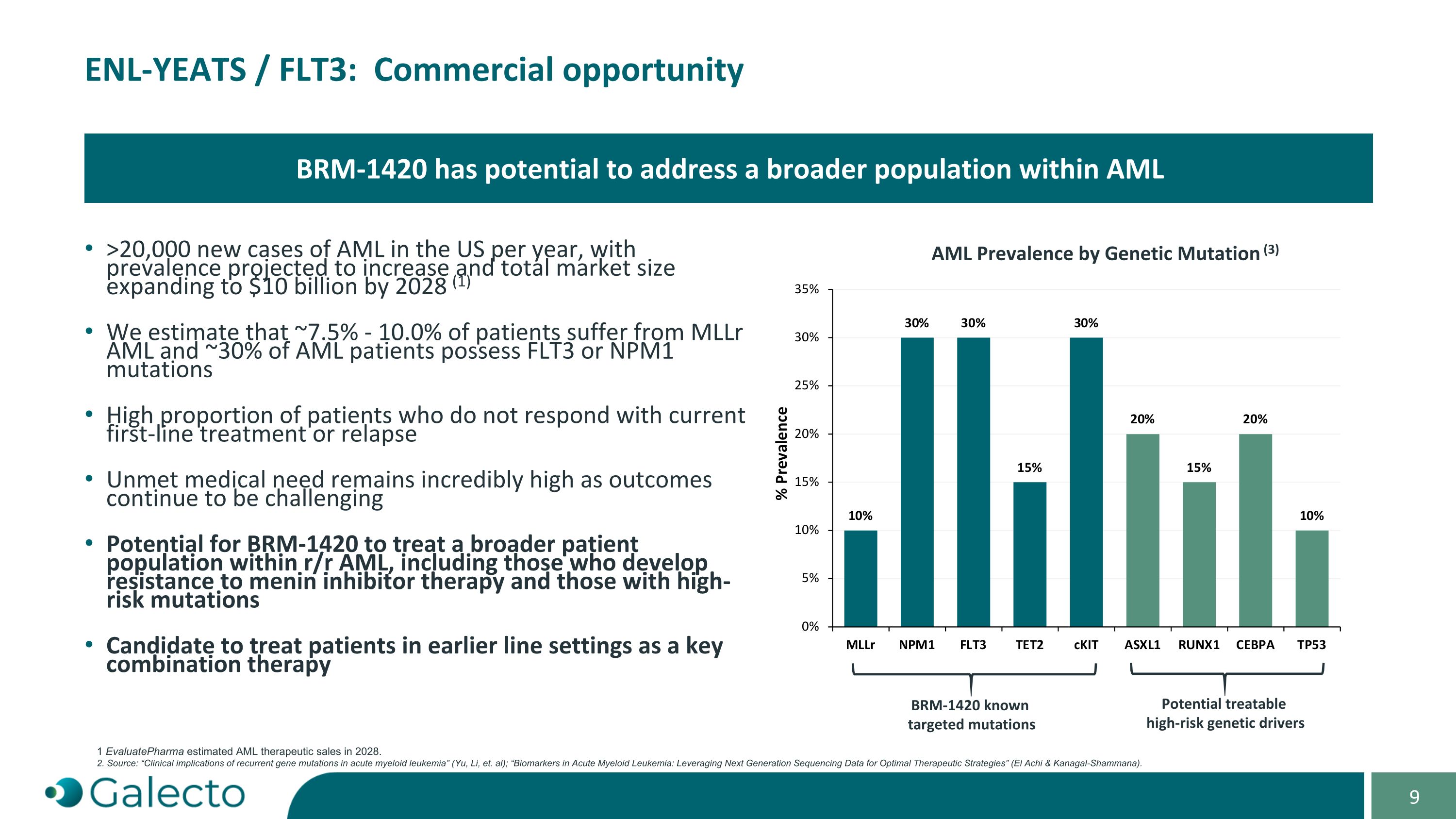
ENL-YEATS / FLT3:商業機會 美國每年AML新病例超過20,000例,預計患病率將增加,2028年總市場規模將擴大至100億美元(1)我們估計約有7.5% - 10.0%的患者患有MLLr AML,約30%的AML患者具有FLT3或NPM1突變,其中大部分患者對目前的一線治療沒有反應或復發 未滿足的醫療需求仍然非常高,因爲治療效果仍然具有挑戰性BRm-1420有望治療更廣泛的r/r AML患者,包括那些對美內蛋白抑制劑治療產生抗藥性和那些具有高風險突變的患者 有望作爲關鍵聯合療法治療早期階段的患者BRm-1420有潛力解決AML中更廣泛的人群 AML按遺傳突變的患病率(3)BRm-1420已知靶向突變 潛在可治療的高風險遺傳驅動因子 1 EvaluatePharma估計2028年AML治療銷售額。2. 資料來源:「急性髓樣白血病複發性基因突變的臨床意義」(Yu,Li等);「急性髓樣白血病生物標誌物:利用下一代測序數據優化治療策略」(El Achi & Kanagal-Shammana)。
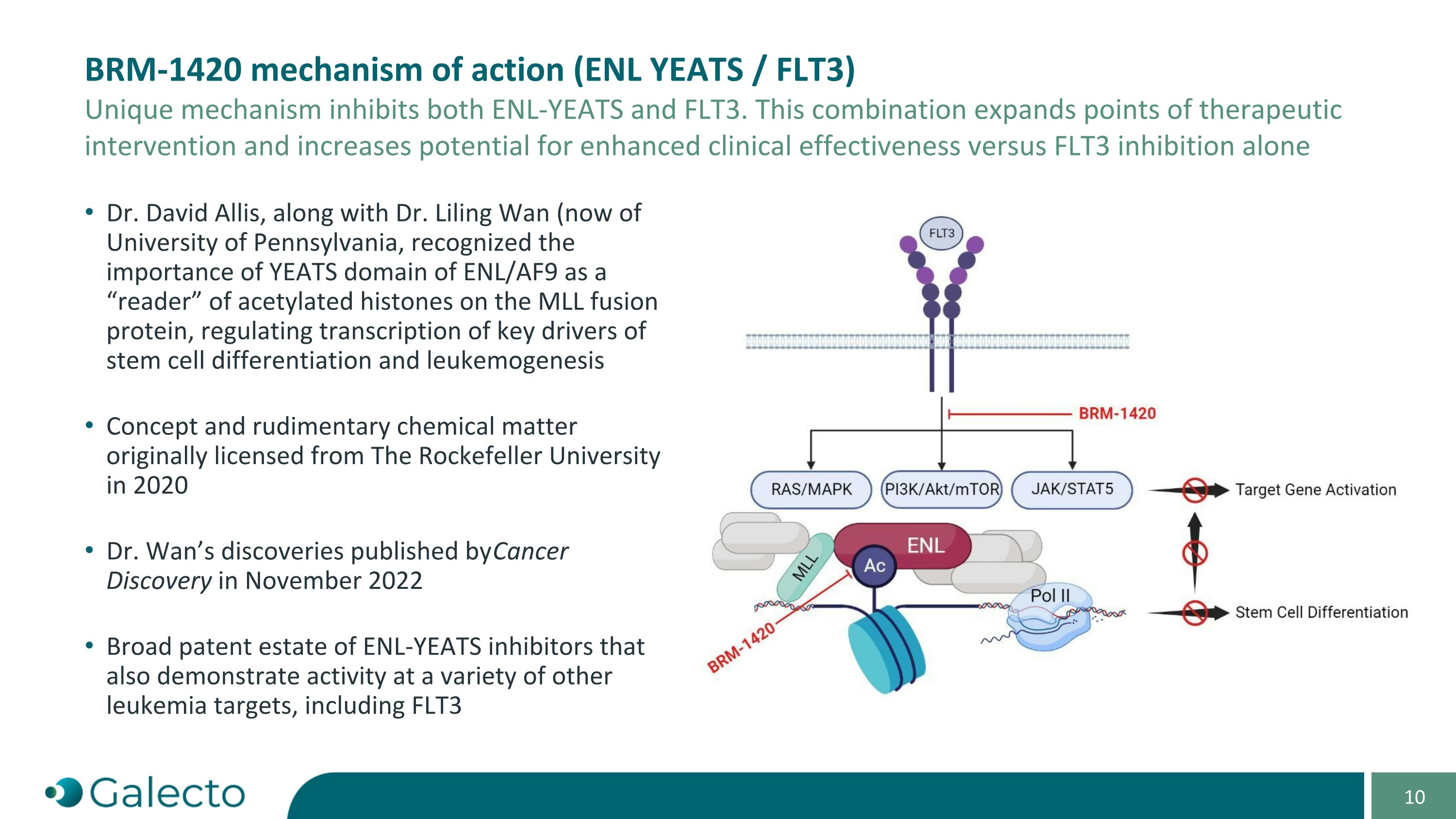
BRm-1420的作用機制(ENL YEATS / FLT3) 這種獨特的機制抑制了ENL-YEATS和FLT3。這種組合擴展了治療干預點,並增加了與單獨抑制FLT3相比的臨床療效增強的潛力。 David Allis博士與Liling Wan博士(現任賓夕法尼亞大學)共同認識到ENL/AF9的YEATS結構域作爲「閱讀器」可激酶在MLL融合蛋白上的乙酰化組蛋白,調節了幹細胞分化和白血病發生關鍵驅動基因的轉錄。概念和基礎化學物質最初於2020年從洛克菲勒大學獲得許可。萬莉玲博士的發現於2022年11月在《癌症發現》上發表。ENL-YEATS抑制劑的廣泛專利組合還表現出在各種其他白血病靶點(包括FLT3)上的活性。
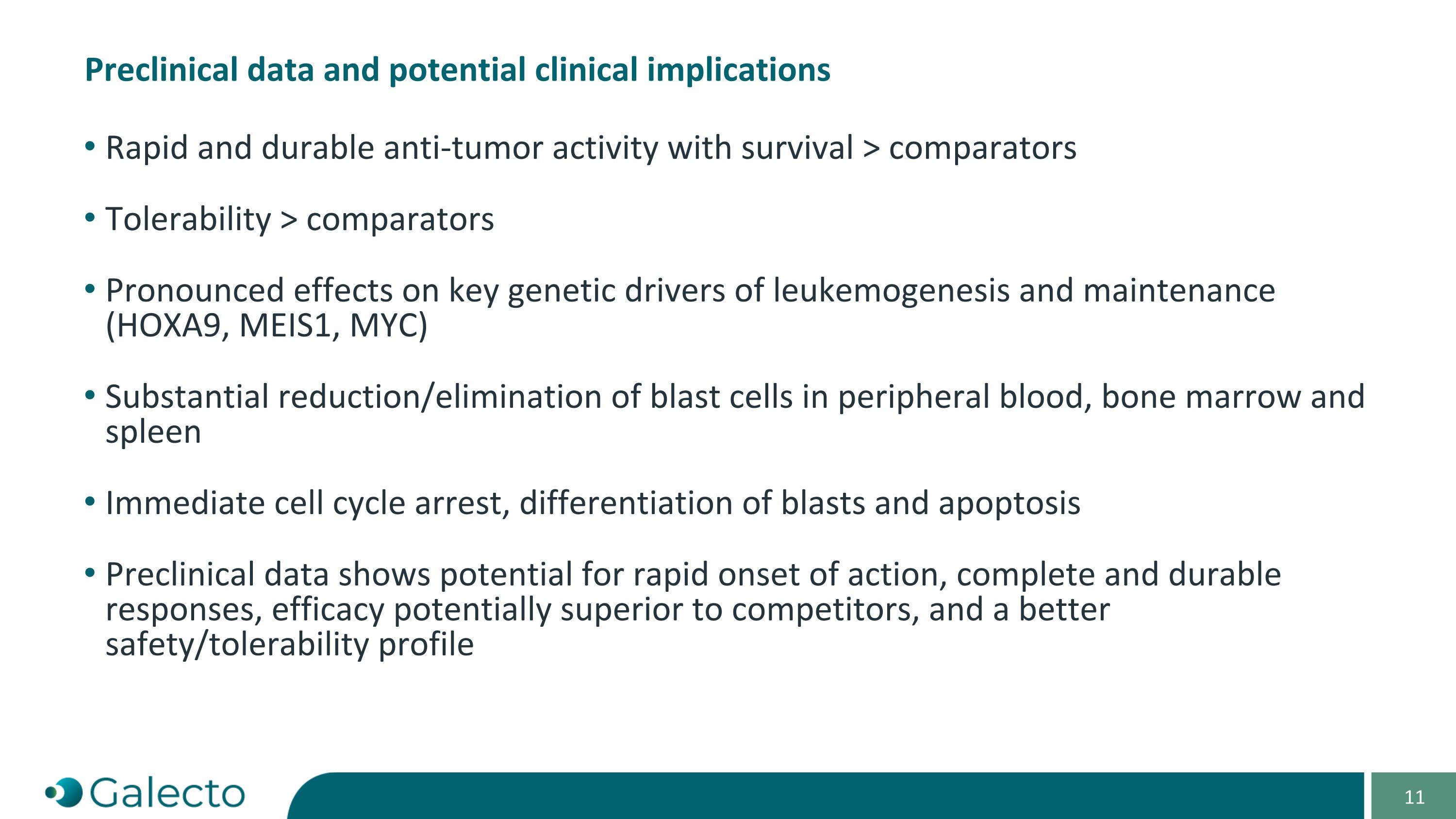
藥物前期研究數據和潛在的臨床意義 迅速持久的抗腫瘤活性,存活率高於對照組 耐受性優於對照組 對白血病發生和維持的關鍵基因驅動因子(HOXA9、MEIS1、MYC)產生明顯影響 外周血、骨髓和脾臟中爆發細胞的顯著減少/消除 立即細胞週期停滯,爆炸細胞分化和凋亡 前期研究數據顯示,可能具有迅速起效、完全持久的療效,療效可能優於競爭對手,以及更好的安全性/耐受性概況
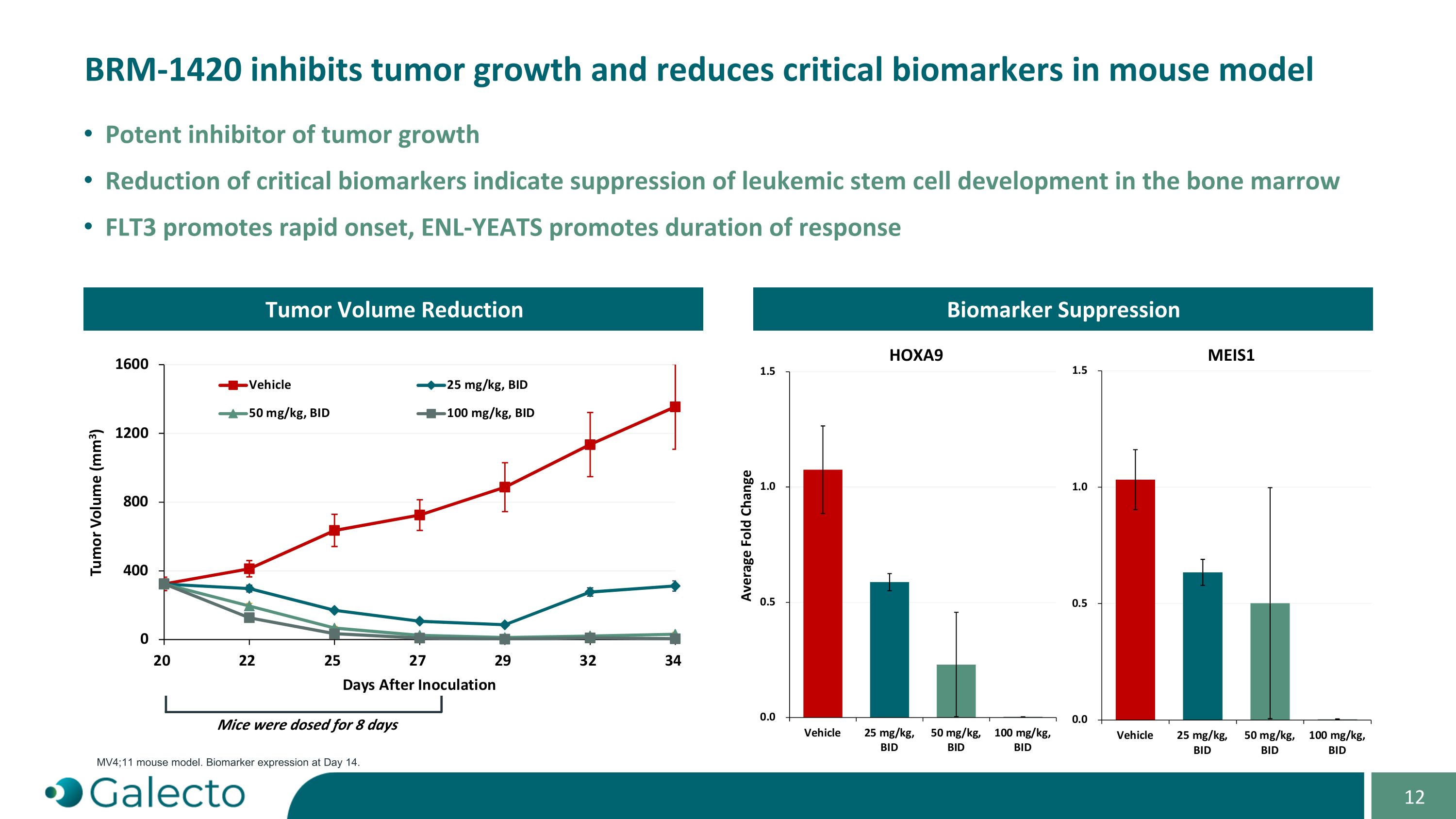
BRm-1420抑制腫瘤生長並降低小鼠模型中的關鍵生物標誌物。對腫瘤生長的有效抑制。降低關鍵生物標誌物表明對骨髓中白血病幹細胞發育的抑制。FLT3促進快速發作,ENL-YEATS促進應答持續時間。腫瘤成交量減少小鼠接受8天的劑量MV4;11小鼠模型。第14天生物標誌物表達。生物標誌物抑制HOXA9 MEIS1平均倍數變化。
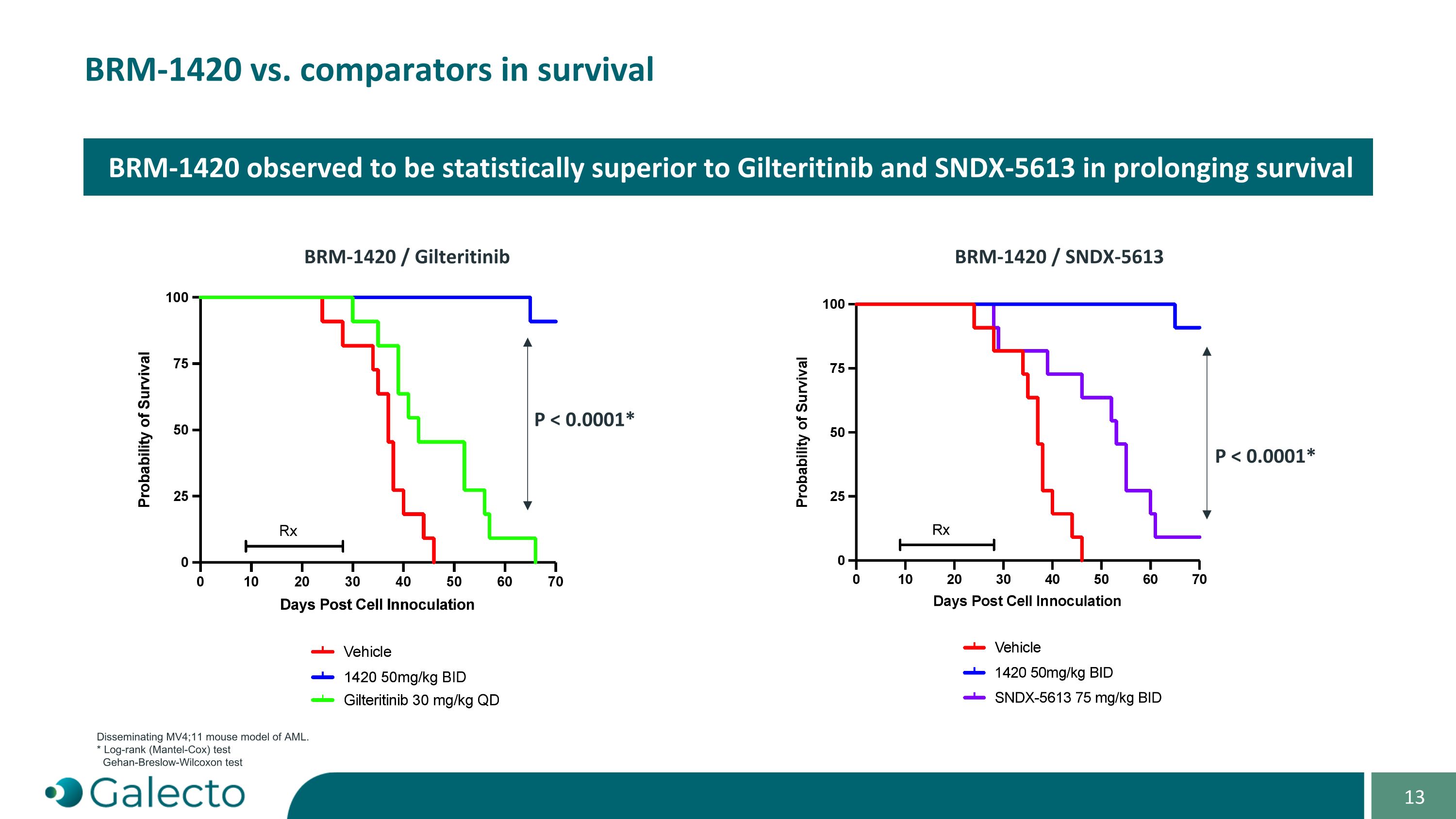
在AML的MV4;11小鼠模型中,BRm-1420與比較藥物在生存方面進行比較。* 對比(Log-rank)檢驗 Gehan-Breslow-Wilcoxon檢驗觀察到BRm-1420在延長生存方面在統計學上優於Gilteritinib和SNDX-5613 BRm-1420 / Gilteritinib BRm-1420 / SNDX-5613 P < 0.0001* P < 0.0001*
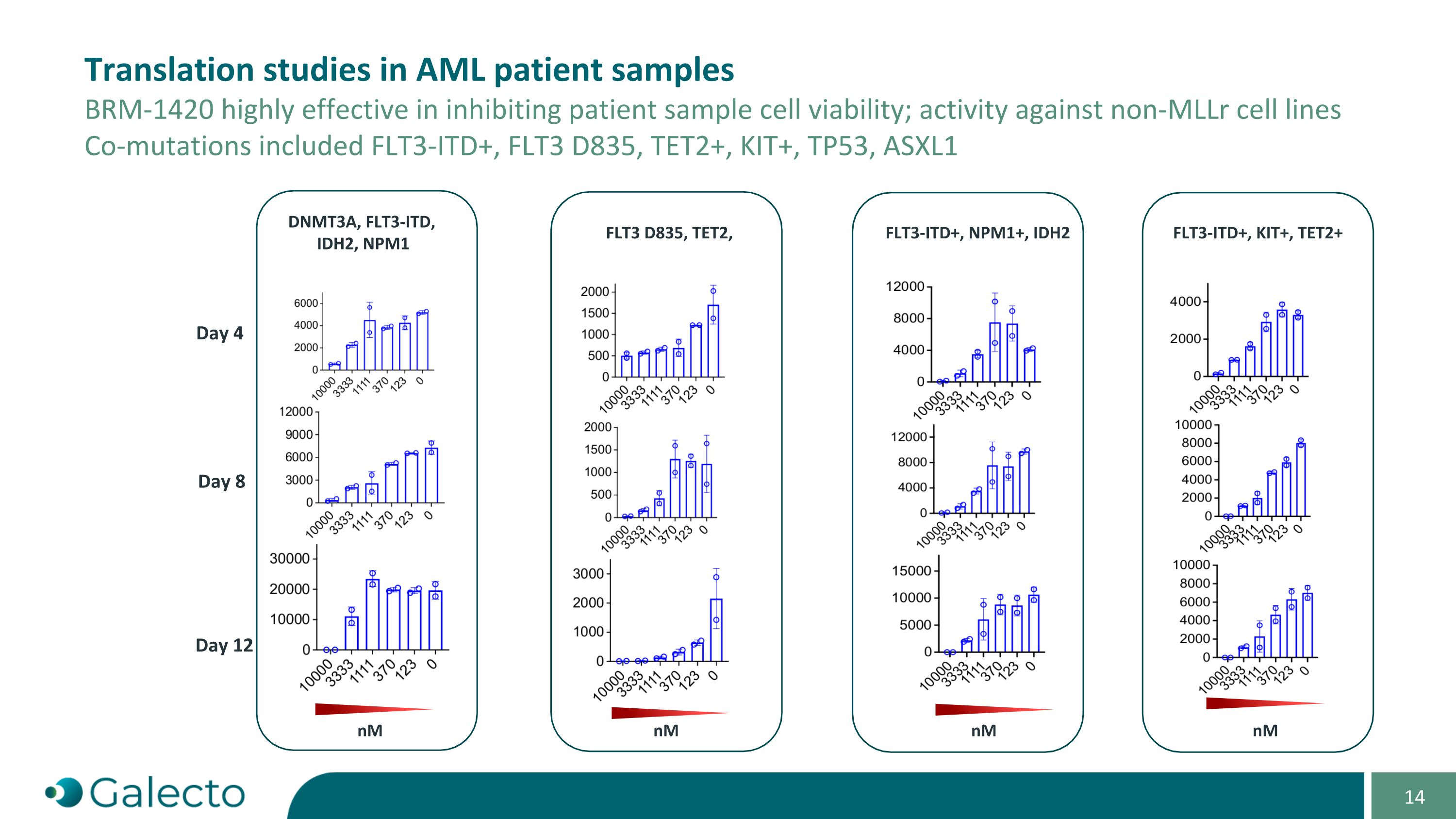
AML患者樣本中的翻譯研究 BRm-1420在抑制患者樣本的細胞存活能力方面非常有效;對非MLLr細胞系的活性 共同突變包括FLT3-ITD+,FLT3 D835,TET2+,KIT+,TP53,ASXL1,DNMT3A,FLT3-ITD,IDH2,NPM1 第4天 第8天 第12天 FLT3 D835,TET2,FLT3-ITD+,NPM1+,IDH2 FLT3-ITD+,KIT+,TET2+ nm nm nm nM
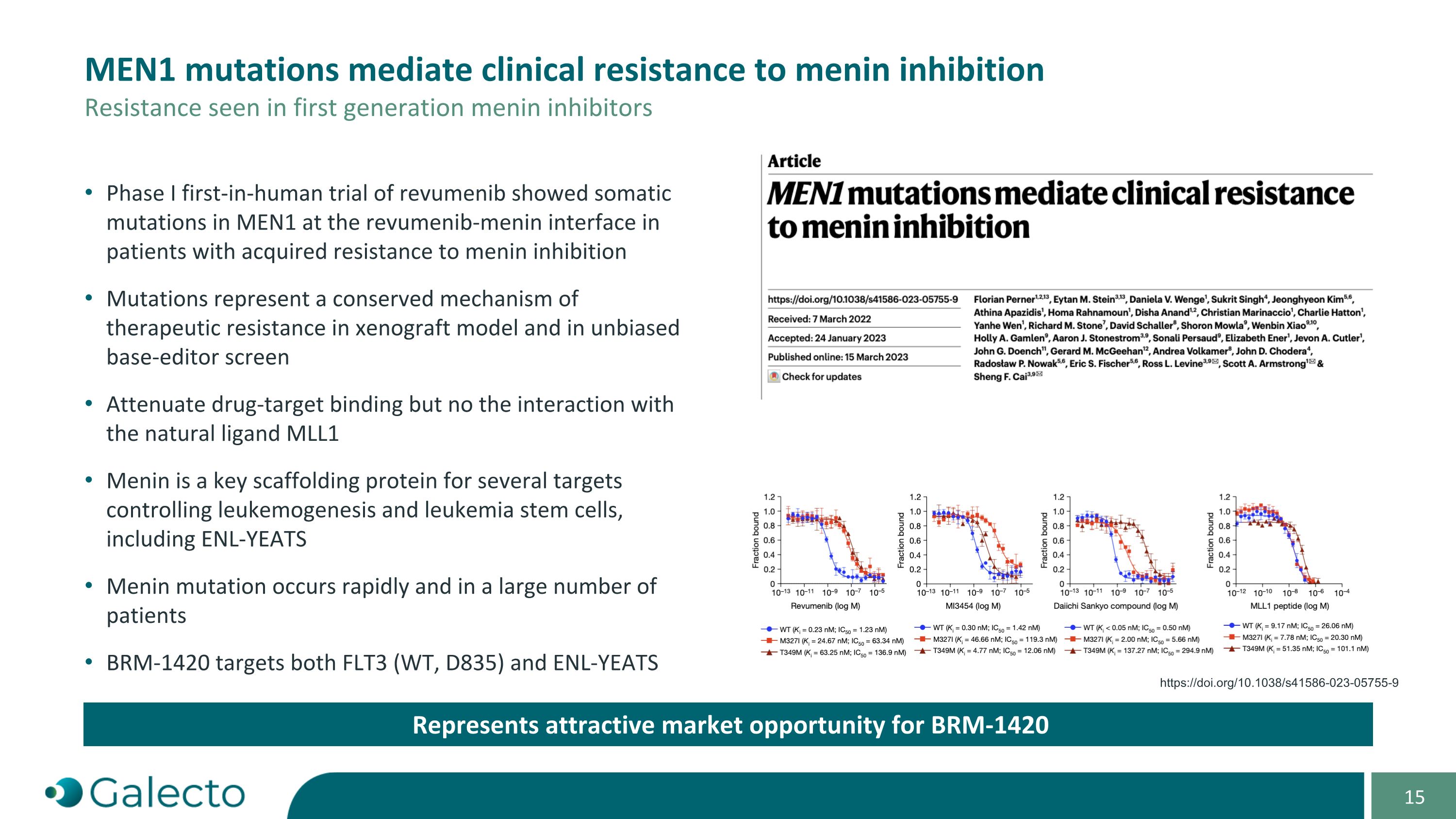
MEN1突變介導對menin抑制的臨床支撐位 第一代menin抑制劑中觀察到的支撐位代表了BRm-1420的有吸引力的市場機會 revumenib的I期首次進行人體試驗顯示,在獲得對menin抑制的耐受性的患者中,MEN1基因發生體細胞突變位於revumenib-menin界面上支撐位進化的治療性阻力機制表示在移植癌模型中及在非偏見的鹼基編輯器篩選中突變減弱藥物靶標結合,但沒有影響與天然配體MLL1的相互作用 Menin是控制白血病發生和白血病幹細胞的幾個靶標的關鍵支架蛋白,包括ENL-YEATS Menin突變迅速發生,並且發生在大量患者中 BRm-1420的靶標包括FLT3(Wt,D835)和ENL-YEATS https://doi.org/10.1038/s41586-023-05755-9
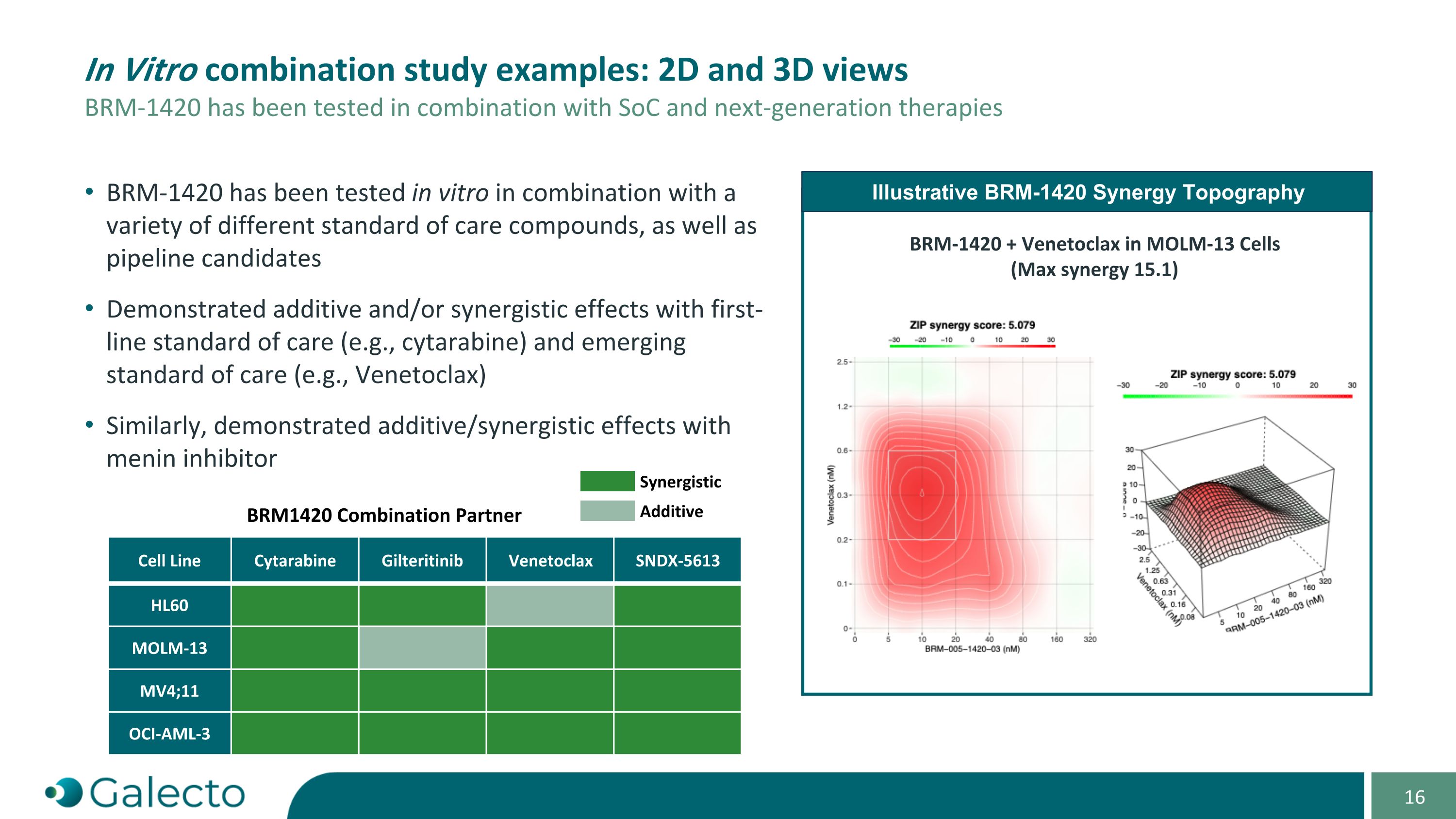
體外組合研究示例:2D和3D視圖 BRm-1420已在與SoC和下一代療法的組合中進行了測試 BRm-1420協同作用拓撲圖 BRm-1420 + Venetoclax在MOLm-13細胞中(最大協同作用15.1) BRm-1420已在體外與各種不同的常規治療化合物以及流水線候選藥物的組合中進行了測試 展示出與一線常規治療(例如,紫杉醇)和新興常規治療(例如,Venetoclax)的相加和/或協同效應 同樣,展示出與menin抑制劑相加/協同效應 電芯系紫杉醇 吉列替尼 Venetoclax SNDX-5613 HL60 MOLm-13 MV4;11 OCI-AML-3 BRM1420組合夥伴 協同 添加

BRm-1420毒理學總結 在大鼠和狗中均耐受良好,無QTc風險。當前標準護理和在研化合物中已遇到安全/Pk風險。FLT3抑制劑吉雷替尼的常見副作用包括腹瀉、貧血、疲勞和肝功能酶升高;警告包括QT延長。Syndax的麥角鉻蛋白抑制劑對耐受性(QT延長)和藥物相互作用(CYP3A4抑制劑)存在問題。在狗心血管研究中,未觀察到BRm-1420對QTc的顯著延長,劑量最高可達每千克100毫克。大鼠和狗的14天試驗中未見死亡、靶器官毒性或臨床化學指標變化。在臨床環境中,白細胞計數、紅細胞比積和血紅蛋白有輕微且可控的影響。尤其在AML的標準護理中,對骨髓/血細胞計數的影響通常更爲嚴重。觀察到網織紅細胞減少,但可在臨床環境中輕鬆監測並可逆轉。網織紅細胞的影響可能歸因於對AF9的抑制,並間接反映了靶向作用。在狗研究中,研究運營商認爲每千克200毫克是最大耐受劑量,根據反覆嘔吐、軟到液體便和體重下降。

GB1211口服型Galectin-3抑制劑用於癌症
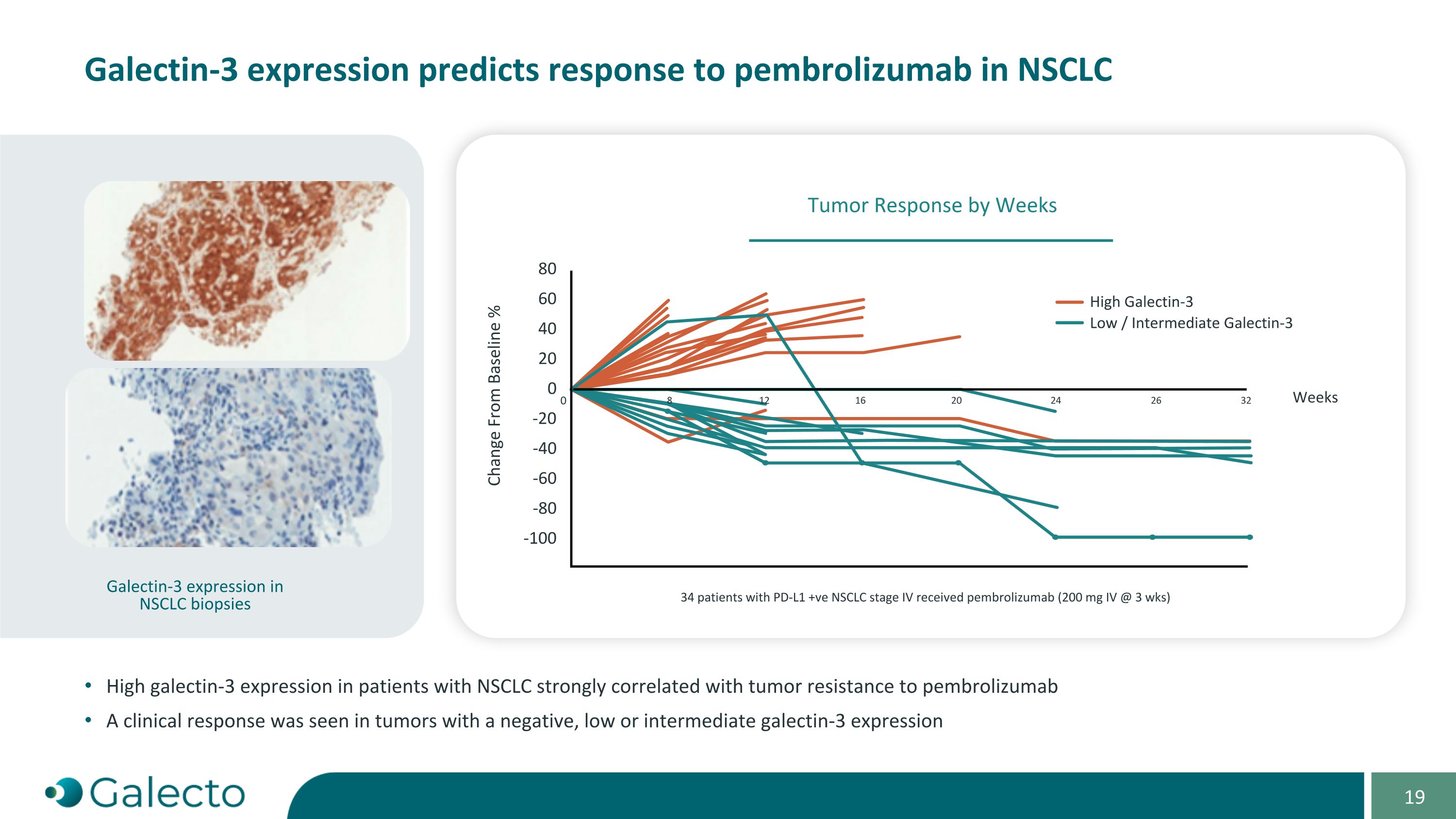
Galectin-3表達預測對NSCLC的Pembrolizumab響應。在NSCLC患者中,高Galectin-3表達與腫瘤對Pembrolizumab的抵抗有很強的相關性。在表達爲陰性、低或中間水平的腫瘤中觀察到臨床反應。NSCLC活檢中的Galectin-3表達,34名PD-L1陽性NSCLC第四期患者接受了Pembrolizumab(每3周200 mg靜脈注射)。-20 80 60 40 20 與基線變化% 0 0 8 12 16 20 24 26 32 高Galectin-3 低/中Galectin-3周 -40 -60 -80 -100 按周腫瘤反應
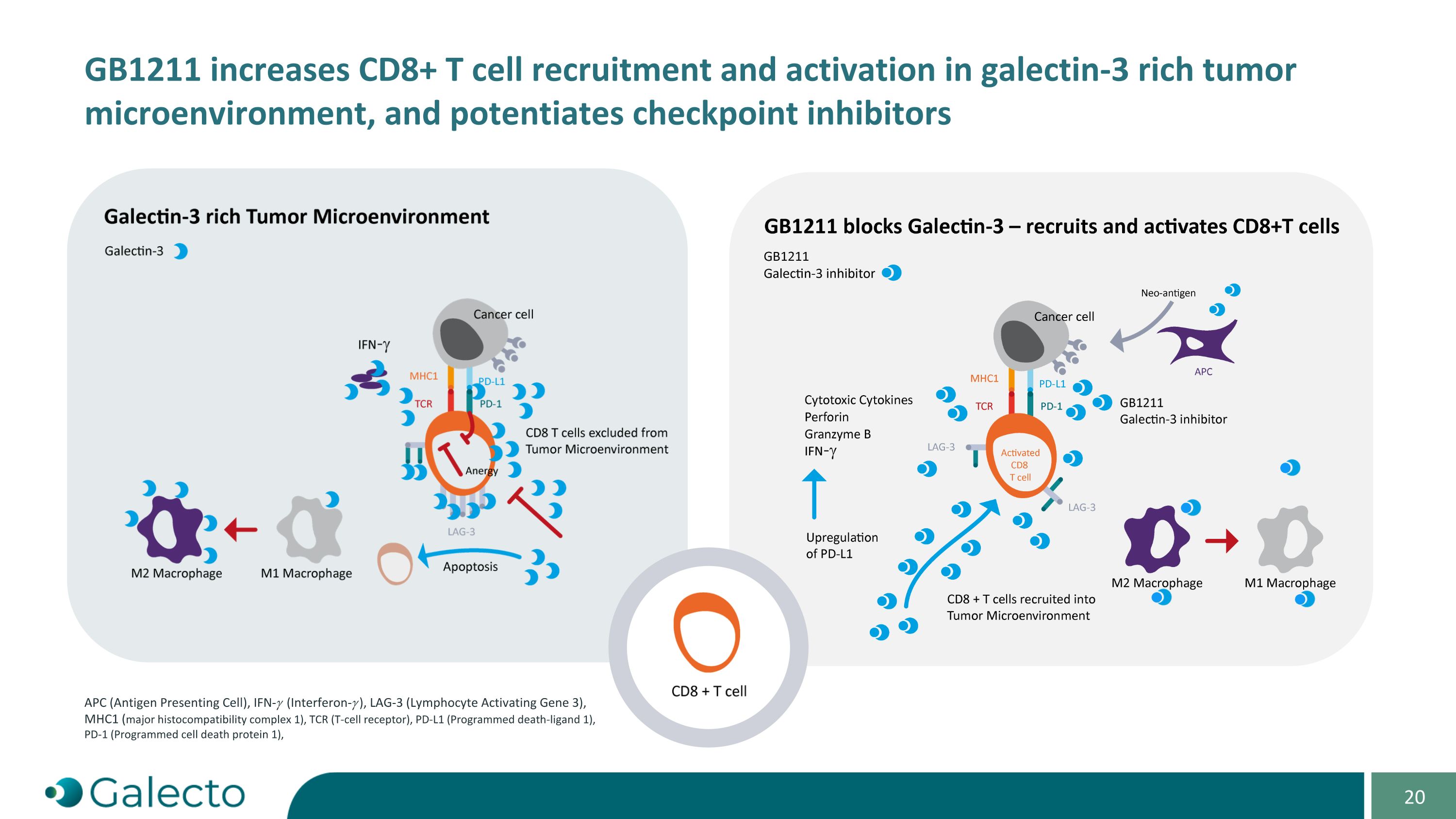
GB1211增加CD8+T細胞在富含galectin-3的腫瘤微環境中的招募和激活,並增強APC(抗原呈遞細胞),IFN-𝛾(干擾素-𝛾),LAG-3(淋巴細胞激活基因3),MHC1(主要組織相容性複合體1),TCR(T細胞受體),PD-L1(程序化死亡配體1),PD-1(程序化細胞死亡蛋白1)的檢查點抑制劑作用。
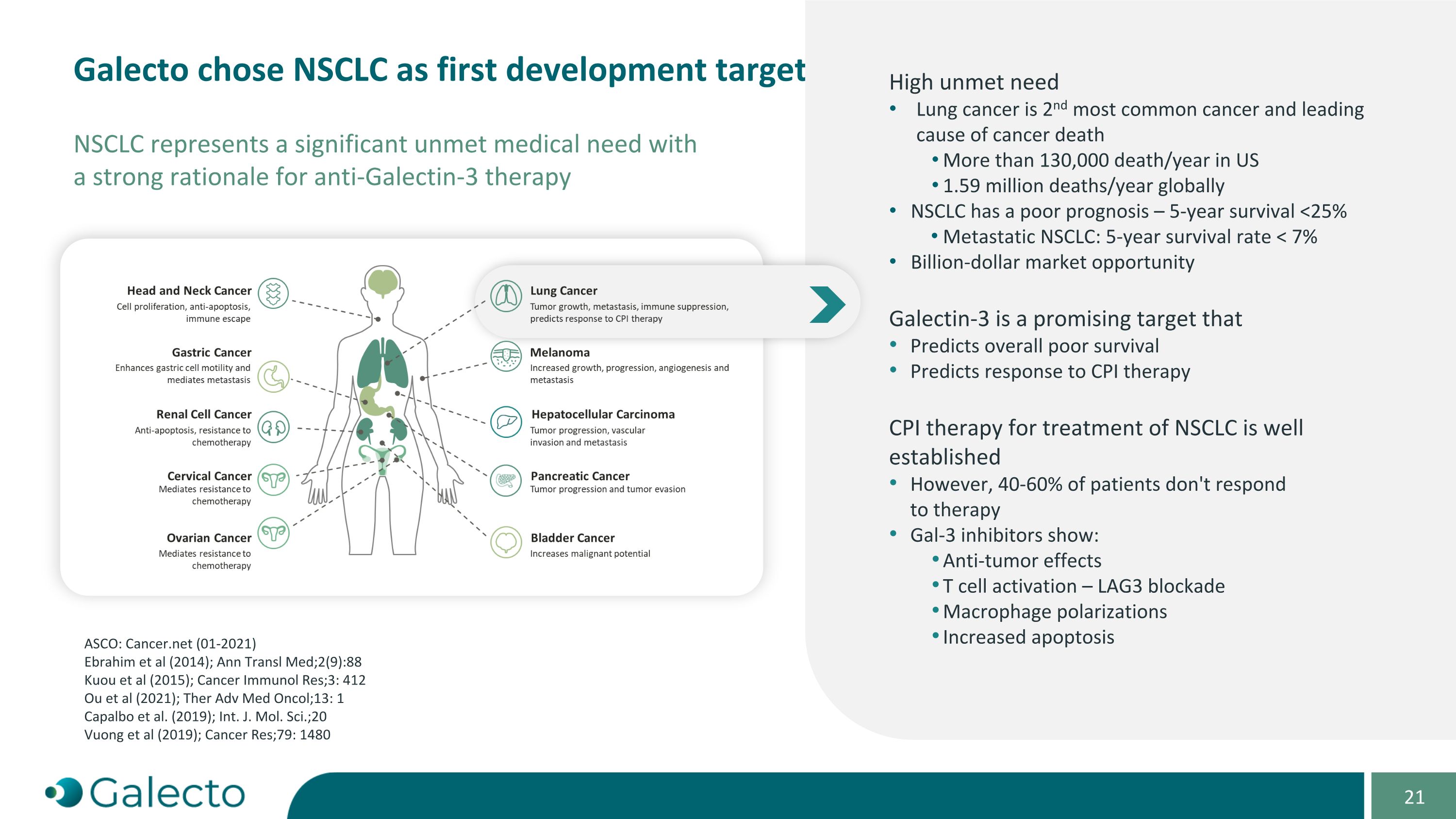
galecto選擇NSCLC作爲首個開發目標 NSCLC代表了一個迫切需要醫療干預的重大疾病,具有抗galectin-3療法強有力的理據 ASCO: Cancer.net (01-2021) Ebrahim等(2014); Ann Transl Med;2(9):88 Kuou等(2015); Cancer Immunol Res;3: 412 Ou等(2021); Ther Adv Med Oncol;13: 1 Capalbo等(2019); Int. J. Mol. Sci.;20 Vuong等(2019); Cancer Res;79: 1480 NSCLC存在嚴重未被滿足的需求 肺癌是第二常見癌症,也是癌症死因的主要原因 美國每年有超過130,000人死於此病,全球每年有159萬人死亡 NSCLC的預後很差 - 5年生存率<25% 轉移性NSCLC: 5年生存率<7% 百億美元的市場機遇 Galectin-3是一個有前景的靶標, 可預測整體差的生存預後 也可預測對CPI療法的反應 對NSCLC的CPI療法已經被廣泛應用 但是40-60%的患者對療法沒有反應 Gal-3抑制劑表現出: 抗腫瘤效果 T細胞激活-LAG3阻斷 巨噬細胞極化 增加細胞凋亡

GALLANt-1 - A/C部分:atezolizumab + GB1211 開放標籤研究,調查GB1211與atezolizumab聯合一線治療非小細胞肺癌患者的安全性和有效性。該研究是與Roche合作進行的患者人群:表達PD-L1的晚期或轉移性非小細胞肺癌的至少50%腫瘤細胞一線治療的主要終點:安全性和耐受性,腫瘤縮小;次要終點包括Pk測量,ORR(RECIST)探索性研究:GB1211對藥效動力學標記和生物標誌物的影響,GB1211 100毫克 每日兩次 + atezo 同時化療不允許 哨兵組 GB1211 200毫克 每日兩次 + atezo 篩選基線
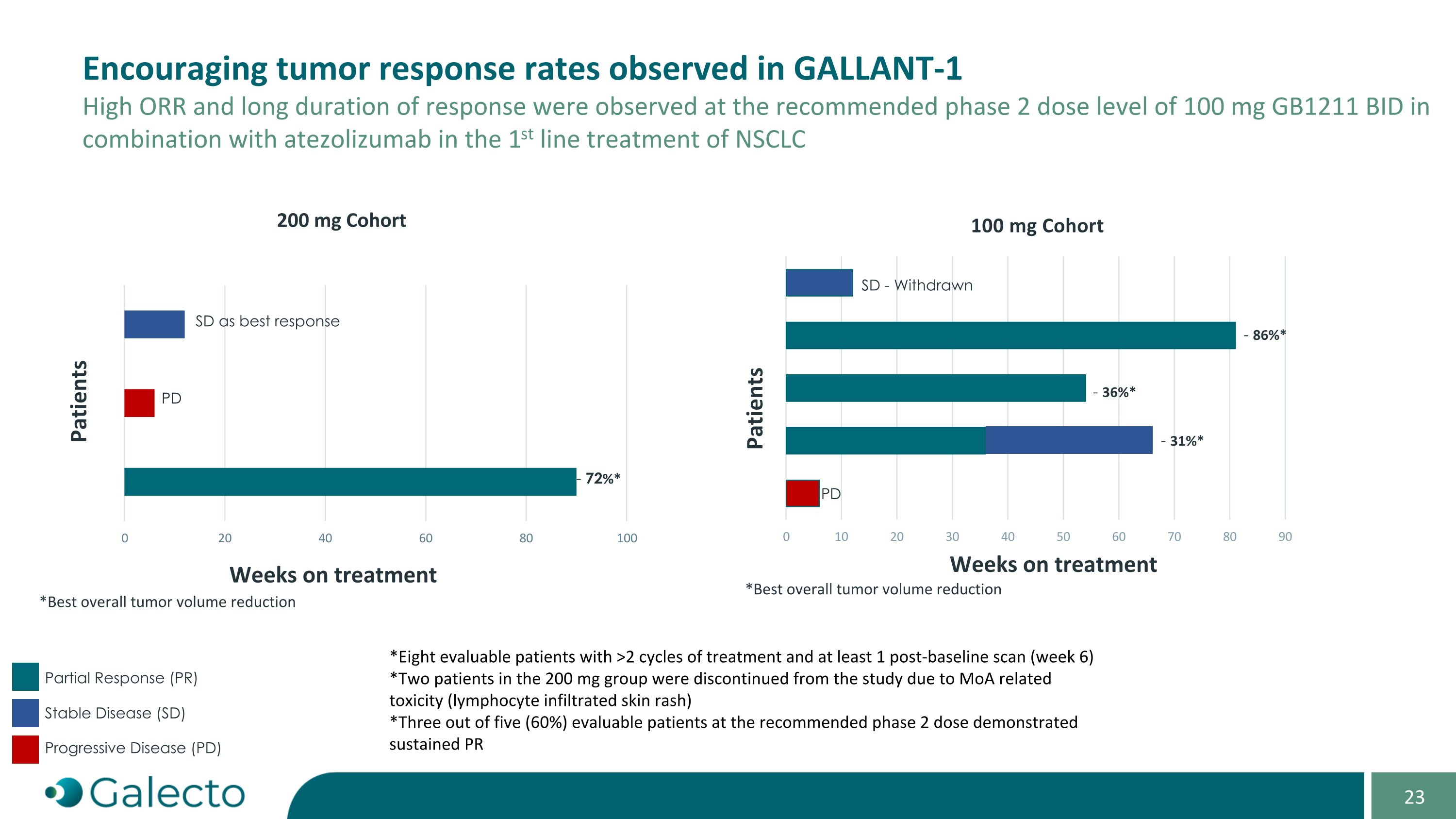
觀察到在GALLANt-1中鼓舞人心的腫瘤反應率。 在尿酸氨基轉肽酶抑制劑GB1211每日100mg開多劑量與atezolizumab相結合治療NSCLC DP的第一線治療中觀察到高ORR和長期反應持續時間 * 通過至少1次基線後(第6周)掃描和至少2個週期治療的八位可評價患者 * 200mg組的兩名患者由於MoA相關毒性(淋巴細胞浸潤性皮疹)而退出研究 * 在推薦的第2期劑量中5名可評價患者中的3名(60%)顯示出持續PR SD作爲最佳反應 PD SD - 退出 - 36%* - 31%* - 86%* PD - 72%* 治療週數 患者 患者 *200mg隊列治療週數 *最佳整體腫瘤體積減少 * 部分緩解(PR) 穩定疾病(SD) 進展性疾病(PD)

200毫克劑量引起的限制劑皮膚反應表明淋巴細胞活化,從而支持GB1211與atezolizumab聯合的作用機制。GALLANt-1研究中納入的患者不適合化療-CPI聯合用藥,儘管ECOG 0-1的表現狀態,研究人群可能代表了難治患者群體的一部分,而100毫克GB1211的開多劑量在atezolizumab基礎上看起來安全且耐受良好。長期治療的患者沒有安全顧慮,基於劑量縮放建模,100毫克的劑量似乎足夠,反應似乎超出了atezolizumab單藥預期療效,R2PD的ORR爲60%,而預期爲30%。反應持續時間和PFS看起來已經超出了預期,所有有反應的患者接受治療時間超過1年。截至2024年9月30日,在試驗的延長期內有兩名患者正在接受GB1211+atezo治療。機密結論-GALLANt-1 GB1211似乎在與atezolizumab單藥聯合中表現出良好的耐受性和令人鼓舞的療效。

GB1211 口服凝集素-3抑制劑 用於肝硬化
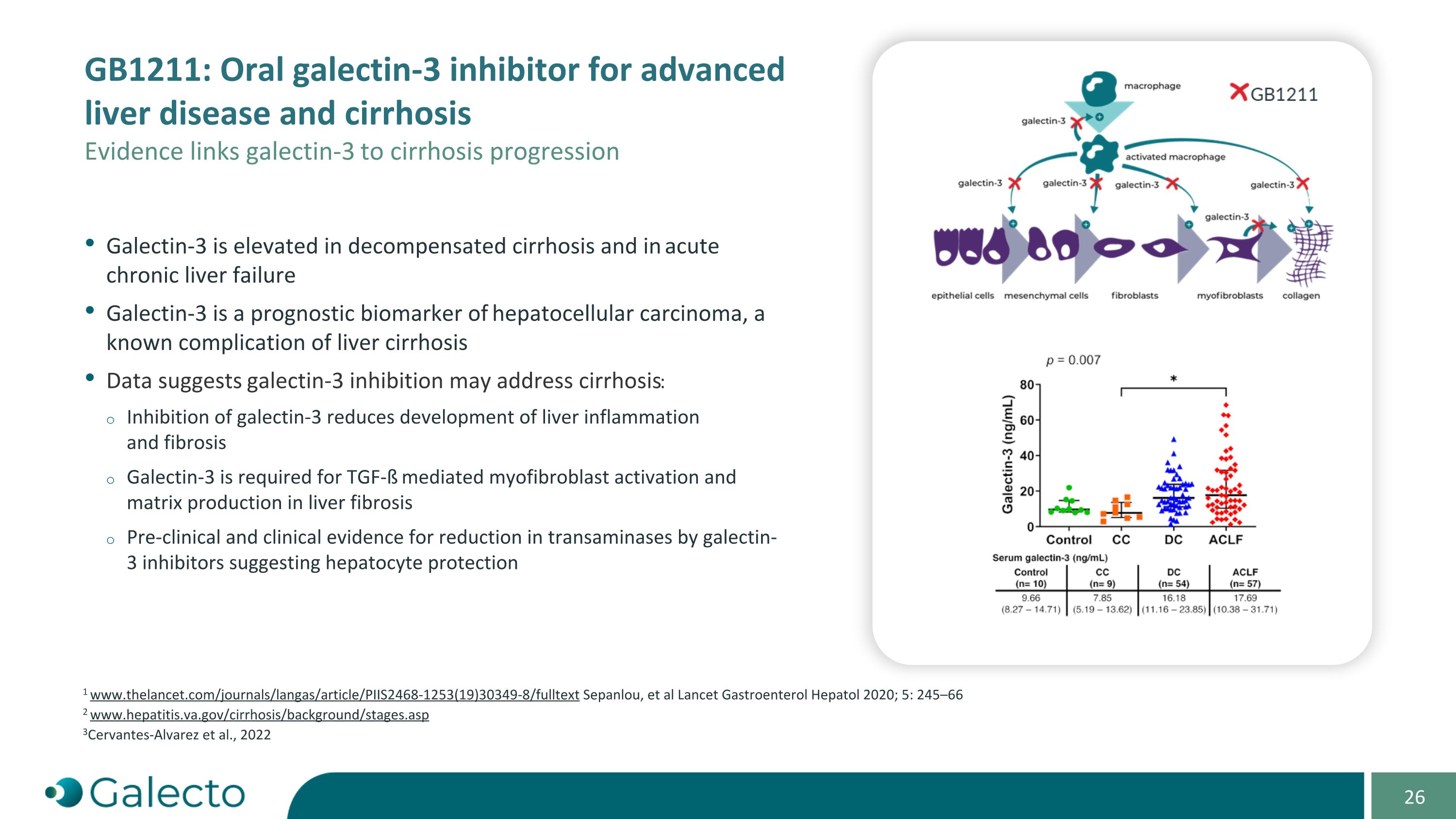
GB1211:口服愛文思控股益生菌治療先進的肝病和肝硬化 證據將愛文思控股與肝硬化進展聯繫起來。愛文思控股在失代償性肝硬化和急性慢性肝衰竭中升高。愛文思控股是肝細胞癌的預後生物標誌物,是肝硬化已知的併發症。數據表明,抑制愛文思控股可能有助於治療肝硬化:抑制愛文思控股可減少肝臟炎症和纖維化的發展。肝硬化需要TGF-ß介導的肝纖維化細胞激活和基質生成。臨床前和臨床證據表明,愛文思控股抑制劑可以減少轉胺酶,提示對肝細胞的保護。1 www.thelancet.com/journals/langas/article/PIIS2468-1253(19)30349-8/fulltext Sepanlou等,Lancet Gastroenterol Hepatol 2020;5:245-66 2 www.hepatitis.va.gov/cirrhosis/background/stages.asp 3Cervantes-Alvarez等,2022

GULLIVER-2 – 第2部分 在Child-Pugh b患者中通過隨機、雙盲、安慰劑對照的爲期12周的研究 買盤,每天兩次; CAP,受控衰減參數; Pk,藥代動力學; VCTE,振動受控瞬時彈性成像 第1部分: 單劑量肝功能不全研究 (Child-Pugh B) 第3部分: 單劑量肝功能不全研究 (Child-Pugh C) GB1211 100mg 買盤 (n=15) 安慰劑 買盤 (n=15) Pk樣本取樣日期:第1天,第7天,第21天,第42天,第63天,第84天 生物化學檢驗日期:第1天,第7天,第42天,隨訪第96天 第2部分: 重複劑量肝功能不全研究 (Child-Pugh B) 主要終點:安全性和耐受性 Pk 探索性終點 生物化學檢驗 肝纖維化 (VCTE) 脂肪變性 (CAP) 探索性生物標誌物
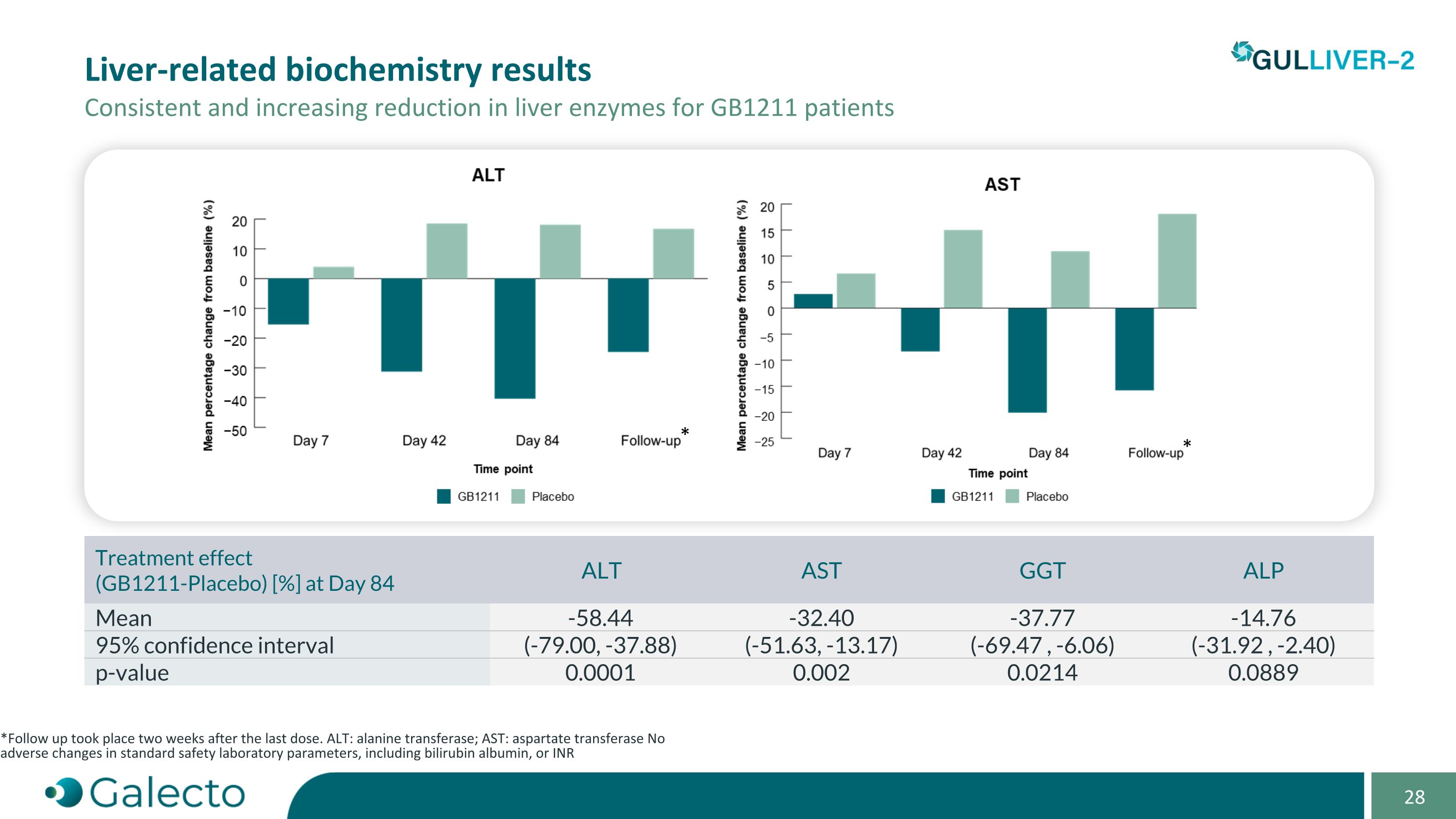
與GB1211患者相關的肝生化學結果 肝酶持續逐漸降低 * 最後一次劑量後兩週進行了隨訪。 ALT:丙氨酸轉移酶; AST:天冬氨酸轉移酶 標準安全實驗室參數未發生不良變化,包括膽紅素白蛋白或INR * * 治療效果(GB1211-安慰劑)[%] 第84天 ALT AST GGt ALP 平均值 -58.44 -32.40 -37.77 -14.76 95%置信區間(-79.00,-37.88)(-51.63,-13.17)(-69.47,-6.06)(-31.92,-2.40)p值 0.0001 0.002 0.0214 0.0889
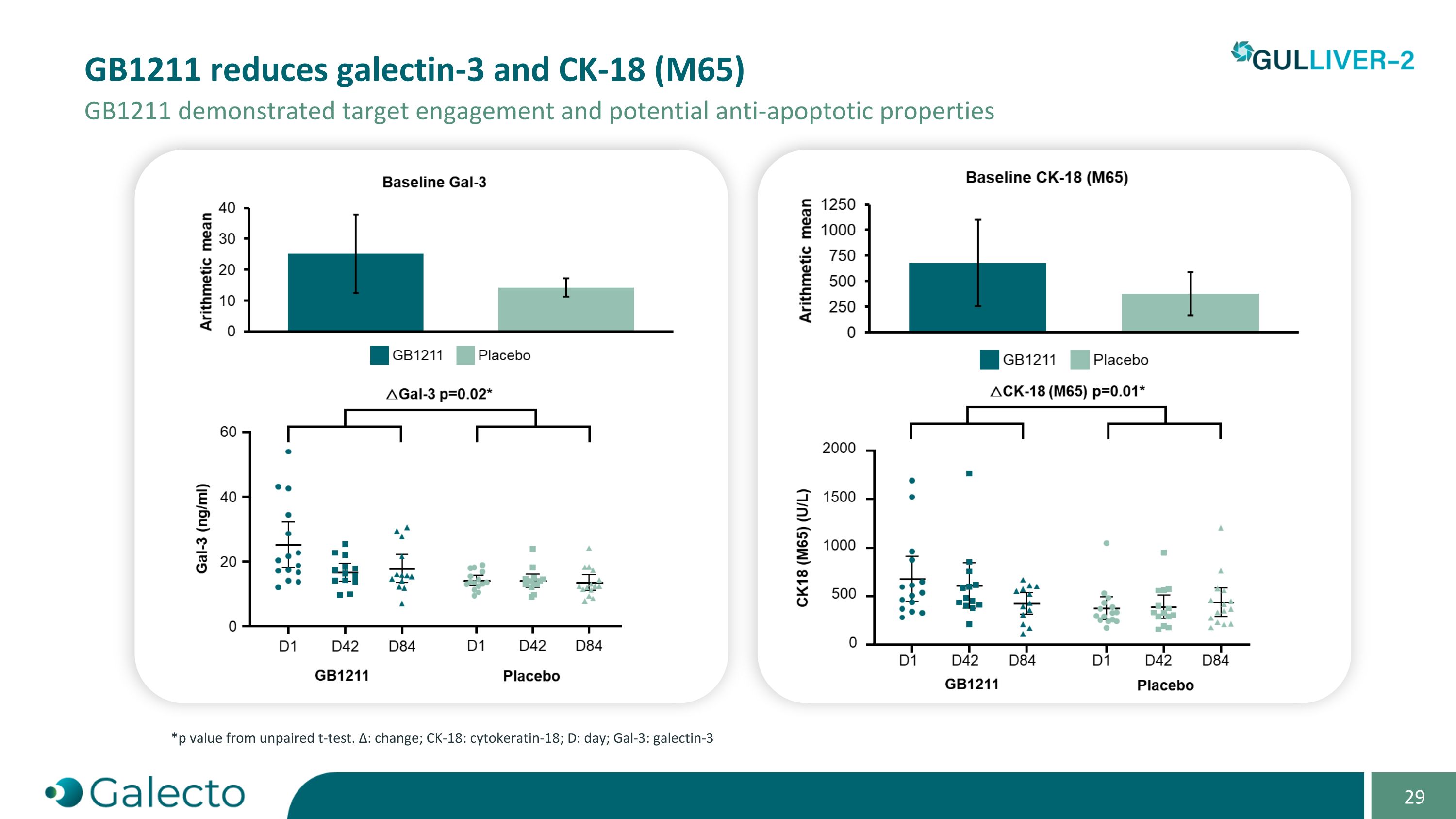
GB1211減少了Galectin-3和Ck-18(M65),GB1211展示了靶點結合和潛在的抗凋亡特性 *p值來自非配對t檢驗。Δ:變化;Ck-18:細胞角蛋白-18;D:天;Gal-3:Galectin-3
GULLIVER-2 - 階段一頂線結果 在代償性肝硬化患者人群中的研究結果令人鼓舞。結果強烈支持在嚴重肝病中進行2/3期研究,肝病中的Galectin-3,一種碳水化合物結合蛋白顯示通過TGF-ß受體驅動纖維化,在代償性肝硬化、酒精性肝炎和ACLF中升高。GB1211是Galectin-3的有效、選擇性、口服抑制劑。耐受良好GB1211在患者中沒有發現藥物相關不良事件。可預測的Pk(藥代動力學)剖面與在肝功能受損患者中重複給藥的選擇一致。臨床Galectin-3的減少證明了靶向效應,ALt、ASt和GGt中一致且具統計顯著性的降低,與肝生化學、肝硬度和脂肪生成的協同變化觀察到了。數據表明GB1211改善了肝臟炎症並減少了肝損傷。

概括

galecto在進行戰略審查後增強了管道,截至2024年6月30日,現金餘額約爲2290萬美元,資金用於正在進行的試驗並通過2026年進入的項目。 完成戰略審查確定核心資產和方向。 在一項全面的戰略審查流程後,galecto已決定專注於癌症和肝病,利用其現有的臨床階段資產GB1211。 管道得到了BRm-1420用於AML的收購的支持,這帶來了新穎性和突破潛力。在Leerink的協助下,通過對多項資產的審查,確定了在AML預臨床模型中表現優異的資產。加強的管道專注於腫瘤和肝病創新平台以針對核心疾病過程,是ENL-YEATS和galectin-3階段的先驅者基於藥理學首個高度特異的口服小分子抑制劑。 所有計劃均解決:以明顯未滿足的醫療需求爲特徵的疾病數十億美元的市場機會初步數據支持藥物活性ENL-YEATS抑制劑:MoA估計覆蓋AML人口30%以上在AML模型中具有快速持久的抗腫瘤活性。 Galectin-3抑制劑:靶向參與顯示積極的生物標誌數據實質證明肝硬化腫瘤微環境轉變中的臨床數據。