
CS
美国
证券交易委员会
华盛顿特区20549
表格
(标记一个)
根据1934年证券交易法第13或15(d)条款的季度报告。 |
截至2024年6月30日季度结束
或
根据1934年证券交易法第13或15(d)条款的过渡报告 |
在从 到的过渡期间
委员会档案编号:

(根据其章程所指定的正式名称)
|
||
(依据所在地或其他管辖区) 的注册地或组织地点) |
|
(国税局雇主识别号码) |
|
|
|
(总部办公地址) |
|
(邮政编码) |
(
(注册人电话号码,包括区号)
根据法案第12(b)条规定注册的证券:
每种类别的名称 |
|
交易 标的 |
|
每个注册交易所的名称 |
|
|
请勾选以下选项以表示申报人(1)已提交证券交易法1934年第13条或15(d)条所要求提交的所有报告,且在过去12个月中(或申报人需要提交此类报告的较短期间)已提交;(2)已受到过去90天内此类提交要求的限制。
请勾选表示,是否公司已根据监管S-t条例第405条(本章第232.405条)的规定,于过去12个月内(或公司必须提交这些文件的较短期间)提交了所有必须提交的互动数据文件。
勾选表示登记人是大型加速申报人、加速申报人、非加速申报人、较小型申报公司或新兴成长公司。详细定义请参阅《交易所法》第1202条中“大型加速申报人”、“加速申报人”、“较小型申报公司”和“新兴成长公司”的定义。
大型加速档案 |
|
☐ |
|
|
☒ |
|
|
|
|
|
|||
非加速文件 |
|
☐ |
|
较小的报告公司 |
|
|
|
|
|
|
|
|
|
新兴成长公司 |
|
|
|
|
|
|
如果是新兴成长型企业,在符合任何依据证券交易法第13(a)条所提供的任何新的或修改的财务会计准则的遵循的延伸过渡期方面,是否选择不使用核准记号进行指示。☐
请勾选是否被视为甲壳公司(依据交易所法规120亿2条所定义)。是 ☐ 否
截至2024年11月5日,申报人持有
arcturus therapeutics holdings inc及其附属公司
目 录
|
|
页面 |
第一部分 |
1 |
|
项目一。 |
1 |
|
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
项目二。 |
16 |
|
第三项目。 |
26 |
|
第四项。 |
26 |
|
第二部分 |
28 |
|
项目一。 |
28 |
|
项目 1A。 |
28 |
|
项目二。 |
28 |
|
第三项目。 |
28 |
|
第四项。 |
28 |
|
第五项。 |
28 |
|
第六项 |
29 |
|
32 |
||
i
有关前瞻性声明的特别注意事项
根据《1933年证券法案》第27A条及《1934年证券交易法》第21E条的修改规定,在这份《第10-Q表格季度报告》(以下简称“季度报告”)中,包括所提及的“管理层对财务状况和营运结果的讨论与分析”部分以及参考资料中可能包含明示或暗示的“前瞻性陈述”并根据 1995 年《私人证券诉讼改革法案》中安全港条款进行陈述。 我们的实际结果可能因多种因素而与这些前瞻性陈述中预期的结果有所不同,包括本季度报告下所列“第II部分,项目1A,本季度报告中的风险因素”中阐述的因素。 除非法律要求,我们不承担更新这些前瞻性陈述的义务,无论是新资料、未来事件或其他原因的结果。 这些陈述代表我们对于各种未来事件的当前期望或信念,可能包含字眼如“可能”、“将”、“期望”、“预期”、“打算”、“计划”、“相信”、“估计”或其他表明未来结果的字眼,但并非所有前瞻性陈述必然包含这些识别字眼。 这样的陈述可能包括但不仅限于下列陈述:
ii
这些以及其他前瞻性的陈述仅为目前的预测,可能受已知和未知的风险、不确定因素和其他因素的影响,这可能导致我们或我们的行业的实际结果、活动水平、表现或成就与前瞻性陈述所预期的大不相同。此外,科学研究、临床前期和临床试验的历史结果并不保证未来的研究或试验将得出同样的结论,也不保证这里提及的历史结果将因进一步的研究、临床前期和临床试验结果或其他原因而以相同方式解释。本季度报告中包含的前瞻性陈述受到风险和不确定性的影响,包括在我们向美国证券交易委员会(“委员会”)提交的其他文件中讨论的风险和不确定性。读者被警告不要过度依赖这些前瞻性陈述,除非另有特别声明,这些陈述仅于本报告之日期起发挥作用。尽管我们目前认为前瞻性陈述中所反映的期望是合理的,但我们无法保证未来的结果、活动水平、表现或成就。
iii
第一部分 - 财务资讯
第1项。基本报表。
arcturus therapeutics holdings inc及其附属公司
缩表合并资产负债表
|
|
九月三十日, |
|
|
12月31日, |
|
||
(以千为单位,除每股面值资料外) |
|
(未经审计) |
|
|
|
|
||
资产 |
|
|
|
|
|
|
||
流动资产: |
|
|
|
|
|
|
||
现金及现金等价物 |
|
$ |
|
|
$ |
|
||
限制性现金 |
|
|
|
|
|
|
||
应收帐款 |
|
|
|
|
|
|
||
预付费用及其他流动资产 |
|
|
|
|
|
|
||
全部流动资产 |
|
|
|
|
|
|
||
物业及设备,扣除折旧后净值 |
|
|
|
|
|
|
||
营运租赁权利资产,净额 |
|
|
|
|
|
|
||
非流动限制性现金 |
|
|
|
|
|
|
||
资产总额 |
|
$ |
|
|
$ |
|
||
负债及股东权益 |
|
|
|
|
|
|
||
流动负债: |
|
|
|
|
|
|
||
应付账款 |
|
$ |
|
|
$ |
|
||
应付负债 |
|
|
|
|
|
|
||
逐步认列的收入 |
|
|
|
|
|
|
||
流动负债合计 |
|
|
|
|
|
|
||
透过分期收入取得的未来收入,减去当前部分 |
|
|
|
|
|
|
||
租赁负债净额,除去当期部分 |
|
|
|
|
|
|
||
其他非流动负债 |
|
|
— |
|
|
|
|
|
总负债 |
|
|
|
|
|
|
||
股东权益 |
|
|
|
|
|
|
||
0.01 |
|
|
|
|
|
|
||
资本公积额额外增资 |
|
|
|
|
|
|
||
累积亏损 |
|
|
( |
) |
|
|
( |
) |
股东权益总额 |
|
|
|
|
|
|
||
负债和股东权益总额 |
|
$ |
|
|
$ |
|
||
附带附注是这些简明综合财务报表中不可或缺的一部分。
1
arcturus therapeutics holdings inc及其附属公司
综合损益及综合亏损简明综合损益表
(未经审计)
|
|
三个月结束 |
|
|
截止九个月 |
|
||||||||||
|
|
九月三十日 |
|
|
九月三十日 |
|
||||||||||
(以千计,每股数据除外) |
|
2024 |
|
|
2023 |
|
|
2024 |
|
|
2023 |
|
||||
收入: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
协作收入 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
拨款收入 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
总收入 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
营运费用: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
研究与开发,网络 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
一般及行政 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
营运开支总额 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
营运损失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
外币(亏损)收益 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
清除债务的收益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
财务收入净额 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
所得税前净亏损 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
所得税预约 |
|
|
( |
) |
|
|
|
|
|
— |
|
|
|
|
||
净亏损 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
每股净亏损(基本和稀释) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
权重平均持续发行、基本及稀释股 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
全面损失: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
净亏损 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
全面损失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
相关附注是这些基本报表的一个不可或缺的部分。
2
arcturus therapeutics holdings inc及其附属公司
综合总表股东权益变动表
(未经审计)
|
|
|
|
|
|
|
|
额外的 |
|
|
|
|
|
总计 |
|
|||||
|
|
普通股 |
|
|
资本剩余 |
|
|
累计 |
|
|
股东权益 |
|
||||||||
(以千为单位) |
|
股份 |
|
|
金额 |
|
|
资本 |
|
|
赤字累计 |
|
|
股权 |
|
|||||
2023年12月31日余额 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
净损失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
股份报酬费用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
行使股票期权获发的普通股份 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
2024年3月31日止结余 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
净损失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
股份报酬费用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
行使股票期权获发的普通股份 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
2024年6月30日余额 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
净损失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
股份报酬费用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
行使股票期权获发的普通股份 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
根据股权计划发行普通股 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
2024年9月30日结余 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
|
|
|
|
|
|
|
|
额外 |
|
|
|
|
|
总计 |
|
|||||
|
|
普通股 |
|
|
付款 |
|
|
累积 |
|
|
股东 |
|
||||||||
(以千计) |
|
股票 |
|
|
金额 |
|
|
资本 |
|
|
赤字 |
|
|
股票 |
|
|||||
二零二二年十二月三十一日结余 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
净收入 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
基于股份的赔偿费用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
二零二三年三月三十一日结余 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
基于股份的赔偿费用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
行使股票期权时发行普通股 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
二零二三年六月三十日结余 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
净亏损 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
基于股份的赔偿费用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
行使股票期权时发行普通股 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
根据股票计划发行普通股 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
余额 — 二零二三年九月三十日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
相关附注是这些基本报表的一个不可或缺的部分。
3
arcturus therapeutics holdings inc及其附属公司
综合所得综合财务报表现金流量表
(未经审计)
|
|
截至9月30日的九个月 |
|
|||||
(以千为单位) |
|
2024 |
|
|
2023 |
|
||
营运活动 |
|
|
|
|
|
|
||
净损失 |
|
$ |
( |
) |
|
$ |
( |
) |
调整为使净亏损转化为经营活动所使用现金: |
|
|
|
|
|
|
||
折旧与摊提 |
|
|
|
|
|
|
||
股份报酬费用 |
|
|
|
|
|
|
||
外币交易损失 |
|
|
|
|
|
|
||
偿还债务收益 |
|
|
— |
|
|
|
( |
) |
其他非现金费用 |
|
|
— |
|
|
|
|
|
资产及负债的变动: |
|
|
|
|
|
|
||
应收帐款 |
|
|
|
|
|
( |
) |
|
预付费用和其他资产 |
|
|
( |
) |
|
|
|
|
租赁资产 |
|
|
|
|
|
|
||
应付账款 |
|
|
|
|
|
|
||
应付负债 |
|
|
( |
) |
|
|
( |
) |
逐步认列的收入 |
|
|
( |
) |
|
|
|
|
租赁负债 |
|
|
( |
) |
|
|
( |
) |
经营活动所使用之净现金流量 |
|
|
( |
) |
|
|
( |
) |
投资活动 |
|
|
|
|
|
|
||
资产及设备的收购 |
|
|
( |
) |
|
|
( |
) |
投资活动中使用的净现金 |
|
|
( |
) |
|
|
( |
) |
融资活动 |
|
|
|
|
|
|
||
行使股票期权所得 |
|
|
|
|
|
|
||
来自股权计划下普通股发行的收入 |
|
|
|
|
|
|
||
债务收入 |
|
|
— |
|
|
|
|
|
偿还负债 |
|
|
— |
|
|
|
( |
) |
筹资活动提供的净现金 |
|
|
|
|
|
( |
) |
|
813,840 |
|
|
( |
) |
|
|
( |
) |
期初的现金、现金等价物和受限现金 |
|
|
|
|
|
|
||
期末的现金、现金等价物和受限现金 |
|
$ |
|
|
$ |
|
||
|
|
截至9月30日的九个月 |
|
|||||
|
|
2024 |
|
|
2023 |
|
||
现金流额外披露 |
|
|
|
|
|
|
||
支付利息的现金 |
|
$ |
— |
|
|
$ |
|
|
非现金投资活动 |
|
|
|
|
|
|
||
非现金资产处分 |
|
$ |
|
|
$ |
— |
|
|
透过营运租赁取得的使用权资产 |
|
$ |
|
|
$ |
— |
|
|
购买应付帐款中的不动产和设备 |
|
$ |
— |
|
|
$ |
|
|
|
|
|
|
|
|
|
||
相关附注是这些基本报表的一个不可或缺的部分。
4
arcturus therapeutics holdings inc及其附属公司
简明综合财务报表附注 基本报表
(未经查核)
注意事项 1.业务描述、简报基础及重要会计政策摘要
业务描述
亚克图斯治疗控股有限公司(「公司」或「Arcturus」)是一家商业信使 RNA 药品公司,专注于开发传染病疫苗和肝脏和呼吸道罕见疾病的机会。Arcturus 于 2020 年成为临床阶段公司,当公司宣布其针对奥尼丁转甲酰胺酶(「OTC」)缺乏症的研究新药(「IND」)申请,以及其 LUNAR-COV19 临床试验申请(「CTA」)获得适用卫生当局批准。2023 年,我们的 2019 冠状病毒病疫苗 ArcT-154(也称为科斯塔伊夫)®),在日本获得上市许可批准
演示基础
随附的简明综合财务报表包括 Arcturus 及其附属公司的帐目,并未经审核。所有公司间账户和交易均已在合并中消除。这些简明的合并财务报表是根据美国公认的会计原则(「GAAP」)拟备中期财务资讯。因此,它们不包括 GAAP 对完整财务报表所需的所有信息和注脚。管理层认为,随附的简明综合财务报表反映了所有调整,包括正常经常性调整,这些调整包括一般经常性调整,这些调整认为对于公平呈现中期间期间的业绩是必要的。
中期财务业绩并不一定表示全年预期的业绩。这些简明综合财务报表应与截至二零二三年十二月三十一日止年度之公司表格 10-k 年报中所载之经审核合并财务报表及注脚一并阅读。
这些简明的合并财务报表是根据 GAAP 拟定,该规定要求管理层对某些债务和股权工具的估值、股份赔偿、负债累计、所得税、收入和延期收入、租赁等影响报告资产和负债金额的事项进行估算和假设,以及报告期间内报告的收入和支出金额的情况。尽管这些估计基于管理层对公司未来可能采取的当前事件和行动的知识,但实际结果最终可能与这些估计和假设有所不同。
合资企业、股票方式投资及变动利益实体
本公司具有重大影响力但没有控制权的投资,将按股票方式进行帐目。股权方式投资活动与该公司在阿卡利斯有限公司与阿克塞莱德公司(「阿克塞莱德」)的合资企业有关。本公司在投资机构业绩中的份额将以股票方式投资所产生的收益或亏损显示于随附的简明综合经营报表及综合损失。
流动性
自成立以来,本公司一直遭受重大的营运损失。截至二零二四年九月三十日及二零二三年十二月三十一日,公司累计赤字为美元
本公司自成立以来的活动主要包括研发活动、一般及行政活动以及筹集资金。本公司的活动存在重大风险和不确定性,包括在公司实现可持续营收和营运利润之前未能获得额外资金。自本公司成立至 2024 年 9 月 30 日,本公司主要用透过合作协议获得的收入、出售资本股、政府合约的费用偿还以及长期债务收益所得的收益来资助其营运。截至 2024 年 9 月 30 日,公司现金及现金等值(包括限制现金)余额为 $
管理层认为,该公司拥有足够的营运资金,至少在这些简明综合财务报表可供发行之日起计 12 个月起计的未来十二个月内提供资金。我们无法保证本公司将成功获得额外资金,公司对未来营运资金需求的预测是准确的,或任何额外的资金将足以在未来几年继续营运。
5
分段资讯
经营部门被识别为公司的一部分,关于该部门可提供独立的财务信息,供首席经营决策者评估并做出有关资源配置和业绩评估方面的决定。 该公司及其首席经营决策者以营运部门为基础来查看该公司的业务,并管理其业务。
营收认证
合同开始时,公司分析其合作安排,以评估该安排是否涉及由双方执行的联合营运活动,这些活动的成功与否与商业活动的成功息息相关,因此属于《会计标准裁定》(“ ASC”)主题808,合作安排(“ ASC 808”)的范畴内。 对于包含多个元素的在ASC 808范围内的合作安排,公司首先确定哪些元素反映供应商与客户关系,因此属于ASC 606范围内。
公司通过执行以下五个步骤来确定ASC 606范围内的安排的营收认识:(i)识别合同;(ii)识别合同中的履行义务;(iii)确定交易价格;(iv)将交易价格分配给合同中的履行义务;及(v)当公司满足履行义务时或随时认定营收。
公司的营收协议条款包括授权费、预付款、开发和监管里程碑付款、利润分配安排、研究和发展活动的费用补偿、期权行使费、药品物质和药品产品供应费、咨询和相关技术转移费以及商业产品销售的版税。 基于事件的里程碑付款代表变数考虑因素,并且公司使用可能性最大数额法来估计这个可变因素,因为公司将收到里程碑付款或不会收到,这使得潜在的里程碑付款成为一个二元事件。 可能性最大数额法要求公司确定获得里程碑付款的可能性。 鉴于这些里程碑实现的高度不确定性,公司确定里程碑金额完全受限,并且在与这些支付相关的不确定性解决之前不承认营收。 公司将根据销售发生的情况来认定基于销售的版税收入。 随著不确定事件得到解决并发生其他情况变化,公司将在每个报告期内重新评估交易价格。
绩效义务是合同中对共同合作伙伴承诺转让独立商品或服务的承诺,并且在ASC 606中是计量基准。合同的交易价格根据相对独立售价来分配给每个独立的绩效义务,当绩效义务被满足时,或与之同时,便被确认为营业收入。
对于按比例认列的绩效义务,公司使用输入法来衡量进度。所使用的输入方法基于为满足绩效义务而耗费的力量或支出的成本。公司估计所耗费的力量,包括完成活动所需的时间估计,或在某一特定期间内支出的成本,相对于预计总力量或成本以满足绩效义务。这种方法要求公司做出许多估计并使用重大的判断。如果估计或判断在合作进程中发生变化,则在识别这些变化的期间内,会对收入进行累积调整。
请查阅有关公司安排的具体细节的“附注2,营业收入”部分。
租赁
公司在开始时判断安排是否为租赁。租赁使用权资产代表公司使用基础资产的权利以进行租赁,而租赁负债代表公司因租赁而产生的租赁支付义务。对于初始期限超过12个月的营运租赁,公司根据起始日期的租赁支付的现值在租赁期内确认营运租赁使用权资产和营运租赁负债。营运租赁使用权资产由租赁负债和已支付的任何租金组成,但不包括租赁激励。租赁期限包括续租或终止租赁的选项,当公司合理确信将行使续租选项时,或当公司合理确信将不行使终止选项时。对于公司的营运租赁,如果用于确定未来租金支付现值的利率不容易确定,公司将估计其增量借贷利率作为租赁折现率。公司的增量借贷利率估计近似于具有类似条款和付款的抵押贷款的利率,并且处于相似的经济环境。租金支付的租赁费用将在租赁期内按直线法确认。公司已选择实用的简化方法,不将租赁和非租赁元素分开。
请查看 《注意事项9、承诺和条件》 了解有关公司租赁的具体细节。
6
研发成本净额
所有研究和发展成本都会在发生时进行费用支出。研究和开发成本主要包括薪金、员工福利、与临床前研究和临床试验有关的成本(包括支付给临床研究组织和其他专业服务的金额)、在研究和开发过程中的开发中研究和开发费用、预启动库存和授权协议费用。研究和开发费用已扣除任何资助款项。在获得货物或服务并用于研究和开发之前支付的款项会被资本化,直到收到货物或服务为止。
公司会为估计的研究和开发成本记录应计项,包括由第三方承包商、实验室、参与临床试验网站等执行的工作的支付。其中一些承包商根据实际提供的服务按月出具帐单,而其他人根据实现某些合同里程碑而定期出具帐单。对于后者,公司会在使用或提供的货物或服务时将费用应计入帐。
由第三方执行的临床试验活动会根据个别临床试验生命周期内工作完成比例的估计以及根据与临床研究机构("CROs")和临床试验网站建立的协议而应计和支出。通过检阅合同、供应商协议和采购订单,以及与内部临床人员和外部服务提供者讨论,以确定试验或服务进度或完成阶段和为该等服务支付的约定费用,来做出估计。
预启动库存
在获得实验性产品候选者的初步监管核准之前,公司会将与库存生产相关的成本视为研究和开发费用在其简明合并损益表中在发生时进行费用支出。当公司认为实验性产品候选者的监管核准以及随后的商业化是可能的,并且公司还预期从实验性产品候选者的销售中获得未来的经济利益时,公司将会将生产成本作为库存资本化。
受限现金
限制性现金包括根据与富国银行(国家协会)(以下简称“富国”)签订的安全协议在公司证券账户中抵押并持有的担保品(附注5)。截至2024年9月30日,此类担保品金额为$
限制性现金还包括作为租金支付的安全保证金和为公司办公室房东的信用状维持所需的现金。截至2024年9月30日和2023年,公司分别拥有$
下表提供了现金及现金等价物以及受限现金的调节,该调节合计与2024年9月30日和2023年损益表中显示的同等金额总和的财务报表未经审计资产负债表。:
(以千为单位) |
|
2024年9月30日 |
|
|
2023年9月30日 |
|
||
现金及现金等价物 |
|
$ |
|
|
$ |
|
||
限制性现金 |
|
|
|
|
|
|
||
非流动限制性现金 |
|
|
|
|
|
|
||
现金及现金等价物总额 |
|
$ |
|
|
$ |
|
||
每股净亏损
基本每股净损益是通过将净损除以流通在外的普通股加权平均股份数计算的,不考虑普通股等价物。稀释每股净损益是通过将净损除以加权平均的普通股和稀释性普通股等价物的股份数计算而得,该数量是使用库藏库存法确定的。截至2024年9月30日结束的三个月和九个月的稀释普通股份由期权和限制性股票单位组成。截至2023年9月30日结束的三个月和九个月的稀释普通股份由期权组成。
7
最近发布的会计准则尚未采纳
不时会有财务会计准则委员会或其他标准制订机构发布新的会计准则,并于指定的生效日期被公司采纳。除非另有讨论,公司认为尚未生效的最新发布的标准对简明合并财务报表和披露不会产生实质影响。
2023年11月,财务会计标准委员会(FASB)发布了《会计准则更新(ASU)2023-07,报告部门(主题280):有关报告部门披露的改进》,要求上市公司在中期和年度披露有关其报告部门重大费用和其他部门项目的信息。仅有一个报告部门的上市公司必须在中期和年度向ASU 2023-07披露要求之外,适用主题280中所有现有的部门披露和调解要求。ASU 2023-07对于开始于2023年12月15日之后的年度报告期间以及开始于2025年1月1日的中期报告期间生效,允许提前采纳。我们目前正在评估采纳ASU 2023-07将对我们的财务报表披露产生的影响。
8
附注2:营业收入
公司已与药品和生物技术公司签订授权协议和合作研究及开发安排,以及相应的咨询、相关科技转让、产品收入和政府资助协议。根据这些安排,公司有权收取授权费、咨询费、产品费、技术转让费、预付款、里程碑费用(在达到特定研究与开发里程碑、技术转让里程碑或基于成功的里程碑时)、已批准产品销售的权利金,以及研究与开发活动的费用。公司执行这些服务的成本包括在研究与开发费用中。公司的里程碑支付通常根据特定的前临床、临床和商业成功标准来定义。前临床里程碑可能包括疾病模型内或活体的概念证明、首选标靶的确定,以及完成IND启动毒理学研究。临床里程碑可能包括成功招募第一位患者、或完成第1、2和3期临床试验,商业里程碑通常基于净销售金额或总销售金额分层。由于与前临床和临床活动有关的风险,导致核酸药物治疗和疫苗的开发,公司无法保证达到这些里程碑。
以下表格介绍载入表终止之九个月内于2024年9月30日变动的合约资产和负债余额,相比于公司年报中所述。 于2024年9月30日结束的九个月内,合同资产和负债的余额与公司年报中所披露的情况相比发生变动。
(以千为单位) |
|
2023年12月31日 |
|
|
新增款项 |
|
|
扣除 |
|
|
2024年9月30日 |
|
||||
合同资产: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
应收帐款 |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
合同负债: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
逐步认列的收入 |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
以下表格总结了公司在指定期间的营业收入。
|
|
三个月内 |
|
|
为期九个月之总结 |
|
||||||||||
(以千为单位) |
|
2024 |
|
|
2023 |
|
|
2024 |
|
|
2023 |
|
||||
合作营收: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
CSL Seqirus |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
其他合作营收 |
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|||
合作总营收 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
补助金营收: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
BARDA |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
总补助营业收入 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
以下段落提供有关公司最重要合作和补助安排性质和目的的资讯。
9
CSL 赛克鲁斯
2022 年 11 月 1 日,本公司与 CSL 有限公司 (以下简称「CSL Seqirus」) 一份合作和授权协议(修订后称为「CSL 合作协议」),以获得针对研究、开发、制造和商业化疫苗的全球独家权利。根据 CSL 合作协议的条款,该公司为 CSL Seqirus 提供其 mRNA 技术(包括 STARR)的全球独家授权®) 和月亮® 脂质中介的交付,以及 mRNA 药物质和药品制造过程。CSL Seqirus 将在合作下领导疫苗的开发和商业化。合作计划推动预防 SARS-CoV-2(COVID-19)、流感、疫情预防以及其他三种呼吸道传染病的疫苗。2024 年 9 月,我们的 2019 冠状病毒疫苗科斯塔伊夫® 成为世界上第一种获批准且市面上可用的自增 RNA(sa-mRNA)疫苗。
该公司收到一美元
在根据 ASC 606 评估 CSL 合作协议时,公司得出 CSL Seqirus 是客户。公司在 CSL 合作协议中确定所有承诺的商品/服务,并在合并某些承诺的商品/服务时,公司得出结论有五个不同的履行责任。履行义务的性质包括提供疫苗许可证、COVID 和非 COVID 疫苗的研发服务,以及 COVID 疫苗的监管活动。对于每项履行义务,本公司会根据 1) 在牌照的情况下估计单独售价、使用重建成本加保证金法的公平价值及 2) 研发服务及监管活动,估计全职等值成本(「FTE」)的成本加利润,包括实验室用品、承包商以及其他研发服务和监管活动的其他自付费用。
截至 2024 年 9 月 30 日,交易价格包括已收到的预付款和实现里程碑。于 2024 年 9 月 30 日的交易价格中未包括额外的变动代价,因为公司无法判断包括可能不会导致收入明显逆转的情况。
本公司将交易价格与其独立销售价格比例分配给履行义务。疫苗许可证在 2022 年转让时被认可。研究开发和监管活动绩效义务是根据使用输入方法提供的服务百分比,即实际产生的成本除以满足履行义务预算的总成本。任何与以销售为基础的特许权费用有关的代价,将在金额有可能不退回时,只要报告的销售额可靠地衡量,并且本公司没有剩余承诺的商品/服务,因为这些金额受限制,因此也被排除在交易价格中。2024 年第三季度记录的收入与交付的许可证、达成的里程碑和截至 2024 年 9 月 30 日之前所提供的服务有关。
截至 2024 年 9 月 30 日和 2023 年 12 月 31 日,CSL 合作协议的延期收入总额为 40.3 美元 百万和美元
在 2023 年期间,公司还收到了 $ 的预付款
于 2023 年期间,本公司就《CSL 合作协议》订立了修订,根据该协议同意赞助和进行流感领域的一期临床研究。作为修订的一部分,公司获得 $
10
在 2023 年第四季度,公司收到了 $ 的预付款
2024 年 3 月,本公司就《CSL 合作协议》订立了修订,根据其他事项,双方同意调整 (i) 某些候选产品的开发计划、(ii) 与该等产品候选人相关的各项开发里程碑、(iii) CSL 合作协议与分销商相关的规定,以及 (iv) 上述有关的专有付款计算。
巴达奖助金
2022 年 8 月,该公司与美国卫生和人类服务部(HHS)办公室的生物医学先进研发管理局(「BARDA」)签订了成本补偿合同(「BARDA 合约」),以获得最高达美元的奖励
本公司确定巴达合约不属于 ASC 808 或 ASC 606 的范围。根据国际会计准则第 20 号(「IAS 20」)「政府资助会计及政府援助披露」,本公司同样地表明支付直接支出、经费拨款及附带福利的拨款所得的拨款收入。与这些补偿相关的成本在本公司简明综合运营报表和综合收益(亏损)中反映为研究和开发费用的一部分。
截至 2024 年 9 月 30 日,剩余的可用资金净额除收入 e被捕的是 $
第3条。公允价值衡量
公司通过在测量日期以市场参与者间进行有序交易时将收到的价格来确定其资产和负债的公允价值。公司建立了基于用于衡量公允价值的输入的公允价值层级。
公允价值层级分为三个级别:
第1级:活跃市场中对于相同资产或负债的报价价格。
第2级:非活跃市场中可直接或间接观察到的输入,且非报价价格。
第3级:具有很少或没有市场数据的不可观察输入,因此由公司开发的估计和假设来确定,反映出市场参与者将使用的估计。
由于现金、受限现金、应收账款、应付账款和应计负债的到期期限相对较短,其携带值接近各自的公允价值。
截至2024年9月30日和2023年12月31日所有资产按照重复性基准计量的公平价值包括货币等价物和货币市场基金,这些被归类在公平价值层次结构的第1级内。这些金融工具的公平价值是根据报价价格进行衡量的。
11
第四点。资产负债表详情
备有下列资产和设备净额:
(以千为单位) |
|
2024年9月30日 |
|
|
2023年12月31日 |
|
||
研究设备 |
|
$ |
|
|
$ |
|
||
电脑及软体 |
|
|
|
|
|
|
||
办公设备和家具 |
|
|
|
|
|
|
||
租赁改良 |
|
|
|
|
|
|
||
在建工程 |
|
|
— |
|
|
|
|
|
总计 |
|
|
|
|
|
|
||
减:累积折旧和摊销 |
|
|
( |
) |
|
|
( |
) |
物业及设备,扣除折旧后净值 |
|
$ |
|
|
$ |
|
||
折旧及摊销费用为$
应计负债包括以下内容:
(以千为单位) |
|
2024年9月30日 |
|
|
2023年12月31日 |
|
||
应计薪酬 |
|
$ |
|
|
$ |
|
||
囊性纤维化基金负债 |
|
|
|
|
|
|
||
应付所得税 |
|
|
— |
|
|
|
|
|
营运租赁负债的当期部分 |
|
|
|
|
|
|
||
临床试验应计费用 |
|
|
|
|
|
|
||
Vinbiocare合同负债 |
|
|
|
|
|
|
||
其他应计研发费用 |
|
|
|
|
|
|
||
总计 |
|
$ |
|
|
$ |
|
||
注意事项 5.债务
威尔斯法戈信用协议
本公司全资附属公司阿克图鲁斯治疗有限公司(「阿克图鲁斯治疗」)于 2023 年 4 月 21 日与威尔斯法戈银行签订信贷协议,并于 2024 年 6 月 26 日修订,其中威尔斯·法戈将赚一个 $
根据协议下的贷款将收取利率为
协议的期限最初是
附注6. 股东权益
每股净亏损
潜在稀释证券,未纳入截至2024年9月30日三个月和九个月的每股帐面总损益稀释计算中,因为它们具有抗稀释性,分别为
12
销售协议
在2022年12月23日,公司与康拓费城金融公司(Cantor Fitzgerald & Co.)、富国证券有限责任公司(Wells Fargo Securities)、威廉布莱尔公司(William Blair & Company, L.L.C.)签订了一份「受控股权发行℠销售协议」,该协议于2023年8月7日经修订(经修订后,称为「销售协议」),涉及公司普通股的股份。根据销售协议的条款,公司可以提供和卖出其普通股,其总发行价值高达$
附注 7. 基于股份的酬劳费用
在2024年6月的公司2024年股东大会(“2024年股东大会”)上,公司的股东们通过了对2019年全面权益奖励计划(经修订后称为“2019计划”)的修正案,其中包括增加了可供2019计划下资格人士获得奖励的股份总...股份,以使可发行的总股份数达到
公司于2021年10月采纳了2021年诱因股权激励计划,该计划涵盖最多-股普通股的奖励。
股票期权
公司综合损益表中包含的三个月和九个月截至日期的股份报酬费用如下: 2024年9月30日和2023年的股份报酬费用如下:
|
|
三个月内 |
|
|
|
为期九个月之总结 |
|
||||||||||
(以千为单位) |
|
2024 |
|
|
2023 |
|
|
|
2024 |
|
|
2023 |
|
||||
研究和开发 |
|
$ |
|
|
$ |
|
|
|
$ |
|
|
$ |
|
||||
一般和行政费用 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
总计 |
|
$ |
|
|
$ |
|
|
|
$ |
|
|
$ |
|
||||
附注8. 所得税
本公司需缴纳美国及各州的税款。公司通过使用预测的年度有效税率来计算季度所得税费用,并调整季度期间出现的任何离散项目。有效税率与联邦法定税率之间的主要差异是由于联邦和州所得税支出,抵销了公司递延所得税资产的估值准备金。
截至2024年9月30日止三个月,公司记录了$百万的所得税利益,截至
附注9. 承诺和条件
囊胞性纤维化基金协议
2023年9月25日,公司修订了与囊胞性纤维化基金(“CFF”)签订的发展计划函协议,该协议的日期为2017年5月16日,经修订分别为2018年7月13日和2019年8月1日。根据修订,CFF 将提高其将用于推进 LUNAR-CF 的奖励金额至$
13
租赁
于二零一七年十月,本公司就其先前占用总部附近的办公空间签订了一份不可取消的营运租赁协议。租约于二零一八年三月开始,租约延长约
该公司与业主签订一份不可撤销的备用信用证,并支付 $ 的保证金
二零二零年二月,本公司就目前总部附近的办公空间签订了第二份不可取消的营运租赁协议。租约延长至
2021 年 9 月,本公司就现有总部附近的办公室、研发、工程及实验室空间签订了第三份不可取消的租赁协议,并于 2022 年第二季开始。此租约的初始期限延长
简明综合资产负债表上的营运租赁使用权资产和负债表代表剩余租赁期间剩余租赁付款的现值。本公司不会将租赁费用分配给非租赁部分,因此,公共区域维护及行政服务的付款不包括在营运租赁使用权资产及责任中。本公司利用其增量借贷利率来计算租赁付款的现值,因为租赁中的隐含利率并无法轻易确定。
截至 2024 年 9 月 30 日,营运租赁责任的剩余款项如下:
(以千计) |
|
剩余租赁付款 |
|
|
2024 年(年度剩余部分) |
|
$ |
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
2028 |
|
|
|
|
之后 |
|
|
|
|
剩余租金总额 |
|
|
|
|
较少:计算利息 |
|
|
( |
) |
营运租赁负债总额 |
|
$ |
|
|
加权平均剩余租赁期限 |
|
|
|
|
加权平均折扣率 |
|
|
% |
|
营运租赁成本包括在营运租赁责任中的固定租赁付款,并在租赁期间以直线方式记录s. 营运租赁成本为 $
14
附注10. 关系人交易
请参阅关于公司与Axcelead达成协议,成立创业公司ARCALIS, Inc.的具体细节「附注1:合资企业、股权法下投资和可变利益实体」。
15
第2项。管理层讨论和分析 财务状况和业务运作的结果。
下文讨论arcturus therapeutics holdings inc的财务状况和营运结果,截至2024年9月30日的三个和九个月期间。除非另有指明,否则本文中提到的「公司」、「Arcturus」、「我们」、「我们的」和「我们」均指arcturus therapeutics holdings inc及其合并子公司。您应该阅读以下讨论和分析,连同本文件其他地方包含的中期简明合并财务报表和相关附注。有关我们管理层对财务状况和营运结果的讨论和分析的更多信息,请参阅我们于2023年12月31日结束的年度报告10-k年报(「2023年度报告」),该报告已于2024年3月14日向美国证券交易委员会(「委员会」)提交。除非另有定义,否则本文中使用的大写单词和表达与2023年度报告中赋予它们的意义相同。
本报告载有前瞻性陈述,虽然基于我们认为合理的假设,但仍受到风险和不确定性的影响,可能导致实际事件或情况与目前预期并且被此等前瞻性陈述所表达或暗示的情况有显著不同。本报告还包括仅基于Seqirus, Inc.和Meiji Holdings Co., Ltd或其各自联属公司提供的或实施的信息、报告和研究的某些陈述。
您应该完整阅读本报告及我们在其中引用并作为本报告附件提交的文件,并明白我们的实际未来结果可能与我们预期的大不相同。您还应该在本报告日期后不时查阅我们将提交或提交的报告中描述的因素和风险。
概览
我们是一家商业讯使-瑞核糖核酸药物公司,专注于开发传染病-疫苗以及肝脏和呼吸道罕见疾病的机会。除了我们的讯使-瑞核糖核酸(mRNA)平台外,我们的专有脂质奈米粒子(LNP)递送系统,LUNAR®,可能使多种核酸药物。我们的专有自我扩增mRNA技术(STARR® 科技)已被证实较传统mRNA在更低剂量水平上具有更持久和更广泛的反应。在2023年,我们的新冠-疫苗,ARCt-154(又称KOSTAIVE®),在日本获得上市授权批准,并于2024年9月,KOSTAIVE成为全球第一款获批准且商业化的自我扩增核瑙酸(sa-mRNA)疫苗。
我们正在利用我们的专有LUNAR平台和核酸技术来开发和推进基于mRNA的疫苗和治疗药物管线,以应对传染病和罕见遗传疾病的重大医疗需求。我们持续扩大这个平台,通过添加新颖的传递解决方案,使我们能够扩大我们的发现努力。我们的专有LUNAR技术旨在解决RNA药物开发中的主要障碍,即将RNA治疗剂有效且安全地运送到相关疾病靶组织。我们相信我们平台的多功能性可以瞄准多个组织,与各种核酸治疗药物兼容,以及我们在开发可扩展制造流程方面的专业知识,可以让我们实现向下一代核酸药物的交付。
业务更新
生物-疫苗与CSL Seqirus合作
2022年11月,我们与塞古睿公司(CSL Seqirus)签署了一份合作及许可协议(经修订后称为“CSL合作协议”),该公司为全球领先的流感疫苗供应商之一,隶属于全球领先的CSL有限公司,获得全球排他性研究、开发、制造和商业化自我放大mRNA疫苗对抗COVID-19、流感和其他三种呼吸道感染疾病的权利,以及全球非独家权利适用于大流行病原体。 CSL合作协议于2022年12月8日生效。该合作结合了CSL Seqirus确立的全球疫苗商业和制造制造行业基础设施与Arcturus的制造专业知识和创新的STARR自身放大mRNA疫苗和LUNAR传递平台技术。在我们与CSL Seqirus的合作框架下,我们将继续开发COVID-19疫苗,建立差异化平台,并及时应对定期疫苗组成更新的建议。
2023年11月,生物-疫苗KOSTAIVE获得了日本的健康、劳动和福利部批准的上市许可,可用于日本18岁及以上成人的初级免疫和助推接种。该批准是基于来自越南进行的数个ARCt-154研究的积极临床数据,其中包括一项涉及19,000名受试者的有效性、安全性和免疫原性研究,以及一项在日本进行的第3期助推接种研究。®,一种自增强讯使核糖核酸 (sa-mRNA) 疫苗,在日本卫生労働省获得了上市授权,可用于18岁及以上成年人的初次免疫和助推接种。该批准是基于越南进行的多项ARCt-154研究的积极临床数据,包括一项涉及19,000名受试者的有效性、安全性和免疫原性研究,以及在日本进行的第3期助推接种研究。
科斯塔伊夫® 是日本批准的 ARCT-154 品牌名称,这是编码 SARS-CoV-2 的祖先菌株的 sa-mRNA COVID 疫苗的版本,以及该疫苗的更新变种特定版本的更新版本。我们可能会使用 KOSTAIVE 或内部产生的特定名称,例如 ArcT-154、ArcT-2302 和 ArcT-2303 来识别疫苗。
16
2024年9月,我们宣布日本卫生、劳工及福利部(MHLW)已经批准并授权更新版本的KOSTAIVE,旨在保护18岁及以上成年人免受Omicron子变异体JN.1系列的威胁。CSL在日本的独家合作伙伴明治控股有限公司(“明治”)于2024年10月开始在日本分发更新的疫苗,标志著世界上首个针对18岁及以上成年人面市的商业sa-mRNA COVID-19疫苗。此次批准基于制造数据,证明疫苗产品的质量和一致性,非临床免疫原性数据反对KOSTAIVE(JN.1)的Omicron子变异体系列,以及支持KOSTAIVE(二价、BA.4/5和祖源菌株)的安全性和免疫原性的临床证据。
欧洲药品管理局(EMA)目前正在审查ARCt-154的上市授权申请。审查程序开始于2023年8月17日。
今年早些时候,CSL Seqirus的合作伙伴将拜时制药公司宣布已提交部分更改申请,以修订制造和市场认可书中的KOSTAIVE。® 以包括日本的制造地点,在其中包括创业公司ARCALIS, Inc.,日本的Arcturus制造合资企业。拜时制药公司将开始销售国内生产的KOSTAIVE® 本季。
KOSTAIVE(COVID-19 生物-疫苗)的临床研究
关于我们与CSL Seqirus的合作,我们继续从以下描述中的各项进行中研究收集数据。
KOSTAIVE(ARCt-154)在日本进行的关键第3期非劣效研究
明治赞助了一项随机、多中心、第3期、观察盲研究,以评估ARCt-154的剂量增强剂的安全性和免疫原性,并评估ARCt-154的非劣性相对于COMIRNATY。® (单价、原始株)。该研究共招募了780名成年参与者,其中一半在ARCt-154组,另一半在比较组,并于2023年2月完成招募,共有828名参与者。该研究达到了所有主要和次要的免疫原性终点,包括预定义的优势评估高于COMIRNATY。® (奥密克戎BA.4/5株)。总的来说,该研究的安全性和免疫原性结果支持ARCt-154疫苗作为成人剂量增强剂时的有利收益/风险概况,这些成人此前接种过其他mRNA COVID-19疫苗。
2024年2月1日,《柳叶刀感染性疾病》期刊发表了一篇文章‘Persistence of immune responses of a self-amplifying RNA COVID-19 vaccine (ARCT154) versus BNT162b2’ (https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(24)00060-4/fulltext),这篇研究的结果在六个月的追踪后对外公布。这些额外数据显示,在临床环境中,与传统mRNA疫苗相比,接种ARCT-154后中和抗体的持久性延长,表明ARCT-154提供更持久的免疫力,暗示ARCT-154可提供更长久的保护期。
2024年9月30日,我们宣布了这项研究的结果,显示ARCt-154在对抗武汉-Hu-1、Omicron BA.4-5和某些其他COVID-19变异株方面,比传统mRNA-疫苗(COMIRNATY)在12个月内保持了优越的免疫原性,而且剂量只有比较剂的六分之一(分别为5µg vs 30µg)。
2024年10月,《柳叶刀传染病学》发表了后续文章『自扩增mRNA COVID-19疫苗的免疫反应持续12个月:ARCt-154与BNT162b2疫苗的比较』,证实日本成年人在接种ARCt-154后存留更好的对抗一系列SARS-CoV-2毒株的中和免疫反应,相较于持续至接种后12个月的传统mRNA疫苗BNT162b2,包括50岁及以上的人。https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(24)00615-7/fulltext),确认了在接种ARCt-154后,日本成年人在抗COVID-19科罗纳病毒的中性化免疫反应方面比传统mRNA疫苗BNT162b2有更好的表现,这种免疫反应可以持续至疫苗接种后12个月,包括50岁及以上的人。
日本进行COVID-19 KOSTAIVE二价版本的第3期研究。
2023年9月29日,明治启动了一项额外的第3期临床研究,使用ARCt-2301,这是KOSTAIVE(祖传株和Omicron BA.4/5的双价版本)来进一步支持我们的自我扩增mRNA平台的免疫原性和安全数据,这可能有助于及时释放针对关注的变异体的未来季节更新的COVID-19生物-疫苗。2024年3月19日,明治宣布双价疫苗达到主要研究终点(非劣效性)。该研究招募了930名健康成年人和具有合并症的个人,他们之前接种了三到五剂mRNA COVID-19疫苗,包括至少在招募前三个月接种的最后增强剂。该研究比较了研究疫苗(ARCt-2301)和COMIRNATY(祖传株和BA.4/5)以评估观察者盲目组之间的安全性和免疫原性。中和抗体对SARS-CoV-2(Omicron BA.4/5和武汉株)的几何平均浓度比(GMT)和血清反应率(SRR)差异满足了预先确定的非劣效性和优势性准则,与COMIRNATY相比。ARCt-2301未导致与严重或严重不良事件有因果关系。
2024年9月,我们宣布了这项研究的6个月免疫原性和安全性结果。与单价生物-疫苗一样,双价sa-mRNA配方显示出比传统双价mRNA疫苗更优越的免疫原性。
17
COMIRNATY,接种增强剂后的免疫反应可持续至六个月,并具备改善的范围,支持sa-mRNA疫苗平台对未来疫苗株更新的稳固性。研究结果于2024年9月在澳洲布里斯本举行的期权XII 控制流感研讨会上发表。
KOSTAIVE(单价XBB1.5)在南半球的第3期研究
2024年3月,Arcturus和CSL Seqirus开展了一项第3期重要研究,该研究使用包含XBB1.5奥密克戎变种的ARCt-2303候选生物-疫苗。该研究旨在产生额外的免疫原性和安全数据,以支持在美国和全球的监管申请。此外,该研究将评估ARCt-2303疫苗与适龄季节性流感疫苗的联合注射。总共有1,499名年轻和老年人参与了澳洲、哥斯达黎加、洪都拉斯和菲律宾的研究。
研究结果显示所有四个主要研究目标和关键次要研究目标均已达成。ARCt-2303在中和Omicron XBb.1.5变异株的中和抗体方面,以GMt比率和SCR差异衡量,展现出优越的免疫反应,相较于ARCt-154。18-64岁成年人接种ARCt-2303和四价流感疫苗(QIV;Flucelvax,CSL)显示了与单独接种QIV相比,非劣效的免疫反应。ARCt-2303和QIV的联合接种与单独接种ARCt-2303相比,同样展现出非劣效的免疫反应。65岁及以上成年人接种ARCt-2303和佐剂型四价流感疫苗(Fluad,CSL)所得的联合接种结果与单独接种结果相似。联合接种疫苗的安全性和反应原性与独立接种相当。根据研究结果,没有出现安全疑虑。
季节性流感合作计划更新
我们的LUNAR-qsFLU (qs; 四价季节性) 计划现在专属授权给CSL Seqirus,旨在生产安全有效的季节性流感-生物-疫苗候选疫苗,相较于传统基于鸡蛋的四价灭活-疫苗,具有显著优势。由于对流行性流感株的不准确预测,以及因鸡蛋培养的疫苗中产生变异会大幅降低其每年的效力。我们相信mRNA平台具有机动适应新病毒株的能力应有助于增加效力。此外,我们不认为mRNA疫苗会面临与鸡蛋培养疫苗普遍变异的挑战。
LUNAR-qsFLU已经设计成利用我们在LUNAR脂质输送系统和我们的STARR自我增殖mRNA技术方面的专业知识。这个平台已被证明能提供有效的COVID-19保护,并已经优化以在一般和高风险人口中引起强大的免疫原性,并且以比传统mRNA疫苗更低的剂量达到可接受的反应原性,以创造一种高效的流感疫苗。与CSL Seqirus合作,我们生成了一个全面的非临床数据套件,以支持新型流感sa-mRNA疫苗候选药物开始进行第1期临床试验。2024年1月,在澳洲开展了一项第1期剂量确定安全性和免疫原性研究。
大流行性流感计划
我们的LUNAR-pandFLU计划在我们于2022年获得的生物医药先进研究与开发局(“BARDA”)的奖项下继续进展。 该计划包括所有非临床、制造和监管支持,以推动一种疫苗,以保护免受H5N1高致病性禽流感引起的疾病。在提交前的新药申请(pre-IND)会议中
18
已获批准,并收到书面回复(“WRO”),以融入未来发展计划中。已完成非临床安全性研究,将使第1期临床试验得以进行。
IND申请于2024年10月9日提交。预计在2024年底前开始招募参加第1期临床试验,以评估ARCt-2304(LUNAR-pandFLU候选-生物-疫苗)的安全性和免疫原性。
关于Arcturus所有mRNA治疗发展候选者的重要更新。
以下图表代表我们目前所拥有的Arcturus mRNA治疗候选药物管线:
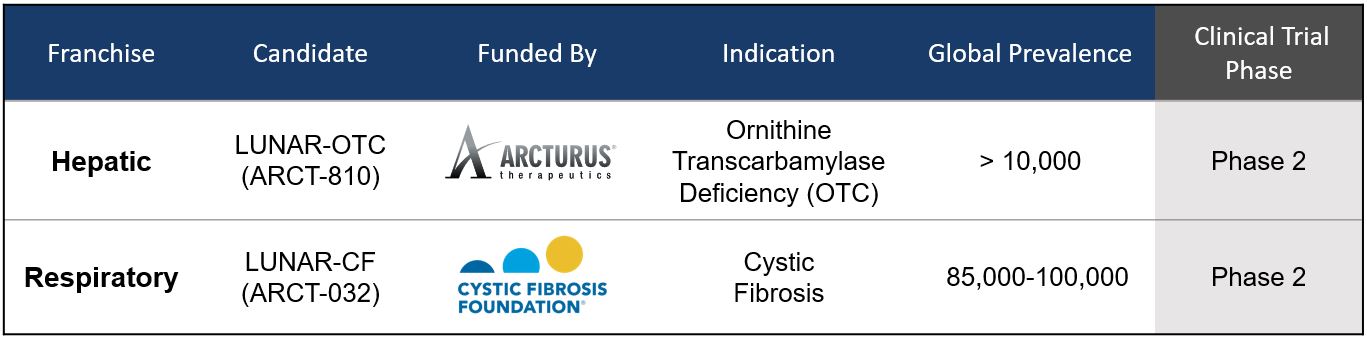
19
有关研究和平台活动的最新消息
我们持续投资和改进我们的LUNAR-脂质介导的mRNA传递,与我们的mRNA和sa-mRNA平台的持续改进相结合,并改进我们的下一代专有脂质,以提高针对性、效力和安全性的特性,适用于我们的疫苗和治疗性蛋白平台。 这项投资已经带来了关键创新,确保我们的LUNAR配方的药品候选者具有最佳的治疗用特性,我们认为这使我们与其他核酸治疗和脂质介导传递平台区分开来。 因此,我们认为自己是领先开发mRNA治疗产品,对多种适应症进行研究和开发的领导者。
我们持续进行探索性平台开发活动,包括对基因组编辑和新的靶向方法的评估,在这些活动中,我们的LUNAR® 和STARR® 平台潜在地可用于识别和开发额外产品以补充我们的投资组合。
探索计划 – 生物-疫苗计划(莱姆病和淋病)
基于KOSTAIVE批准提供的LUNAR和STARR技术的临床和监管验证,用于COVID-19的自扩增信使RNA(sa-mRNA)疫苗,我们今年早些时候启动了新的疫苗发现计划,用于莱姆病和淋病,并且持续推进这些计划。这些发现计划依赖于卓越的免疫原性,持久性和免疫反应范围的证据,相较于COVID-19计划中观察到的传统mRNA疫苗。
莱姆病是一种细菌感染,是美国最常见的传播疾病。感染可以扩散至关节、心脏和神经系统。淋病是一种可以感染生殖道粘膜的性传染病(STD)。它是美国报告第二多的细菌性性传染病。我们基于高度未满足的医疗需求、对生物-疫苗目标选择未来路径的良好理解、以及概念板块的证明,以及在有利的疫苗产品中可能转化的平台优势,选择了这些疾病。
供应和制造业更新
我们与合作伙伴建立了全球制造业基地,包括Aldevron、catalent、Recipharm、Polymun和ARCALIS。通过这些合作,我们建立了一个统一的全球供应链网络,我们的主要和次要采购合同开发和制造组织(CDMOs)位于美国、欧盟和亚洲,用于生产关键原材料、药物物质和包装成品。随著COVID疫苗市场从多剂量瓶转向较低和单剂量瓶呈现,我们将继续与合作伙伴CSL Seqirus共同评估并积极追求不同形式的药物产品呈现,推进制造工艺和能力以及技术转移,并为COVID疫苗的储备和商业化做准备。
营运业绩结果
对我们的财务状况和经营成果的以下讨论和分析应与本报告其他地方出现的简明综合财务报表及相关附注,以及截至2023年12月31日我们的经过审计的财务报表及相关附注一同阅读。我们的历史营运结果及接下来的营运结果年度对比未必能反映未来的结果。
20
营业收入
我们与药品和生物技术合作伙伴以及可能包括预付款、研发安排授权费、研发资金、里程碑付款、选择权行使和专属费用、未来销售权利金、咨询费以及科技转移付款的政府机构订立安排。我们预期KOSTAIVE的销售® 由日本Meiji Holdings Co., Ltd,CSL在日本的合作伙伴将于2024年第四季度在日本开始。然而,我们的收入将受到利润分配机制的影响,其中开发成本将在销售收入中扣除后,再分配给公司。以下表格总结了我们所示期间的总收入:
|
|
截至九月三十日止三个月, |
|
|
二零三年至二零二四 |
|
||||||||||
(以千计) |
|
2024 |
|
|
2023 |
|
|
$ 变更 |
|
|
变动百分比 |
|
||||
收入 |
|
$ |
41,673 |
|
|
$ |
45,140 |
|
|
$ |
(3,467 |
) |
|
|
-7.7 |
% |
营业收入在截至2024年9月30日的三个月内比截至2023年9月30日的三个月减少了350万美元。这一下降主要是由于2024年第三季度来自CSL协议的里程碑达成较低所致。这一减少部分被来自与KOSTAIVE商业生产相关的供应协议所确认的营业收入所抵销。® 以及截至2024年9月30日的三个月内来自BARDA协议的营业收入增加。
|
|
截至九月三十日止九个月 |
|
|
二零三年至二零二四 |
|
||||||||||
(以千计) |
|
2024 |
|
|
2023 |
|
|
$ 变更 |
|
|
变动百分比 |
|
||||
收入 |
|
$ |
129,544 |
|
|
$ |
135,944 |
|
|
$ |
(6,400 |
) |
|
|
-4.7 |
% |
截至2024年9月30日结束的九个月内,营业收入比截至2023年9月30日结束的九个月减少了640万美元。这是由于截至2023年结束的九个月内的里程碑成就的时间和价值以及条件付款的达成,相对于本年度供应协议的营业收入减少所致。此外,由于合作协议活动减少或完成的较低程度,导致截至2024年9月30日结束的九个月内其他协议所认可的营业收入下降。从BARDA合同认可的营业收入增加抵消了总体营业收入的减少。
营业费用
我们的营业费用包括研究和开发费用以及一般行政费用。
|
|
截至九月三十日止三个月, |
|
|
二零三年至二零二四 |
|
|
截至九月三十日止九个月 |
|
|
二零三年至二零二四 |
|
||||||||||||||||||||
(以千计) |
|
2024 |
|
|
2023 |
|
|
$ 变更 |
|
|
变动百分比 |
|
|
2024 |
|
|
2023 |
|
|
$ 变更 |
|
|
变动百分比 |
|
||||||||
营运费用: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
研究与开发,网络 |
|
$ |
39,134 |
|
|
$ |
51,077 |
|
|
$ |
(11,943 |
) |
|
|
-23.4 |
% |
|
$ |
151,376 |
|
|
$ |
155,513 |
|
|
$ |
(4,137 |
) |
|
|
-2.7 |
% |
一般及行政 |
|
|
13,276 |
|
|
|
13,377 |
|
|
|
(101 |
) |
|
|
-0.8 |
% |
|
|
40,443 |
|
|
|
40,364 |
|
|
|
79 |
|
|
|
0.2 |
% |
总计 |
|
$ |
52,410 |
|
|
$ |
64,454 |
|
|
$ |
(12,044 |
) |
|
|
-18.7 |
% |
|
$ |
191,819 |
|
|
$ |
195,877 |
|
|
$ |
(4,058 |
) |
|
|
-2.1 |
% |
研究与开发费用,净额
21
以下表格显示我们按类别分类的总研发费用:
|
|
截至9月30日的三个月 |
|
|
2023年至2024年 |
|
|
截至9月30日的九个月 |
|
|
2023年至2024年 |
|
||||||||||||||||||||
(以千为单位) |
|
2024 |
|
|
2023 |
|
|
美金变动 |
|
|
%变化 |
|
|
2024 |
|
|
2023 |
|
|
美金变动 |
|
|
%变化 |
|
||||||||
场外管道开发费用: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
LUNAR-COVID,净额 |
|
$ |
12,035 |
|
|
$ |
24,892 |
|
|
$ |
(12,857 |
) |
|
|
-51.7 |
% |
|
$ |
55,092 |
|
|
$ |
71,501 |
|
|
$ |
(16,409 |
) |
|
|
-22.9 |
% |
LUNAR-OTC,净额 |
|
|
890 |
|
|
|
2,001 |
|
|
|
(1,111 |
) |
|
|
-55.5 |
% |
|
|
7,200 |
|
|
|
7,520 |
|
|
|
(320 |
) |
|
|
-4.3 |
% |
BARDA |
|
|
1,347 |
|
|
|
930 |
|
|
|
417 |
|
|
|
44.8 |
% |
|
|
6,949 |
|
|
|
1,576 |
|
|
|
5,373 |
|
|
* |
|
|
早期项目 |
|
|
7,602 |
|
|
|
2,326 |
|
|
|
5,276 |
|
|
* |
|
|
|
26,543 |
|
|
|
10,018 |
|
|
|
16,525 |
|
|
* |
|
||
发现技术 |
|
|
2,071 |
|
|
|
4,662 |
|
|
|
(2,591 |
) |
|
|
-55.6 |
% |
|
|
4,453 |
|
|
|
16,266 |
|
|
|
(11,813 |
) |
|
|
-72.6 |
% |
外部平台开发费用: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
人事相关费用 |
|
|
13,718 |
|
|
|
13,478 |
|
|
|
240 |
|
|
|
1.8 |
% |
|
|
43,234 |
|
|
|
40,206 |
|
|
|
3,028 |
|
|
|
7.5 |
% |
设施和设备费用 |
|
|
1,471 |
|
|
|
2,788 |
|
|
|
(1,317 |
) |
|
|
-47.2 |
% |
|
|
7,905 |
|
|
|
8,426 |
|
|
|
(521 |
) |
|
|
-6.2 |
% |
研发费用总额净额 |
|
$ |
39,134 |
|
|
$ |
51,077 |
|
|
$ |
(11,943 |
) |
|
|
-23.4 |
% |
|
$ |
151,376 |
|
|
$ |
155,513 |
|
|
$ |
(4,137 |
) |
|
|
-2.7 |
% |
* 超过100%
我们的研发费用主要包括外部制造成本、体内研究和医药外包概念执行的临床试验、临床和监管顾问费用、人员相关费用、设施相关费用以及与进行研发活动有关的实验室耗材。截至2024年9月30日的三个月,研发费用为3910万美元,相较于2023年9月30日的三个月的5110万美元。该减少主要是因为2023年的制造费用高于梅时(Meiji)供应批次和其他临床试验批次,而2024年未发生这些支出。2024年的设施和设备费用较低也是导致减少的原因。这一减少部分被临床试验相关费用增加所抵销。截至2024年9月30日的九个月,研发费用为15140万美元,相较于2023年9月30日的九个月的15550万美元。该减少主要是因为2023年的制造费用高于梅时(Meiji)供应批次和其他临床试验批次,而2024年未发生这些支出。此外,2024年的顾问费用、设施和设备费用也减少。这一减少部分被COVID计划相关的临床费用增加以及2024年人员相关费用增加所抵销。我们预计随著我们的产品管道的进展,我们的研发努力和相关成本在未来几年将继续是重大的。
早期项目代表处于临床前或第1期临床阶段的项目,可能是合作或非合作的,包括LUNAR-CF和LUNAR-FLU项目。探索技术代表我们扩大产品渠道的努力,主要与预先合作研究和新能力评估相关。对于我们一些项目,活动是我们合作伙伴和其他关系的一部分,支出可能部分弥补已授予公司的所有基金类型。早期项目和探索技术的支出主要包括外部制造成本、实验室用品、设备、咨询和专业费用。预计早期项目和探索技术的支出将在未来几年持续增加。
人事相关费用主要包括员工薪水和福利、基于股份的酬劳以及顾问。虽然2024年这些费用相较于2023年有所增加,我们预计在未来十二个月内不会再增加。
设施和设备费用主要包括租金费用、共用区维护费用、运输成本、办公室和实验室等各种成本以及折旧费用。预计在未来十二个月内,设施和设备费用不会增加。
一般和管理费用
一般和行政费用主要包括我们行政、管理、法律和会计职能的薪水和相关福利,以及法律和会计服务的专业服务费用,以及其他一般和行政费用。
截至2024年9月30日的三个月中,总务及行政费用为1330万美元,相较于截至2023年9月30日的三个月的1340万美元。总务及行政费用的减少归因于人员费用的下降,部分抵销了法律和其他专业费用、设施费用以及其他各种一般与行政费用的增加。截至2024年9月30日的九个月,一般和行政费用与截至2023年9月30日的九个月保持一致。公司预计,总务和行政费用在未来财政年度将保持相对稳定状态,与目前的项目管线保持一致。
22
财务收入(费用),净额
|
|
截至九月三十日止三个月, |
|
|
二零三年至二零二四 |
|
|
截至九月三十日止九个月 |
|
|
二零三年至二零二四 |
|
||||||||||||||||||||
(以千计) |
|
2024 |
|
|
2023 |
|
|
$ 变更 |
|
|
变动百分比 |
|
|
2024 |
|
|
2023 |
|
|
$ 变更 |
|
|
变动百分比 |
|
||||||||
利息收入 |
|
$ |
3,818 |
|
|
$ |
4,001 |
|
|
|
(183 |
) |
|
|
-4.6 |
% |
|
$ |
11,981 |
|
|
$ |
10,473 |
|
|
$ |
1,508 |
|
|
|
14.4 |
% |
利息支出 |
|
|
— |
|
|
|
(20 |
) |
|
|
20 |
|
|
|
-100.0 |
% |
|
|
— |
|
|
|
(763 |
) |
|
|
763 |
|
|
|
-100.0 |
% |
总计 |
|
$ |
3,818 |
|
|
$ |
3,981 |
|
|
$ |
(163 |
) |
|
|
-4.1 |
% |
|
$ |
11,981 |
|
|
$ |
9,710 |
|
|
$ |
2,271 |
|
|
|
23.4 |
% |
现金及现金等价物产生利息收入。2024年9月30日结束的三个月的利息收入下降,与2023年9月30日结束的三个月相比,主要是投资账户赚取的利息减少所致。2024年9月30日结束的九个月的利息收入增加,与2023年9月30日结束的九个月相比,主要是由于利率上升,使投资账户获得的利息增加。截至2023年9月30日的九个月,利息支出涉及Western Alliance Agreement和Singapore Loan,两者均已终止。
其他收入和支出
|
|
截至九月三十日止三个月, |
|
|
二零三年至二零二四 |
|
|
截至九月三十日止九个月 |
|
|
二零三年至二零二四 |
|||||||||||||||||||
(以千计) |
|
2024 |
|
|
2023 |
|
|
$ 变更 |
|
|
变动百分比 |
|
|
2024 |
|
|
2023 |
|
|
$ 变更 |
|
|
变动百分比 |
|||||||
外币(亏损)收益 |
|
$ |
(201 |
) |
|
$ |
4 |
|
|
$ |
(205 |
) |
|
* |
|
|
$ |
(642 |
) |
|
$ |
(175 |
) |
|
$ |
(467 |
) |
|
* |
|
清除债务的收益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
33,953 |
|
|
|
(33,953 |
) |
|
* |
总计 |
|
$ |
(201 |
) |
|
$ |
4 |
|
|
$ |
(205 |
) |
|
* |
|
|
$ |
(642 |
) |
|
$ |
33,778 |
|
|
$ |
(34,420 |
) |
|
* |
|
* 超过100%
其他收入和支出主要涉及外汇交易的收益和损失。此外,由于新加坡贷款被宽恕,我们在2023年第一季度记录了一笔3400万美元的债务清偿收益。
离表安排
截至2024年9月30日,我们没有与未纳入合并财务集团或财务合作伙伴关系,即通常称为结构化融资或特殊目的实体的实体,设立为促进额外资产负债表安排或其他合约范围狭窄或有限目的。
流动性和资本资源
从公司成立至2024年9月30日结束的季度,公司主要通过出售股本、长期债务、以及通过合作协议和政府合同赚取的收入来资助其运营。截至2024年第三季度,我们从CSL Seqirus获得了总计约46210万美元的前期支付和里程碑款项,包括在本季度实现的2500万美元里程碑,预计在2024年第四季度支付。截至2024年9月30日,我们的现金及现金等价物以及限制性现金为29410万美元。
CSL Seqirus, Inc. 合作与许可协议
我们与全球领先的流感疫苗供应商之一,CSL Seqirus(CSL有限公司的一部分),签署了CSL合作协议,获得了全球范围内对研究、开发、制造和商业化mRNA疫苗的独家权利。
CSL Seqirus获得了我们疫苗技术对抗SARS-CoV-2(COVID-19)、流感和另外三种呼吸道感染疾病的独家全球权利,以及对于流行病病原体的非独家权利。我们在2022年第四季度收到了20000万美元的前期付款。如果所有产品在授权领域注册,我们有资格获得总额超过13亿美元的研发里程碑。我们还有资格根据各领域疫苗的「净销售额」获得高达30亿美元的商业里程碑。
此外,我们有权从COVID-19疫苗销售的净利润中获得40%的份额,以及在抗流感生物-疫苗和其他指定的三种传染病病原体的年度净销售额中取得低两位数的版税,以及从因应大流行而开发的疫苗的收入中获得版税。
23
CSL合作协议概述了CSL Seqirus和我们将如何合作研究和开发疫苗候选者。 在COVID-19领域,我们将在美国和欧洲领导ARCt-154的某些监管申报活动,并进行下一代COVID疫苗候选者的研究和开发活动。 CSL Seqirus将在COVID-19、流感和其他领域中领导并负责所有其他的研究和开发。
富国银行信贷协议
于2023年4月21日,我们的全资子公司arcturus therapeutics公司与富国银行国家协会(“富国银行”)签订了一项信贷协议,富国银行同意向公司提供一条5000万美元的循环信贷额度(“富国银行贷款”),每笔富国银行贷款均以循环信用额度票据(“票据”)证明。
根据协议,借款将以每年由联邦准备银行纽约分行管理的担保隔夜融资利率为基础,利率为每年1.00%加Daily Simple SOFR或Term SOFR(如韦尔斯·法戈注解所定义),其中“SOFR”是利率,即每年一次。如果发生信贷协议中所定义的违约事件,那么所有威尔斯·法戈的贷款将以等于违约事件发生前利息率的2.00%为基础。截至2024年9月30日,对威尔斯·法戈票据尚未进行借款。
协议期最初为两年,具一年续约选项,需获得富国银行批准,并支付非退还性承诺费,相当于每次续约的富国银行贷款金额的0.25%。2024年6月,arcturus therapeutics和富国银行对该票据进行了修订,将票据期限延长一年至2026年4月。终止协议不会有任何处罚。在富国银行票据到期日期之前终止借款设施也不会有任何处罚。作为抵押,我们同意将5500万美元现金抵押在我们的证券账户中,该账户设立在富国证券有限责任公司,这是富国银行的附属机构,根据一份安防协议。
生物医药爱文思控股先进研究与发展局的资助
2022年8月31日,我们与爱文思控股先进生物医药研究和发展局(“BARDA”)签订了一项成本退款合同(“BARDA合同”),BARDA是美国卫生和人类服务部(HHS)助理部长办公室(ASPR)内一个部门,旨在支持基于我们专有的自我放大信使RNA疫苗平台的低剂量流感疫苗候选品的开发。 BARDA合同旨在支持我们的非临床和前临床研究,以及通过第1阶段的早期临床研究,并在为期三年的一段时间内进行相关药物产品制造、监管和保证质量的活动。根据BARDA对我们合法成本的最高补贴为6,320万美元。截至2024年9月30日,剩余的可用资金扣除营业收入后为4,160万美元。
Vinbiocare 协议
于2021年,我们与Vingroup股份有限公司旗下的Vinbiocare签订了一项科技许可证和技术支援协议,以及一项核心药物物质供应协议(统称「Vinbiocare许可证与供应协议」),根据协议,我们将向Vinbiocare提供技术专业知识和支援服务,以协助在越南建立mRNA药品制造设施。作为Vinbiocare许可证和供应协议的一部分,我们收到总额为4000万美元的预付款。2022年10月,随著终止Vinbiocare许可证与供应协议,我们与Vinbiocare签订了Vinbiocare支援协议,该协议继续履行Vinbiocare的临床义务,并保留原来从许可证和供应协议中收到的4000万美元预付款的一部分,将在未来时间段内支付。
生物-疫苗支援协议要求我们支付生物-疫苗某些有限的款项,包括在2025年第一季发生的特定事件。如果Arcturus从ARCt-154(或下一代COVID疫苗)的净销售中收到任何款项,生物-疫苗也有资格获得单位数近似比例的款项,不超过一定金额。
财务资源总览
我们当前现金余额的一部分预计将于2024年度用于资助(i)我们的LUNAR-CF计划在临床试验中的进展,(ii)继续进行ARCt-810的第2期试验,我们的LUNAR-场外交易(OTC)候选者,(iii)在与CSL合作协议和BARDA合同下客户付款之前已产生的费用以及(iv)与我们平台和其他一般行政活动相关的持续探索活动。
我们未来的资本需求很难预测,将取决于许多无法控制的因素。如果我们无法维持足够的财务资源,将对我们的业务、财务状况和营运成果造成重大不利影响。无法保证我们能够以可接受的条件或根本无法取得所需的额外融资。此外,股权或债务融资可能对现有股东的持股产生稀释效应。
我们预计在长期内继续遭受额外亏损,我们将需要在CSL合作协议中达成里程碑,筹集额外的债务或股权融资,或是进行额外的合作来为发展筹集基金。我们转向盈利的能力依赖于在CSL合作协议中达成里程碑,OTC和CF的成功临床试验,以及辨识和发展成功的mRNA药物和生物-疫苗候选者。如果我们无法
24
如未能达成计划里程碑或产生超过预测的成本,我们将需要减少自由支出,中止部分或全部项目的开发,这将延迟我们开发计划中的一部分,所有这些都将对我们实现预期业务目标的能力产生重大不利影响。
筹资需求
我们预计在可预见的将来将继续出现亏损,而且随著我们持续开发和寻求对我们的产品候选者进行监管批准,以及开始商业化我们的产品,预计亏损将会增加。因此,我们将需要额外的资本来资助我们的运营,以支持我们的长期计划。我们相信我们目前的现金状况将足以满足我们预期的现金需求,至少在接下来的十二个月内,假设,除其他事项外,没有重大的不可预见开支以及持续来自合作伙伴的预期资金支持。我们打算通过股权和/或债务融资、与合作伙伴的合作或其他资金安排,或透过其他融资来源来寻求额外资本。如果我们需要从外部来源筹措额外资金,我们可能无法按照对我们可接受或完全接受的条件筹集此类资金。如果我们无法在需要时或按可接受的条件筹集额外资本,我们可能需要缩减或停止产品候选者的推进、减少员工人数、清算我们的资产、申请破产、重新组织、与另一个实体合并,或者停止运营。
我们未来的资金需求难以预测,将取决于许多因素,包括以下:
关键的会计政策和估计
我们按照GAAP的规定准备我们的总体基本报表。因此,我们进行某些估计、判断和假设,我们认为这些是合理的,基于我们所掌握的资讯。这些判断涉及对本质上不确定的事项的影响进行估计,可能会对我们公告的营运结果和财务状况产生重大影响。我们在截至2023年12月31日的综合基本报表中更详细地描述我们的重要会计政策,参见附注2。
我们的关键会计政策和估计,在2023年度报告中附录的第7项《管理层讨论和分析财务控制项和业绩结果》中提供的信息没有发生实质变更。
25
第三项。市场风险的定量和定性披露有关市场风险的披露。
我们对市场风险的主要敞口是利率期货敏感度,受美国利率水平的变化影响。由于我们现金及现金等价物的性质,我们认为我们不会受到任何重要市场风险敞口的影响。我们没有任何外币或其他衍生金融工具。
第四条:控制及程序 和程序。
揭示控制和程序的评估
根据《交易所法》第13a-15(b)条和第15d-15(b)条的规定,我们的管理层,包括我们的首席执行官、我们的信安金融主管和我们的主计主管,在截至此份季度报告的10-Q表格的期末进行了对我们的披露控制和程序的设计和控制项的有效性评估。基于该评估,管理层认为截至2024年9月30日时,我们的披露控制和程序由于下面描述的财务报告内部控制的实质缺陷而不有效。
公司的资讯披露控制措施已经设计,以确保:(i) 我们在交易所法案下向SEC提交的报告中所要求披露的资讯被记录、处理、汇总和报告在适用规则和表格中规定的时限内; 和 (ii) 在交易所法案下我们提交的报告中需要披露的重要资讯被积累并传达给管理层,包括CEO和CFO,以便依适当情况进行准确和及时的有关所需披露的决定。
管理阶层不预期我们的资讯揭露控制与程序将能预防所有错误和所有欺诈。然而,无论设计和操作的揭露控制与程序多么完善,其有效性只能提供合理的保证,系统目标的达成并不保证,并受到某些限制的影响,包括在设计、实施和评估控制与程序时行使判断以及在确定未来事件发生可能性时使用的假设。
截至2024年9月30日存在的财务报告内部控制方面的实质缺陷
一个重大缺失是关于基本报表内部控制的缺陷,或缺陷组合,以致合理可能性存在,我们的年度或中期合并财务报表中的重大错误将无法及时预防或检测。
管理层于2024年12月31日结束的财政年度的公司年度报告表格10-K中披露的实质性弱点,在2024年9月30日仍然存在。具体而言,管理层认为截至2024年9月30日存在以下实质性弱点:
虽然已确定存在重大弱点,管理层认为这些缺陷并未对我们报告的营运结果或财务状况产生不利影响,管理层已确定这份报告及其他定期文件中包含的财务报表和其他资讯,在所有重大方面均公正地呈现了我们的财务状况和营运结果,涵盖了所述时期。
补救重大弱点的计划
我们的整改工作正在进行中,我们将继续推进措施,以确保对导致实质缺陷的控制缺陷进行整改,从而确保这些控制的设计、实施和运作有效。我们致力于对我们的控制系统进行必要的变更和改进,以解决上述财务报告内部控制的实质缺陷。
我们重新强调设计和实施改进的流程和控制,包括但不限于以下:
26
We are in the process of implementing the remediation activities as of the date of this report and believe that upon completion, we will have strengthened our ITGCs, and controls related to accounting for collaboration arrangements to address and successfully remediate the identified material weaknesses. However, control weaknesses are not considered remediated until new internal controls have been operational for a period of time, are tested, and management concludes that these controls are operating effectively. We expect to complete the remediation activities in the fiscal year 2024. We will continue to monitor the effectiveness of these remediation measures, and we will make any changes to the design of this plan and take such other actions that we deem appropriate given the circumstances.
Changes in Internal Control over Financial Reporting
As required by Rule 13a-15(d) and Rule 15d-15(d) of the Exchange Act, our management, including our principal executive officer and our principal financial and accounting officer, conducted an evaluation of the internal control over financial reporting to determine whether any other changes occurred during the period covered by this Quarterly Report on Form 10-Q that have materially affected, or are reasonably likely to materially affect, our internal control over financial reporting. Based on that evaluation, our principal executive officer and our principal financial and accounting officer concluded that there were no changes in our internal controls over financial reporting during the periods covered by this Quarterly Report on Form 10-Q that materially affected, or were reasonably likely to materially affect, our internal control over financial reporting.
27
PART II—OTHER INFORMATION
Item 1. Legal Proceedings.
From time to time, we may be involved in various legal proceedings and subject to claims that arise in the ordinary course of business, including those related to governmental inquiries, intellectual property and commercial relationships. The subject matter of any such legal proceedings or claims are or will be highly complex and subject to substantial uncertainties. The outcome of any such proceedings or claims, regardless of the merits, are and will be inherently uncertain; therefore, assessing the likelihood of loss and any estimated damages is difficult and subject to considerable judgment.
Item 1A. Risk Factors.
Our business is subject to various risks, including those described in Item 1A of our Annual Report on Form 10-K for the fiscal year ended December 31, 2023, which we strongly encourage you to review. There have been no material changes from the risk factors described in our Annual Report on Form 10-K for the year ended December 31, 2023 filed with the Commission on March 14, 2024.
Item 2. Unregistered Sales of Equity Securities and Use of Proceeds.
None.
Item 3. Defaults Upon Senior Securities.
None.
Item 4. Mine Safety Disclosures.
Not applicable.
Item 5. Other Information.
Rule 10b5-1 Trading Arrangements
During the three months ended September 30, 2024, none of our directors or officers
28
Item 6. Exhibits.
Exhibit Index
Exhibit Number |
|
Description |
|
|
|
1.1 |
|
|
|
|
|
1.2 |
|
|
|
|
|
3.1 |
|
|
|
|
|
3.2 |
|
|
|
|
|
3.3 |
|
|
|
|
|
4.1 |
|
|
|
|
|
10.1† |
|
|
|
|
|
10.2† |
|
|
|
|
|
10.3** |
|
|
|
|
|
10.4** |
|
|
|
|
|
10.5** |
|
|
|
|
|
10.6** |
|
|
|
|
|
10.7** |
|
|
|
|
|
10.8** |
|
|
|
|
|
10.9** |
|
|
|
|
|
10.10** |
|
|
|
|
|
10.11** |
|
|
29
|
|
|
10.12** |
|
|
|
|
|
10.13 |
|
|
|
|
|
10.14 |
|
|
|
|
|
10.15 |
|
|
|
|
|
10.16** |
|
|
|
|
|
10.17† |
|
|
|
|
|
10.18 |
|
|
|
|
|
10.19 |
|
|
|
|
|
10.20 |
|
|
|
|
|
10.21 |
|
|
|
|
|
10.22† |
|
|
|
|
|
10.23† |
|
|
|
|
|
10.24** |
|
|
|
|
|
10.25** |
|
|
|
|
|
10.26** |
|
|
|
|
|
10.27** |
|
|
|
|
|
10.28** |
|
|
|
|
|
30
10.29** |
|
|
|
|
|
10.30** |
|
|
|
|
|
10.31** |
|
|
|
|
|
10.32** |
|
|
|
|
|
10.33** |
|
|
|
|
|
10.34† |
|
|
|
|
|
10.35** |
|
|
|
|
|
10.36* |
|
|
|
|
|
31.1* |
|
|
|
|
|
31.2* |
|
|
|
|
|
32.1* |
|
|
|
|
|
32.2* |
|
|
|
|
|
101* |
|
The following financial statements and footnotes from the Registrant’s Quarterly Report on Form 10-Q for the fiscal quarter ended September 30, 2024 formatted in Inline Extensible Business Reporting Language (Inline XBRL): |
|
|
101.INS Inline XBRL Instance Document - the instance document does not appear in the Interactive Data File because its XBRL tags are embedded within the Inline XBRL document |
|
|
101.SCH Inline XBRL Taxonomy Extension Schema |
|
|
101.CAL Inline XBRL Taxonomy Extension Calculation Linkbase |
|
|
101.DEF Inline XBRL Taxonomy Extension Definition Linkbase |
|
|
101.LAB Inline XBRL Taxonomy Extension Label Linkbase |
|
|
101.PRE Inline XBRL Taxonomy Extension Presentation Linkbase |
104 |
|
Cover Page Interactive Data File (embedded within the Inline XBRL document) |
|
|
|
* Filed herewith.
** Certain confidential portions of this exhibit have been redacted from the publicly filed document because such portions are (i) not material and (ii) would be competitively harmful if publicly disclosed.
† Management compensatory plan, contract or arrangement.
31
SIGNATURE
Pursuant to the requirements of the Securities Exchange Act of 1934, the registrant has duly caused this report to be signed on its behalf by the undersigned, thereunto duly authorized.
|
ARCTURUS THERAPEUTICS HOLDINGS INC. |
|
|
|
|
Date: November 7, 2024 |
By: |
/s/ Andy Sassine |
|
|
Andy Sassine |
|
|
Chief Financial Officer Principal Financial and Accounting Officer |
32