
創新癌症治療的未來以治癒患者和保持器官功能 2024 年 11 月附錄 99.2

法律披露本演示文稿包含前瞻性陳述,所有前瞻性陳述均受本警示性陳述的全面限制。此處包含的許多前瞻性陳述可以通過使用諸如 「可能」、「預期」、「相信」、「可能」、「期望」、「應該」、「計劃」、「打算」、「估計」、「將」、「潛在」 和 「持續」 等前瞻性詞語來識別,儘管並非所有前瞻性陳述都包含這些識別詞。這些前瞻性陳述包括有關我們的研發項目以及我們當前和未來的臨床前研究和臨床試驗的啓動、時間、進展、結果和成本的陳述,包括關於啓動和完成研究或試驗的時間以及相關準備工作的陳述、試驗結果公佈期限以及我們的研發計劃;關於我們期望在接受bel-sar治療後改善患者生活質量的陳述,以及患者治療模式的變化;如果獲得批准,我們成功製造用於臨床前用途、臨床試驗和更大規模商業用途的藥物物質和候選產品的能力;我們的第三方戰略合作者繼續開展與我們的開發候選品和候選產品相關的研發活動的能力和意願;如果獲得批准,我們的產品商業化的能力;我們爲完成進一步開發所需的運營獲得資金的能力,以及候選產品的商業化;我們獲得和維持監管部門對候選產品的批准的能力;候選產品的市場規模和增長潛力以及我們爲這些市場服務的能力;我們的財務業績;我們到2026年下半年的預期現金流;以及我們的商業模式的實施,包括業務和候選產品的戰略計劃。除非另有說明,否則這些前瞻性陳述僅代表截至本演講之日,我們沒有義務更新或修改任何此類陳述以反映本演示之後發生的事件或情況。由於前瞻性陳述本質上受風險和不確定性的影響,其中一些是無法預測或量化的,有些是我們無法控制的,因此您不應依賴這些前瞻性陳述作爲對未來事件的預測。有關這些風險和不確定性以及其他重要因素的討論,其中任何一個都可能導致我們的實際業績與前瞻性陳述中包含的有所不同,請參閱我們最近向美國證券交易委員會(SEC)提交的10-k表年度報告和10-Q表季度報告中標題爲 「風險因素」 的部分,以及我們隨後向美國證券交易委員會提交的其他文件中對潛在風險、不確定性和其他重要因素的討論可在美國證券交易委員會的網站www.sec.gov上查閱。我們的前瞻性陳述中反映的事件和情況可能無法實現或發生,實際結果可能與前瞻性陳述中的預測存在重大差異。我們提醒您不要過分依賴本演示文稿中包含的前瞻性陳述。本演示文稿討論了正在進行臨床前或臨床評估且尚未獲得美國食品藥品監督管理局 (FDA) 或任何其他監管機構批准上市的候選產品。在臨床研究報告最終確定之前,此處提供的臨床試驗數據仍有待根據臨床現場審計和其他審查流程進行調整。沒有就這些候選產品的安全性或有效性作出任何陳述,以供研究此類候選產品的用途。根據任何此類州或其他司法管轄區的證券法,在任何州或其他司法管轄區的證券法進行註冊或獲得資格認證之前,如果該等要約、招標或出售是非法的,則本演示不構成賣出要約或徵求買入要約,也不應在任何州或其他司法管轄區出售這些證券。

1。你 G-P 等人Am J Othalmol. 2003; 135 (6): 800-6. 2.Triay E 等人Br J Othalmol. 2009; 93 (11): 1524-8. 3.牛頓 R 等人《柳葉刀》1996; 347 (9013): 1450-1. 4.洛杉磯達爾文Br J Othalmol. 2018; 102 (12): 1728-1734. 5.Sun EC 等人癌症流行病學生物標誌物 Prev. 1997; 6 (2): 73-7. 6.ClearView Healthcare Partners和Putman對脈絡膜黑色素瘤和脈絡膜轉移的流行病學分析。7.美國癌症協會。視網膜母細胞瘤的關鍵統計數據。可在以下網址獲得:https://www.cancer.org/cancer/types/retinoblastoma/about/key-statistics.html。已於 2024 年 9 月 5 日訪問。8.膀胱癌。Putnam & Assoc流行病學分析。 FDA,美國食品藥品監督管理局;SPA,特殊協議評估;VDC,病毒樣藥物偶聯物,MoA,作用機制;NMIBC,非肌肉浸潤性膀胱癌 VDC 在多種短期臨床催化劑下處於有利地位 VDC 有可能改變早期癌症治療新型 MoA:直接殺死腫瘤細胞和激活免疫細胞新一類藥物病毒樣藥物偶聯物早期脈絡膜中的 2 期數據呈陽性根據美國食品藥品監督管理局的協議,3期黑色素瘤正在進行多項臨床完全反應,單次低水平NMIBC 正在進行的 1 期試驗中的劑量多種適應症的陽性臨床數據眼部腫瘤學 >60,000 名患者/年(美國/歐盟)1—7 名泌尿外科腫瘤學 ~500,000 名患者/年(全球)8 未滿足需求領域的巨大市場機會多個臨床數據 預計將在2025年公佈數據:NMIBC的1b/2階段擴張數據和脈絡膜轉移的初始第二階段數據現金預計將提供資金 運營至 2026 年下半年即將推出的關鍵催化劑
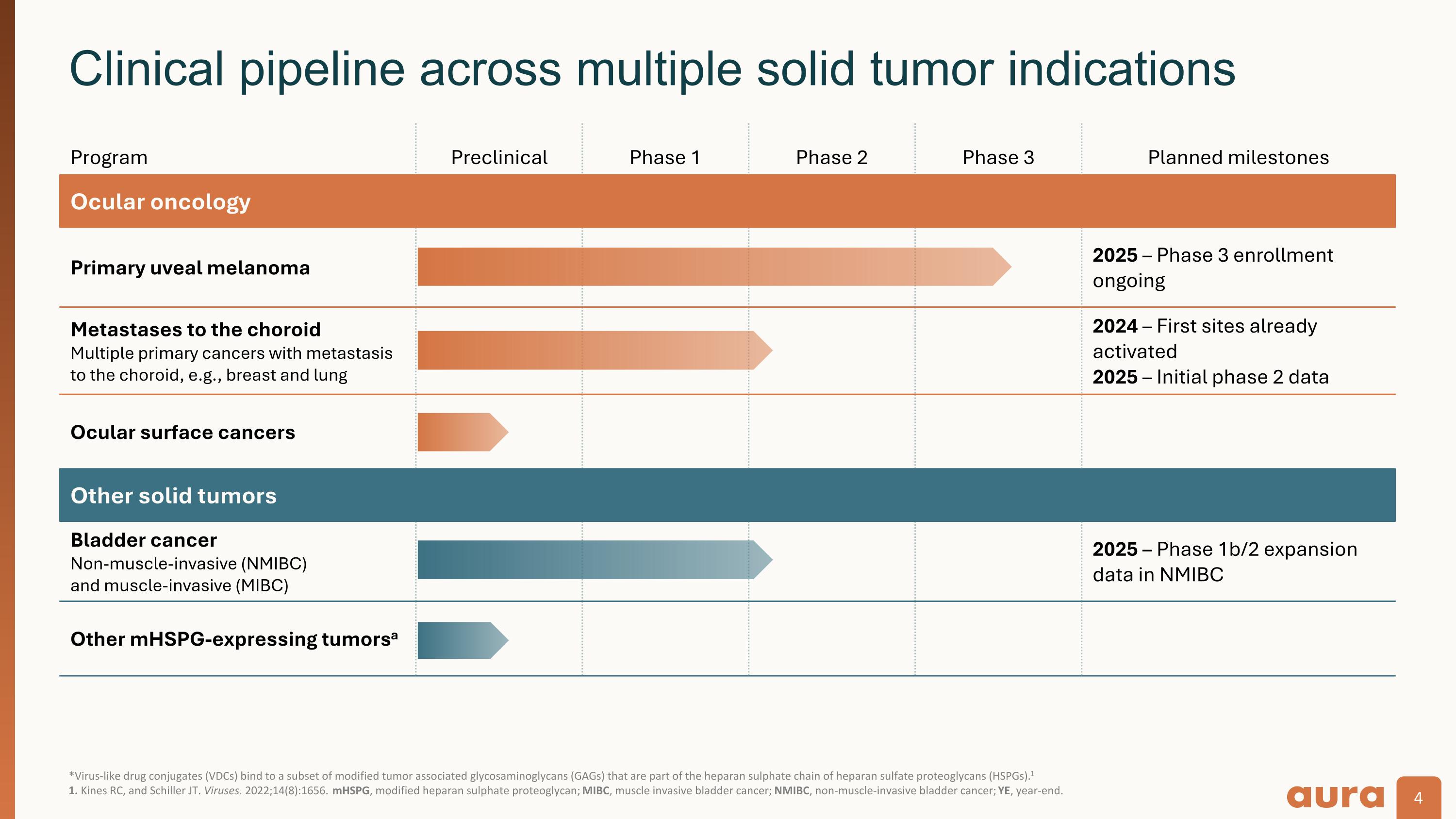
*病毒樣藥物偶聯物(VDC)與一部分改性腫瘤相關糖胺聚糖(GAG)結合,這些糖胺聚糖是硫酸肝素蛋白聚糖(HSPG)硫酸肝素鏈的一部分。1 1。Kines RC 和 Schiller Jt.病毒。2022;14 (8): 1656。mHSPG,改性硫酸肝素蛋白聚糖;MIBC,肌肉浸潤性膀胱癌;NMIBC,非肌肉浸潤性膀胱癌;YE,年底。跨多個實體瘤適應症的臨床管線項目臨床前第一階段第二階段三期計劃里程碑眼部腫瘤原發性葡萄膜黑色素瘤 2025 年 — 3 期入組正在進行脈絡膜轉移的多種原發性癌症,例如乳腺和肺部 2024 年 — 首批部位已激活 2025 — 第 2 階段初始數據眼表癌其他實體瘤膀胱癌非肌肉侵襲性 (NMIBC) 和 2025 年肌肉侵入性 (MIBC) — NMIBC 1b/2 期擴張數據其他 mhspg 表達 mhspg 的腫瘤a

Bel-sar 是治療多種實體瘤的潛在首創療法
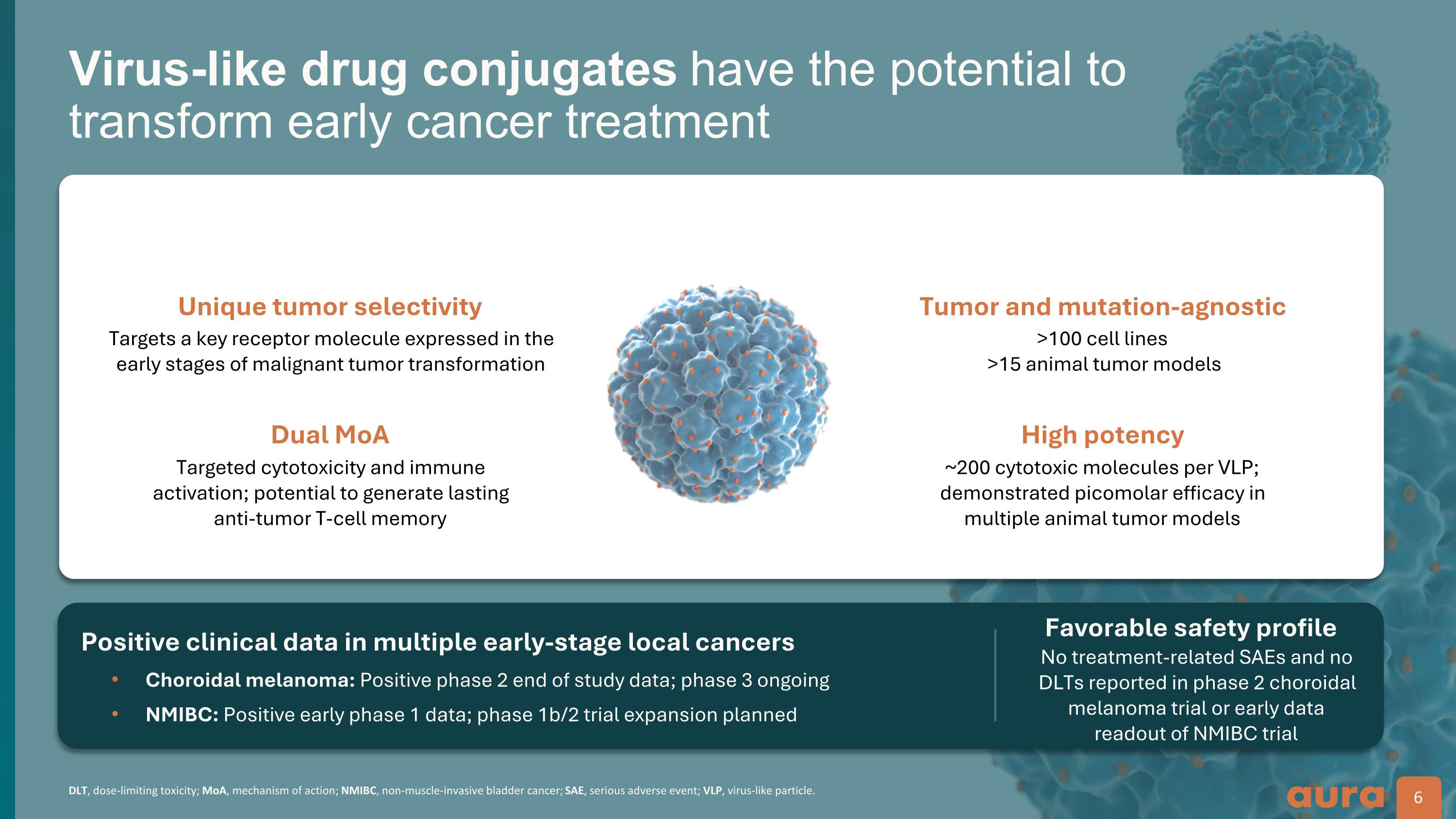
dLT,劑量限制毒性;MoA,作用機制;NMIBC,非肌肉浸潤性膀胱癌;SAE,嚴重不良事件;VLP,病毒樣顆粒。病毒樣藥物偶聯物有可能改變早期癌症治療 6 多種早期局部癌症的陽性臨床數據脈絡膜黑色素瘤:正面的 2 期研究結束數據;第 3 階段正在進行中 NMIBC:正面的 1 期早期數據;1b/2 期試驗擴展計劃良好的安全性獨特的腫瘤選擇性雙重MoA靶向惡性腫瘤轉化早期階段表達的關鍵受體分子靶向細胞毒性和免疫激活; 有可能產生持久的抗腫瘤 t 細胞記憶腫瘤和突變無關高效力 >100 個細胞系 >15 個動物腫瘤模型,每個 VLP 約 200 個細胞毒性分子;在多個動物腫瘤模型中顯示出皮摩爾效應 2 期脈絡膜黑色素瘤試驗或 NMIBC 試驗早期數據讀取中未報告治療相關的 SAE 和 DLT
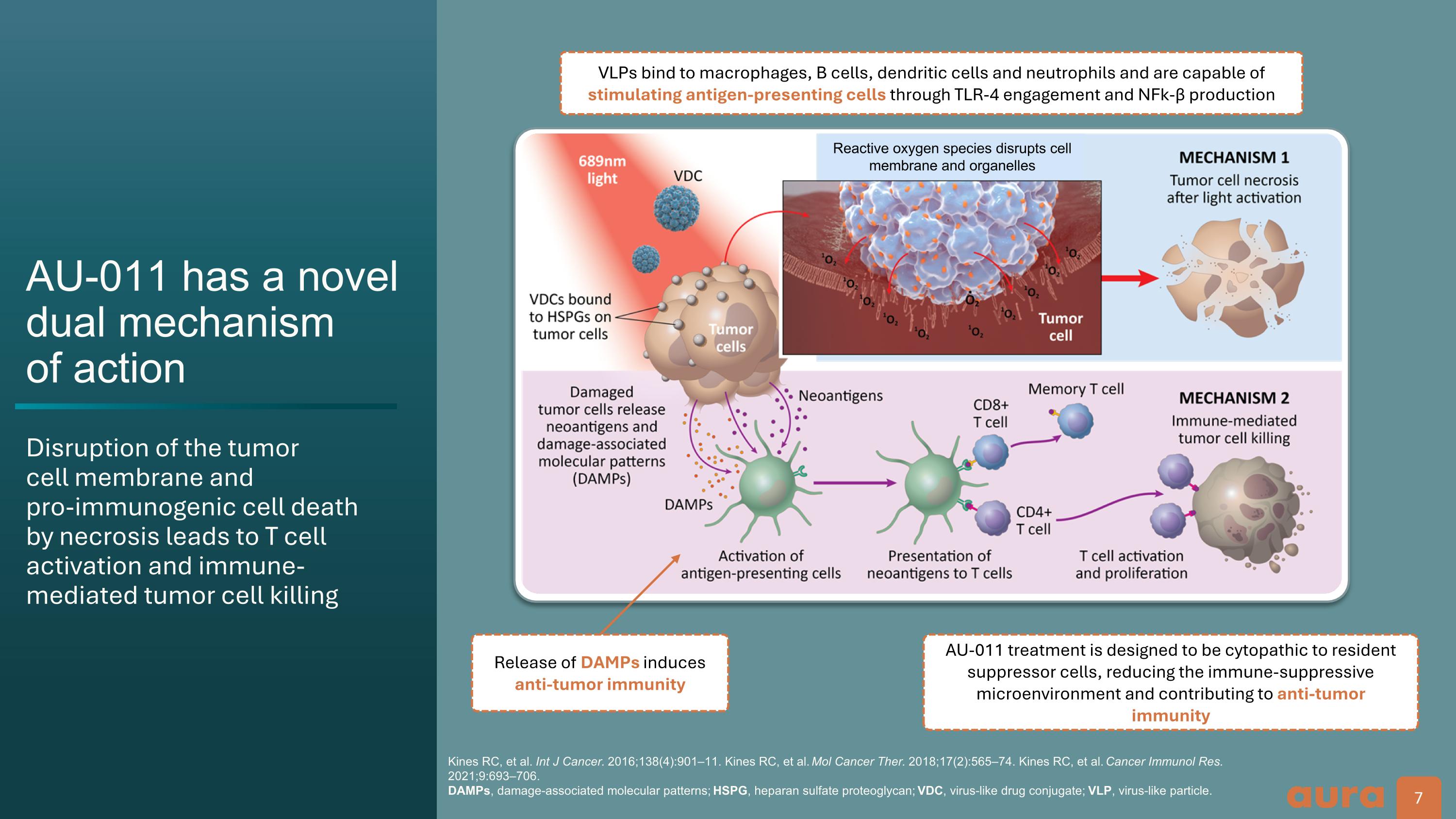
AU-011 具有新穎的雙重機制 作用破壞腫瘤 細胞膜和 促免疫原細胞死亡 壞死導致 T 細胞激活和免疫介導的腫瘤細胞殺死 Kines RC 等人國際癌症雜誌。2016; 138 (4): 901—11。Kines RC 等人Mol Cancer Ther. 2018; 17 (2): 565—74。Kines RC 等人癌症免疫學研究報告 2021; 9:693 —706。 DAMP,損傷相關分子模式;HSPG,硫酸肝素蛋白聚糖;VDC,病毒樣藥物偶聯物;VLP,病毒樣顆粒。DAMP 的釋放可誘導抗腫瘤免疫 AU-011 治療旨在對駐留抑制細胞產生細胞病變,減少免疫抑制微環境並促進抗腫瘤免疫 VLP 與巨噬細胞、樹突狀細胞和中性粒細胞結合,能夠通過 TLR-4 的參與和 NFK-β 的產生刺激抗原呈遞細胞。活性氧物質破壞細胞 膜和細胞器

眼部腫瘤學 Bel-SAR 靶向適應症:原發性葡萄膜黑色素瘤 | 脈絡膜轉移 | 眼表癌
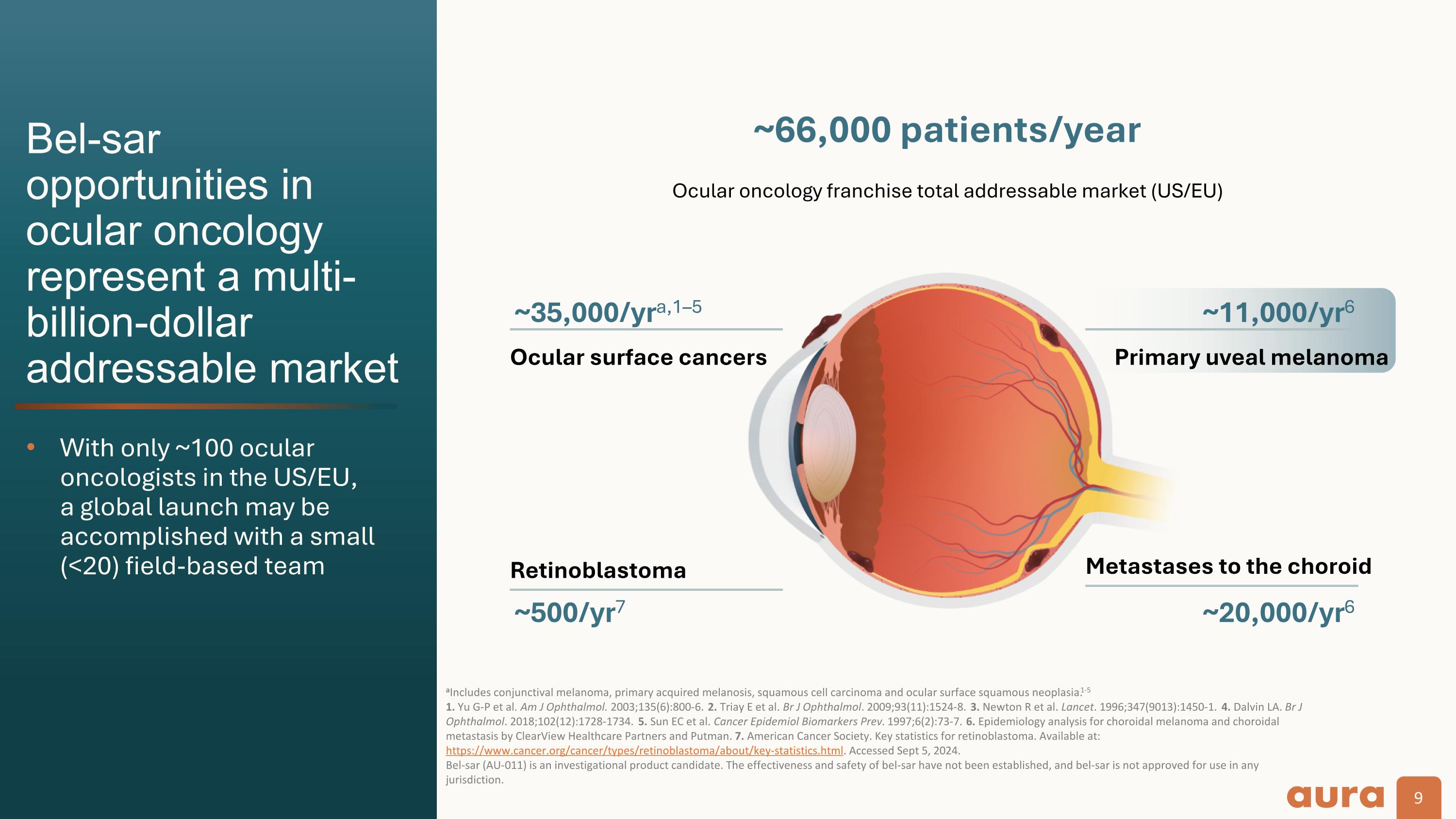
Bel-SAR眼部腫瘤學的機會代表着數十億美元的潛在市場,美國/歐盟只有大約100名眼部腫瘤學家, 全球發射可以用一小部分完成 (<20) 實地研究小組包括結膜黑色素瘤、原發性獲得性黑色素病、鱗狀細胞癌和眼表鱗狀腫瘤。1-5 1.你 G-P 等人Am J Othalmol. 2003; 135 (6): 800-6. 2.Triay E 等人Br J Othalmol. 2009; 93 (11): 1524-8. 3.牛頓 R 等人柳葉刀。1996; 347 (9013): 1450-1. 4.洛杉磯達爾文Br J Othalmol. 2018; 102 (12): 1728-1734. 5.Sun EC 等人癌症流行病學生物標誌物 Prev. 1997; 6 (2): 73-7. 6.ClearView Healthcare Partners和Putman對脈絡膜黑色素瘤和脈絡膜轉移的流行病學分析。7.美國癌症協會。視網膜母細胞瘤的關鍵統計數據。可在以下網址獲得:https://www.cancer.org/cancer/types/retinoblastoma/about/key-statistics.html。已於 2024 年 9 月 5 日訪問。Bel-SAR(AU-011)是研究候選產品。bel-sar的有效性和安全性尚未確定,bel-sar未獲準在任何司法管轄區使用。眼表癌約66,000名患者/年 ~35,000/年,1—5 原發性葡萄膜黑色素瘤 ~11,000/yr6 向脈絡膜轉移 ~20,000/yr6 視網膜母細胞瘤 ~500/yr7 眼部腫瘤特許經營權總潛在市場(美國/歐盟)

Bel-sar 原發性葡萄膜黑色素瘤處於第 3 階段,這是最常見的原發性眼內癌 在成人中,原發性葡萄膜黑色素瘤是一種尚未得到滿足的高度醫療需求。由於沒有獲得批准的視力保護療法,目前的護理標準是放射療法,這種治療會導致法律失明4,5 1.Heiting,G. Iris/UVEA of the eye。可在以下網址獲得:https://www.allaboutvision.com/en-gb/resources/uvea-iris-choroid/。已於 2023 年 10 月 3 日訪問。2.Kaliki S 和 Shields CL。眼睛(倫敦)。2017;31 (2): 241-257. 3.ClearView Healthcare Partners和Putman對脈絡膜黑色素瘤和脈絡膜轉移的流行病學分析。4.Jarczak J、Karska-Basta I、Romanowska-Dixon b. 葡萄膜黑色素瘤的近距離放射治療和質子治療後的視力下降,以及根據最近的出版物對抗這種併發症的方法。醫學 (考納斯). 2023; 59 (6): 1131. 5.Tsui I、Beardsley Rm、McCannel TA、Oliver SC 等對脈絡膜和睫狀體黑色素瘤進行碘125近距離放射三年後的視力、對比敏感度和色覺。Open Ophathalmol J. 2015;9:131-5。脈絡膜佔葡萄膜的 90% 1 葡萄膜:脈絡膜、睫狀體和虹膜睫狀體虹膜成人中最常見的原發性眼內癌2,3 50% 的患者在 15 年內出現轉移(轉移性葡萄膜黑色素瘤)2 ~ 80% 的被診斷爲早期疾病的患者3 脈絡膜黑色素瘤 ~11,000/yr3 Bel-SAR 有可能提供治療保留視力的選項

a每個數字代表大約 250 人。Shields CL 等脈絡膜和睫狀體黑色素瘤。可在以下網址獲得:https://eyewiki.aao.org/Choroidal_and_Ciliary_Body_Melanoma 已於 2024 年 9 月 9 日訪問。Singh AD 等。眼科學. 2005; 112 (10): 1784—89。ClearView Healthcare Partners和Putman對脈絡膜黑色素瘤和脈絡膜轉移的流行病學分析。Cm,脈絡膜黑色素瘤;Enuc。,摘除。原發性葡萄膜黑色素瘤的當前治療模式不確定病變小黑色素瘤危險因素生長小厘米觀察發病率:患者 美國/美國本地 — 早期(約 8,000)局部 — 晚期(約 2,300)轉移(約 2,000)大小 (mm):小型中型大型轉移性放射治療放射治療 1 2.5 — 3 >10 Enuc。全身化療 (KIMMTRAK®)
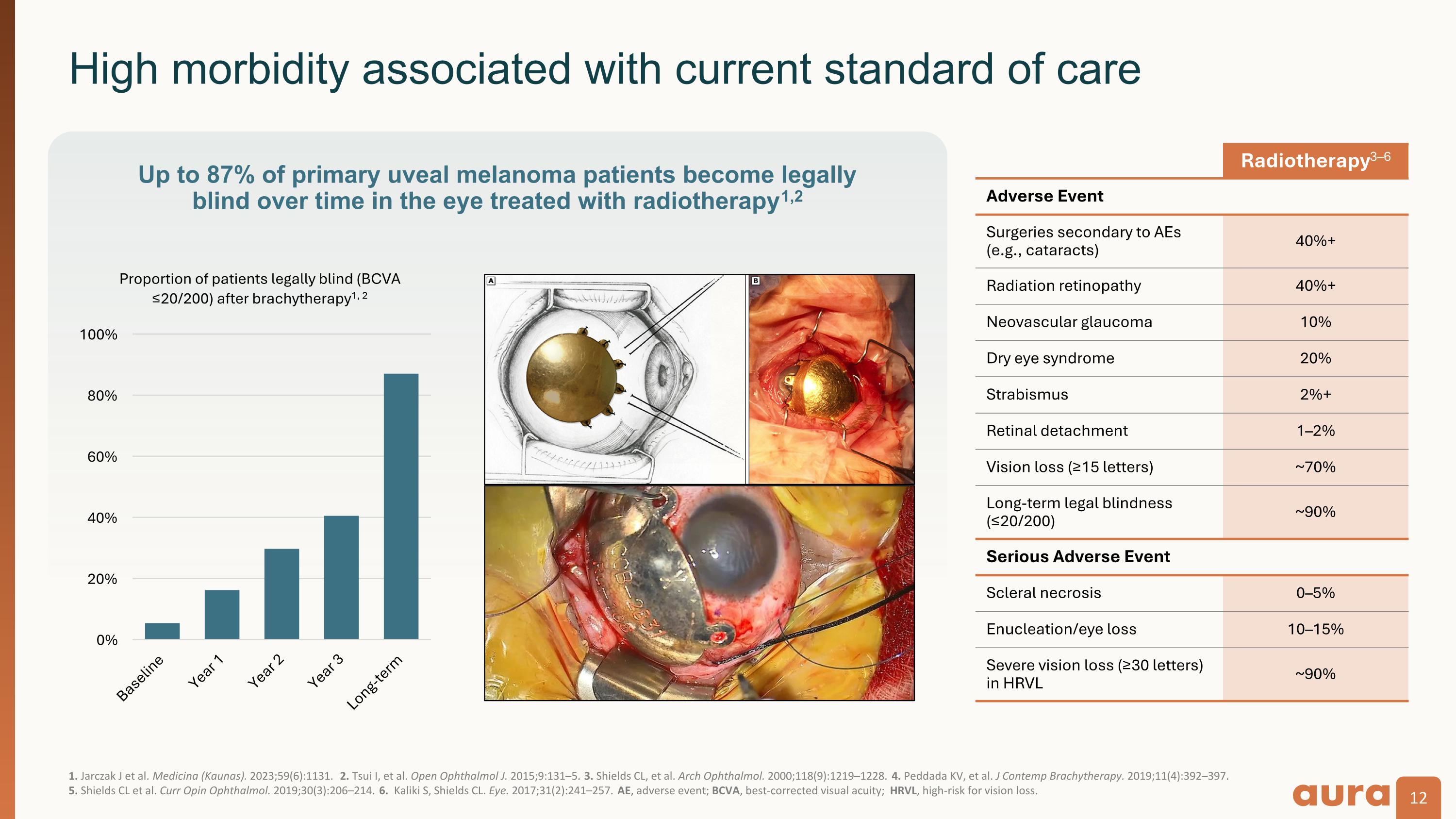
1。Jarczak J 等人醫學(考納斯). 2023; 59 (6): 1131. 2.Tsui I 等人Open Ophathalmol J. 2015;9:131 —5. 3.Shields CL 等Arch Ophthalmol. 2000; 118 (9): 1219—1228. 4.Peddada KV 等人J Contemp 近距離放射療法。2019;11 (4): 392—397。 5。Shields CL 等Curr Opin Ophthalmol. 2019; 30 (3): 206—214. 6.Kaliki S,Shields CL。眼睛. 2017; 31 (2): 241—257。AE,不良事件;BCVA,最佳矯正視力;HRVL,視力喪失的風險。與當前護理標準相關的高發病率隨着時間的推移,多達 87% 的原發性葡萄膜黑色素瘤患者在接受放射治療的眼部會合法失明1,2 放射療法3—6 繼發於 AE 的不良事件手術(例如白內障)40% + 放射性視網膜病變 40% + 新生血管性青光眼 10% 乾眼綜合徵 20% 斜視 2% + 視網膜脫離 1—2% 視力喪失(≥15 個字母) ~ 70% 長期合法失明 (≤20/200) ~ 90% 嚴重不良事件鞏膜壞死 0— 5% 摘除術/失眼 10—15% HRVL 中嚴重視力喪失(≥ 30 個字母)~ 90%

Bel-sar有可能成爲第一種獲得批准的原發性葡萄膜黑色素瘤的視力保護療法無放射治療- 相關發病率願景 保存局部腫瘤控制減少轉移 早期治療的風險提高安全性 和生活質量治療目標辦公室內手術兩次注射(每次 2 分鐘)間隔 30 分鐘 10-30 分鐘手術通過以下方式交付 使用標準眼科激光器進行光活化上絡膜上腔體 Bel-SAR (AU-011) 是一種研究候選產品。bel-sar的有效性和安全性尚未確定,bel-sar未獲準在任何司法管轄區使用。

收到的快速審批和孤兒藥物名稱一項SPA協議表明FDA同意該試驗的設計能夠充分支持監管機構提交的BCVA,最佳矯正視力;ETDRS,早期治療糖尿病視網膜病變研究;LBD,最大基礎直徑;SPA,特殊協議評估。 ClinicalTrials.gov 標識符:NCT06007690;AU-011-301。Bel-sar 用於小脈絡膜黑色素瘤或不確定病變:全球 3 期 COMPass 試驗現已註冊爲期 15 個月的主要療效分析 80 µg bel-sar 治療組 (n=40) 40 µg bel-sar 治療臂 (n=20) 假控制臂 (n=40) 參與者 患有小脈絡膜黑色素瘤或不確定病變隨機化 2:1:2 第一個關鍵次要終點腫瘤進展時間腫瘤厚度增加 ≥0.5 mm 或 ≥1.5 mm 複合終點時間:腫瘤進展或視力衰竭ETDRS-BCVA信件評分較基線下降≥15 LBD腫瘤厚度增加≥0.5 mm或≥1.5 mm或靶向招生約100名參與者北美預計地點歐洲、中東和亞太地區
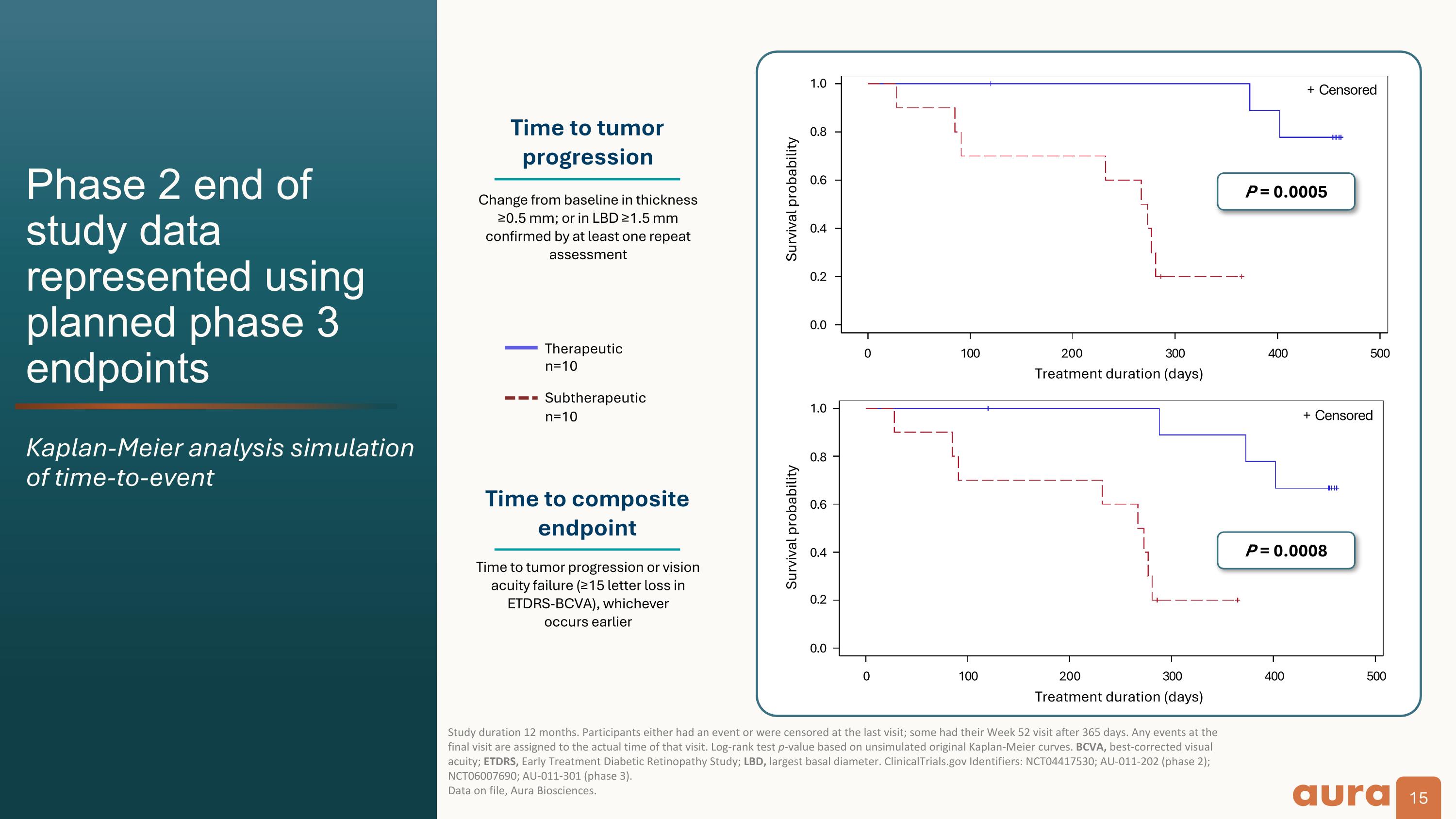
使用計劃中的第 3 階段終點來表示第 2 階段研究結束數據 Kaplan-Meier 分析模擬,研究持續時間爲 12 個月。參與者要麼參加了活動,要麼在上次訪問時受到審查;有些參與者在第 52 周訪問了 365 天。最後一次訪問中的任何活動都將以該次訪問的實際時間爲準。基於未模擬的原始 Kaplan-Meier 曲線對數等級測試 p 值。BCVA,最佳矯正視力;ETDRS,早期治療糖尿病視網膜病變研究;LBD,最大基底直徑。ClinicalTrials.gov 標識符:NCT04417530;AU-011-202(第 2 階段);NCT06007690;AU-011-301(第 3 階段)。 存檔數據,Aura Biosciences。存活概率 P = 0.0005 腫瘤進展時間到達複合終點的時間與基線相比厚度變化≥0.5 mm;或經至少一次重複評估證實的 LBD ≥1.5 mm 治療方法 n=10 亞治療 n=10 腫瘤進展或視力衰竭的時間(ETDRS-BCVA 中有 ≥ 15 個字母損失),以兩者爲準 早期 0.0 0.2 0.4 0.6 0.8 1.0 + 審查 0.0 0.2 0.4 0.6 0.8 0 0 100 200 300 500 P = 0.0008 存活概率 0 100 200 300 400 500 P = 0.0008 存活概率 0 100 200 300 400 500 + 審查治療持續時間(天)

Bel-SAR眼部腫瘤學的機會代表着數十億美元的潛在市場,美國/歐盟只有大約100名眼部腫瘤學家, 全球發射可以用一小部分完成 (<20) 實地研究小組包括結膜黑色素瘤、原發性獲得性黑色素病、鱗狀細胞癌和眼表鱗狀腫瘤。1-5 1.你 G-P 等人Am J Othalmol. 2003; 135 (6): 800-6. 2.Triay E 等人Br J Othalmol. 2009; 93 (11): 1524-8. 3.牛頓 R 等人柳葉刀。1996; 347 (9013): 1450-1. 4.洛杉磯達爾文Br J Othalmol. 2018; 102 (12): 1728-1734. 5.Sun EC 等人癌症流行病學生物標誌物 Prev. 1997; 6 (2): 73-7. 6.ClearView Healthcare Partners和Putman對脈絡膜黑色素瘤和脈絡膜轉移的流行病學分析。7.美國癌症協會。視網膜母細胞瘤的關鍵統計數據。可在以下網址獲得:https://www.cancer.org/cancer/types/retinoblastoma/about/key-statistics.html。已於 2024 年 9 月 5 日訪問。Bel-SAR(AU-011)是研究候選產品。bel-sar的有效性和安全性尚未確定,bel-sar未獲準在任何司法管轄區使用。眼表癌約66,000名患者/年 ~35,000/年,1—5 原發性葡萄膜黑色素瘤 ~11,000/yr6 向脈絡膜轉移 ~20,000/yr6 視網膜母細胞瘤 ~500/yr7 眼部腫瘤特許經營權總潛在市場(美國/歐盟)

脈絡膜轉移是一項尚未得到滿足的高度醫療需求,有可能使眼部腫瘤學市場機會翻一番脈絡膜轉移會降低對抗轉移性癌症患者的視力和生活質量 1.Mathis 等人。Prog Ret Eye Res. 2019;68:144-176。2.Shields CL 等眼科學。1997; 104 (8): 1265-76. 3.ClearView Healthcare Partners和Putman對脈絡膜黑色素瘤和脈絡膜轉移的流行病學分析。4.Cohen VML。眼睛(倫敦)。2013;27(2):137-41。胃腸道,胃腸道。脈絡膜轉移源於多種原發性癌症1 ~1/4的患者有雙邊腫瘤2 脈絡膜轉移約20,000/年(美國/歐盟)3 皮膚 2% 腎臟 2% 乳房 40—53% 肺 20—29% 胃腸道 4% 前列腺 2% 標準護理是每日放射治療,最長可持續 4 周,4 患者負擔沉重,並伴有輻射相關併發症
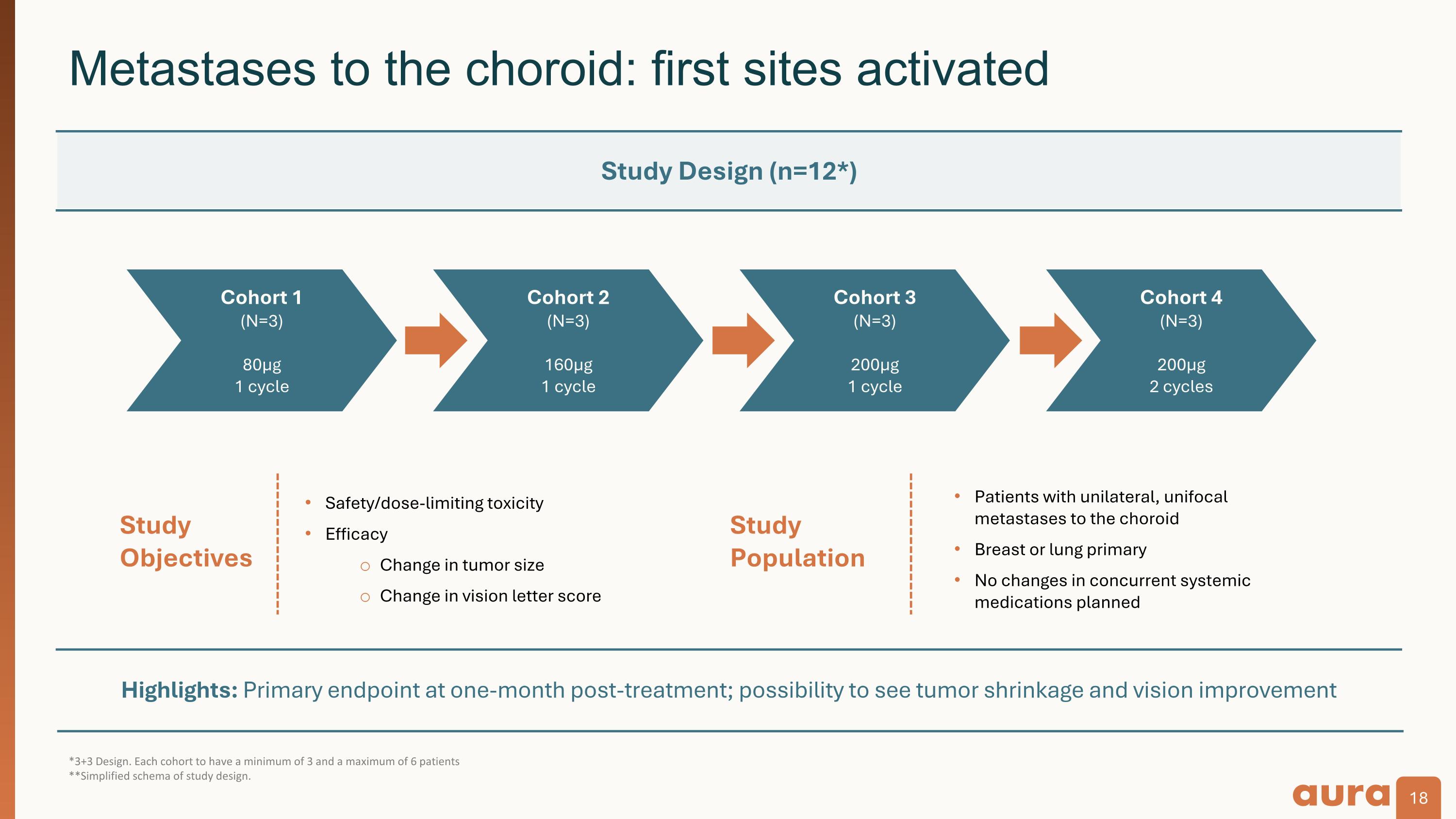
亮點:治療後一個月的主要終點;腫瘤縮小和視力改善的可能性*3+3 Design。每個隊列至少有3名和最多6名患者 **研究設計的簡化架構。脈絡膜轉移:首批部位激活研究 人口研究 目標安全性/劑量限制毒性療效腫瘤大小變化視力信評分變化單側單竈轉移至脈絡膜的患者乳房或肺原發性乳腺或肺原發性併發藥物無變化研究設計 (n=12*) 隊列 1 (N=3) 80µg 1 週期隊列 2 (N=3) 200µg 1 週期隊列 4 (N=3) 200µg 1 週期隊列 4 (N=3) =3) 200µg 2 個週期

泌尿外科腫瘤學 Bel-SAR 靶向適應症:非肌肉浸潤性膀胱癌 | 肌肉浸潤性膀胱癌

1。GLOBOCAN 2022。膀胱。可在以下網址獲得:https://gco.iarc.who.int/media/globocan/factsheets/cancers/30-bladder-fact-sheet.pdf。[2024 年 10 月 1 日訪問]。2.Sung H 等CA Cancer J Clin. 2021; 71 (3): 209—49. 3.Burger m 等。Eur Urol. 2013; 63 (2): 234—41. 4.Flaig TW 等人J Natl Compr Canc Netw. 2018;16 (9): 1041—53. 5.Clark O 等人Pharmacoecon 公開賽。2024 年 8 月 18 日。doi:10.1007/s41669-024-00512-8。[印刷前在線]。6.Lamm DL 等人J Urol. 2000; 163 (4): 1124-9. 7.北達科他州肖爾等Urol Oncol. 39 (10): 642—63. 8.Shalata At 等人癌症(巴塞爾)。2022年;14(20):5019。BCG、Bacillus Calmette-Guerin;MIBC,肌肉浸潤性膀胱癌。QoL,生活質量;turbT,經尿道膀胱腫瘤切除術。膀胱癌:維持功能的器官保留療法的高未得到滿足的醫療需求排名第九 全球癌症1 > 60億美元年度成本 美國的治療 5 是所有癌症中終身治療成本最高的治療成本之一傳統膀胱癌治療不太理想短期和長期副作用對生活質量影響相當大療效不足多次 TurbT 手術疾病進展/轉移膀胱流失/囊腫切除術 MIBC 25% NMIBC 75% 死亡率排名第 13 位1 20 20 大多數出現 NMIBC3 的膀胱癌患者約 70-80% 的 NMIBC 患者會出現 治療後復發8 NMIBC MIBC >600,000 614,298 人在 2021 年被診斷出來 (與2020年相比增長超過7%)全球每年1,2例1 84%由於全球短缺,患者接受的卡介苗療程減少了7%的患者沒有完成整個療程的卡介苗治療6
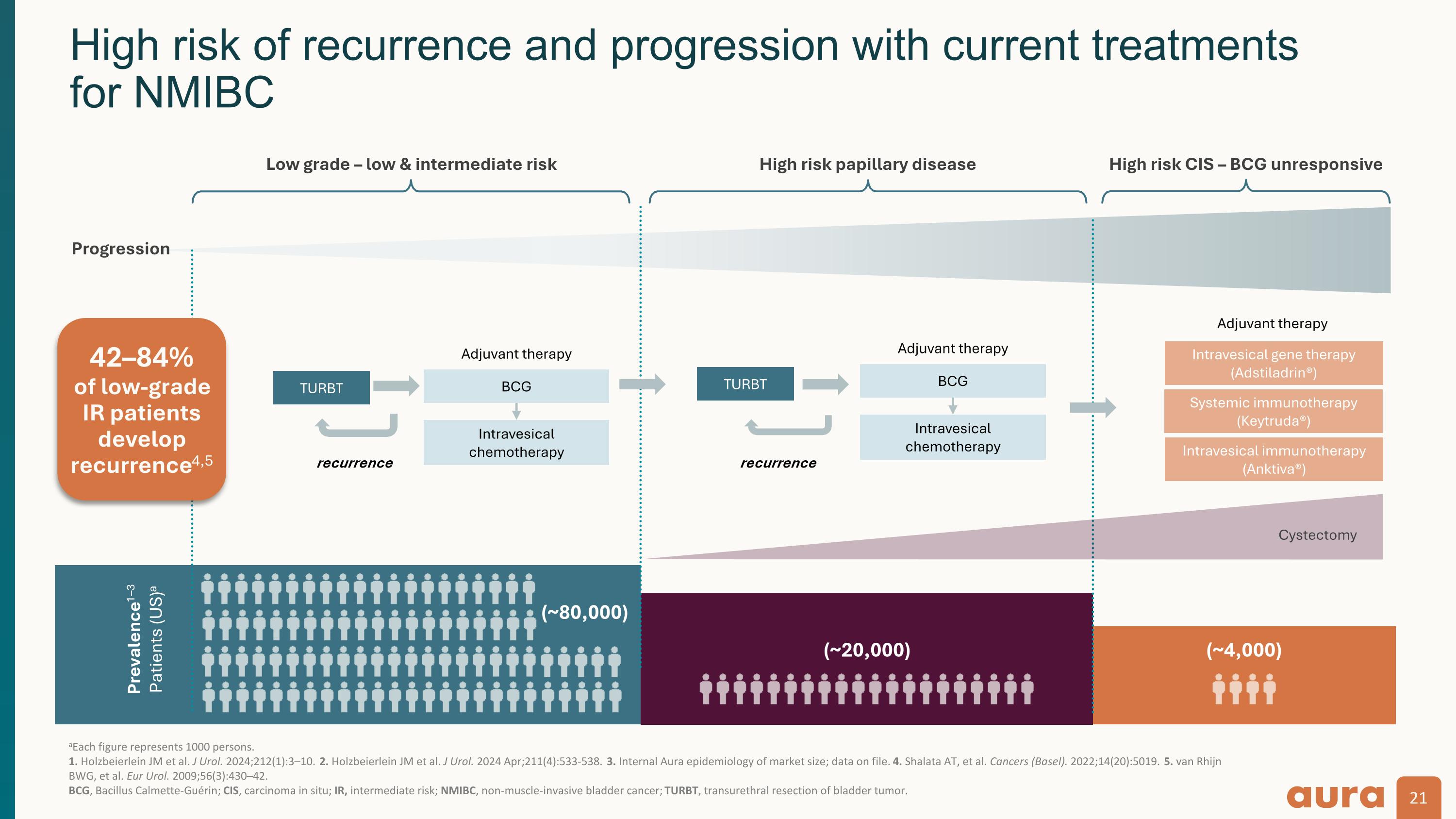
a每個數字代表 1000 人。1.Holzbeierlein Jm 等人。J Urol. 2024; 212 (1): 3—10. 2.Holzbeierlein Jm 等人。J Urol. 2024 年 4 月;211 (4): 533-538. 3.市場規模的內部Aura流行病學;存檔數據。4.Shalata At 等人。癌症(巴塞爾)。2022;14 (20): 5019。5. van Rhijn BWG 等人。Eur Urol. 2009; 56 (3): 430—42。 卡介苗,Bacillus Calmette-Guérin;CIS,原位癌;投資者關係,中等風險;NMIBC,非肌肉浸潤性膀胱癌;turbT,經尿道膀胱腫瘤切除術。患病率1—3 名患者(美國)a(約 80,000)(約 20,000)進展低級 — 低風險和中等風險高風險 CIS — 卡介苗無反應卡介苗膀胱內化療(約 4,000)TurbT 復發膀胱內基因療法(Adstiladrin®)全身免疫療法(Keytruda®)膀胱切除術 turBT 復發輔助療法膀胱內注射治療(Keytruda®)膀胱切除術 turBT 復發輔助療法免疫療法(Anktiva®)卡介苗膀胱內化療輔助治療當前治療復發和進展的風險很高 適用於 NMIBC 42-84% 的低級別投資者關係患者出現復發4,5

AU-011 作爲潛在的一線免疫消融療法 在 NMIBC 中,AU-011 具有雙重作用機制,有可能減輕治療負擔 NMIBC,非肌肉浸潤性膀胱癌;turBT,經尿道膀胱腫瘤切除術。治療目標通過直接殺滅腫瘤細胞進行局部治療降低復發和進展的風險避開 turbt/手術室刺激廣泛的抗腫瘤 t 細胞反應局部疾病的一線早期干預以良好的安全性減輕治療負擔

AU-011 的給藥和激活可以針對泌尿科診所 AU-011 的當地管理進行優化 與泌尿科辦公室TurbT(經尿道膀胱腫瘤切除術)的現行做法一致。辦公室內手術使用標準膀胱鏡針進行局部膀胱鏡給藥激光激活 <10 分鐘激光總時間 <15 分鐘總手術時間 <5 分鐘泌尿科醫生熟悉的程序 通常使用膀胱注射(例如肉毒桿菌毒素)和激光注射。無需全身麻醉 對於有全身麻醉/Turbt 禁忌症(例如合併症)的患者,AU-011 治療可能是可行的。在藥物處理中不需要額外的安全預防措施 沒有病毒複製或脫落
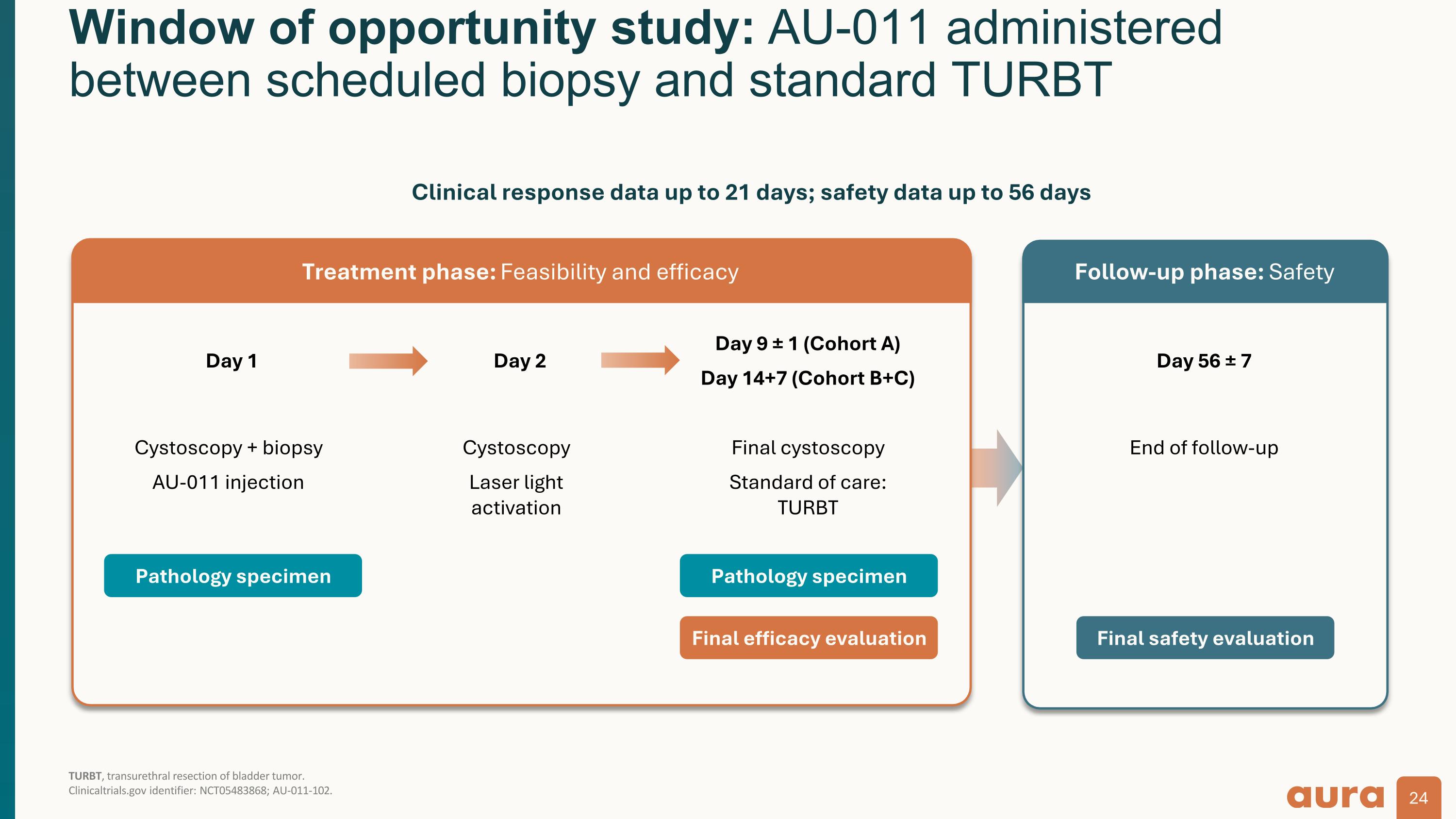
機會之窗研究:在定期活檢和標準 turbT TurbT(經尿道膀胱腫瘤切除術)之間進行的 AU-011。 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。第 1 天膀胱鏡檢查 + 活檢 AU-011 注射第 2 天膀胱鏡檢查激光激活第 9 天 ± 1(隊列 A)第 14+7 天(隊列 B+C)最終膀胱鏡檢查護理標準:turbT 第 56 天 ± 7 隨訪結束病理標本病理學標本最終療效評估最終療效評估治療階段:可行性和療效隨訪階段:安全性臨床反應數據最多 21 天;安全性數據最長 56 天

旨在評估安全性、可行性和作用機制的 AU-011 第 1 期試驗,安全審查委員會在每個隊列後完成。爲了安全起見,患者在TurbT之後隨訪至56天。NMIBC,非肌肉浸潤性膀胱癌;MoA,作用機制;turBT,膀胱腫瘤的經尿道切除術。 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。腫瘤基底總計 100 µg NMIBC (N=5) 50 µg 腫瘤本體層內 50 µg 僅限藥物(無光)腫瘤基底總計 100 µg NMIBC (N=4) 50 µg 在專有層狀隊列 A 中:藥物 + 輕組總計 100 µg NMIBC (N=3) 100 µg 腫瘤基礎隊列 B:藥物 + 輕型研究目標安全和狗極限毒性焦點分佈 AU-011 技術的可行性 Focal 的壞死標誌物 免疫激活組織病理學評估在標準護理時完成 turbT 第 1 部分(n=5)AU-011 + 聚焦光激活僅針對 NMIBC 所有來者 AU-011 的單劑量機會之窗研究第 2 部分(n=~10)隊列 C:藥物 + 輕總計 200 µg NMIBC (N~3) 腫瘤底部 200 µg
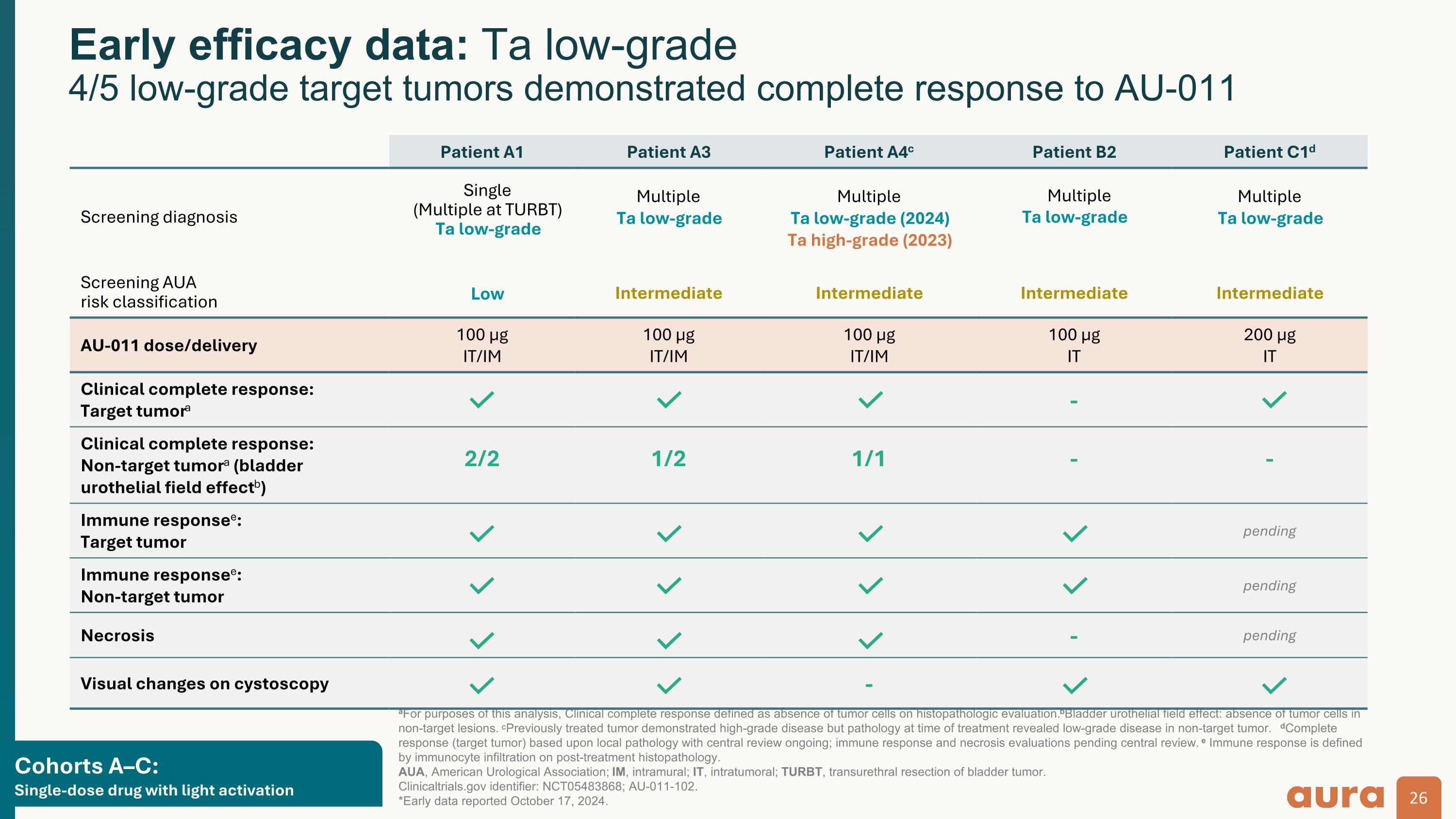
群組 A—C: 具有輕度激活的單劑量藥物 a出於本分析的目的,臨床完全反應定義爲組織病理學評估中沒有腫瘤細胞。b膀胱尿路上皮場效應:非靶損中沒有腫瘤細胞。c先前接受過治療的腫瘤顯示出高等級疾病,但治療時的病理顯示非靶腫瘤存在低度疾病。d完全反應(靶向腫瘤)基於局部病理,中心審查正在進行中;免疫反應和壞死評估尚待中心審查。e 免疫反應由治療後組織病理學中的免疫細胞浸潤定義。 AUA,美國泌尿外科學會;我,壁內;It,腫瘤內;turbT,經尿道膀胱腫瘤切除術。 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。*2024年10月17日公佈的早期數據。早期療效數據:Ta 低等級 4/5 低度靶腫瘤表現出對 AU-011 患者 A1 患者 A3 患者 A4c 患者 B2 患者 C1d 篩查診斷單一(TURBT 多個)Ta 低級別多個 Ta 低級(2024)Ta 高等級(2024 年)多個 Ta 低等級(2023)多個 Ta 低度多重篩查 AUA 風險分類低中級中間體中間體 AU-011 劑量/給藥量 100 µg 它/我是 100 µg 它/我是 100 µg 它/我是 100 µg 它 200 微克 它的臨床完整回應: 靶腫瘤-臨床完全反應:非靶向腫瘤(膀胱尿路上皮場效應b)2/2 1/2 1/1--免疫反應: 靶腫瘤待免疫應答者:待壞死的非靶腫瘤-待膀胱鏡檢查的視覺變化-

群組 A + B: 具有輕度激活的單劑量藥物 a臨床完全反應定義爲組織病理學評估中沒有腫瘤細胞。bblass尿路上皮場效應:非靶損中沒有腫瘤細胞。Cimmune反應由治療後組織病理學中的免疫細胞浸潤來定義 AUA,美國泌尿外科學會;卡介苗,Bacillus Calmette-Guerin;CIS,原位癌;Im,壁內;It,腫瘤內;turbT,經尿道膀胱腫瘤切除術。 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。*2024年10月17日公佈的早期數據。早期功效數據:Ta 高級 3/3 個高等級腫瘤表現出對 AU-011 患者 A2 患者 B1 患者 B3 篩查診斷單一腫瘤高等級多個 Ta 高等級單一腫瘤高等級單一腫瘤高等級篩查 AUA 風險分類高中級 AU-011 劑量/ 交貨量 100 µg 它/我是 100 µg 它 100 微克 它的臨床完整反應:靶腫瘤---臨床完整反應:非靶腫瘤(膀胱尿路上皮場效應 b)NA-NA 免疫反應:靶腫瘤免疫反應ec:非靶腫瘤 NA 壞死---膀胱鏡檢查的視覺變化腫瘤視覺上較小腫瘤視覺上變小-
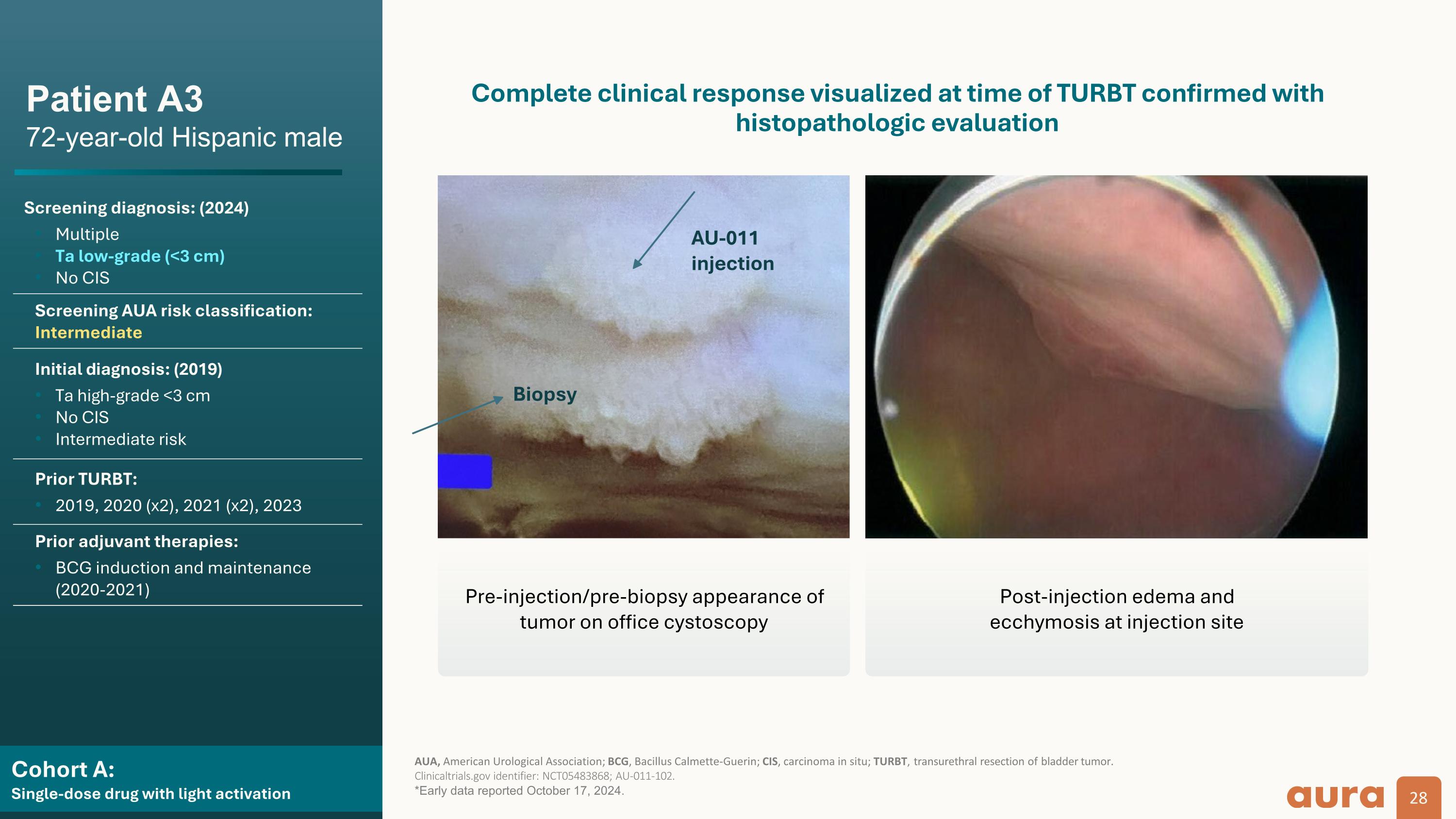
群組 A: 具有光激活功能的單劑量藥物患者 A3 72 歲西班牙裔男性篩查診斷:(2024)多個 Ta 低等級(<3 cm)無 CIS 篩查 AUA 風險分類:中級初步診斷:(2019)Ta 高級 <3 cm 無獨聯體中度風險先前 TURBT:2019、2020(x2)、2021(x2)、2023 年先前的輔助治療:卡介苗誘導和維持(2020-2021)AUA,美國泌尿外科學會;卡介苗,卡爾梅特-蓋爾特芽孢桿菌 IN;CIS,原位癌;turBT,經尿道膀胱腫瘤切除術。 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。*2024年10月17日公佈的早期數據。通過組織病理學評估確認 TurbT 時可視化的完整臨床反應活檢 AU-011 注射前/活檢前辦公室膀胱鏡檢查腫瘤的外觀注射後水腫和 注射部位的瘀斑

患者 A3:AU-011 局竈分佈、壞死和免疫染色陽性(目標病變)隊列 A: 具有光活化的單劑量藥物 H&E CD3 CD4 CD8 預處理後處理 H&E、蘇木精和曙紅。 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。*2024年10月17日公佈的早期數據。

光激活隊列(A + B): 有力的免疫介導作用機制證據 apAtients 可以進行活檢。b有組織的免疫細胞聚集體。 MOA,行動機制 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。*2024年10月17日公佈的早期數據。100%(7/7)的靶腫瘤顯示效應CD8+ t和CD4+細胞浸潤,早在激光激活後的7天內,100%(7/7)的非靶腫瘤(在有可用免疫染色的五名患者中)顯示出T細胞浸潤,支持膀胱尿路上皮場效應,57%(4/7)觀察到局竈性嗜酸性粒細胞浸潤靶腫瘤和 14% (1/7) 非靶腫瘤中,支持對腫瘤壞死的局部先天免疫反應在 71% (5/7) 的靶點中觀察到淋巴濾泡的生成b支持局部適應性免疫反應的腫瘤 AU-011 顯示出產生抗免疫原性的證據 有可能橋接、激活和增強適應性免疫力的原位變化,符合其預期的MOA
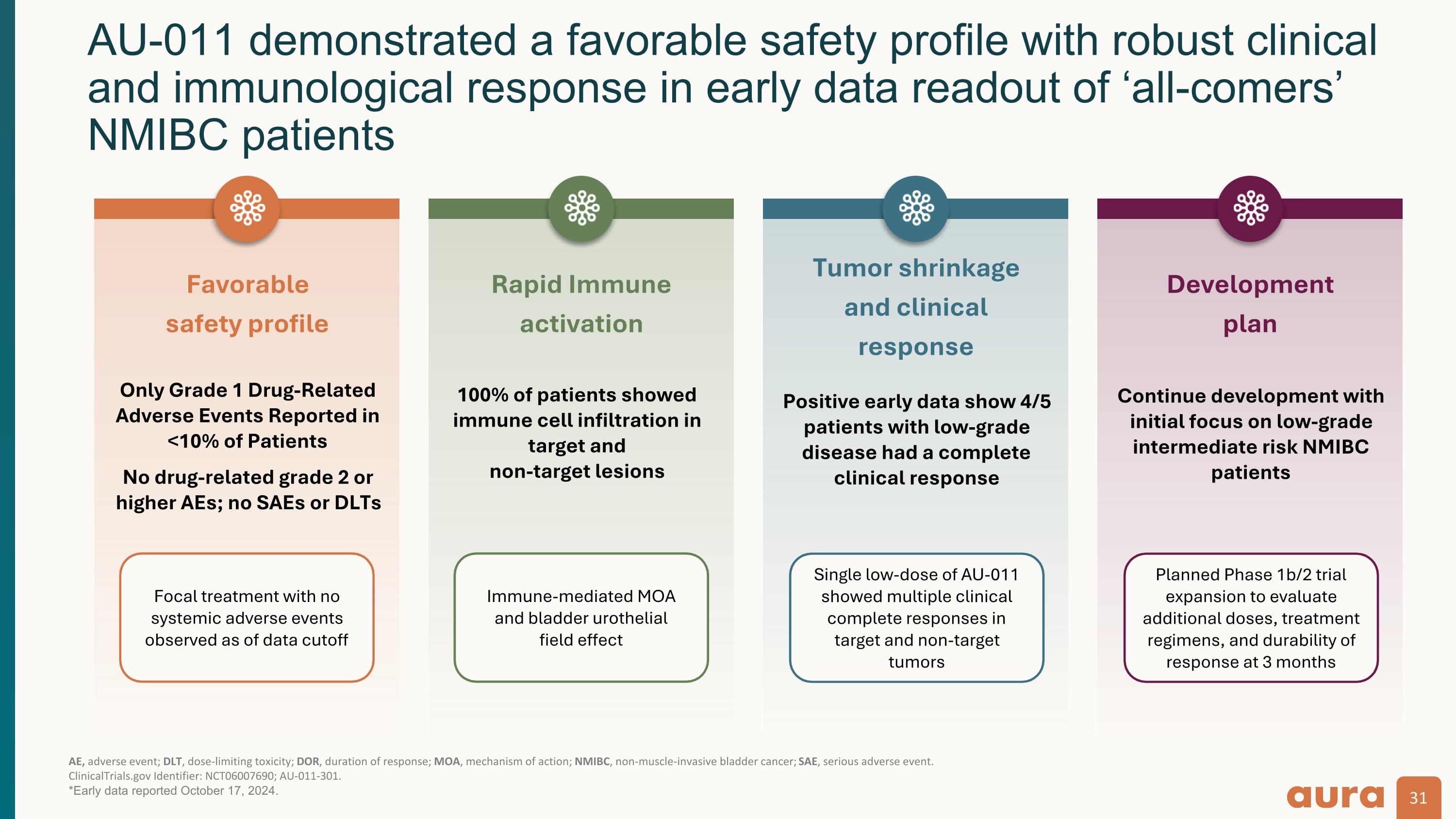
AU-011 在 「全能型」 NMIBC 患者 AE,不良事件;dlT,劑量限制毒性;DOR,反應持續時間;MOA,作用機制;NMIBC,非肌肉浸潤性膀胱癌;SAE,嚴重不良事件的早期數據讀出中表現出良好的安全性和強大的臨床和免疫學反應。 ClinicalTrials.gov 標識符:NCT06007690;AU-011-301。*2024年10月17日公佈的早期數據。快速免疫激活 100% 的患者表現出免疫細胞浸潤靶標和 非靶損腫瘤萎縮和臨床反應積極的早期數據顯示,有4/5的低級別疾病患者有完整的臨床反應開發計劃繼續開發,最初的重點是低級別的中等風險NMIBC患者。良好的安全性僅在<10%的患者中報告了1級藥物相關不良事件沒有藥物相關2級或更高的AE;沒有SAE或DLTs局竈性治療,截至數據截止時未觀察到全身不良事件免疫介導的MOA和膀胱尿路上皮 場效應:單次低劑量 AU-011 在靶腫瘤和非靶腫瘤中顯示出多種臨床完整反應計劃擴大 1b/2 期試驗,以評估額外劑量、治療方案和 3 個月後反應的持續性

1。ClearView & Putnam & Assoc流行病學分析脈絡膜黑色素瘤和脈絡膜轉移。FDA,美國食品藥品監督管理局。NMIBC,非肌肉浸潤性膀胱癌。Bel-SAR(AU-011)是研究候選產品。bel-sar的有效性和安全性尚未確定,bel-sar未獲準在任何司法管轄區使用。公司亮點強勁的現金狀況——預計將爲2026年下半年的運營提供資金經驗豐富的跨職能領導團隊企業眼部腫瘤治療領域原發性葡萄膜黑色素瘤全球3期Compass試驗積極註冊特別協議評估(SPA)協議,美國食品藥品管理局的第三階段假設得到美國食品藥品管理局第三階段假設的支持 陽性 2 期研究結束數據脈絡膜轉移 2 期試驗首批研究點已激活初步數據預計於 2025 年發佈該眼部腫瘤學適應症有可能 市場機會翻倍1 泌尿外科腫瘤學治療領域正在進行的 1 期 NMIBC 試驗 1b/2 期擴展數據預計將於 2025 年評估額外劑量、治療方案和 NMIBC 早期反應持久性的多種臨床完整反應

附錄眼部腫瘤學

目標:確定安全性、最佳劑量和治療方案一個週期 = 第 1 天、第 8 天和第 15 天的劑量。a12 名患者入組,1 名因無關 SAE 而在 1 個週期後停止治療的患者不包括在數據分析中(n=11)。bcoHort 2:計劃了 2 名參與者;由於 1 名受試者的劑量誤差,第三名受試者額外入組。 LBD,最大基底直徑;QW,每週一次;SAE,嚴重不良事件。ClinicalTrials.gov 標識符,NCT04417530:AU-011-202。存檔數據,Aura Biosciences。bel-sar 治療脈絡膜黑色素瘤的二期試驗: 開放標籤、劑量遞增及經脈絡膜上給藥試驗設計 — 22 名參與者註冊了代表早期疾病的患者群體:小脈絡膜黑色素瘤和不確定的病變終點腫瘤進展腫瘤進展腫瘤高度相對於基線的增長≥0.5 mm或≥1.5 mm 視力下降≥15個字母腫瘤厚度增長率變化 1 劑量: 20 μg x 1 激光 1 劑量: 40 μg x 1 激光 1 劑量: 40 μg x 2 激光器 2 劑量: 40 μg x 2 激光器 QW x 2 9 劑量: 80 μg x 2 激光器 QW x 3, 3 個週期的亞治療方案 (N=10) 1—2 劑量 (n=9);2 個週期(6 劑量;n=1)治療方案 (N=11) a 3 個週期(9 劑量)隊列 1 (n=1) 隊列 2 (n=3b) 隊列 3 (n=2) 隊列 4 (n=3) 隊列 5 (n=3) 隊列 5 (n=3) 隊列 6 (n=10) 6—9 劑量: 40 μg x 2 激光器 QW x 3, 最多 3 個週期 (20 µg) (40 µg) (40 µg) (80 µg) (240—360 µg) (720 µg) 總預期劑量

基線特徵所有研究參與者視力喪失的高風險定義爲腫瘤邊緣位於中央凹中心3毫米或視盤邊緣3毫米以內。BCVA,最佳矯正視力;ETDRS,糖尿病視網膜病變早期治療研究;LBD,最大基底直徑。存檔數據,Aura Biosciences。所有患者 (n=22) 女性 (%) 54.5 白人,非西班牙裔或拉丁裔 (%) 100 篩查時視網膜下積液 (%) 100 篩查時橙色素 (%) 86.4 篩查前有記錄的增長 (%) 86.4 (佔治療組的100%)篩查時的平均年齡(歲,±SD)59.2(±16.5)研究眼睛的平均基線 BCVA(ETDRS 字母,± SD)83.2(±7.2)平均基線 LBD(mm,± SD)8.5(±1.4)平均基線腫瘤厚度(mm,± SD)2.0(±0.5)腫瘤與最接近視覺關鍵結構的平均距離(mm,± SD)2.0(±0.5)2.0(±0.5)腫瘤與最接近的視覺關鍵結構的平均距離(mm,± SD)2.0(±SD)2.0(±0.5)2.3) 視力喪失風險高的腫瘤 (%) a 73% (治療組的 80% [8/10])
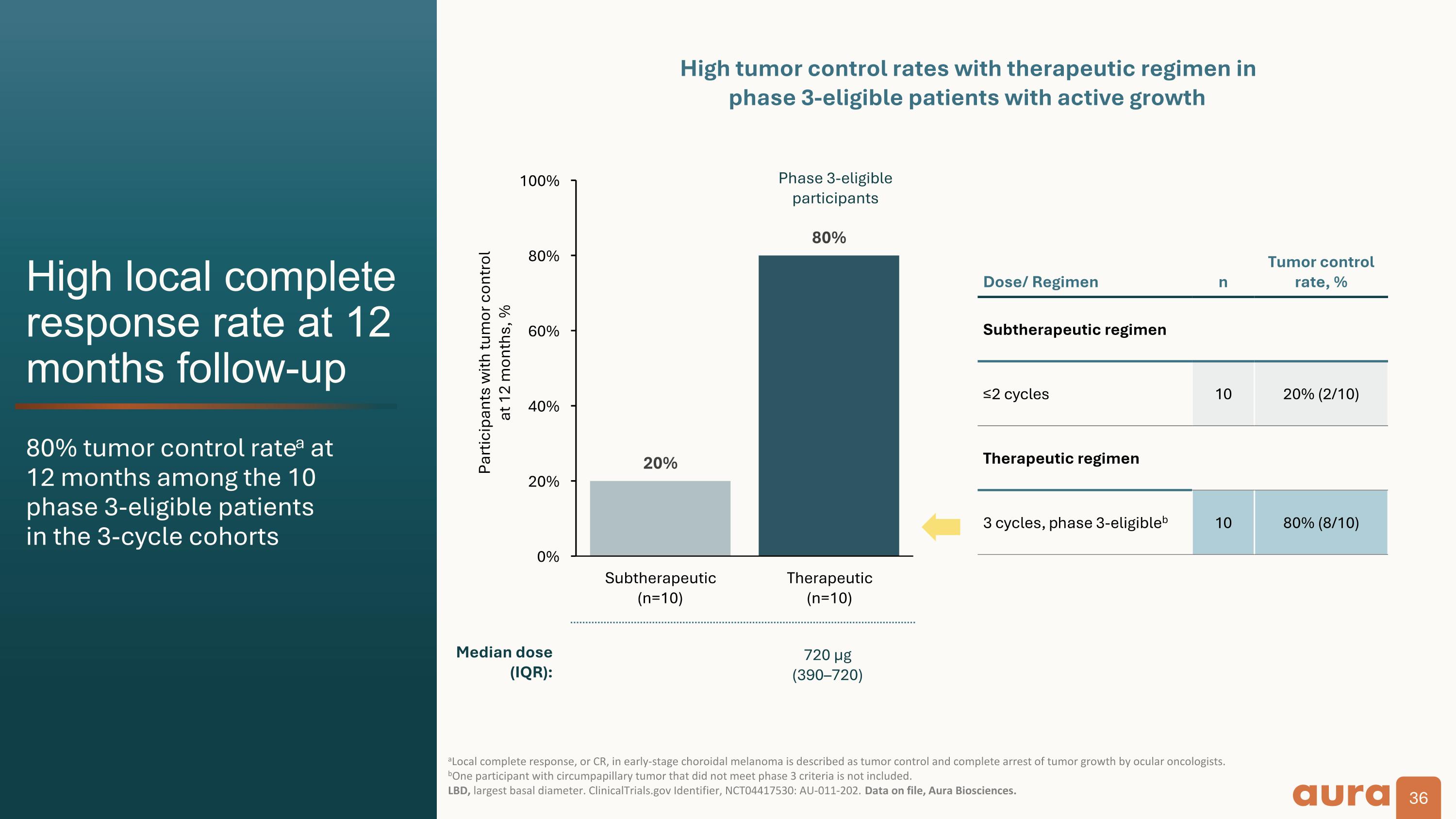
隨訪 12 個月時局部完全緩解率高 80% 腫瘤控制率a 10 個月中有 12 個月 符合第 3 階段資格的患者 在三週期隊列中,眼部腫瘤學家將早期脈絡膜黑色素瘤的局部完全反應(CR)描述爲腫瘤控制和完全抑制腫瘤生長。 不包括患有環乳頭狀腫瘤但不符合3期標準的BoNE參與者。 LBD,最大的基礎直徑。ClinicalTrials.gov 標識符,NCT04417530:AU-011-202。存檔數據,Aura Biosciences。12 個月時有腫瘤控制的參與者,% 劑量/方案 n 腫瘤控制率,% 亞治療方案 ≤2 週期 10 20% (2/10) 治療方案 3 個週期,第 3 階段合格b 10 80% (8/10) 符合第 3 階段資格的參與者使用治療方案的腫瘤控制率高 符合三期條件的活躍生長患者中位劑量 (IQR):140 µg (80160) 720 µg (390—720)

腫瘤生長率 ± SE,mm/yr P < 0.0001 bel-sar 治療的腫瘤生長速率在符合第 3 期條件的患者中,三週期方案導致應答者停止生長(N=8)使用重複測量混合模型(MMRM)估算的腫瘤厚度增長率/斜率;歷史和研究時期的隨機截距和斜率模型。ClinicalTrials.gov 標識符,NCT04417530:AU-011-202。存檔數據,Aura Biosciences。後處理實際增長率未經處理的預計增長率預處理的實際增長率
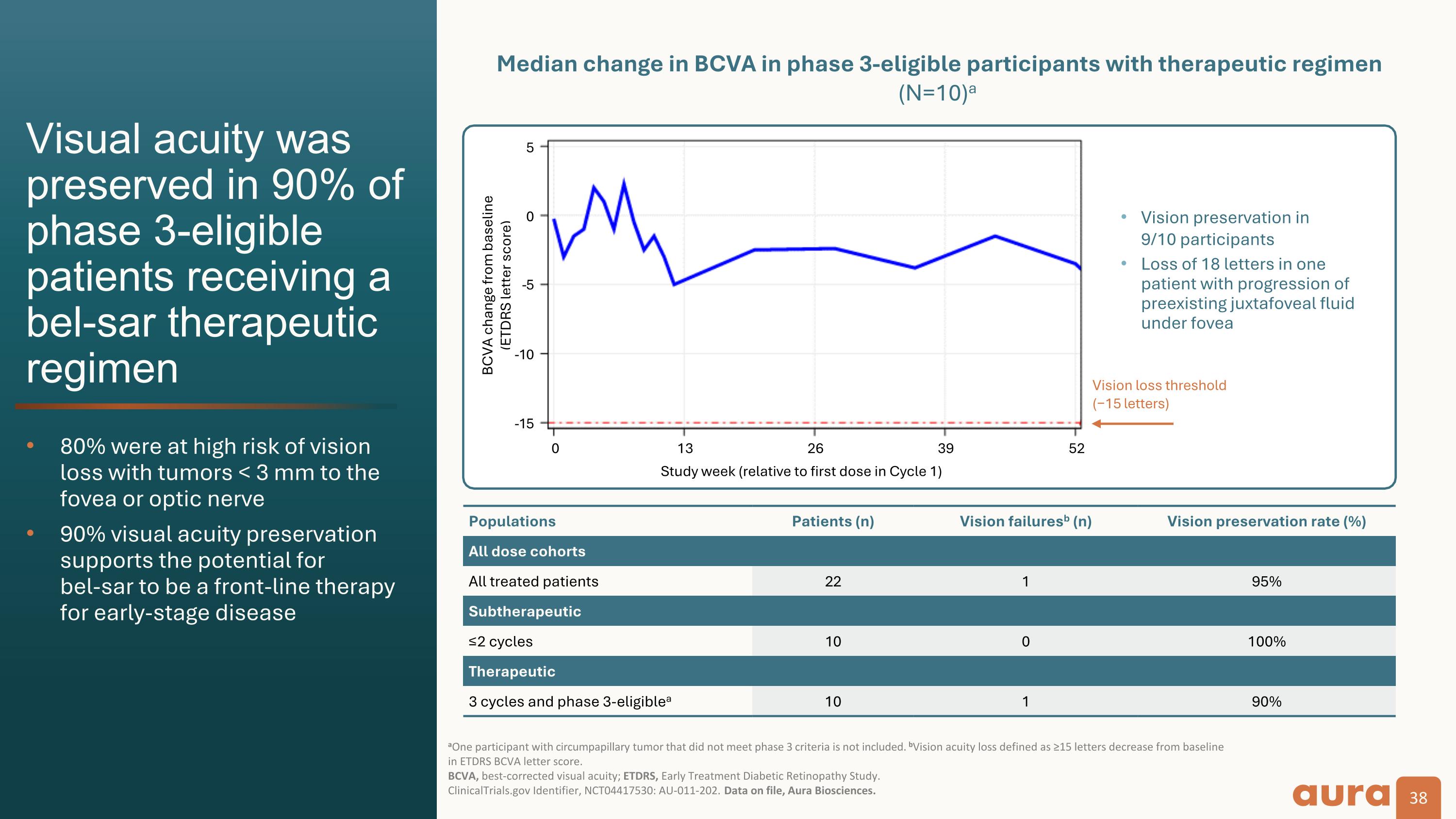
視力喪失閾值 (−15 個字母) 群體患者 (n) 視力衰竭b (n) 視力保持率 (%) 所有劑量組群所有接受治療的患者 22 1 95% 亞治療 ≤2 週期 10 0 100% 治療 3 個週期和第 3 階段符合條件a 10 1 90% BCVA 與基線相比變化 (ETDRS 信件分數)在接受bel-sar治療方案的符合3期條件的參與者(N=10)中,90% 的符合3期條件的患者視力得以保持,80% 視力下降的風險很高,腫瘤位於中央凹或視神經 3 mm 以下 90% 的視力保持支持視力下降的可能性 bel-sar將成爲早期疾病的一線治療AOne患有環乳頭狀腫瘤但不符合3期標準的參與者。bVision敏銳度喪失定義爲ETDRS BCVA字母評分比基線下降≥15個字母。 BCVA,最佳矯正視力;ETDRS,早期治療糖尿病視網膜病變研究。ClinicalTrials.gov 標識符,NCT04417530:AU-011-202。存檔數據,Aura Biosciences。研究周(相對於週期1中的第一劑量)視力保持 9/10 參與者在一名患者中丟失了 18 個字母,其中一個患者在中央凹槽下已有積液的進展情況 -5 0 5 -5 -5 -10 -15 0 13 26 39 52
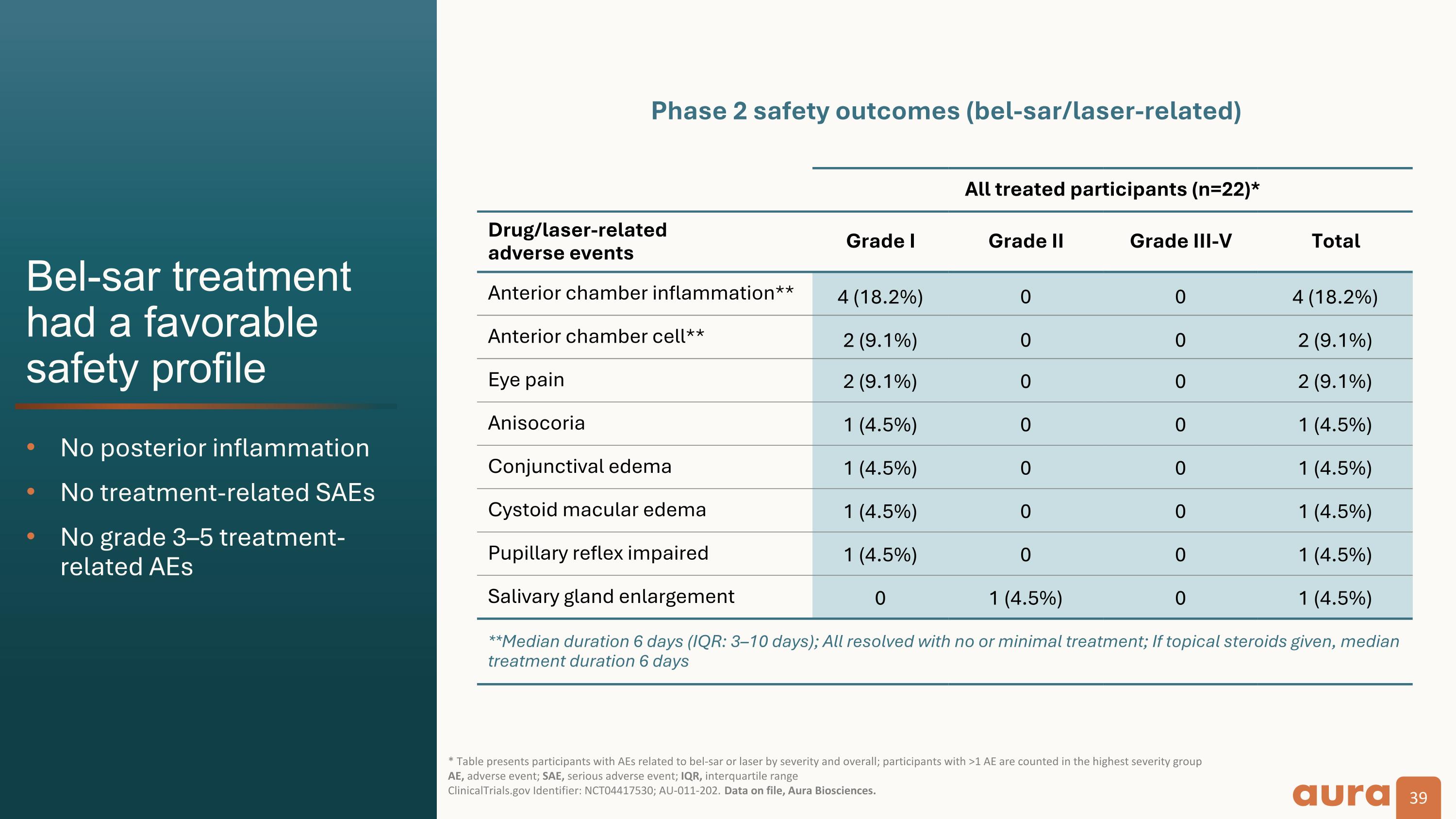
Bel-sar 治療 過得不錯 安全概況無後部炎症無治療相關的 SAE 沒有 3—5 級治療相關不良事件 * 該表按嚴重程度和總體情況顯示了與 bel-sar 或激光相關的不良反應的參與者;AE >1 的參與者被計入最高嚴重程度組 AE,不良事件;SAE,嚴重不良事件;IQR,四分位數範圍 ClinicalTrials.gov 標識符:NCT04417530;AU-011-202。存檔數據,Aura Biosciences。所有接受治療的參與者(n=22)* 藥物/激光相關 不良事件 I 級 II 級 III-V 級前房總炎症** 4 (18.2%) 0 0 4 (18.2%) 前房細胞** 2 (9.1%) 0 0 2 (9.1%) 眼痛 2 (9.1%) 0 0 2 (9.1%) 0 0 (9.1%) Anisocoria 1 (4.5%) 0 1 (4.5%) 結膜水腫 1 (4.5%) 0 0 1 (4.5%) 囊狀黃斑水腫 1 (4.5%) 0 0 1 (4.5%) 瞳孔反射受損 1 (4.5%) 0 0 1 (4.5%) 唾液腺腫大 0 1 (4.5%) 0 1 (4.5%) **中位持續時間 6 天(IQR:3—10 天);如果不進行或最少的治療,則治療時間中位數 6 天安全結果 (bel-sar/激光相關)
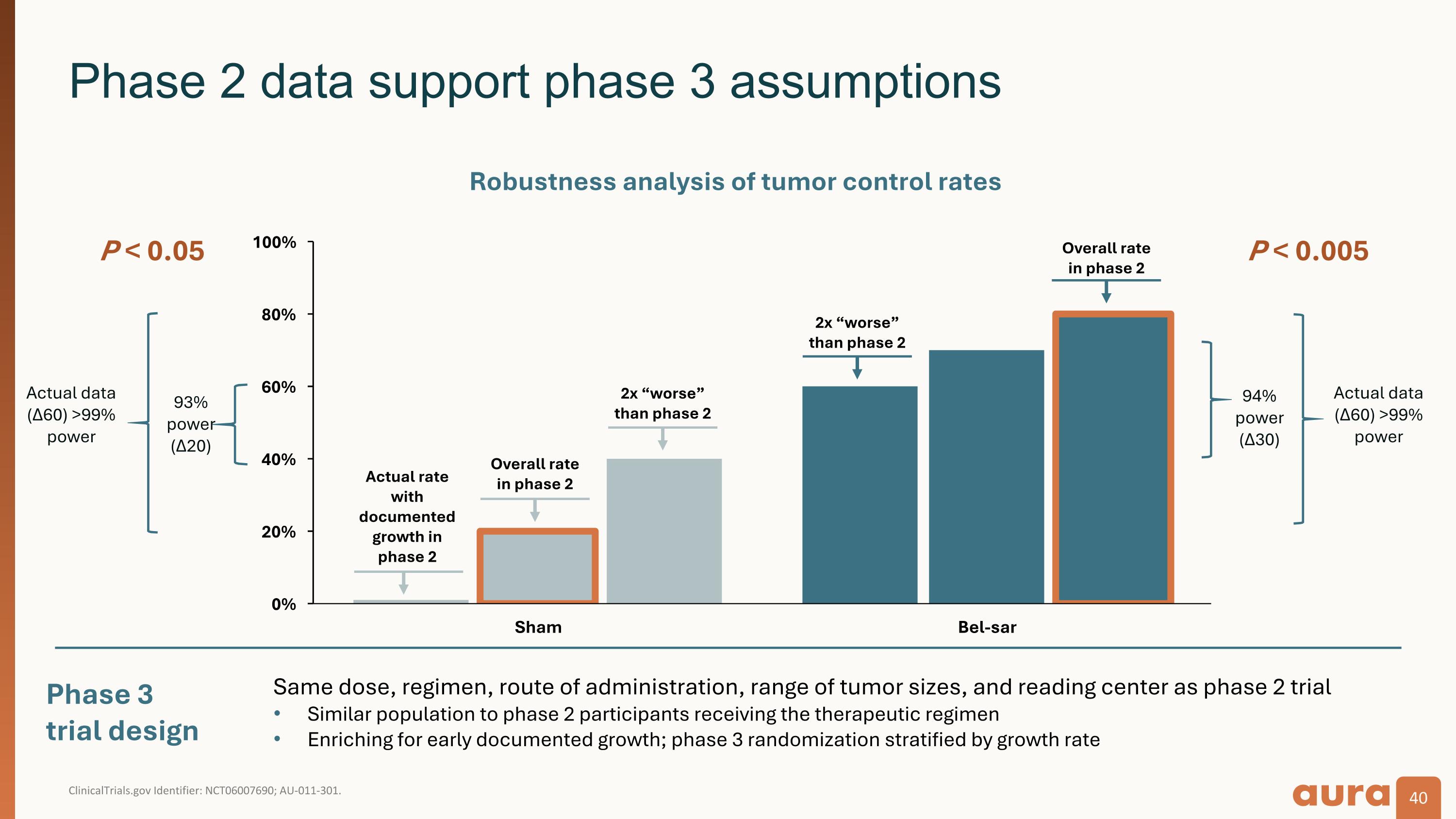
ClinicalTrials.gov 標識符:NCT06007690;AU-011-301。第 2 階段數據支持第 3 階段假設第 3 階段試驗設計 P < 0.005 93% power (Δ20) Actual data (Δ60) > 99% 功率 P < 0.05 腫瘤控制率的穩健性分析總體率 在第 2 階段 「差」 比第 2 階段 「差」 2 倍實際比率 「差」 2 倍 有記錄的增長 第 2 階段總體費率 在第 2 階段中,功率 94%(△30)實際數據(60)> 99% 功效與 2 期試驗相同的劑量、方案、給藥途徑、腫瘤大小範圍和閱讀中心與接受治療方案的 2 期參與者相似人群豐富早期記錄的生長;按生長率分層的 3 期隨機分層

附錄泌尿外科腫瘤學

AUA,美國泌尿外科學會。 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。*2024年10月17日公佈的早期數據。患者群體:AUA 風險分類和篩查分級低等級高等級低風險中級- 風險僅限高風險藥物:患者 3 僅限藥物:患者 4 藥物 + 照明:患者 A3 藥物 + 照明:患者 B2 藥物 + 光照:患者 B3 藥物 + 光照:患者 A2 藥物 + 燈:患者 B1 僅限藥物:患者 1 僅限藥物:患者 5 藥物 + 照明:患者 A1 藥物 + 照明:患者 C1
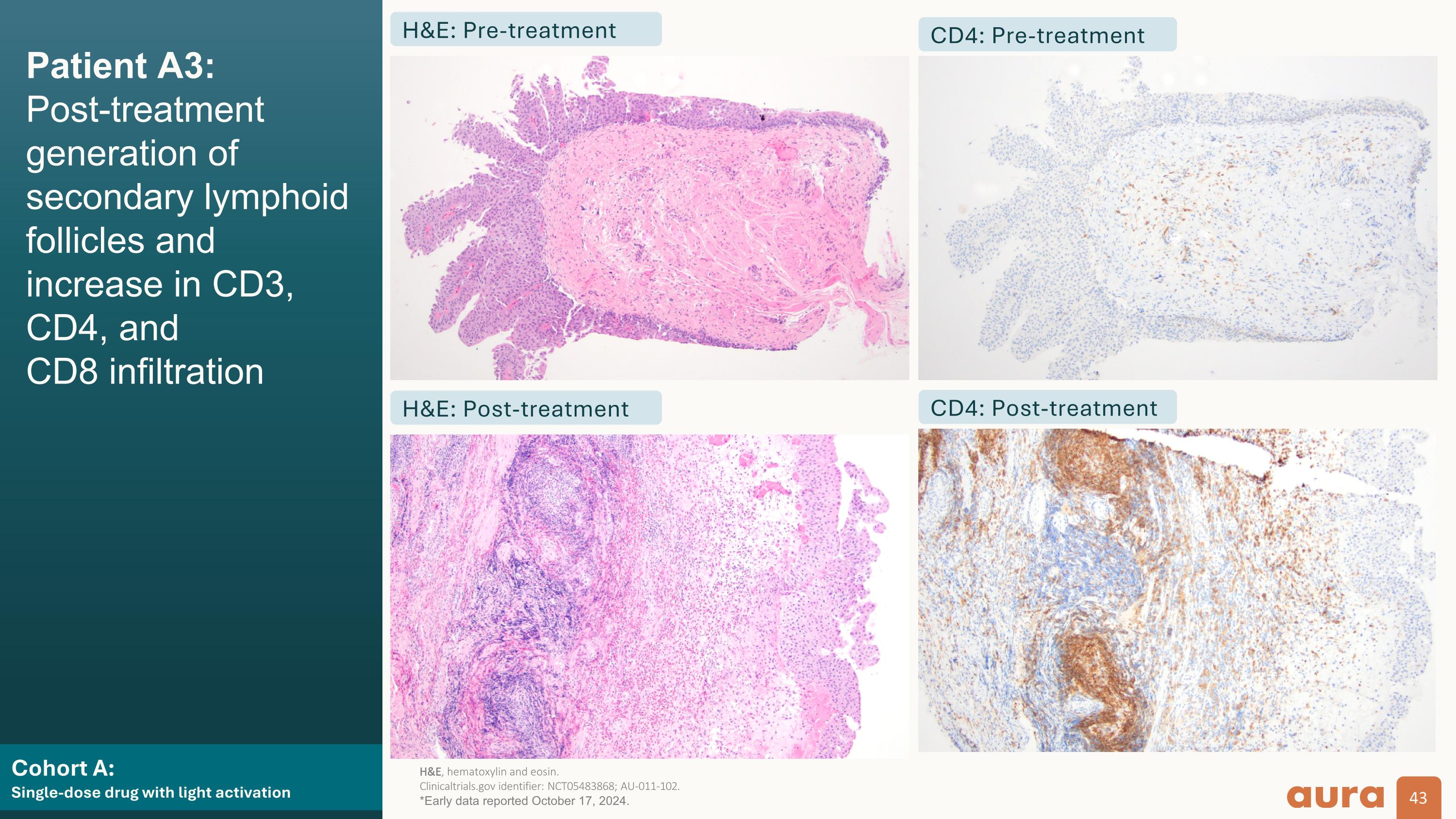
群組 A: 具有光激活功能的單劑量藥物患者 A3: 治療後產生二級淋巴樣濾泡,CD3、CD4 和 CD8 浸潤 H&E:預處理 H&E:後處理 CD4:預處理 CD4:後處理 H&E、蘇木精和曙紅。 ClinicalTrials.gov 標識符:NCT05483868;AU-011-102。*2024年10月17日公佈的早期數據。