
99.1展品 保留® 终身视力网络研讨会呈现52周 LUNA和4年OPTIC结果以及关键项目th November 18 , 2024

前瞻性陈述本文档中以及任何 附带演示有关未来可能发生的事项、事件、统计数据或临床或财务结果的陈述是《1995年私人证券诉讼改革法案》的“前瞻性陈述”。 此类陈述包括但不限于对Ixo-vec作为湿性AMD治疗的潜在好处的陈述,包括潜在的最佳产品特性、临床活性、有利的安全性概况和长期 受益; 与Adverum的产品候选者、临床研究和试验(包括Ixo-vec第3期关键项目的试验设计和预计启动时间)以及监管申报相关的计划和里程碑; Adverum的产品候选者的治疗 和商业潜力; 对Ixo-vec市场规模的预期; Ixo-vec改变湿性AMD患者治疗范式的潜力; Adverum的现金充裕性和 持续时间; 以及其他包含“预期”、“可能”、“潜在”、“将”等表达的陈述,所有这些都是基于Adverum在当前条件下所做的某些假设 、预期未来发展和Adverum认为适当的其他因素。 Adverum可能不会按时实施任何这些计划或这些产品、临床开发、工艺开发、制造或监管目标,也可能不会在 时间充足,或完全执行或实现其前瞻性陈述中披露的意图或达到预期或披露的预测,并且您不应过分依赖这些前瞻性陈述。 实际结果和 事件的时间可能会因各种风险和不确定性而与这些前瞻性陈述中预期的结果不同,这些风险和不确定性包括但不限于,Adverum的资源是否足够 用于进行或继续计划的发展项目和计划的临床试验,Adverum的临床试验的初步或中期数据可能随着更多患者数据的出现而发生变化, Adverum的临床研究中患者招募或用于此类临床研究的产品的制造可能会有延迟的风险,产品开发和监管审批过程中天生的风险和不确定性, Adverum是否能够成功地开发、制造或商业化其任何产品候选者,以及Adverum是否将延迟收到或无法收到所需的监管审批。 Adverum面临的附加风险和不确定性 在Adverum的证券交易委员会(SEC)的申报和报告中以及Adverum最近一份年度报告10-k中的标题“风险因素”及其他地方中设置, 至于2023年12月31日结束的年度报告,已于2024年3月18日向SEC申报,以及我们随后提交的每份季度报告10-Q,以及其中所反映的任何内部修订 SEC的后续申报。 本文件包含,并且任何附带演示中可能包含,关于Adverum的行业、业务和 某些药物市场的估计、投影和其他信息,包括涉及那些市场估计规模、其预计增长率及某些医疗条件发生率的数据。基于估计、预测、投影或类似方法 的信息固有地会受到不确定性的影响,实际数额可能会与该信息中反映的数额有实质性差异。 除非另有明确声明,Adverum获得该行业、业务、市场及其他数据 基于第三方准备的报告、研究调查、研究以及类似数据、行业、医学和一般出版物、政府数据和相似来源,Adverum相信该等信息可靠, 但该信息的准确性或完整性不受保证,并且不应被理解为Adverum所作的陈述。

今天的议程 欢迎词及关键摘要 患者偏好调查 01 05 莱昂特·菲舍尔, 医学博士 莱昂特·菲舍尔, 医学博士 总裁兼首席执行官 总裁兼首席执行官 Ixo-vec及湿性AMD商业机会 02 06 莱昂特·菲舍尔, 医学博士 杰森·米切尔 总裁兼首席执行官 首席商务官 4年OPTIC和52周 03 07 KOL专家小组 LUNA结果 主持人:斯塔·塞义德·凯泽米, 药学博士 斯塔·塞义德·凯泽米, 药学博士 首席发展官 首席发展官 主要关键项目元素 04 结论及问答 08 罗米亚·古尔斯·奥兹顿, 医学博士 Adverum管理公司 首席医学官 3

Adverum 参与者 莱昂特·菲舍尔, 医学博士 罗米亚·古尔斯·奥兹顿, 医学博士 斯塔·塞义德·凯泽米, 药学博士 总裁暨首席医学官 首席发展官 首席执行官 林达·鲁宾斯坦 迈克·扎诺尼 杰森·米切尔 彼得·索帕卡 首席财务官 投资者关系负责人 首席商务官 首席运营官 4

关键意见领袖参与者 S.HasKey 提斯, 医学博士 查尔斯·C. 怀卡夫, 医学博士, 博士 马克·巴拉卡特, 医学博士 眼科学杰出教授, 研究主任, 临床研究主任 视网膜服务主任 德州视网膜顾问 视网膜黄斑研究所 康奈尔大学 Adverum 董事会成员 5

要点摘要

Ixo-vec的第三期和市场规模 临床更新突显 Ixo-vec 的潜在最佳产品特性 • 潜在最佳产品特性 在难治患者中注射免费率超过 50%、治疗负担减少率超过 80% • 超过 4年追踪,安全保障 10倍 • 在OPTIC 2E11患者中, 第1年至第4年未出现炎症 • 在LUNA 6E10患者中, 52周及随访无炎症 有利的地方预防安全概况 • LUNA患者调查 表明患者强烈偏好 Ixo-vec Broad 6E10 EOP2 284 1H25 ARTEMIS 患者群体 配合美国局部研究,融入患者 预期第三期 第三期试验 类固醇滴眼剂 FDA意见 启动 7 无炎症:无1 AC/V细胞及以上;OPTIC 2E11 参与者第2.5年出现炎症, 在OPTIC ExT开始附近进行了白内障手术;EOP2:第2期结束会议 数据截至:OPTIC 2024年8月21日,LUNA 2024年8月29日

5年以上的临床经验建立了10倍的安全边际 Ixo-vec 6E10,通过延长预防期减轻了第3阶段的风险及商业化 6E11 N=15 2E11 N=15 4年以上的临床数据 8数据截止日期: 2024年8月21日视网膜鸟 OpTic18, 2024年8月29日 LuNa30 剂量 (vg/眼) 10倍的安全边际

5年以上的临床经验确立了10倍安全边际 Ixo-vec 6E10,通过延长预防期减轻了第3阶段的风险和商业化 6E11 第3阶段剂量 N=15 提升的安全性能 延长的类固醇预防性能 可能是最佳的临床疗效连续性 N=30 6E10 N=30 4年以上的临床数据 9数据截止日期: 2024年8月21日视网膜鸟 OpTic18, 2024年8月29日 LuNa30 剂量 (vg/眼) 10倍的安全边际

6E10 剂量选择最大化了第3阶段和商业成功,展示了潜在的最佳产品概况受益安全治疗负担 % 接受 ≤1次注射 无需注射的 % 具有AC≥1+ 第3阶段继续下去的剂量减少类固醇用于IOI 6E10 88% 75% 54% 0% 4% (n = 28) N=1 2E11 92% 79% 69% 3% 7% (n = 29) 2E11 84% 73% 60% 0% 27% (n = 15) 6E11 97% 87% 87% 0% 60% (n = 15) 通过增强安全性能对关键研究的6E10进行潜在最佳的临床活性 对初步的OPTIC和LUNA的前52周测得的成果进行了10项收益比较 对于OPTIC和LUNA 52周测得的安全性来对比了数据截止日:2024年8月21日视网膜鸟, 2024年8月29日 LuNa30

可靠的受益和可预测的安全概况使真正的模式变更发生 4年的视网膜鸟和52周的 LuNa 数据突显了 Ixo-vec的概况 显示出可靠的长期受益 78%的患者在第1年没有注射的情况下到第4年仍然免注射 88%的患者在第2年没有注射的情况下到第4年仍然免注射 显示出可预测的安全概况,伴随着延长的局部预防措施 在第30周后没有新的发炎 100%的炎症在第1年解决了 11 无炎症 :无 ≥ 1个AC/V细胞 ; OPTIC结果参见2E11剂量 数据截止日期:2024年8月21日视网膜鸟, 2024年8月29日 LuNa30

Ixo-vec & 湿性AMD

庞大而不断增长的全球市场机会湿性AMD 医师和患者欢迎创新 湿性年龄相关性黄斑变性的多亿美元市场机会 是老年人造成视力损失的主要原因 随着人口老龄化和产品创新的增长 推动全球湿性AMD销售 2000万 150万 约130亿美元 美国患者 全球范围内约90亿 约60亿 约20万 美国患者每年诊断 高达42%的患者在首次诊断后2-3年内发展双眼疾病 2015年 2025年E 2035年E 参考资料:明亮聚焦基金会. 年龄相关性黄斑变性:事实和数字.;Wong WL等.年龄相关性黄斑变性的全球患病率和2020年和2040年疾病负担预测:系统综述和荟萃分析. 《柳叶切》,2014;2:106-16.;Gangnon RE 等(2015) JAMA 眼科学, 133 (2):125-132;2023年 Cowen Equity Research – 治疗类别展望.;公司估计.

真实世界视力由于慢性治疗不足而下降10 5 0 IRIS(N>160,000) -5 HORIZON (N=600) Gilles, al (N=1,212) CATt (N=647) -10 SEVEN-UP (N=65) -15 0 1 2 3 4 5 6 7 年 达到 ~40% 在2年内停止抗VEGF治疗的人数,达到57%在5年内停止 Sources: https://futureofvision.global/home/the-reality-of-retinal-disease.html。 改编自 Singer MA 等人。眼科学。2012;119(6):1175-1183。 改编自 Gillies MC 等人。眼科学。2015;122(9):1837- 14 1845。 改编自年龄相关性黄斑变性治疗试验(CATT)研究组,Maguire MG,等人 Ophthalmology。2016;123(8):1751-1761。 改编自Rofagha S,等人。 Ophthalmology。2013;120(11):2292-2299。 Wykoff CC,Garmo V,Tabano D,等人,Ophthalmol Sci。2023;4(2):100421。 从基线平均函改变

真实世界视力由于慢性治疗不足而下降 Ixo-vec旨在输送稳定的阿非利班以保持长期视力 Ixo-vec 10 5 0 IRIS (N>160,000) -5 HORIZON (N=600) Gilles, al (N=1,212) CATt (N=647) -10 SEVEN-UP (N=65) -15 0 1 2 3 4 5 6 7 年 达到 ~40% 在2年内停止抗VEGF治疗的人数,达到57% 在5年内停止 15 * Ixo-vec的潜在长期视力结果 Sources: https://futureofvision.global/home/the-reality-of-retinal-disease.html。 改编自 Singer MA 等人。眼科学。2012;119(6):1175-1183。 改编自 Gillies MC,et al。 Ophthalmology。2015;122(9):1837-1845。 改编自年龄相关性黄斑变性治疗试验(CATT)研究组,Maguire MG,et al。 Ophthalmology。2016;123(8):1751-1761。 改编自Rofagha S,et al。 Ophthalmology。2013;120(11):2292-2299。 Wykoff CC,Garmo V,Tabano D,et al,Ophthalmol Sci。2023;4(2):100421。 从基线平均函改变

治疗不足常常是由于治疗障碍所致 医师ASRS 调查强调对更持久治疗的需求 治疗障碍需要更持久的治疗选择 医师调查:治疗湿性AMD和DME的未满足需求 注射恐惧性合并疾病 74% 更持久 79% 55%改善视力 50%漏打注射 58%较长的VEGF抑制 47% 46%稳定解剖学 生活事件 交通工具不足 30% 美国和国际上 Ixo-vec 可能通过输送稳定的阿非利班来解决湿性AMD的未满足需求 16 Hahn P,编。ASRS 2023偏好和 趋势会员调查芝加哥,伊利诺伊州。视网膜专家协会;2023。

Ixo-vec定位为转变治疗模式, 相比之下, 第二代湿性年龄相关性黄斑变性(AMD)治疗只有渐进性进展, Ixo-vec旨在提供稳定并持续的注射可能的2024年美国免费营业收入4D-150(调查中)模式转变Ixo-vec超过50%[已中止Q26W并重新推出]第二代Q8-Q16W16亿美元第二代Q8-Q16W43亿美元Q8W46亿美元第一代Q4W2300万美元Q12WQ26W1年2年5年以上17

Ixo-vec通过单次眼内注射传递抗血管内皮生长因子(VEGF)阿非利普汀, AAV.7 m8衣壳能够将稳定的阿非利普汀水平输送至视网膜AAV.7 m8 ILm神经节内核视杆细胞RPE IVt注射单体细胞膜环IV视网膜环IV.7 m8插入启动子阿非利普汀PolyA AAV.7 m8:通过定向进化创建• 已工程化以用于眼内注射; 肽环使Ixo-vec 7 m8能够穿越内限膜(ILM)• AAV.7 m8将阿非利普汀输送至视网膜AAV.7 m8用于眼内基因治疗CNV•在3个临床项目中验证了阿非利普汀分泌的IVt注射CNV的持久抑制•已发表于同行评议期刊18 Kh

4年OPTIC和52周LUNA结果

OPTIC首次人体试验设计6E11和2E11与难治人群短期预防主要目标次要目标•视力维持(BCVA)长期安全性和有效性的Ixo-vec IVt在•解剖学(SD-OCT)治疗经验丰富的患者•需要补充疗法第-15天至-7天:第1天:Ixo-vec2年安全性和有效性当前更新:5年安全性和有效性基线4年IVt阿非利普汀筛选2年OPTIC研究3年延长研究期皮质类固醇预防*皮质类固醇延长计划的Ixo-vec剂量辅助阿非利普汀(2毫克IVT)标准:预防访视队集团1(n=6)6E11口服, 13天•从基线丧失≥10个字母BCVA(ETDRS)OR的视力,季度评估•CSt大于75μmOR的基线增加,队集团2(n=6)口服, 13天2E11完成后•新视力威胁性出血由于AMD的2年OPTIC亲本队集团3(n=9)眼药水,6周2E11研究•在初始辅助注射之后,接下来的注射队集团4(n=9)眼药水,6周6E11由研究者酌情给予20研究时间表非规模.*队1和2的参与者在第3天从第-3天开始接受60毫克口服强的松酮,随后, 为期7天的缓慢减少;队3和4的参与者在第1天开始接受QID地福普利(四次每日)3周的预防性暴露,随后是为期3周的减少. QID,四次每日. OPTIC:NCT03748784; OPTIC EXT:NCT04645212.数据截至日期:OPTIC 2024年8月21日

Ixo-vec的临床前数据表明其在6E10剂量下具有最佳潜力 NHP研究表明稳定的aflibercept产量伴有较低的炎症 3个对数间的低于剂量成反比的aflibercept水平 低剂量下改善的炎症评分(无预防措施) 水潴液中的Aflibercept水平 炎症评分 8 * 6 4 2 0 I I 车辆 3E10 1E11 2E11 4E11 6E11 2E12 6E12 2E13 NHP 3E10 1E11 2E11 4E11 6E11 2E12 6E12 2E13 NHP 车辆 3E10 1E11 2E11 4E11 6E11 2E12 6E12 2E13 剂量(vg/眼) 人类等效 车辆 6E10 2E11 4E11 8E11 1E12 4E12 1E13 4E13 人类等效 6E10 2E11 4E11 8E11 1E12 4E12 1E13 4E13 剂量(vg/眼) 剂量(vg/眼) * 缩放是两个参数的累积,最高得分为8。 21 Schaefer-Swale k. 非临床数据支持ADVm-022每眼6E10 vg的人等效剂量用于治疗新生血管性年龄相关性黄斑变性。 海报在ASGCt 2023年展出。 人类等效剂量(HED)大约是相应NHP剂量的两倍,基于眼部容积。例如,2E11是1E11 NHP剂量的HED。 NOAEL在1E11 vg/眼的NHP剂量确定。 Aflibercept(ng/l) Hackett-McDonald峰值评分(AC + VC)

OPTIC的经验教训在LUNA第2期试验中表明,LUNA的目标:优化Ixo-vec在关键试验进入时的利益/风险优势I目标二判断第3期预防性剂量的最佳选择第3期方案22

LUNA第2期试验设计6E10和2E11,扩展预防措施适应难治患者多中心、双盲、随机、平行分组第2期研究 主要入选标准:对VEGF疗法作出反应并接受活跃治疗的CNV继发nAMD(在入组前4个月内至少接受2次注射),研究眼视力范围为25-83 ETDRS字母 五年:第-21至-14天:第-7天:第1天: 26周: 52周: 基线 随机 IVt Ixo-vec 主要终点 EXt 完成 中期分析 IVt Aflibercept 2mg 长期2E11(n=30)延长结束筛选期 6E10(n=30) 在第五年 皮质类固醇预防措施(剂后21+周) 皮质类固醇预防策略 补充注射标准 •Difluprednate 22周±积极 来自巴金德-麦克唐纳的峰值得分(AC + VC)

OPTIC和LUNA所评估的人口统计和基线特征为难治患者。LUNA的参与者人数较多,OPTIC的人数较少。年龄及特征数据如下:N = 30。平均年龄为75.4岁(SD:8.2)、77.7岁(SD:7.4)、76.6岁(SD:7.8)、79.0岁(SD:7.3)。女性,人数分别为16(53%)、18(60%)、34(57%)、15(50%)。种族数据为:白种人27人(90%)、28人(93%)、55人(92%)、亚洲人2人(7%)、2人(7%)、4人(7%)、0人。研究眼部年龄相关黄斑变性(AMD)诊断平均年限为3.0年(SD:2.9)、3.0年(SD:3.1)、3.0年(SD:2.9)、3.7年(SD:2.8)。前一年的抗血管内皮生长因子(VEGF)注射的年均数为10.2次(1.7)、10.0次(3.3)、10.1次(2.6)、9.9次(1.9)。第1天(SD)。最佳矫正视力(Best Corrected Visual Acuity,BCVA)、ETDRS字母平均数为72.9(SD:8.8)、71.8(SD:6.4)、72.3(SD:7.7)、65.4(SD:7.2)。黄斑中心厚度(Central Subfield Thickness,CSt)平均数为360.6μm(SD:112.0)、340.5μm(SD:119.3)、350.6μm(SD:115.2)、397.0μm(SD:137.3)。晶状体状态:有11人(37%)、11人(37%)、22人(37%)、10人(33.3%)未知。数据截至日期:OPTIC 2024年8月21日,LUNA 2024年8月29日。

Ixo-vec注射后展示出持久的治疗水平。持续的水溶性阿非利普汀水平长达5年。早期阿非利普汀水平与持续的长期蛋白质表达相关,10万个NHP研究表明眼底的阿非利普汀水平可能是背景的7倍。LUNA(n=18)的阿非利普汀水平为6E10,LUNA(n=13)为6E10,OPTIC(n=7)为6E11,OPTIC(n=10)为2E11。时间轴为0-5年。LUNA在第14周为60位参与者中的31位画出的阿非利普汀水平。LUNA已修改以停止采集玻璃体(眼内湿液)样品。低于定量分析法水平(25ng/ml)的测量结果未显示。NHP数据:Kiss, Szilárd等人,Molecular Therapy Methods & Clinical Development,第18卷,第345 - 353页。数据截至日期:OPTIC 2024年8月21日,LUNA 2024年8月29日。

Ixo-vec注射后展示出持久的治疗水平。使用6E10测量的持续性阿非利普汀水平为1年。早期的阿非利普汀水平与持续的长期蛋白质表达相关。10万个NHP研究表明眼底的阿非利普汀水平可能是背景的7倍。LUNA(n=18)的阿非利普汀水平为6E10,LUNA(n=13)为6E10,OPTIC(n=7)为6E11,OPTIC(n=10)为2E11。时间轴为0-5年。LUNA在第14周为60位参与者中的31位画出的阿非利普汀水平。LUNA已修改以停止采集玻璃体(眼内湿液)样品。低于定量分析法水平(25ng/ml)的测量结果未显示。NHP数据:Kiss, Szilárd等人,Molecular Therapy Methods & Clinical Development,第18卷,第345 - 353页。数据截至日期:OPTIC 2024年8月21日,LUNA 2024年8月29日。

Ixo-vec通过4年降低治疗负担,2E11显示每年用药抗VEGF注射减少80%以上, Ixo-vec后的年均值:第1年 | 2 | 3 | 4 | | | 前的年均值11 9.9 10 9 8 7 60% 53% 47% 53% 6无需注射无需注射无需注射无需注射5 81% 84% 84% 4 86% 3 1.9 1.6 1.6 2 1.4 1 0 参与者数2E11 N=15年均值(前)=(距离Ixo-vec过去12个月内的第一个IVT的天数)/(距离Ixo-vec到过去12个月的最后一个IVt的天数/ 365.25)。27年均值(后)=(自Ixo-vec以来的aflibercept IVT数量)/(自Ixo-vec到最后一次研究随访的天数/ 365.25)。分析包括OPTIC研究的所有参与者。数据截止日:OPTIC 2024年8月21日 抗VEGF注射的年均番数量(每位患者)

连续4年注射免除率 每年随访期间注射免除患者比例一致 无需注射 60% 53% 67% 73% 按年份划分* OPTIC OPTIC EXt 2E11(n = 15)-1 0 1 2 3 4年 提前终止Aflibercept Bevacizumab Ranibizumab三联治疗 后续访问没有补充注射% 28 *第一个aflibercept注射后,可能根据医生的意愿进行补充注射。由于失访、死亡或其他原因而终止的所有患者均包括在所有期间的计算中[ %注射免除=(总队列-在该期间内获救的患者)/(总队列)* 100 ] 数据截止日:OPTIC 2024年8月21日

52周LUNA和OPTIC注射负担减少保持一致 超过80%的抗VEGF注射年均减少,超过50%无需注射 前的年均值 后的年均值Ixo-vec: LUNA OPTIC 11 10.2 10.1 9.9 10 -88% -92% -84% 9 8 75% 79% 73% 7≤ 1注射≤ 1注射≤ 1注射6 54% 69% 60% 5无需注射无需注射 无需注射 4 3 1.6 2 1.3 0.8 1 0 6E10参与者至第52周2E11参与者至第52周6E10 2E11 2E11 N=30 N=30 N=28 N=29 N=15 29 年均值(前)=(距离Ixo-vec过去12个月内的第一个IVT的天数)/(距离Ixo-vec到过去12个月的最后一个IVt的天数/ 365.25)。年均值(后)=(自Ixo-vec以来的aflibercept IVT数量)/(距Ixo-vec到最后遵循分析期内的天数/ 365.25)。数据截至日:OPTIC 2024年8月21日,LUNA 2024年8月29日 抗VEGF注射的年均数量(每位患者)

潜在的最佳无注射比率52周LUNA数据显示在难治患者中超过50%的无注射LUNA 52周整体6E10 2E11 (N = 57) (n = 28) (n = 29) 无注射61% 54% 69% ≤1次注射77% 75% 79% ≤2次注射89% 89% 90% -52周 -26周 研究周 26周 52周 91周 阿法利切普没有给予补充注射协议外补充注射 绮腾注射法利晶注射别嘌醇注射其他提前终止 30个剂量在泳道图中汇总以保持正在进行的双盲研究中的研究者掩盖。提前终止患者不包括在注射计算中。[%无注射 = (总队列 - 提前终止患者 - 被救助患者) / (总队列 - 提前终止患者) * 100] 数据截取:LUNA 29AUG2024 所有参与者 (N=60)

Ixo-vec保持BCVA和CSt通过4年的跟踪展示了稳健和持久的活性OPTIC OPTIC EXt 90平均BCVA平均BCVA (90% CI)根据剂量随时间的变化 (字母) 从基线到最后访问的变化 (90% CI) -2.9 (-12.3, 6.5) 2E11 50 40 30 0 0 12 0 24 .5 36 48 1 60 72 1.5 84 96 2108 120 2 1.5 32 144 156 3 168 180 3.5 192 204 4 (N) 15 13 14 13 12 12 12 11 11均值CSt (90% CI)根据时间计算的不同剂量 平均CSt(μm)从基线到最后访问的变化 (90% CI) 当2E11 250 200 150 100 0 0 4 00 12 24 0.5 36 48 1 60 72 1.584 96 1 208 120 12 32 .5 144 156 3 168 1803.5 192 204 4 (N) 15 13 13 12 12 11 12 11 12年 31 *白内障手术数据截取:OPTIC 21AUG2024 均值CSt μm (90% CI) 均值BCVA (90% CI)

Ixo-vec保持BCVA和CSt两种剂量均展示了稳健和持久的活性,与OPTIC一致最小二乘均值最佳矫正视力 (BCVA) 随时间按剂量变化52周,来自基线的LS均值BCVA变化6E10 (n=29) 2E11 (n=29) 52周时的字母 (95% CI) -2.1 (-4.8, 0.7) 6E10从基线时-1.8 (-4.6, 0.9) 2E11 // BL 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54周 最小二乘均值中心亚视网膜厚度 (CST) 随时间按剂量变化52周,μm (95% CI) 150 LS均值CSt变化6E10 (n=30) 2E11 (n=30) 从基线时100字母 -10.2 (-29.0, 8.5) 6E10 -21.9 (-40.4, -3.3) 0 2E11 -50 // 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 BL周32最小二乘均值基于混合模型重复测量(MMRM)包括剂量组、基线值、访问和访问剂量组。*排除了每个剂量因白内障视力损失而有的参与者 数据截取:LUNA 29AUG2024 LS均值CSt变化 LS均值BCVA变化 (95% CI)μm (95% CI)

OPTIC 2E11在4年的时间内被100%的患者所耐受,所有在第1年发炎的患者炎症在後期得到缓解。OPTIC OPTIC EXt OPTIC 2E11 15个AC细胞≥1+ VC细胞≥1+ § 2E11在4个2E11年后的随访中通常被良好地耐受。炎症与剂量呈正相关,不影响视力,而且当存在时,对局部皮质类固醇有反应。* 0 12 24 36 48 60 72 84 96 108 120 132 144 156 168 18 * 0 192 204 § 从最高测试剂量的10倍安全边际,可见2E11的长期安全数据在治疗nAMD的过程中。短预防性方案涉及13天的口服泼尼松或6周的局部滴剂。*2E11参与者在第2.5年患有炎症并接近OPTIC EXt的开始时接受了白内障手术。在接下来的预定赴约(3个月后—第2.5年),检测到对33局部皮质类固醇具有反应的炎症。通过裂隙灯检查评估的细胞等级,等级类别基于标准的虹膜炎命名(SUN)标准和国家卫生研究院的玻璃体细胞指南。数据截止日期:2024年8月21日OPTIC参与者人数统计

安全摘要:LUNA 52周Ixo-vec继续被良好地耐受,证明具有潜在的最佳产品特性Ixo-vec在总LUNA人群中具有有利的安全性且耐受良好。• 无与Ixo-vec相关的严重不良事件。所有与Ixo-vec相关的不良事件(AEs)要么是轻微的,要么是中度的。• 无睑结膜炎、血管炎、视网膜炎、脉络膜炎、血管闭塞或低眼压和Ixo-vec相关的最常见的AE是剂量相关的前房炎,对局部皮质类固醇有反应以及前房色素变化,对视力无影响。• 在52周时和任何随访期间,有6E10患者没有炎症。• 仅一个患者在任何时间点有炎症,但在52周前得到缓解。前房细胞、前房色素沉着、虹膜透光缺损、虹膜炎。没有炎症:没有≥ 1 AC/VC细胞。联合使用局部地氟地奈特和伴有或不伴有IVt地塞米松(N=34)的局部地氟地奈特单独(N=10)。数据截止日期:2024年8月29日的LUNA

Extended Local Prophylaxis Effective in Minimizing Inflammation Inflammation responded to local corticosteroids and resolved over time Initial IVt DEX IVt DEX + DFBA Initial IVt DEX IVt DEX + DFBA Prophylactic Steroid Prophylactic Steroid Injection Injection Usage** Usage** DFBA Prophylaxis Period (DFBA Only) DFBA Prophylaxis Period (DFBA Only) 0 0 0 0 0 tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 ANTERIOR VITREOUS 6E10 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr tr tr 0 0 0 0 0 6E10 CHAMBER 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 CELLS 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 CELLS 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p 0 0 0 1+ tr p 0 p p 0 0 0 0 0 0 0 0 0 0 p p p p 0 0 0 0 0 0 0 0 0 et et 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 None None 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr 1+ 0 0 1+ 0 0 0 0 0 0 0 0 0 0 1+ 1+ tr 0 tr tr 1+ 1+ tr tr tr tr tr tr 1+ 1+ * * * * * 0 0 0 0 0 0 0 0 0 0 0 p p p 0 0 0 p p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2+ 2+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 3+ 3+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 4+ 0 0 0 0 0 0 0 0 0 0 0 0 p 0 p 0 0 p 0 p 4+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p p p p p p p p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2E11 2E11 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr 0 0 0 0 0 0 0 0 p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr tr tr tr tr tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p p p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr 0 0 0 0 0 0 2+ 0 1+ 0 2+ 0 tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1+ 0 0 0 p p p p * * * * 0 0 0 2+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p p 0 p 0 0 p p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p p p 0 p 0 p p p p p 0 p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr tr tr tr 0 0 0 0 0 0 0 0 0 0 0 0 0 p tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 No patients had inflammation at week 52 or at any subsequent visit No inflammation: no ≥ 1 AC/V cells. IVt DEX = Ozurdex, DFBA = dilfuprednate, tr = Trace, p = Pigmented Cells, * = Mixed Pigmented / Non-Pigmented Cells, et – Early Termination. **IVt DEX + DFBA: protocol amended 35 early in study to include difluprednate starting at week 4 to match the taper in the difluprednate only regimen; if initiated after week 4 visit, difluprednate may be adjusted at the discretion of investigator in consult with medical monitors. Due to this, difluprednate prophylaxis with IVt DEX + DFBA may have lasted up to week 34. Data cut: LUNA 29AUG2024 DFBA IVt DEX + DFBA IVt DEX + DFBA (N=7) DFBA (N=7) (N=10) (N=10) SCRN RAND D1 D3 D8 W2 W4 W6 W8 W10 W14 W18 W22 W26 W30 W34 W38 W42 W48 W52 W65 W78 DFBA IVt DEX + DFBA IVt DEX + (N=10) DFBA (N=7) (N=10) DFBA (N=7) SCRN RAND D1 D3 D8 W2 W4 W6 W8 W10 W14 W18 W22 W26 W30 W34 W38 W42 W48 W52 W65 W78
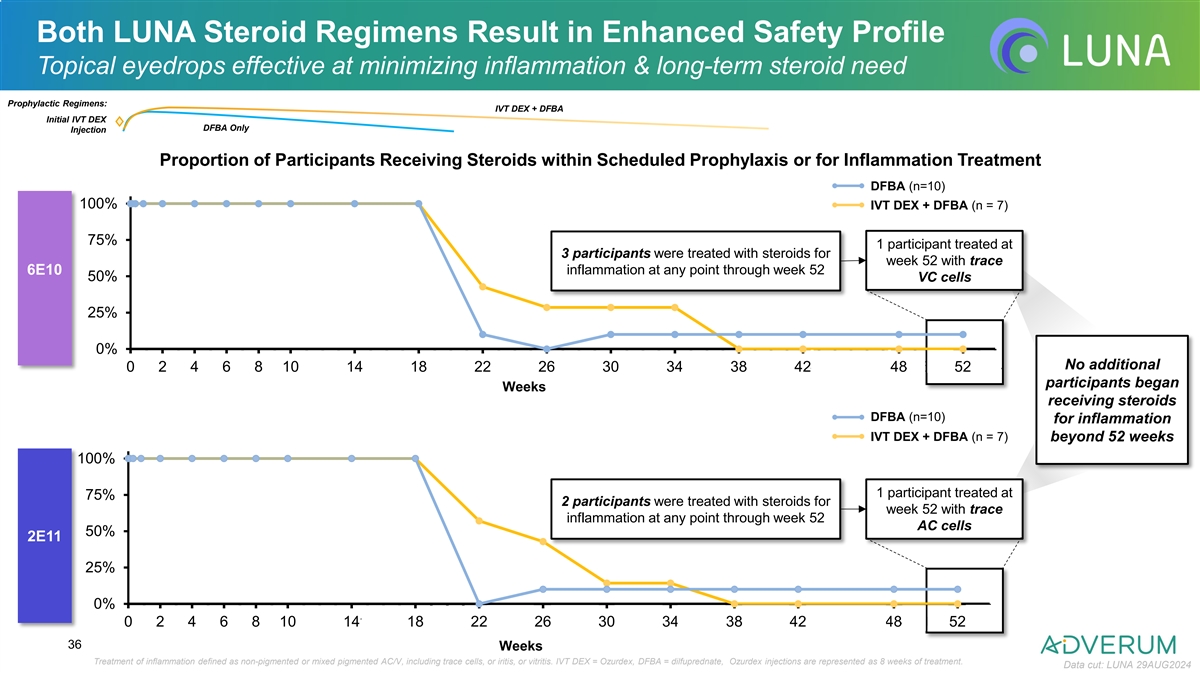
LUNA两种类固醇方案均导致增强安全性 防止剂用点眼液有效减少炎症和长期类固醇需求 预防方案:IVt DEX + DFBA 初次IVt DEX DFBA只注射参与者在计划内预防或为了治疗炎症而接受类固醇治疗DFBA(n=10)100% IVt DEX + DFBA(n = 7)75% 1名参与者在第52周接受治疗,3名参与者在第52周因轻微6E10炎症而接受治疗,所有VC细胞的50%,AC细胞的25%的参与者额外0%没有额外,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52位参与者从开始计划周数接受治疗的DFBA(n=10)为了治疗炎症的IVt DEX + DFBA(n = 7)超过52周100% 1名参与者在第75% 2名参与者在第52周接受治疗,3名参与者在第52周因轻微炎症而接受治疗,所有AC细胞的50%,2E11,AC细胞的25%的参与者额外0%没有额外,0,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52 36周炎症治疗定义为非色素或混合色素AC/V,包括轻度细胞,或虹膜炎或玻璃体炎。IVt DEX = Ozurdex,DFBA = 柠二酸酶,Ozurdex注射表示8周的治疗。数据截止日期:LUNA 2024年8月29日

LUNA延长预防措施优于OPTIC的经验 第3阶段方案增强整体安全性并减少长期类固醇需求 LUNA DFBA预防期间 OPTIC在计划内预防或治疗炎症的参与者比例为100% 75% 50% 25% 0% 0 1 2 3 4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52周LUNA:DFBA Only OPTIC:DFBA Only 2E11(n = 9) 6E10(n = 10) 6E11(n = 9) 2E11(n = 10) 37 炎症治疗定义为非色素或混合色素AC/V细胞,虹膜炎或玻璃体炎。DFBA = 消炎酸。数据截止日期:OPTIC 2024年8月21日,LUNA2024年8月29日

患有高疾病负担的患者中的CSt维持 在基线CSt >300μm的患者中的液体减少;在≤300μm的患者中的维持 LUNA基线CSt ≤300μm(n = 27) LUNA基线CSt >300μm(n = 33) 平均CSt在第52周从基线变化,μm(95%置信区间) 2.9(-14.3,20.2)在基线≤300μm -34.4(-64.9,-3.9)在基线>300μm 基线特征子组:CSt ≤300 µm CSt >300 µm 平均CSt,μm(SD) 269.9(18.7) 416.6(119.1) 数据截止日期:LUNA2024年8月29日 平均CSt从基线变化,μm(95%置信区间)

广大患者中具有一贯的解剖学益处,无需注射的患者其解剖稳定性得到维持并减少CSt 150 LUNA 基线 CSt ≤300μm 的患者(n=27)LUNA 基线 CSt >300μm 的患者(n=33)来自 LUNA 基线 CSt ≤300μm,无需注射(n=16)的患者的平均CSt 变化 LUNA 基线 CSt >300μm,无需注射(n=20)的患者 52周时的基线,μm(95% CI) 100 所有参与者 2.9(-14.3,20.2) 50 BL ≤300 μm,所有 -34.4(-64.9,-3.9) BL >300 μm,所有 0 无需注射 -50 -7.6(-20.7,5.5) BL ≤300 μm,无需注射 -100 -38.0(-67.0,-9.0) BL >300 μm,无需注射 -150 // 基线 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 周 理想患者亚组的基线特征 CSt ≤300 µm CSt >300 µm CST ≤300 µm CSt >300 µm 所有参与者 所有参与者 无需注射 无需注射 平均CSt,μm(SD) 269.9(18.7) 416.6(119.1) 273.8(16.7) 417.6(142.0) 39 数据截止:LUNA 2024年8月29日 基线变化的平均CSt,μm(95% CI)

Ixo-vec 维持视觉和解剖结果 BCVA 在整体人群和无需注射患者中证明了 BCVA 的维持 平方均数最佳矫正视力(BCVA)随时间变化的变化* 15 LS 平均 BCVA 变化 6E10(n=29)2E11(n=29) 52 周时与基线相比,10个字母(95% CI) 5 -2.1(-4.8,0.7) 0 6E10 -5 -1.8(-4.6,0.9) 2E11 -10 -15 // BL 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 周 最佳矫正视力(BCVA)随时间变化的平方均数按剂量在补充处理方面无需注射的参与者** 15 LS 平均 BCVA 变化 6E10(n=15)2E11(n=20) 52 周时与基线相比,10个字母(95% CI) 5 +1.1(-2.7,4.9) 0 6E10 -5 -2.2(-5.5,1.2) 2E11 -10 -15 // 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 BL 周 40 最小平方平均值基于混合模型重复测量(MMRM),包括剂量组、基线值、访问和访问剂量组 * 不包括因白内障而失去信件的每剂量中的1名参与者 ** 不包括因白内障而失去信件的1名参与者 数据截止:LUNA 2024年8月29日 平方均数变化 BCVA 平方均数变化 BCVA (95% CI)(95% CI)

75%的6E10患者在治疗负担较小的情况下无需注射 有限治疗经验的患者在前一年内注射次数≤6次 平均注射速率: 4.7 Ixo-vec LUNA 52周总体结果 6E10 2E11 (N = 13) (n = 4) (n = 9) 无需注射 69% 75% 67% ≤1次注射 92% 100% 89% ≤2次注射 92% 100% 89% 只有一名患者需要在第52周时进行补充注射。 第-52周 第-26周 研究周 第26周 第52周 第91周 Aflibercept 未进行补充注射 根据方案进行补充注射 Ranibizumab Faricimab Bevacizumab 其他 提前终止 41剂药物被汇总到游泳通道图中,以维护正在进行的双盲研究中的掩盖调查者。 提前终止的患者不包括在注射计算中。 [注射免费率 = (总队列 - 提前终止患者 - 被救助患者) / (总队列 - 提前终止患者) * 100] 有限经验的患者:在接受Ixo-vec治疗前至少一年被确诊。 数据截止日期: 2024年8月29日有限 参与者≤6次注射(N=13)

临床更新凸显Ixo-vec的潜在最佳类别 产品概况 • 潜在的最佳类别产品概况 在超过80%注射负担减少和超过50%注射自由的基础上保持视觉和解剖终点 • 超过4年的跟踪,安全边际高达10倍 • OPTIC 2E11患者在第1年至第4年无炎症 • LUNA 6E10患者在52周或任何随访时段均无炎症 良好的局部预防安全概况 注册试验的去危险化剂量和预防性方案 42 无炎症:没有≥ 1 AC/V细胞。 OPTIC 2E11参与者在第2.5年有炎症,在OPTIC EXt开始附近进行了白内障手术。 数据截止日期:2024年8月21日(OPTIC),2024年8月29日(LUNA)

Ixo-vec关键计划

Ixo-vec湿性AMD广泛患者人群关键计划 旨在最大化临床、监管和商业成功的概率 5年以上的临床经验 Ixo-vec 全球关键计划 广泛湿性AMD 10倍安全人群边缘 § 两个双盲随机的第3期试验 Ixo-vec § 与标签上的aflibercept非劣效设计第3期 § ARTEMIS美国研究基于EOP2反馈 受到监管机构严格的建议 § 该研究将在美国和美国以外地区进行 全球KOL(Knowledge Organization Leader学问组织领袖) 解决未满足的需求和患者 偏好 44

ARTEMIS第3阶段湿性 AMD 研究设计 非劣效试验设计,旨在实现监管批准并推动商业成功 在广泛人群中进行随机、双盲的On-Label Aflibercept对照第3阶段试验 目标 证明Ixo-vec 6E10单次眼内注射能够达到与官方推荐的 aflibercept 相当的视觉结果,同时显著减少治疗负担 试验设计 终点 主要终点 • 在美国进行的双臂非劣效试验 • Ixo-vec 6E10 从基线到 第52周和第56周的Aflibercept 对照 2mg q8W 的最终变化平均值 • 284例湿性 AMD 的治疗初次和已治疗患者 • 用于掩盖效应的皮下注射 次要终点 • 一年主要终点设定为 -4.5治疗负担 缩减的非劣性边际 45

ARTEMIS第3阶段湿性 AMD 研究设计 针对抗VEGF反应的广泛目标患者群 重要的纳入标准 治疗初次和已治疗的湿性 AMD BCVA:抗VEGF反应性: 35 - 78个字符 两次 aflibercept 装载剂后 -8 -4 D1 1 4 8 12 16 20 24 28 32 36 40 44 48 52 56 104 周 Ixo-vec 6E10 n = 142 Aflibercept 2mg (Q8w) n = 142 基线反应 随机化 主要终点 Ixo-vec 眼内注射 如符合条件,则进行假操作或补充注射 Aflibercept 眼内注射 如符合条件,则进行补充注射 安慰剂

ARTEMIS第3阶段湿性 AMD 研究设计 患者在3次 aflibercept 装载剂后随机分组,并每4周评估一次疾病活动 关键的纳入标准 治疗初次和已治疗的湿性 AMD BCVA:抗VEGF反应性: 35 - 78个字符 两次 aflibercept 装载剂之后 Difluprednate 预防 措施 -8 -4 D1 1 4 8 12 16 20 24 28 32 36 40 44 48 52 56 LTFU 周 Ixo-vec 6E10 n = 142 Aflibercept 2mg (Q8w) n = 142 基线反应 随机化 根据预先确定的标准进行补充 aflibercept 注射,以保护 主要终点的掩盖,以及主要和次要终点 Ixo-vec 眼内注射 如符合条件,则进行假操作或补充注射 Aflibercept 眼内注射 如符合条件,则进行补充注射 安慰剂 旨在最大化临床、监管和商业成功的概率 长期随访

患者偏好调查

预先指定的患者偏好调查 旨在了解患者需求和商业潜力“...患者偏好指的是患者对健康的看法、期望和目标,以及评估每种治疗方案的潜在益处、危害和成本所涉及的过程...”•患者偏好和直接向患者的广告开始推动新型湿性年龄相关性黄斑变性疗法的采纳,Vabysmo的“开启你的世界”活动为超过40亿美元的年销售额做出了贡献。•在LUNA研究中,Adverum的预先指定的患者偏好调查询问患者是否更喜欢Ixo-vec而不是他们之前接受的静注治疗,预防是否易于管理,以及患者是否会向家人或朋友推荐Ixo-vec。 49来源:Montori Vm等人 决策与患者,循证临床实践手册2008年。

超过90%的患者更喜欢Ixo-vec而不是目前的标准治疗 LUNA预先指定的患者偏好调查52周结果 您是否更喜欢Ixo-vec疗法 是否想接受Ixo-vec 是否愿意 把我推荐给你家人或朋友 如果你的 在你的另一只眼睛中,在你家人或朋友 如果他们接受 对待湿性年龄相关黄斑变性的治疗 湿性年龄相关性黄斑变性湿性年龄相关性黄斑变性湿性年龄相关性黄斑变性? 5% 4% 7% 95 % 96% 93% 总研究 总研究 总研究 (n = 56) (n = 56) (n = 56) 是 否 50 Adverum在LUNA进行了预先指定的患者喜好调查 数据截取:LUNA 2024年8月29日

眼部顶点类固醇滴眼液容易或非常容易管理 LUNA预先指定的患者偏好调查52周结果 您接受的类固醇治疗易于管理吗? 5% 5% 13% 35% 60% 88% 95% Difluprednate Ozurdex +口服泼尼松 +仅Difluprednate Difluprednate +/- Ozurdex(n = 20)(n = 16)(n = 20) 容易或非常容易管理 未决定 较难或非常难管理 51 Adverum在LUNA进行了预先指定的患者偏好调查 数据截取:LUNA 2024年8月29日

100%的Ixo-vec 6E0 +类固醇滴剂比标準治疗更受青睐 LUNA预先指定的患者偏好调查52周结果 您是否更喜欢Ixo-vec疗法 是否想要接受Ixo-vec 是否愿意 将我推荐给你家人或朋友 如果你的 治疗湿性年龄相关性年龄相关性黄斑变性的湿性年龄相关性黄斑变性湿性年龄相关性黄斑变性的疗法湿性年龄相关性黄斑变性,湿性年龄相关十黄斑变性湿性年龄相关十黄斑变性湿性年龄相关十黄斑变性 药物(n = 10)(n = 10)(n = 10) 52 是 否 Adverum在LUNA进行了预先指定的患者偏好调查 数据截取:LUNA 2024年8月29日

商业机会

全球湿性年龄相关性黄斑变性市场机会规模庞大并且不断增长,医生和患者 embrace 创新,是数十亿美元的市场机会,是老年人视力损失的主要原因,增长受老龄化人口和产品创新推动。全球湿性年龄相关性黄斑变性销售额2000万 150万约为130亿美元,全球患者大约有9亿美元 6亿美元 20万,美国每年诊断的患者多达42%,在最初诊断后2-3年内有多达42%的患者发展为双侧疾病。2015年、2025年E、2035年E。数据来源:Bright Focus Foundation. Age-Related Macular Degeneration: Facts & Figures.; Wong WL, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health. 2014;2:106–16.; Gangnon RE et al. (2015) JAMA 眼科,133 (2): 125–132.; 2023 Cowen Equity Research – Therapeutic Categories Outlook.; 公司估计。

Ixo-vec准备改变对待湿性年龄相关性黄斑变性的方式,潜力产品介绍旨在满足关键利益相关者的需求,无缝的患者强大和新兴可预测的实践偏好持久的安全配置文件产品概况功效概况集成和影响•持续视力•没有新发病迹象•IVt给药•减少患者停药•过去30周的炎症•持久的解剖•整合进临床•持续的长期视力提高•炎症是罕见的,练习,手术和对于患者的模型•治疗负担减轻•>50%注射•易管理•较少的诊疗•93%偏好•优于过去的自由类固醇眼药水IVt注射患者&•常规视网膜检查•终身持续视力•100%称多种注射为易或非常易管理•潜力•降低医疗系统负担,并且以经济有效的方式支付者•通过只需一次注射,最大限度地提高投资回报,以保持长期视力基于LUNA和OPTIC数据呈现的预期结果以及公司对做法和支付者将如何演变为改变的范式的预期。

潮湿性AMD的市场领导可能需要最佳类别的特征,首先在难治患者中取得成功,年度注射负担(IRIS注册表,加权平均)随时间采用>9次注射 7-9次注射 4-6次注射 1-3次注射早期采用者随后扩展难治患者较轻患者56参考来源:Wykoff CC,Garmo V,Tabano D等,眼科学 2023;4(2):100421。患者比例

潮湿性AMD可能是基因疗法的第一个大市场适应症市场流行病学经济环境高市场紧迫情况预计需要采用疾病普遍性定价在大可寻址性人群中视力无法保持低每患者成本真实世界显示早期采用市场上市面临的挑战突发病成本每年较少有效发生率COGS治疗,新患者,双侧>1000倍低剂量,比Aflibercept持续释放更大,通过体内基因治疗逐步增长的疾病,成为一种超级畅销抗VEGF大人群年龄1使用在超过7000万次注射57 1 https://investor.regeneron.com/news-releases/news-release-details/eylea-hdr-aflibercept-injection-8-mg-data-euretina-reinforce

CMC定位支持关键项目和商业规模扩张Ixo-vec目前在商业规模制造,全球CDMO处于商业规模制造阶段支持健全的监管CMC投入所有Ixo-vec第3阶段材料已制造成本效益的Sf9悬浮工艺使生物样COGS 58

KOL小组

KOL小组与主要视网膜专家讨论LUNA和OPTIC结果,以及关键试验设计调解员 Charles C. Wykoff, MD, PhD 研究主任,德克萨斯视网膜顾问 Star Seyedkazemi,药剂博士 首席开发官 Szilárd Kiss,医学博士 Mark Barakat, MD 眼科学杰出教授,临床研究主任 视网膜服务主任 阿利桑那州视黄斑协会康奈尔大学 Adverum 董事会成员 60

结论与要点

在难治患者中的治疗负担减少最显著的是从6个月到>4年注射负担的年降幅95% 92% 90% 89% 88% 86% 86% 85% 84% 84% 81% 81% 80% OPTIC(2E11)76% 71% LUNA(6E10)68% LUNA(2E11)RGX-314 SCS(2.5E11)RGX-314 SCS(5E11)RGX-314 SCS(1E12)4D-150(1E10)4D-150(3E10) 月 6 年:1 2 3 4 在湿性AMD的静脉内和视网膜下基因治疗中; 排除了ABBV-RGX-314视网膜下。 ABBV-RGX-314 SCS在AAVIATE(注:56名受试者中有21名接受1E12剂量的增强剂在第4周,未包括在RGX-314后的平均年注射次数中。 RGX-314数据截至2024年2月3日。最新可用的4D-150 PRISm第2a剂量拓展队列数据截至2024年9月18日(1E10剂量的第1/2a阶段因未单独报告而不包括)62 数据基于跨试验比较,并不基于头对头临床试验。跨试验比较在本质上有限,可能表明结果的相似性或差异有误导性。头对头比较的结果可能与这里提出的结果有显著不同。数据截止日期:OPTIC 2024年8月21日,LUNA 2024年8月29日
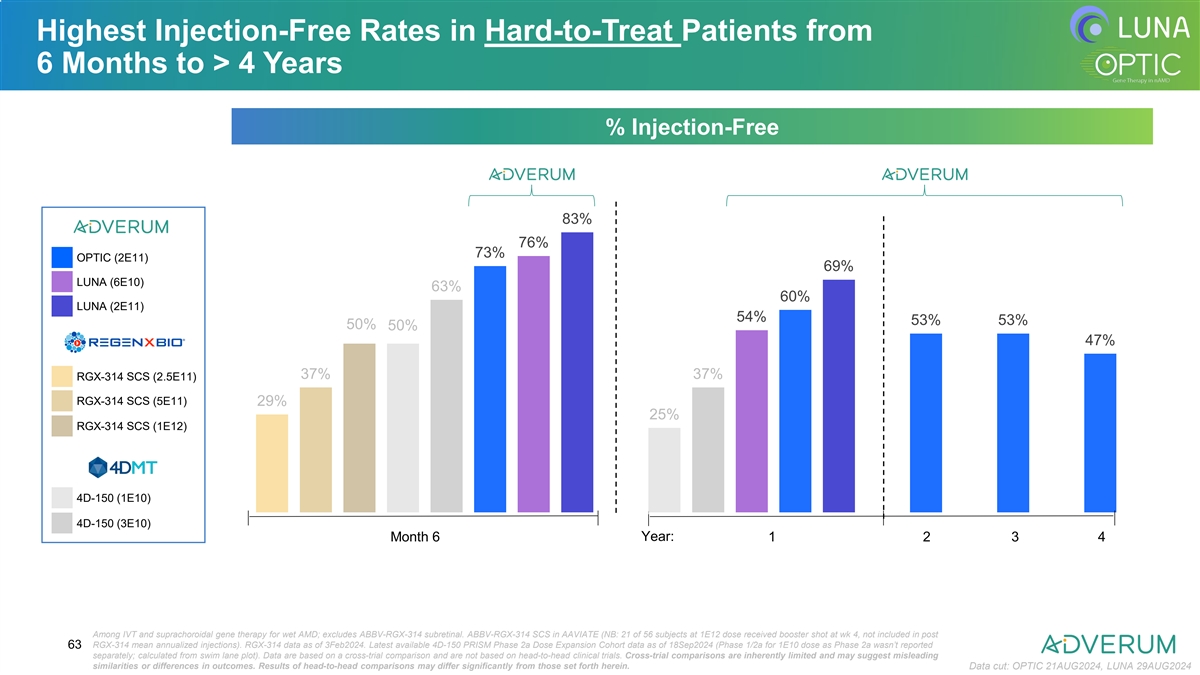
在6个月至4年内,难治疗患者中的最高无注射率% 无注射率 83% 76% 73% OPTIC (2E11) 69% LUNA (6E10) 63% 60% LUNA (2E11) 54% 53% 53% 50% 50% 47% 37% 37% RGX-314 SCS (2.5E11) RGX-314 SCS (5E11) 29% 25% RGX-314 SCS (1E12) 4D-150 (1E10) 4D-150 (3E10) 6年内的第6个月和第1年:1 2 3 4 针对湿性AMD的IVT和葸膜下基因治疗;不包括ABBV-RGX-314次视网膜下注射。 ABBV-RGX-314 SCS在AAVIATE(NB:在1E12剂量中,56名受试者中的21名在第4周接种了增强剂量,不包括在发帖RGX-314平均年化注射中)。 RGX-314数据截至2024年3月3日。最新可用的4D-150 PRISm 2a期剂量扩展队列数据截至2024年9月18日(1E10剂量的1/2a期作为2a期未单独报道;从游 泳道图中计算)。 数据基于交叉试验比较,并不基于头对头的临床试验。交叉试验比较固有地有限,可能会显示出具有误导性的相似性或差异性的结果。头对头比较的结果与此处设定的可能大不相同。 数据截至2024年8月21日:OPTIC,2024年8月29日:LUNA

5年以上的临床经验确立10倍安全边际 Ixo-vec 6E10,伴随延长预防措施降低3期和商业化的风险 6E11 3期剂量 N=15 ü 增强的安全性概况 ü 延长糖类皮质激素预防措施 ü 潜在的最佳效能概况 2E11 2E11 N=15 N=30 6E10 N=30 4年以上的临床数据 64 数据截至2024年8月21日:OPTIC,2024年8月29日:LUNA 剂量(vg/眼)10倍安全边际

可靠的益处和可预测的安全性使真正的范式转变成为可能 4年的OPTIC和52周的LUNA数据强调了Ixo-vec的概况 展示了可靠的长期益处 78% 的患者从第一年开始无注射并保持到第四年 88% 的患者从第二年开始无注射并保持到第四年 展示了具有局部预防的可预测的安全概况 在30周后没有新的炎症发作 100% 的炎症在第一年前得到解决 65 无炎症:没有≥1 AC/VC细胞;OPTIC结果指2E11剂量 数据截至2024年8月21日:OPTIC,2024年8月29日:LUNA

Ixo-vec的去风险化III期和商业模式临床更新突显了Ixo-vec潜在的一流产品特性 • 潜在的一流产品特性在难治患者中享有50%以上的无注射率和80%以上的治疗负担减轻率 • 安全边际是10倍,随访超过4年 • OPTIC 2E11患者在第1年至第4年没有发炎反应 • LUNA 6E10患者在52周及后续访问期间没有发炎反应,利用局部预防,具有良好的安全性 • LUNA患者调查表明,患者对Ixo-vec拥有广泛的6E10 EOP2 284 1H25 ARTEMIS患者人群美国研究,纳入了患者,预计III期III期试验激素滴眼FDA反馈启动66 没有发炎:没有≥1个AC/VC胞; OPTIC 2E11参与者在OPTIC EXt.开始之初进行了近视白内障手术; EOP2: 第二阶段会议数据截取:OPTIC 2024年8月21日,LUNA 2024年8月29日

问答

问题与回答环节 Laurent Fischer, MD Rabia Gurses Ozden, MD Star Seyedkazemi, PharmD 总裁兼首席医学官 首席开发官 首席执行官 Linda Rubinstein Mike Zanoni Jason Mitchell Peter Soparkar 首席财务官 投资者关系主管 首席商务官 首席运营官 Mark Barakat, MD Szilárd Kiss, MD Charles C. Wykoff, MD, PhD 临床研究主任 眼科医疗著名教授,亚利桑那州黄斑学研究所研究主任 视网膜服务主任 视网膜顾问 托马斯大学 Adverum 董事

www.adverum.com如有其他问题,请联系:IR@adverum.com® 保护生命的视力

附录 IVt 湿性黄斑变性基因治疗

LUNA & OPTIC研究布局 90名患者参与了LUNA & OPTIC试验 LUNA OPTIC 参与者布局 合计参与并接受Ixo-vec治疗的参与者总数 60 30 完成52周访问的参与者数量 57 30 参与开放标签延长试验的参与者数量 - 23 完成第4年访问的参与者数量 - 21 Ixo-vec给药后退出的参与者数量 3 7 第52周访问时 3 0 第4年访问时 - 7 停止治疗的原因(与Ixo-vec无关) 不相关的不良事件(包括死亡) 3 3 失访/撤回同意 - 4 71 数据截取:OPTIC 2024年8月21日,LUNA 2024年8月29日

治疗经验不足与治疗经验丰富的抗血管内皮生长因子反应:初始两剂治疗后相似最佳矫正视力轨迹,治疗经验丰富 10 15 8 10 5 6 0 -5 4 -10 2 -15 0 4 8 12 16 20 24 28 32 36 40 0 0 4 8 12 16 20 24 28 32 36 40 44 48 周 周 6 15 5 4 10 3 2 5 1 0 0 -1 4 8 12 16 20 24 28 32 36 40 44 48 基线 4 8 12 16 20 24 28 32 36 40 44 48 52 周 周 72 Heier等人,第3阶段,多中心,随机,双盲,活性对照研究,评估法利西替单抗和抗肝生长因子融合蛋白在新生血管性年龄相关性黄斑变性患者中的疗效和安全性,2021年血管新生2021虚拟大会。艾乐雅注射EYLEA HD【说明书】,2023年。Holekamp等,眼科医学。2022年;129(3):295-307. Khanani等人。眼科医学。2022年;129(9):974-985 PULSAR卢塞恩(艾乐雅高清)(VABYSMO),矫正后平均最佳矫正视力变化 矫正后最佳矫正视力变化(ETDRS字母)(字母) MERLIN ARCHWAY(贝欧坞)(SUSVIMO),最佳矫正视力变化的均数 自矫正的最佳矫正视力变化(ETDRS 字母) 基线(字母)

高疾病负担患者中的CSt维持 拥有基线CSt >300 μm的患者:在≤300 μm处的维持,52周时与基线相比的平均CSt变化,μm(95% CI) 150 LUNA 基线CSt ≤300μm(n=27) LUNA 基线CSt >300μm(n=33) 2.9(-14.3,20.2) 基线≤300 μm 100 6E10 9.2(-24.6,43.0) 基线≤300 μm 50 2E11 -3.4(-17.9,11.1) 0 基线≤300 μm -50 -34.4(-64.9,-3.9) 基线>300 μm 6E10 -100 -35.5(-83.3,12.3) 基线>300 μm -150 // 2E11 基线 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 -33.3(-77.6,10.9) 基线>300 μm 周 基线 子组CSt ≤300 µm CSt >300 µm 平均CSt,μm(SD) 269.9 (18.7) 416.6 (119.1) 数据截至:LUNA 2024年8月29日 自基线的平均CSt变化,μm(95% CI)

两个剂量下的稳定眼压 随时间变化的平均眼压 6E10 30 6E10 研究眼 6E10 同侧眼 25 20 15 10 5 0 // 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 BL Week 2E11 2E11 研究眼 2E11 同侧眼 30 25 20 15 10 5 0 // BL 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 周 74 数据截至:LUNA 2024年8月29日 平均(SD)眼压mm 平均(SD)眼压mm 水银柱 水银柱

LUNA整体人口:6E10剂量下的炎症频率 52周或任何随访中,没有患者出现炎症。剂量逐渐增加导致的时间点上的炎症频率:6E10 2E11 LUNA LUNA 30 30 25 25 20 20 15 15 10 10 5 5 0 0 0 2 4 6 8 1012141618202224262830323436384042444648505254565860626466 0 2 4 6 8 10121416182022242628303234363840424446485052545658606264 65 66 65 * 周次 周次 细胞 ≥1+ ≥1+ 75 AC, 前房眼底细胞; VC, 玻璃体细胞。根据前房细胞的标准化(SUN)和国立卫生研究院有关玻璃体细胞的指南,细胞等级经过裂隙灯检查,分类标准:AC:0.5+:1-5细胞 1+:6-15细胞 2+:16-25细胞 3+:26-50细胞 4+:>50细胞; VC:0.5+:1-10细胞 1+:11-20细胞 2+:21-30细胞 3+:31-100细胞 4+:>100细胞; 分析中罕见细胞标记为0.5+,*。 *研究早期修订方案,从第4周开始加入地氟普利醇,以配合地氟普利醇疗程的逐渐减少;如果在第4周后开始使用地氟普利醇,地氟普利醇可能根据研究者和医学监察员的决定进行调整(6名参与者未作为预防措施接受地氟普利醇)。据统计数据显示:LUNA 2024年8月29日参与者数量统计

案例研究:Ixo-vec 2E11减少了液体和中心亚区厚度(CST)的波动 90岁女性,在接受Ixo-vec治疗前的12个月内接受了9次视網膜內注射,之前进行过56周的Aflibercept Q5W治疗,与Ixo-vec进行基线前的-2周。 90 BCVA:53个字 CST:358µm 80 70 第0天 60 Ixo-vec治疗 50 40 0 1 2 3 年 600 500 400 300 200 100 -1 2 3 0 1 -55 -43 -31 -19 -7 5 17 29 41 53 65 77 89 101 113 125 137 149 161 173 年 基准线 抗VEGF注射研究访问,无需额外注射 统计数据显示:OPTIC 2024年8月21日 CSt(µm) BCVA(ETDRS)

案例研究:Ixo-vec 2E11减少了液体和中心亚区厚度(CST)的波动 90岁女性,在接受Ixo-vec治疗前的12个月内接受了9次视网膜内注射,之前进行过56周的Aflibercept Q5W治疗,100%没有接受过抗VEGF注射,Ixo-vec治疗基线前的-2周。 90 BCVA:53个字 CST:358µm 80 70 第0天 60 Ixo-vec治疗 50 9个月 40 0 1 2 3 BCVA ∆:+18个字 年 CSt ∆:-127µm Ixo-vec 1年 600 BCVA ∆:+16个字 500 CSt ∆:-132µm 400 2年 300 BCVA ∆:+5个字 200 CSt ∆:-93 µm 100 -1 2 3 2.2年 0 1 -55 -43 -31 -19 -7 5 17 29 41 53 65 77 89 101 113 125 137 149 161 173 年 BCVA ∆:+13个字 CSt ∆:-135µm 77 研究基线 抗VEGF注射研究访问,无需额外注射 统计数据显示:OPTIC 21AUG2024 CSt(µm) BCVA(ETDRS)
