
99.1展品 保留® 終身視力網絡研討會呈現52周 LUNA和4年OPTIC結果以及關鍵項目th November 18 , 2024

前瞻性陳述本文檔中以及任何 附帶演示有關未來可能發生的事項、事件、統計數據或臨床或財務結果的陳述是《1995年私人證券訴訟改革法案》的「前瞻性陳述」。 此類陳述包括但不限於對Ixo-vec作爲溼性AMD治療的潛在好處的陳述,包括潛在的最佳產品特性、臨床活性、有利的安全性概況和長期 受益; 與Adverum的產品候選者、臨床研究和試驗(包括Ixo-vec第3期關鍵項目的試驗設計和預計啓動時間)以及監管申報相關的計劃和里程碑; Adverum的產品候選者的治療 和商業潛力; 對Ixo-vec市場規模的預期; Ixo-vec改變溼性AMD患者治療範式的潛力; Adverum的現金充裕性和 持續時間; 以及其他包含「預期」、「可能」、「潛在」、「將」等表達的陳述,所有這些都是基於Adverum在當前條件下所做的某些假設 、預期未來發展和Adverum認爲適當的其他因素。 Adverum可能不會按時實施任何這些計劃或這些產品、臨床開發、工藝開發、製造或監管目標,也可能不會在 時間充足,或完全執行或實現其前瞻性陳述中披露的意圖或達到預期或披露的預測,並且您不應過分依賴這些前瞻性陳述。 實際結果和 事件的時間可能會因各種風險和不確定性而與這些前瞻性陳述中預期的結果不同,這些風險和不確定性包括但不限於,Adverum的資源是否足夠 用於進行或繼續計劃的發展項目和計劃的臨床試驗,Adverum的臨床試驗的初步或中期數據可能隨着更多患者數據的出現而發生變化, Adverum的臨床研究中患者招募或用於此類臨床研究的產品的製造可能會有延遲的風險,產品開發和監管審批過程中天生的風險和不確定性, Adverum是否能夠成功地開發、製造或商業化其任何產品候選者,以及Adverum是否將延遲收到或無法收到所需的監管審批。 Adverum面臨的附加風險和不確定性 在Adverum的證券交易委員會(SEC)的申報和報告中以及Adverum最近一份年度報告10-k中的標題「風險因素」及其他地方中設置, 至於2023年12月31日結束的年度報告,已於2024年3月18日向SEC申報,以及我們隨後提交的每份季度報告10-Q,以及其中所反映的任何內部修訂 SEC的後續申報。 本文件包含,並且任何附帶演示中可能包含,關於Adverum的行業、業務和 某些藥物市場的估計、投影和其他信息,包括涉及那些市場估計規模、其預計增長率及某些醫療條件發生率的數據。基於估計、預測、投影或類似方法 的信息固有地會受到不確定性的影響,實際數額可能會與該信息中反映的數額有實質性差異。 除非另有明確聲明,Adverum獲得該行業、業務、市場及其他數據 基於第三方準備的報告、研究調查、研究以及類似數據、行業、醫學和一般出版物、政府數據和相似來源,Adverum相信該等信息可靠, 但該信息的準確性或完整性不受保證,並且不應被理解爲Adverum所作的陳述。

今天的議程 歡迎詞及關鍵摘要 患者偏好調查 01 05 萊昂特·菲舍爾, 醫學博士 萊昂特·菲舍爾, 醫學博士 總裁兼首席執行官 總裁兼首席執行官 Ixo-vec及溼性AMD商業機會 02 06 萊昂特·菲舍爾, 醫學博士 傑森·米切爾 總裁兼首席執行官 首席商務官 4年OPTIC和52周 03 07 KOL專家小組 LUNA結果 主持人:斯塔·塞義德·凱澤米, 藥學博士 斯塔·塞義德·凱澤米, 藥學博士 首席發展官 首席發展官 主要關鍵項目元素 04 結論及問答 08 羅米亞·古爾斯·奧茲頓, 醫學博士 Adverum管理公司 首席醫學官 3

Adverum 參與者 萊昂特·菲舍爾, 醫學博士 羅米亞·古爾斯·奧茲頓, 醫學博士 斯塔·塞義德·凱澤米, 藥學博士 總裁暨首席醫學官 首席發展官 首席執行官 林達·魯賓斯坦 邁克·扎諾尼 傑森·米切爾 彼得·索帕卡 首席財務官 投資者關係負責人 首席商務官 首席運營官 4

關鍵意見領袖參與者 S.HasKey 提斯, 醫學博士 查爾斯·C. 懷卡夫, 醫學博士, 博士 馬克·巴拉卡特, 醫學博士 眼科學傑出教授, 研究主任, 臨床研究主任 視網膜服務主任 德州視網膜顧問 視網膜黃斑研究所 康奈爾大學 Adverum 董事會成員 5

要點摘要

Ixo-vec的第三期和市場規模 臨床更新突顯 Ixo-vec 的潛在最佳產品特性 • 潛在最佳產品特性 在難治患者中注射免費率超過 50%、治療負擔減少率超過 80% • 超過 4年追蹤,安全保障 10倍 • 在OPTIC 2E11患者中, 第1年至第4年未出現炎症 • 在LUNA 6E10患者中, 52周及隨訪無炎症 有利的地方預防安全概況 • LUNA患者調查 表明患者強烈偏好 Ixo-vec Broad 6E10 EOP2 284 1H25 ARTEMIS 患者群體 配合美國局部研究,融入患者 預期第三期 第三期試驗 類固醇滴眼劑 FDA意見 啓動 7 無炎症:無1 AC/V細胞及以上;OPTIC 2E11 參與者第2.5年出現炎症, 在OPTIC ExT開始附近進行了白內障手術;EOP2:第2期結束會議 數據截至:OPTIC 2024年8月21日,LUNA 2024年8月29日

5年以上的臨床經驗建立了10倍的安全邊際 Ixo-vec 6E10,通過延長預防期減輕了第3階段的風險及商業化 6E11 N=15 2E11 N=15 4年以上的臨床數據 8數據截止日期: 2024年8月21日視網膜鳥 OpTic18, 2024年8月29日 LuNa30 劑量 (vg/眼) 10倍的安全邊際

5年以上的臨床經驗確立了10倍安全邊際 Ixo-vec 6E10,通過延長預防期減輕了第3階段的風險和商業化 6E11 第3階段劑量 N=15 提升的安全性能 延長的類固醇預防性能 可能是最佳的臨床療效連續性 N=30 6E10 N=30 4年以上的臨床數據 9數據截止日期: 2024年8月21日視網膜鳥 OpTic18, 2024年8月29日 LuNa30 劑量 (vg/眼) 10倍的安全邊際

6E10 劑量選擇最大化了第3階段和商業成功,展示了潛在的最佳產品概況受益安全治療負擔 % 接受 ≤1次注射 無需注射的 % 具有AC≥1+ 第3階段繼續下去的劑量減少類固醇用於IOI 6E10 88% 75% 54% 0% 4% (n = 28) N=1 2E11 92% 79% 69% 3% 7% (n = 29) 2E11 84% 73% 60% 0% 27% (n = 15) 6E11 97% 87% 87% 0% 60% (n = 15) 通過增強安全性能對關鍵研究的6E10進行潛在最佳的臨床活性 對初步的OPTIC和LUNA的前52周測得的成果進行了10項收益比較 對於OPTIC和LUNA 52周測得的安全性來對比了數據截止日:2024年8月21日視網膜鳥, 2024年8月29日 LuNa30

可靠的受益和可預測的安全概況使真正的模式變更發生 4年的視網膜鳥和52周的 LuNa 數據突顯了 Ixo-vec的概況 顯示出可靠的長期受益 78%的患者在第1年沒有注射的情況下到第4年仍然免注射 88%的患者在第2年沒有注射的情況下到第4年仍然免注射 顯示出可預測的安全概況,伴隨着延長的局部預防措施 在第30周後沒有新的發炎 100%的炎症在第1年解決了 11 無炎症 :無 ≥ 1個AC/V細胞 ; OPTIC結果參見2E11劑量 數據截止日期:2024年8月21日視網膜鳥, 2024年8月29日 LuNa30

Ixo-vec & 溼性AMD

龐大而不斷增長的全球市場機會溼性AMD 醫師和患者歡迎創新 溼性年齡相關性黃斑變性的多億美元市場機會 是老年人造成視力損失的主要原因 隨着人口老齡化和產品創新的增長 推動全球溼性AMD銷售 2000萬 150萬 約130億美元 美國患者 全球範圍內約90億 約60億 約20萬 美國患者每年診斷 高達42%的患者在首次診斷後2-3年內發展雙眼疾病 2015年 2025年E 2035年E 參考資料:明亮聚焦基金會. 年齡相關性黃斑變性:事實和數字.;Wong WL等.年齡相關性黃斑變性的全球患病率和2020年和2040年疾病負擔預測:系統綜述和薈萃分析. 《柳葉切》,2014;2:106-16.;Gangnon RE 等(2015) JAMA 眼科學, 133 (2):125-132;2023年 Cowen Equity Research – 治療類別展望.;公司估計.

真實世界視力由於慢性治療不足而下降10 5 0 IRIS(N>160,000) -5 HORIZON (N=600) Gilles, al (N=1,212) CATt (N=647) -10 SEVEN-UP (N=65) -15 0 1 2 3 4 5 6 7 年 達到 ~40% 在2年內停止抗VEGF治療的人數,達到57%在5年內停止 Sources: https://futureofvision.global/home/the-reality-of-retinal-disease.html。 改編自 Singer MA 等人。眼科學。2012;119(6):1175-1183。 改編自 Gillies MC 等人。眼科學。2015;122(9):1837- 14 1845。 改編自年齡相關性黃斑變性治療試驗(CATT)研究組,Maguire MG,等人 Ophthalmology。2016;123(8):1751-1761。 改編自Rofagha S,等人。 Ophthalmology。2013;120(11):2292-2299。 Wykoff CC,Garmo V,Tabano D,等人,Ophthalmol Sci。2023;4(2):100421。 從基線平均函改變

真實世界視力由於慢性治療不足而下降 Ixo-vec旨在輸送穩定的阿非利班以保持長期視力 Ixo-vec 10 5 0 IRIS (N>160,000) -5 HORIZON (N=600) Gilles, al (N=1,212) CATt (N=647) -10 SEVEN-UP (N=65) -15 0 1 2 3 4 5 6 7 年 達到 ~40% 在2年內停止抗VEGF治療的人數,達到57% 在5年內停止 15 * Ixo-vec的潛在長期視力結果 Sources: https://futureofvision.global/home/the-reality-of-retinal-disease.html。 改編自 Singer MA 等人。眼科學。2012;119(6):1175-1183。 改編自 Gillies MC,et al。 Ophthalmology。2015;122(9):1837-1845。 改編自年齡相關性黃斑變性治療試驗(CATT)研究組,Maguire MG,et al。 Ophthalmology。2016;123(8):1751-1761。 改編自Rofagha S,et al。 Ophthalmology。2013;120(11):2292-2299。 Wykoff CC,Garmo V,Tabano D,et al,Ophthalmol Sci。2023;4(2):100421。 從基線平均函改變

治療不足常常是由於治療障礙所致 醫師ASRS 調查強調對更持久治療的需求 治療障礙需要更持久的治療選擇 醫師調查:治療溼性AMD和DME的未滿足需求 注射恐懼性合併疾病 74% 更持久 79% 55%改善視力 50%漏打注射 58%較長的VEGF抑制 47% 46%穩定解剖學 生活事件 交通工具不足 30% 美國和國際上 Ixo-vec 可能通過輸送穩定的阿非利班來解決溼性AMD的未滿足需求 16 Hahn P,編。ASRS 2023偏好和 趨勢會員調查芝加哥,伊利諾伊州。視網膜專家協會;2023。

Ixo-vec定位爲轉變治療模式, 相比之下, 第二代溼性年齡相關性黃斑變性(AMD)治療只有漸進性進展, Ixo-vec旨在提供穩定並持續的注射可能的2024年美國免費營業收入4D-150(調查中)模式轉變Ixo-vec超過50%[已中止Q26W並重新推出]第二代Q8-Q16W16億美元第二代Q8-Q16W43億美元Q8W46億美元第一代Q4W2300萬美元Q12WQ26W1年2年5年以上17

Ixo-vec通過單次眼內注射傳遞抗血管內皮生長因子(VEGF)阿非利普汀, AAV.7 m8衣殼能夠將穩定的阿非利普汀水平輸送至視網膜AAV.7 m8 ILm神經節內核視杆細胞RPE IVt注射單體細胞膜環IV視網膜環IV.7 m8插入啓動子阿非利普汀PolyA AAV.7 m8:通過定向進化創建• 已工程化以用於眼內注射; 肽環使Ixo-vec 7 m8能夠穿越內限膜(ILM)• AAV.7 m8將阿非利普汀輸送至視網膜AAV.7 m8用於眼內基因治療CNV•在3個臨床項目中驗證了阿非利普汀分泌的IVt注射CNV的持久抑制•已發表於同行評議期刊18 Kh

4年OPTIC和52周LUNA結果

OPTIC首次人體試驗設計6E11和2E11與難治人群短期預防主要目標次要目標•視力維持(BCVA)長期安全性和有效性的Ixo-vec IVt在•解剖學(SD-OCT)治療經驗豐富的患者•需要補充療法第-15天至-7天:第1天:Ixo-vec2年安全性和有效性當前更新:5年安全性和有效性基線4年IVt阿非利普汀篩選2年OPTIC研究3年延長研究期皮質類固醇預防*皮質類固醇延長計劃的Ixo-vec劑量輔助阿非利普汀(2毫克IVT)標準:預防訪視隊集團1(n=6)6E11口服, 13天•從基線喪失≥10個字母BCVA(ETDRS)OR的視力,季度評估•CSt大於75μmOR的基線增加,隊集團2(n=6)口服, 13天2E11完成後•新視力威脅性出血由於AMD的2年OPTIC親本隊集團3(n=9)眼藥水,6周2E11研究•在初始輔助注射之後,接下來的注射隊集團4(n=9)眼藥水,6周6E11由研究者酌情給予20研究時間表非規模.*隊1和2的參與者在第3天從第-3天開始接受60毫克口服強的松酮,隨後, 爲期7天的緩慢減少;隊3和4的參與者在第1天開始接受QID地福普利(四次每日)3周的預防性暴露,隨後是爲期3周的減少. QID,四次每日. OPTIC:NCT03748784; OPTIC EXT:NCT04645212.數據截至日期:OPTIC 2024年8月21日

Ixo-vec的臨床前數據表明其在6E10劑量下具有最佳潛力 NHP研究表明穩定的aflibercept產量伴有較低的炎症 3個對數間的低於劑量成反比的aflibercept水平 低劑量下改善的炎症評分(無預防措施) 水瀦液中的Aflibercept水平 炎症評分 8 * 6 4 2 0 I I 車輛 3E10 1E11 2E11 4E11 6E11 2E12 6E12 2E13 NHP 3E10 1E11 2E11 4E11 6E11 2E12 6E12 2E13 NHP 車輛 3E10 1E11 2E11 4E11 6E11 2E12 6E12 2E13 劑量(vg/眼) 人類等效 車輛 6E10 2E11 4E11 8E11 1E12 4E12 1E13 4E13 人類等效 6E10 2E11 4E11 8E11 1E12 4E12 1E13 4E13 劑量(vg/眼) 劑量(vg/眼) * 縮放是兩個參數的累積,最高得分爲8。 21 Schaefer-Swale k. 非臨床數據支持ADVm-022每眼6E10 vg的人等效劑量用於治療新生血管性年齡相關性黃斑變性。 海報在ASGCt 2023年展出。 人類等效劑量(HED)大約是相應NHP劑量的兩倍,基於眼部容積。例如,2E11是1E11 NHP劑量的HED。 NOAEL在1E11 vg/眼的NHP劑量確定。 Aflibercept(ng/l) Hackett-McDonald峯值評分(AC + VC)

OPTIC的經驗教訓在LUNA第2期試驗中表明,LUNA的目標:優化Ixo-vec在關鍵試驗進入時的利益/風險優勢I目標二判斷第3期預防性劑量的最佳選擇第3期方案22

LUNA第2期試驗設計6E10和2E11,擴展預防措施適應難治患者多中心、雙盲、隨機、平行分組第2期研究 主要入選標準:對VEGF療法作出反應並接受活躍治療的CNV繼發nAMD(在入組前4個月內至少接受2次注射),研究眼視力範圍爲25-83 ETDRS字母 五年:第-21至-14天:第-7天:第1天: 26周: 52周: 基線 隨機 IVt Ixo-vec 主要終點 EXt 完成 中期分析 IVt Aflibercept 2mg 長期2E11(n=30)延長結束篩選期 6E10(n=30) 在第五年 皮質類固醇預防措施(劑後21+周) 皮質類固醇預防策略 補充注射標準 •Difluprednate 22周±積極 來自巴金德-麥克唐納的峯值得分(AC + VC)

OPTIC和LUNA所評估的人口統計和基線特徵爲難治患者。LUNA的參與者人數較多,OPTIC的人數較少。年齡及特徵數據如下:N = 30。平均年齡爲75.4歲(SD:8.2)、77.7歲(SD:7.4)、76.6歲(SD:7.8)、79.0歲(SD:7.3)。女性,人數分別爲16(53%)、18(60%)、34(57%)、15(50%)。種族數據爲:白種人27人(90%)、28人(93%)、55人(92%)、亞洲人2人(7%)、2人(7%)、4人(7%)、0人。研究眼部年齡相關黃斑變性(AMD)診斷平均年限爲3.0年(SD:2.9)、3.0年(SD:3.1)、3.0年(SD:2.9)、3.7年(SD:2.8)。前一年的抗血管內皮生長因子(VEGF)注射的年均數爲10.2次(1.7)、10.0次(3.3)、10.1次(2.6)、9.9次(1.9)。第1天(SD)。最佳矯正視力(Best Corrected Visual Acuity,BCVA)、ETDRS字母平均數爲72.9(SD:8.8)、71.8(SD:6.4)、72.3(SD:7.7)、65.4(SD:7.2)。黃斑中心厚度(Central Subfield Thickness,CSt)平均數爲360.6μm(SD:112.0)、340.5μm(SD:119.3)、350.6μm(SD:115.2)、397.0μm(SD:137.3)。晶狀體狀態:有11人(37%)、11人(37%)、22人(37%)、10人(33.3%)未知。數據截至日期:OPTIC 2024年8月21日,LUNA 2024年8月29日。

Ixo-vec注射後展示出持久的治療水平。持續的水溶性阿非利普汀水平長達5年。早期阿非利普汀水平與持續的長期蛋白質表達相關,10萬個NHP研究表明眼底的阿非利普汀水平可能是背景的7倍。LUNA(n=18)的阿非利普汀水平爲6E10,LUNA(n=13)爲6E10,OPTIC(n=7)爲6E11,OPTIC(n=10)爲2E11。時間軸爲0-5年。LUNA在第14周爲60位參與者中的31位畫出的阿非利普汀水平。LUNA已修改以停止採集玻璃體(眼內溼液)樣品。低於定量分析法水平(25ng/ml)的測量結果未顯示。NHP數據:Kiss, Szilárd等人,Molecular Therapy Methods & Clinical Development,第18卷,第345 - 353頁。數據截至日期:OPTIC 2024年8月21日,LUNA 2024年8月29日。

Ixo-vec注射後展示出持久的治療水平。使用6E10測量的持續性阿非利普汀水平爲1年。早期的阿非利普汀水平與持續的長期蛋白質表達相關。10萬個NHP研究表明眼底的阿非利普汀水平可能是背景的7倍。LUNA(n=18)的阿非利普汀水平爲6E10,LUNA(n=13)爲6E10,OPTIC(n=7)爲6E11,OPTIC(n=10)爲2E11。時間軸爲0-5年。LUNA在第14周爲60位參與者中的31位畫出的阿非利普汀水平。LUNA已修改以停止採集玻璃體(眼內溼液)樣品。低於定量分析法水平(25ng/ml)的測量結果未顯示。NHP數據:Kiss, Szilárd等人,Molecular Therapy Methods & Clinical Development,第18卷,第345 - 353頁。數據截至日期:OPTIC 2024年8月21日,LUNA 2024年8月29日。

Ixo-vec通過4年降低治療負擔,2E11顯示每年用藥抗VEGF注射減少80%以上, Ixo-vec後的年均值:第1年 | 2 | 3 | 4 | | | 前的年均值11 9.9 10 9 8 7 60% 53% 47% 53% 6無需注射無需注射無需注射無需注射5 81% 84% 84% 4 86% 3 1.9 1.6 1.6 2 1.4 1 0 參與者數2E11 N=15年均值(前)=(距離Ixo-vec過去12個月內的第一個IVT的天數)/(距離Ixo-vec到過去12個月的最後一個IVt的天數/ 365.25)。27年均值(後)=(自Ixo-vec以來的aflibercept IVT數量)/(自Ixo-vec到最後一次研究隨訪的天數/ 365.25)。分析包括OPTIC研究的所有參與者。數據截止日:OPTIC 2024年8月21日 抗VEGF注射的年均番數量(每位患者)

連續4年注射免除率 每年隨訪期間注射免除患者比例一致 無需注射 60% 53% 67% 73% 按年份劃分* OPTIC OPTIC EXt 2E11(n = 15)-1 0 1 2 3 4年 提前終止Aflibercept Bevacizumab Ranibizumab三聯治療 後續訪問沒有補充注射% 28 *第一個aflibercept注射後,可能根據醫生的意願進行補充注射。由於失訪、死亡或其他原因而終止的所有患者均包括在所有期間的計算中[ %注射免除=(總隊列-在該期間內獲救的患者)/(總隊列)* 100 ] 數據截止日:OPTIC 2024年8月21日

52周LUNA和OPTIC注射負擔減少保持一致 超過80%的抗VEGF注射年均減少,超過50%無需注射 前的年均值 後的年均值Ixo-vec: LUNA OPTIC 11 10.2 10.1 9.9 10 -88% -92% -84% 9 8 75% 79% 73% 7≤ 1注射≤ 1注射≤ 1注射6 54% 69% 60% 5無需注射無需注射 無需注射 4 3 1.6 2 1.3 0.8 1 0 6E10參與者至第52周2E11參與者至第52周6E10 2E11 2E11 N=30 N=30 N=28 N=29 N=15 29 年均值(前)=(距離Ixo-vec過去12個月內的第一個IVT的天數)/(距離Ixo-vec到過去12個月的最後一個IVt的天數/ 365.25)。年均值(後)=(自Ixo-vec以來的aflibercept IVT數量)/(距Ixo-vec到最後遵循分析期內的天數/ 365.25)。數據截至日:OPTIC 2024年8月21日,LUNA 2024年8月29日 抗VEGF注射的年均數量(每位患者)

潛在的最佳無注射比率52周LUNA數據顯示在難治患者中超過50%的無注射LUNA 52周整體6E10 2E11 (N = 57) (n = 28) (n = 29) 無注射61% 54% 69% ≤1次注射77% 75% 79% ≤2次注射89% 89% 90% -52周 -26周 研究周 26周 52周 91周 阿法利切普沒有給予補充注射協議外補充注射 綺騰注射法利晶注射別嘌醇注射其他提前終止 30個劑量在泳道圖中滙總以保持正在進行的雙盲研究中的研究者掩蓋。提前終止患者不包括在注射計算中。[%無注射 = (總隊列 - 提前終止患者 - 被救助患者) / (總隊列 - 提前終止患者) * 100] 數據截取:LUNA 29AUG2024 所有參與者 (N=60)

Ixo-vec保持BCVA和CSt通過4年的跟蹤展示了穩健和持久的活性OPTIC OPTIC EXt 90平均BCVA平均BCVA (90% CI)根據劑量隨時間的變化 (字母) 從基線到最後訪問的變化 (90% CI) -2.9 (-12.3, 6.5) 2E11 50 40 30 0 0 12 0 24 .5 36 48 1 60 72 1.5 84 96 2108 120 2 1.5 32 144 156 3 168 180 3.5 192 204 4 (N) 15 13 14 13 12 12 12 11 11均值CSt (90% CI)根據時間計算的不同劑量 平均CSt(μm)從基線到最後訪問的變化 (90% CI) 當2E11 250 200 150 100 0 0 4 00 12 24 0.5 36 48 1 60 72 1.584 96 1 208 120 12 32 .5 144 156 3 168 1803.5 192 204 4 (N) 15 13 13 12 12 11 12 11 12年 31 *白內障手術數據截取:OPTIC 21AUG2024 均值CSt μm (90% CI) 均值BCVA (90% CI)

Ixo-vec保持BCVA和CSt兩種劑量均展示了穩健和持久的活性,與OPTIC一致最小二乘均值最佳矯正視力 (BCVA) 隨時間按劑量變化52周,來自基線的LS均值BCVA變化6E10 (n=29) 2E11 (n=29) 52周時的字母 (95% CI) -2.1 (-4.8, 0.7) 6E10從基線時-1.8 (-4.6, 0.9) 2E11 // BL 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54周 最小二乘均值中心亞視網膜厚度 (CST) 隨時間按劑量變化52周,μm (95% CI) 150 LS均值CSt變化6E10 (n=30) 2E11 (n=30) 從基線時100字母 -10.2 (-29.0, 8.5) 6E10 -21.9 (-40.4, -3.3) 0 2E11 -50 // 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 BL周32最小二乘均值基於混合模型重複測量(MMRM)包括劑量組、基線值、訪問和訪問劑量組。*排除了每個劑量因白內障視力損失而有的參與者 數據截取:LUNA 29AUG2024 LS均值CSt變化 LS均值BCVA變化 (95% CI)μm (95% CI)

OPTIC 2E11在4年的時間內被100%的患者所耐受,所有在第1年發炎的患者炎症在後期得到緩解。OPTIC OPTIC EXt OPTIC 2E11 15個AC細胞≥1+ VC細胞≥1+ § 2E11在4個2E11年後的隨訪中通常被良好地耐受。炎症與劑量呈正相關,不影響視力,而且當存在時,對局部皮質類固醇有反應。* 0 12 24 36 48 60 72 84 96 108 120 132 144 156 168 18 * 0 192 204 § 從最高測試劑量的10倍安全邊際,可見2E11的長期安全數據在治療nAMD的過程中。短預防性方案涉及13天的口服潑尼松或6周的局部滴劑。*2E11參與者在第2.5年患有炎症並接近OPTIC EXt的開始時接受了白內障手術。在接下來的預定赴約(3個月後—第2.5年),檢測到對33局部皮質類固醇具有反應的炎症。通過裂隙燈檢查評估的細胞等級,等級類別基於標準的虹膜炎命名(SUN)標準和國家衛生研究院的玻璃體細胞指南。數據截止日期:2024年8月21日OPTIC參與者人數統計

安全摘要:LUNA 52周Ixo-vec繼續被良好地耐受,證明具有潛在的最佳產品特性Ixo-vec在總LUNA人群中具有有利的安全性且耐受良好。• 無與Ixo-vec相關的嚴重不良事件。所有與Ixo-vec相關的不良事件(AEs)要麼是輕微的,要麼是中度的。• 無瞼結膜炎、血管炎、視網膜炎、脈絡膜炎、血管閉塞或低眼壓和Ixo-vec相關的最常見的AE是劑量相關的前房炎,對局部皮質類固醇有反應以及前房色素變化,對視力無影響。• 在52周時和任何隨訪期間,有6E10患者沒有炎症。• 僅一個患者在任何時間點有炎症,但在52周前得到緩解。前房細胞、前房色素沉着、虹膜透光缺損、虹膜炎。沒有炎症:沒有≥ 1 AC/VC細胞。聯合使用局部地氟地奈特和伴有或不伴有IVt地塞米松(N=34)的局部地氟地奈特單獨(N=10)。數據截止日期:2024年8月29日的LUNA

Extended Local Prophylaxis Effective in Minimizing Inflammation Inflammation responded to local corticosteroids and resolved over time Initial IVt DEX IVt DEX + DFBA Initial IVt DEX IVt DEX + DFBA Prophylactic Steroid Prophylactic Steroid Injection Injection Usage** Usage** DFBA Prophylaxis Period (DFBA Only) DFBA Prophylaxis Period (DFBA Only) 0 0 0 0 0 tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 ANTERIOR VITREOUS 6E10 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr tr tr 0 0 0 0 0 6E10 CHAMBER 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 CELLS 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 CELLS 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p 0 0 0 1+ tr p 0 p p 0 0 0 0 0 0 0 0 0 0 p p p p 0 0 0 0 0 0 0 0 0 et et 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 None None 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr 1+ 0 0 1+ 0 0 0 0 0 0 0 0 0 0 1+ 1+ tr 0 tr tr 1+ 1+ tr tr tr tr tr tr 1+ 1+ * * * * * 0 0 0 0 0 0 0 0 0 0 0 p p p 0 0 0 p p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2+ 2+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 3+ 3+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 4+ 0 0 0 0 0 0 0 0 0 0 0 0 p 0 p 0 0 p 0 p 4+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p p p p p p p p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 2E11 2E11 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr 0 0 0 0 0 0 0 0 p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr tr tr tr tr tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p p p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr 0 0 0 0 0 0 2+ 0 1+ 0 2+ 0 tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 1+ 0 0 0 p p p p * * * * 0 0 0 2+ 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p p 0 p 0 0 p p p p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 p p p 0 p 0 p p p p p 0 p 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 tr tr tr tr 0 0 0 0 0 0 0 0 0 0 0 0 0 p tr 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 No patients had inflammation at week 52 or at any subsequent visit No inflammation: no ≥ 1 AC/V cells. IVt DEX = Ozurdex, DFBA = dilfuprednate, tr = Trace, p = Pigmented Cells, * = Mixed Pigmented / Non-Pigmented Cells, et – Early Termination. **IVt DEX + DFBA: protocol amended 35 early in study to include difluprednate starting at week 4 to match the taper in the difluprednate only regimen; if initiated after week 4 visit, difluprednate may be adjusted at the discretion of investigator in consult with medical monitors. Due to this, difluprednate prophylaxis with IVt DEX + DFBA may have lasted up to week 34. Data cut: LUNA 29AUG2024 DFBA IVt DEX + DFBA IVt DEX + DFBA (N=7) DFBA (N=7) (N=10) (N=10) SCRN RAND D1 D3 D8 W2 W4 W6 W8 W10 W14 W18 W22 W26 W30 W34 W38 W42 W48 W52 W65 W78 DFBA IVt DEX + DFBA IVt DEX + (N=10) DFBA (N=7) (N=10) DFBA (N=7) SCRN RAND D1 D3 D8 W2 W4 W6 W8 W10 W14 W18 W22 W26 W30 W34 W38 W42 W48 W52 W65 W78
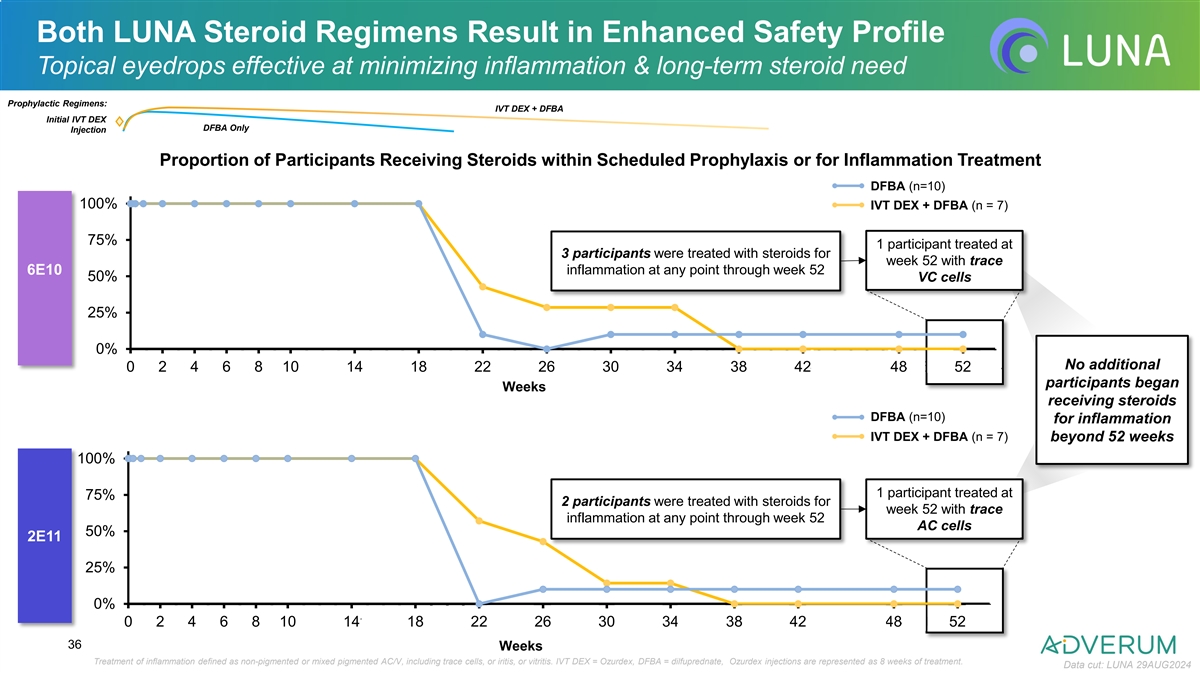
LUNA兩種類固醇方案均導致增強安全性 防止劑用點眼液有效減少炎症和長期類固醇需求 預防方案:IVt DEX + DFBA 初次IVt DEX DFBA只注射參與者在計劃內預防或爲了治療炎症而接受類固醇治療DFBA(n=10)100% IVt DEX + DFBA(n = 7)75% 1名參與者在第52周接受治療,3名參與者在第52周因輕微6E10炎症而接受治療,所有VC細胞的50%,AC細胞的25%的參與者額外0%沒有額外,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52位參與者從開始計劃週數接受治療的DFBA(n=10)爲了治療炎症的IVt DEX + DFBA(n = 7)超過52周100% 1名參與者在第75% 2名參與者在第52周接受治療,3名參與者在第52周因輕微炎症而接受治療,所有AC細胞的50%,2E11,AC細胞的25%的參與者額外0%沒有額外,0,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52 36周炎症治療定義爲非色素或混合色素AC/V,包括輕度細胞,或虹膜炎或玻璃體炎。IVt DEX = Ozurdex,DFBA = 檸二酸酶,Ozurdex注射表示8周的治療。數據截止日期:LUNA 2024年8月29日

LUNA延長預防措施優於OPTIC的經驗 第3階段方案增強整體安全性並減少長期類固醇需求 LUNA DFBA預防期間 OPTIC在計劃內預防或治療炎症的參與者比例爲100% 75% 50% 25% 0% 0 1 2 3 4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52周LUNA:DFBA Only OPTIC:DFBA Only 2E11(n = 9) 6E10(n = 10) 6E11(n = 9) 2E11(n = 10) 37 炎症治療定義爲非色素或混合色素AC/V細胞,虹膜炎或玻璃體炎。DFBA = 消炎酸。數據截止日期:OPTIC 2024年8月21日,LUNA2024年8月29日

患有高疾病負擔的患者中的CSt維持 在基線CSt >300μm的患者中的液體減少;在≤300μm的患者中的維持 LUNA基線CSt ≤300μm(n = 27) LUNA基線CSt >300μm(n = 33) 平均CSt在第52周從基線變化,μm(95%置信區間) 2.9(-14.3,20.2)在基線≤300μm -34.4(-64.9,-3.9)在基線>300μm 基線特徵子組:CSt ≤300 µm CSt >300 µm 平均CSt,μm(SD) 269.9(18.7) 416.6(119.1) 數據截止日期:LUNA2024年8月29日 平均CSt從基線變化,μm(95%置信區間)

廣大患者中具有一貫的解剖學益處,無需注射的患者其解剖穩定性得到維持並減少CSt 150 LUNA 基線 CSt ≤300μm 的患者(n=27)LUNA 基線 CSt >300μm 的患者(n=33)來自 LUNA 基線 CSt ≤300μm,無需注射(n=16)的患者的平均CSt 變化 LUNA 基線 CSt >300μm,無需注射(n=20)的患者 52周時的基線,μm(95% CI) 100 所有參與者 2.9(-14.3,20.2) 50 BL ≤300 μm,所有 -34.4(-64.9,-3.9) BL >300 μm,所有 0 無需注射 -50 -7.6(-20.7,5.5) BL ≤300 μm,無需注射 -100 -38.0(-67.0,-9.0) BL >300 μm,無需注射 -150 // 基線 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 周 理想患者亞組的基線特徵 CSt ≤300 µm CSt >300 µm CST ≤300 µm CSt >300 µm 所有參與者 所有參與者 無需注射 無需注射 平均CSt,μm(SD) 269.9(18.7) 416.6(119.1) 273.8(16.7) 417.6(142.0) 39 數據截止:LUNA 2024年8月29日 基線變化的平均CSt,μm(95% CI)

Ixo-vec 維持視覺和解剖結果 BCVA 在整體人群和無需注射患者中證明了 BCVA 的維持 平方均數最佳矯正視力(BCVA)隨時間變化的變化* 15 LS 平均 BCVA 變化 6E10(n=29)2E11(n=29) 52 周時與基線相比,10個字母(95% CI) 5 -2.1(-4.8,0.7) 0 6E10 -5 -1.8(-4.6,0.9) 2E11 -10 -15 // BL 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 周 最佳矯正視力(BCVA)隨時間變化的平方均數按劑量在補充處理方面無需注射的參與者** 15 LS 平均 BCVA 變化 6E10(n=15)2E11(n=20) 52 周時與基線相比,10個字母(95% CI) 5 +1.1(-2.7,4.9) 0 6E10 -5 -2.2(-5.5,1.2) 2E11 -10 -15 // 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 BL 周 40 最小平方平均值基於混合模型重複測量(MMRM),包括劑量組、基線值、訪問和訪問劑量組 * 不包括因白內障而失去信件的每劑量中的1名參與者 ** 不包括因白內障而失去信件的1名參與者 數據截止:LUNA 2024年8月29日 平方均數變化 BCVA 平方均數變化 BCVA (95% CI)(95% CI)

75%的6E10患者在治療負擔較小的情況下無需注射 有限治療經驗的患者在前一年內注射次數≤6次 平均注射速率: 4.7 Ixo-vec LUNA 52周總體結果 6E10 2E11 (N = 13) (n = 4) (n = 9) 無需注射 69% 75% 67% ≤1次注射 92% 100% 89% ≤2次注射 92% 100% 89% 只有一名患者需要在第52周時進行補充注射。 第-52周 第-26周 研究周 第26周 第52周 第91周 Aflibercept 未進行補充注射 根據方案進行補充注射 Ranibizumab Faricimab Bevacizumab 其他 提前終止 41劑藥物被彙總到游泳通道圖中,以維護正在進行的雙盲研究中的掩蓋調查者。 提前終止的患者不包括在注射計算中。 [注射免費率 = (總隊列 - 提前終止患者 - 被救助患者) / (總隊列 - 提前終止患者) * 100] 有限經驗的患者:在接受Ixo-vec治療前至少一年被確診。 數據截止日期: 2024年8月29日有限 參與者≤6次注射(N=13)

臨床更新凸顯Ixo-vec的潛在最佳類別 產品概況 • 潛在的最佳類別產品概況 在超過80%注射負擔減少和超過50%注射自由的基礎上保持視覺和解剖終點 • 超過4年的跟蹤,安全邊際高達10倍 • OPTIC 2E11患者在第1年至第4年無炎症 • LUNA 6E10患者在52周或任何隨訪時段均無炎症 良好的局部預防安全概況 註冊試驗的去危險化劑量和預防性方案 42 無炎症:沒有≥ 1 AC/V細胞。 OPTIC 2E11參與者在第2.5年有炎症,在OPTIC EXt開始附近進行了白內障手術。 數據截止日期:2024年8月21日(OPTIC),2024年8月29日(LUNA)

Ixo-vec關鍵計劃

Ixo-vec溼性AMD廣泛患者人群關鍵計劃 旨在最大化臨床、監管和商業成功的概率 5年以上的臨床經驗 Ixo-vec 全球關鍵計劃 廣泛溼性AMD 10倍安全人群邊緣 § 兩個雙盲隨機的第3期試驗 Ixo-vec § 與標籤上的aflibercept非劣效設計第3期 § ARTEMIS美國研究基於EOP2反饋 受到監管機構嚴格的建議 § 該研究將在美國和美國以外地區進行 全球KOL(Knowledge Organization Leader學問組織領袖) 解決未滿足的需求和患者 偏好 44

ARTEMIS第3階段溼性 AMD 研究設計 非劣效試驗設計,旨在實現監管批准並推動商業成功 在廣泛人群中進行隨機、雙盲的On-Label Aflibercept對照第3階段試驗 目標 證明Ixo-vec 6E10單次眼內注射能夠達到與官方推薦的 aflibercept 相當的視覺結果,同時顯著減少治療負擔 試驗設計 終點 主要終點 • 在美國進行的雙臂非劣效試驗 • Ixo-vec 6E10 從基線到 第52周和第56周的Aflibercept 對照 2mg q8W 的最終變化平均值 • 284例溼性 AMD 的治療初次和已治療患者 • 用於掩蓋效應的皮下注射 次要終點 • 一年主要終點設定爲 -4.5治療負擔 縮減的非劣性邊際 45

ARTEMIS第3階段溼性 AMD 研究設計 針對抗VEGF反應的廣泛目標患者群 重要的納入標準 治療初次和已治療的溼性 AMD BCVA:抗VEGF反應性: 35 - 78個字符 兩次 aflibercept 裝載劑後 -8 -4 D1 1 4 8 12 16 20 24 28 32 36 40 44 48 52 56 104 周 Ixo-vec 6E10 n = 142 Aflibercept 2mg (Q8w) n = 142 基線反應 隨機化 主要終點 Ixo-vec 眼內注射 如符合條件,則進行假操作或補充注射 Aflibercept 眼內注射 如符合條件,則進行補充注射 安慰劑

ARTEMIS第3階段溼性 AMD 研究設計 患者在3次 aflibercept 裝載劑後隨機分組,並每4周評估一次疾病活動 關鍵的納入標準 治療初次和已治療的溼性 AMD BCVA:抗VEGF反應性: 35 - 78個字符 兩次 aflibercept 裝載劑之後 Difluprednate 預防 措施 -8 -4 D1 1 4 8 12 16 20 24 28 32 36 40 44 48 52 56 LTFU 周 Ixo-vec 6E10 n = 142 Aflibercept 2mg (Q8w) n = 142 基線反應 隨機化 根據預先確定的標準進行補充 aflibercept 注射,以保護 主要終點的掩蓋,以及主要和次要終點 Ixo-vec 眼內注射 如符合條件,則進行假操作或補充注射 Aflibercept 眼內注射 如符合條件,則進行補充注射 安慰劑 旨在最大化臨床、監管和商業成功的概率 長期隨訪

患者偏好調查

預先指定的患者偏好調查 旨在了解患者需求和商業潛力「...患者偏好指的是患者對健康的看法、期望和目標,以及評估每種治療方案的潛在益處、危害和成本所涉及的過程...」•患者偏好和直接向患者的廣告開始推動新型溼性年齡相關性黃斑變性療法的採納,Vabysmo的「開啓你的世界」活動爲超過40億美元的年銷售額做出了貢獻。•在LUNA研究中,Adverum的預先指定的患者偏好調查詢問患者是否更喜歡Ixo-vec而不是他們之前接受的靜注治療,預防是否易於管理,以及患者是否會向家人或朋友推薦Ixo-vec。 49來源:Montori Vm等人 決策與患者,循證臨床實踐手冊2008年。

超過90%的患者更喜歡Ixo-vec而不是目前的標準治療 LUNA預先指定的患者偏好調查52周結果 您是否更喜歡Ixo-vec療法 是否想接受Ixo-vec 是否願意 把我推薦給你家人或朋友 如果你的 在你的另一隻眼睛中,在你家人或朋友 如果他們接受 對待溼性年齡相關黃斑變性的治療 溼性年齡相關性黃斑變性溼性年齡相關性黃斑變性溼性年齡相關性黃斑變性? 5% 4% 7% 95 % 96% 93% 總研究 總研究 總研究 (n = 56) (n = 56) (n = 56) 是 否 50 Adverum在LUNA進行了預先指定的患者喜好調查 數據截取:LUNA 2024年8月29日

眼部頂點類固醇滴眼液容易或非常容易管理 LUNA預先指定的患者偏好調查52周結果 您接受的類固醇治療易於管理嗎? 5% 5% 13% 35% 60% 88% 95% Difluprednate Ozurdex +口服潑尼松 +僅Difluprednate Difluprednate +/- Ozurdex(n = 20)(n = 16)(n = 20) 容易或非常容易管理 未決定 較難或非常難管理 51 Adverum在LUNA進行了預先指定的患者偏好調查 數據截取:LUNA 2024年8月29日

100%的Ixo-vec 6E0 +類固醇滴劑比標準治療更受青睞 LUNA預先指定的患者偏好調查52周結果 您是否更喜歡Ixo-vec療法 是否想要接受Ixo-vec 是否願意 將我推薦給你家人或朋友 如果你的 治療溼性年齡相關性年齡相關性黃斑變性的溼性年齡相關性黃斑變性溼性年齡相關性黃斑變性的療法溼性年齡相關性黃斑變性,溼性年齡相關十黃斑變性溼性年齡相關十黃斑變性溼性年齡相關十黃斑變性 藥物(n = 10)(n = 10)(n = 10) 52 是 否 Adverum在LUNA進行了預先指定的患者偏好調查 數據截取:LUNA 2024年8月29日

商業機會

全球溼性年齡相關性黃斑變性市場機會規模龐大並且不斷增長,醫生和患者 embrace 創新,是數十億美元的市場機會,是老年人視力損失的主要原因,增長受老齡化人口和產品創新推動。全球溼性年齡相關性黃斑變性銷售額2000萬 150萬約爲130億美元,全球患者大約有9億美元 6億美元 20萬,美國每年診斷的患者多達42%,在最初診斷後2-3年內有多達42%的患者發展爲雙側疾病。2015年、2025年E、2035年E。數據來源:Bright Focus Foundation. Age-Related Macular Degeneration: Facts & Figures.; Wong WL, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health. 2014;2:106–16.; Gangnon RE et al. (2015) JAMA 眼科,133 (2): 125–132.; 2023 Cowen Equity Research – Therapeutic Categories Outlook.; 公司估計。

Ixo-vec準備改變對待溼性年齡相關性黃斑變性的方式,潛力產品介紹旨在滿足關鍵利益相關者的需求,無縫的患者強大和新興可預測的實踐偏好持久的安全配置文件產品概況功效概況集成和影響•持續視力•沒有新發病跡象•IVt給藥•減少患者停藥•過去30周的炎症•持久的解剖•整合進臨床•持續的長期視力提高•炎症是罕見的,練習,手術和對於患者的模型•治療負擔減輕•>50%注射•易管理•較少的診療•93%偏好•優於過去的自由類固醇眼藥水IVt注射患者&•常規視網膜檢查•終身持續視力•100%稱多種注射爲易或非常易管理•潛力•降低醫療系統負擔,並且以經濟有效的方式支付者•通過只需一次注射,最大限度地提高投資回報,以保持長期視力基於LUNA和OPTIC數據呈現的預期結果以及公司對做法和支付者將如何演變爲改變的範式的預期。

潮溼性AMD的市場領導可能需要最佳類別的特徵,首先在難治患者中取得成功,年度注射負擔(IRIS註冊表,加權平均)隨時間採用>9次注射 7-9次注射 4-6次注射 1-3次注射早期採用者隨後擴展難治患者較輕患者56參考來源:Wykoff CC,Garmo V,Tabano D等,眼科學 2023;4(2):100421。患者比例

潮溼性AMD可能是基因療法的第一個大市場適應症市場流行病學經濟環境高市場緊迫情況預計需要採用疾病普遍性定價在大可尋址性人群中視力無法保持低每患者成本真實世界顯示早期採用市場上市面臨的挑戰突發病成本每年較少有效發生率COGS治療,新患者,雙側>1000倍低劑量,比Aflibercept持續釋放更大,通過體內基因治療逐步增長的疾病,成爲一種超級暢銷抗VEGF大人群年齡1使用在超過7000萬次注射57 1 https://investor.regeneron.com/news-releases/news-release-details/eylea-hdr-aflibercept-injection-8-mg-data-euretina-reinforce

CMC定位支持關鍵項目和商業規模擴張Ixo-vec目前在商業規模製造,全球CDMO處於商業規模製造階段支持健全的監管CMC投入所有Ixo-vec第3階段材料已製造成本效益的Sf9懸浮工藝使生物樣COGS 58

KOL小組

KOL小組與主要視網膜專家討論LUNA和OPTIC結果,以及關鍵試驗設計調解員 Charles C. Wykoff, MD, PhD 研究主任,德克薩斯視網膜顧問 Star Seyedkazemi,藥劑博士 首席開發官 Szilárd Kiss,醫學博士 Mark Barakat, MD 眼科學傑出教授,臨床研究主任 視網膜服務主任 阿利桑那州視黃斑協會康奈爾大學 Adverum 董事會成員 60

結論與要點

在難治患者中的治療負擔減少最顯著的是從6個月到>4年注射負擔的年降幅95% 92% 90% 89% 88% 86% 86% 85% 84% 84% 81% 81% 80% OPTIC(2E11)76% 71% LUNA(6E10)68% LUNA(2E11)RGX-314 SCS(2.5E11)RGX-314 SCS(5E11)RGX-314 SCS(1E12)4D-150(1E10)4D-150(3E10) 月 6 年:1 2 3 4 在溼性AMD的靜脈內和視網膜下基因治療中; 排除了ABBV-RGX-314視網膜下。 ABBV-RGX-314 SCS在AAVIATE(注:56名受試者中有21名接受1E12劑量的增強劑在第4周,未包括在RGX-314後的平均年注射次數中。 RGX-314數據截至2024年2月3日。最新可用的4D-150 PRISm第2a劑量拓展隊列數據截至2024年9月18日(1E10劑量的第1/2a階段因未單獨報告而不包括)62 數據基於跨試驗比較,並不基於頭對頭臨床試驗。跨試驗比較在本質上有限,可能表明結果的相似性或差異有誤導性。頭對頭比較的結果可能與這裏提出的結果有顯著不同。數據截止日期:OPTIC 2024年8月21日,LUNA 2024年8月29日
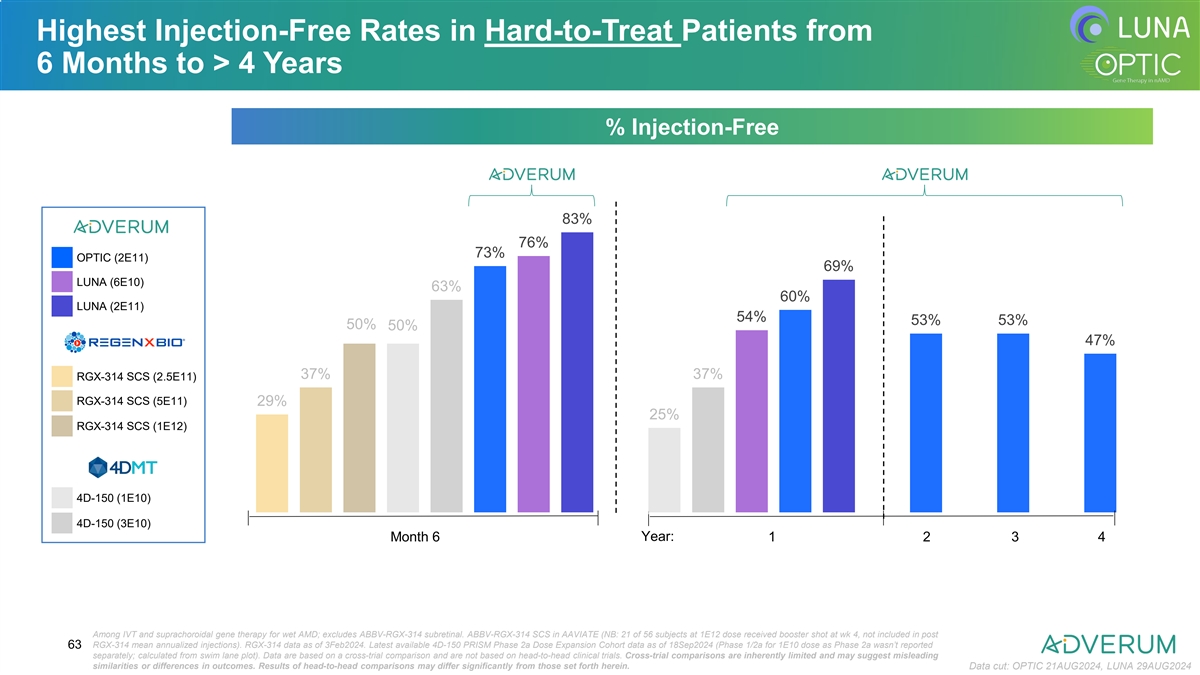
在6個月至4年內,難治療患者中的最高無注射率% 無注射率 83% 76% 73% OPTIC (2E11) 69% LUNA (6E10) 63% 60% LUNA (2E11) 54% 53% 53% 50% 50% 47% 37% 37% RGX-314 SCS (2.5E11) RGX-314 SCS (5E11) 29% 25% RGX-314 SCS (1E12) 4D-150 (1E10) 4D-150 (3E10) 6年內的第6個月和第1年:1 2 3 4 針對溼性AMD的IVT和葸膜下基因治療;不包括ABBV-RGX-314次視網膜下注射。 ABBV-RGX-314 SCS在AAVIATE(NB:在1E12劑量中,56名受試者中的21名在第4周接種了增強劑量,不包括在發帖RGX-314平均年化注射中)。 RGX-314數據截至2024年3月3日。最新可用的4D-150 PRISm 2a期劑量擴展隊列數據截至2024年9月18日(1E10劑量的1/2a期作爲2a期未單獨報道;從遊 泳道圖中計算)。 數據基於交叉試驗比較,並不基於頭對頭的臨床試驗。交叉試驗比較固有地有限,可能會顯示出具有誤導性的相似性或差異性的結果。頭對頭比較的結果與此處設定的可能大不相同。 數據截至2024年8月21日:OPTIC,2024年8月29日:LUNA

5年以上的臨床經驗確立10倍安全邊際 Ixo-vec 6E10,伴隨延長預防措施降低3期和商業化的風險 6E11 3期劑量 N=15 ü 增強的安全性概況 ü 延長糖類皮質激素預防措施 ü 潛在的最佳效能概況 2E11 2E11 N=15 N=30 6E10 N=30 4年以上的臨床數據 64 數據截至2024年8月21日:OPTIC,2024年8月29日:LUNA 劑量(vg/眼)10倍安全邊際

可靠的益處和可預測的安全性使真正的範式轉變成爲可能 4年的OPTIC和52周的LUNA數據強調了Ixo-vec的概況 展示了可靠的長期益處 78% 的患者從第一年開始無注射並保持到第四年 88% 的患者從第二年開始無注射並保持到第四年 展示了具有局部預防的可預測的安全概況 在30周後沒有新的炎症發作 100% 的炎症在第一年前得到解決 65 無炎症:沒有≥1 AC/VC細胞;OPTIC結果指2E11劑量 數據截至2024年8月21日:OPTIC,2024年8月29日:LUNA

Ixo-vec的去風險化III期和商業模式臨床更新突顯了Ixo-vec潛在的一流產品特性 • 潛在的一流產品特性在難治患者中享有50%以上的無注射率和80%以上的治療負擔減輕率 • 安全邊際是10倍,隨訪超過4年 • OPTIC 2E11患者在第1年至第4年沒有發炎反應 • LUNA 6E10患者在52周及後續訪問期間沒有發炎反應,利用局部預防,具有良好的安全性 • LUNA患者調查表明,患者對Ixo-vec擁有廣泛的6E10 EOP2 284 1H25 ARTEMIS患者人群美國研究,納入了患者,預計III期III期試驗激素滴眼FDA反饋啓動66 沒有發炎:沒有≥1個AC/VC胞; OPTIC 2E11參與者在OPTIC EXt.開始之初進行了近視白內障手術; EOP2: 第二階段會議數據截取:OPTIC 2024年8月21日,LUNA 2024年8月29日

問答

問題與回答環節 Laurent Fischer, MD Rabia Gurses Ozden, MD Star Seyedkazemi, PharmD 總裁兼首席醫學官 首席開發官 首席執行官 Linda Rubinstein Mike Zanoni Jason Mitchell Peter Soparkar 首席財務官 投資者關係主管 首席商務官 首席運營官 Mark Barakat, MD Szilárd Kiss, MD Charles C. Wykoff, MD, PhD 臨床研究主任 眼科醫療著名教授,亞利桑那州黃斑學研究所研究主任 視網膜服務主任 視網膜顧問 托馬斯大學 Adverum 董事

www.adverum.com如有其他問題,請聯繫:IR@adverum.com® 保護生命的視力

附錄 IVt 溼性黃斑變性基因治療

LUNA & OPTIC研究佈局 90名患者參與了LUNA & OPTIC試驗 LUNA OPTIC 參與者佈局 合計參與並接受Ixo-vec治療的參與者總數 60 30 完成52周訪問的參與者數量 57 30 參與開放標籤延長試驗的參與者數量 - 23 完成第4年訪問的參與者數量 - 21 Ixo-vec給藥後退出的參與者數量 3 7 第52周訪問時 3 0 第4年訪問時 - 7 停止治療的原因(與Ixo-vec無關) 不相關的不良事件(包括死亡) 3 3 失訪/撤回同意 - 4 71 數據截取:OPTIC 2024年8月21日,LUNA 2024年8月29日

治療經驗不足與治療經驗豐富的抗血管內皮生長因子反應:初始兩劑治療後相似最佳矯正視力軌跡,治療經驗豐富 10 15 8 10 5 6 0 -5 4 -10 2 -15 0 4 8 12 16 20 24 28 32 36 40 0 0 4 8 12 16 20 24 28 32 36 40 44 48 周 周 6 15 5 4 10 3 2 5 1 0 0 -1 4 8 12 16 20 24 28 32 36 40 44 48 基線 4 8 12 16 20 24 28 32 36 40 44 48 52 周 周 72 Heier等人,第3階段,多中心,隨機,雙盲,活性對照研究,評估法利西替單抗和抗肝生長因子融合蛋白在新生血管性年齡相關性黃斑變性患者中的療效和安全性,2021年血管新生2021虛擬大會。艾樂雅注射EYLEA HD【說明書】,2023年。Holekamp等,眼科醫學。2022年;129(3):295-307. Khanani等人。眼科醫學。2022年;129(9):974-985 PULSAR盧塞恩(艾樂雅高清)(VABYSMO),矯正後平均最佳矯正視力變化 矯正後最佳矯正視力變化(ETDRS字母)(字母) MERLIN ARCHWAY(貝歐塢)(SUSVIMO),最佳矯正視力變化的均數 自矯正的最佳矯正視力變化(ETDRS 字母) 基線(字母)

高疾病負擔患者中的CSt維持 擁有基線CSt >300 μm的患者:在≤300 μm處的維持,52周時與基線相比的平均CSt變化,μm(95% CI) 150 LUNA 基線CSt ≤300μm(n=27) LUNA 基線CSt >300μm(n=33) 2.9(-14.3,20.2) 基線≤300 μm 100 6E10 9.2(-24.6,43.0) 基線≤300 μm 50 2E11 -3.4(-17.9,11.1) 0 基線≤300 μm -50 -34.4(-64.9,-3.9) 基線>300 μm 6E10 -100 -35.5(-83.3,12.3) 基線>300 μm -150 // 2E11 基線 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 -33.3(-77.6,10.9) 基線>300 μm 周 基線 子組CSt ≤300 µm CSt >300 µm 平均CSt,μm(SD) 269.9 (18.7) 416.6 (119.1) 數據截至:LUNA 2024年8月29日 自基線的平均CSt變化,μm(95% CI)

兩個劑量下的穩定眼壓 隨時間變化的平均眼壓 6E10 30 6E10 研究眼 6E10 同側眼 25 20 15 10 5 0 // 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 BL Week 2E11 2E11 研究眼 2E11 同側眼 30 25 20 15 10 5 0 // BL 0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 周 74 數據截至:LUNA 2024年8月29日 平均(SD)眼壓mm 平均(SD)眼壓mm 水銀柱 水銀柱

LUNA整體人口:6E10劑量下的炎症頻率 52周或任何隨訪中,沒有患者出現炎症。劑量逐漸增加導致的時間點上的炎症頻率:6E10 2E11 LUNA LUNA 30 30 25 25 20 20 15 15 10 10 5 5 0 0 0 2 4 6 8 1012141618202224262830323436384042444648505254565860626466 0 2 4 6 8 10121416182022242628303234363840424446485052545658606264 65 66 65 * 周次 周次 細胞 ≥1+ ≥1+ 75 AC, 前房眼底細胞; VC, 玻璃體細胞。根據前房細胞的標準化(SUN)和國立衛生研究院有關玻璃體細胞的指南,細胞等級經過裂隙燈檢查,分類標準:AC:0.5+:1-5細胞 1+:6-15細胞 2+:16-25細胞 3+:26-50細胞 4+:>50細胞; VC:0.5+:1-10細胞 1+:11-20細胞 2+:21-30細胞 3+:31-100細胞 4+:>100細胞; 分析中罕見細胞標記爲0.5+,*。 *研究早期修訂方案,從第4周開始加入地氟普利醇,以配合地氟普利醇療程的逐漸減少;如果在第4周後開始使用地氟普利醇,地氟普利醇可能根據研究者和醫學監察員的決定進行調整(6名參與者未作爲預防措施接受地氟普利醇)。據統計數據顯示:LUNA 2024年8月29日參與者數量統計

案例研究:Ixo-vec 2E11減少了液體和中心亞區厚度(CST)的波動 90歲女性,在接受Ixo-vec治療前的12個月內接受了9次視網膜內注射,之前進行過56周的Aflibercept Q5W治療,與Ixo-vec進行基線前的-2周。 90 BCVA:53個字 CST:358µm 80 70 第0天 60 Ixo-vec治療 50 40 0 1 2 3 年 600 500 400 300 200 100 -1 2 3 0 1 -55 -43 -31 -19 -7 5 17 29 41 53 65 77 89 101 113 125 137 149 161 173 年 基準線 抗VEGF注射研究訪問,無需額外注射 統計數據顯示:OPTIC 2024年8月21日 CSt(µm) BCVA(ETDRS)

案例研究:Ixo-vec 2E11減少了液體和中心亞區厚度(CST)的波動 90歲女性,在接受Ixo-vec治療前的12個月內接受了9次視網膜內注射,之前進行過56周的Aflibercept Q5W治療,100%沒有接受過抗VEGF注射,Ixo-vec治療基線前的-2周。 90 BCVA:53個字 CST:358µm 80 70 第0天 60 Ixo-vec治療 50 9個月 40 0 1 2 3 BCVA ∆:+18個字 年 CSt ∆:-127µm Ixo-vec 1年 600 BCVA ∆:+16個字 500 CSt ∆:-132µm 400 2年 300 BCVA ∆:+5個字 200 CSt ∆:-93 µm 100 -1 2 3 2.2年 0 1 -55 -43 -31 -19 -7 5 17 29 41 53 65 77 89 101 113 125 137 149 161 173 年 BCVA ∆:+13個字 CSt ∆:-135µm 77 研究基線 抗VEGF注射研究訪問,無需額外注射 統計數據顯示:OPTIC 21AUG2024 CSt(µm) BCVA(ETDRS)
