美国
证券交易委员会
华盛顿特区20549
形式
(Mark一)
| | 根据1934年《证券交易所法》第13或15(d)条提交的年度报告 |
日终了的财政年度
| | 根据1934年《证券交易所法》第13或15(d)条提交的过渡报告 |
从 至
委员会档案编号
Veru Inc.
(Name注册人的章程规定)
| | | |
| (成立或组织的州或其他司法管辖区) | (国税局雇主识别号) | |
| | | |
| (主要行政办公室地址) | (Zip代码) |
注册人的电话号码,包括地区代码 (
根据该法第12(b)条登记的证券:
| 每个班级的标题 | 交易符号 | 注册的每个交易所的名称 | ||
| | | |
根据该法第12(g)条登记的证券:
没有一
如果注册人是《证券法》第405条所定义的知名经验丰富的发行人,则通过勾选标记进行验证。是的
用复选标记表示注册人是否不需要根据该法第13节或第15(D)节提交报告。是的☐
用复选标记表示注册人(1)是否在过去12个月内(或注册人被要求提交此类报告的较短期限内)提交了1934年《证券交易法》第13或15(D)节要求提交的所有报告,以及(2)在过去90天内是否符合此类提交要求。
用复选标记表示注册人是否在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-t法规第405条规定必须提交的每个互动数据文件。
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司、较小的报告公司或新兴成长型公司。请参阅《交易法》第120亿2条规则中的“大型加速申报公司”、“加速申报公司”、“较小报告公司”和“新兴成长型公司”的定义。
| 大型加速文件夹 | ☐ | 加速编报公司 | ☐ | |
| | ☑ | 小型上市公司 | ||
| 新兴成长型公司 |
如果是一家新兴的成长型公司,用复选标记表示注册人是否已选择不使用延长的过渡期来遵守根据交易所法案第13(A)节提供的任何新的或修订的财务会计准则。☐
用复选标记表示注册人是否提交了一份报告,证明其管理层根据《萨班斯-奥克斯利法案》(《美国联邦法典》第15编,第7262(B)节)第404(B)节对其财务报告的内部控制的有效性进行了评估,该评估是由编制或发布其审计报告的注册会计师事务所进行的。
如果证券是根据该法第12(B)条登记的,应用复选标记表示登记人的财务报表是否反映了对以前发布的财务报表的错误更正。
用复选标记表示这些错误更正中是否有任何重述需要对注册人的任何执行人员在相关恢复期间根据第240.10D-1(B)条收到的基于激励的补偿进行恢复分析。☐
用复选标记表示注册人是否是空壳公司(如该法第120亿2条所界定)。是
截至2024年3月29日,注册人的非关联公司持有的普通股的总市值约为$
有几个
通过引用并入的文件:
注册人股东2025年股东周年大会的委托书部分以参考方式并入本报告第III部分。
索引
| 部分 I | ||
| 页面 | ||
| 项目1C. | 网络安全 | 55 |
| 部分 II |
||
| 项目9 C. | 有关阻止检查的外国司法管辖区的披露 | 71 |
| 部分 III |
||
| 部分 IV |
||
如本报告中所使用的,术语“我们”、“我们的”、“Veru”和“公司”是指Veru Inc.。及其子公司统称,除非上下文另有含义,术语“普通股”是指我们的普通股,每股面值0.01美元。
本报告中出现的所有商标、服务标记或商品名称均为其各自所有者的财产。我们无意使用或展示其他公司的商品名称、商标或服务标记暗示与任何这些其他公司的关系、认可或赞助或由任何这些其他公司的认可或赞助
前瞻性陈述
本年度报告中包含的非历史事实陈述的10-k表格中的某些陈述,旨在成为1995年《私人证券诉讼改革法》所指的前瞻性陈述,特此予以确认。此类陈述包括但不限于有关我们的财务状况或业务、与我们的候选产品和产品相关的开发和商业化计划的陈述,包括最初作为一种治疗方法的enobosarm的任何潜在开发或商业化,以增加脂肪损失和防止骨节源性肥胖或超重老年患者的瘦体重(肌肉)损失,这些患者接受高血糖素样多肽-1受体激动剂(GLP-1 RA)治疗,有发生肌肉萎缩和肌肉无力的风险,某些乳腺癌患者使用enobosarm,以及用于病毒诱导的急性呼吸窘迫综合征(ARDS)的沙比布林,通过远程医疗客户,我们FC2业务的增长前景,这些陈述包括:我们的门户网站和全球公共卫生部门的未来财务和经营业绩、计划、目标、预期和意图、成本和开支、特许权使用费支付、诉讼结果和其他意外情况、财务状况、经营结果、流动性、成本节约、我们作为持续经营企业的能力、我们客户的未来订购模式、管理目标、业务战略、临床试验时机、计划和结果、临床和商业里程碑的实现、我们技术和产品的进步以及候选药物,以及其他非历史事实的陈述。您可以通过使用“预期”、“相信”、“可能”、“预期”、“打算”、“可能”、“机会”、“计划”、“预测”、“潜在”、“估计”、“应该”、“将”、“将”或这些术语的否定或其他类似含义的词语来识别前瞻性陈述。这些陈述是以我们目前的计划和战略为基础的,反映了我们目前对与我们业务相关的风险和不确定性的评估,是截至本报告日期作出的。这些陈述本身就会受到已知和未知的风险和不确定性的影响。你应该仔细阅读这些声明,因为它们讨论了我们未来的期望或陈述了其他“前瞻性”信息。未来可能会发生我们无法准确预测或控制的事件,我们的实际结果可能与我们在前瞻性陈述中描述的预期大不相同。可能导致实际结果与目前预期的结果大相径庭的因素包括:
| ● |
临床试验和研究的时间和结果的潜在延迟,包括招募患者及其有效参与此类试验和研究的能力的潜在延迟,任何此类试验或研究的可能暂停或终止,以及此类结果将不支持在美国或任何其他国家/地区的上市批准、紧急使用授权(“EUA”)或商业化的风险; |
|
| ● |
向美国食品和药物管理局(FDA)或世界各地的任何其他监管机构提交任何申请的时间可能出现延误,正在开发的产品可能会推迟或未能从任何此类监管机构获得批准,包括与FDA就任何临床试验的设计(包括任何批准后或授权后研究)达成协议的风险,或在美国或其他地方开始临床试验或将候选产品商业化的授权的风险,以及任何监管批准的条款可能限制该药物的商业潜力的风险; |
|
| ● |
FDA或任何其他监管机构对生产批次批准产品放行的批准时间可能会出现延误; |
|
| ● |
临床试验结果支持任何潜在的监管批准或授权我们的任何产品,包括enobosarm最初作为一种治疗方法,以增加脂肪损失和防止精瘦质量(肌肉)损失的老年患者接受GLP-1 RA谁有发展成肌肉萎缩和肌肉无力的风险,可能不会在临床实践中复制; |
|
| ● |
临床试验的临床结果或早期数据可能不会被复制或继续出现在其他试验中,或者可能不支持指定候选产品的进一步开发,或者根本不支持; |
|
| ● |
与我们在需要时以可接受的条件获得足够资金以资助产品开发、候选产品商业化和我们的运营并使我们能够继续作为持续经营企业的能力有关的风险; |
|
| ● | 由于我们未能及时向美国证券交易委员会提交两份报告,我们在不早于2025年3月1日之前没有资格使用我们现行有效的S-3表格搁置登记声明或提交新的S-3表格登记声明,这可能会影响我们的融资活动; | |
| ● |
我们需要获得大量资金来推进我们的候选药物,包括政府拨款、制药公司合作或类似的外部来源,以促进将萨比布林作为治疗病毒引起的ARDS的药物的开发; |
|
| ● |
我们可能不会收到Onconentix,Inc.(前身为Blue Water Vaccines Inc.)与出售我们的ENTADFI资产有关的任何额外付款,也可能不会收到我们可能不时持有的ONCO普通股的任何价值; |
|
| ● |
与开发我们的产品组合相关的风险,包括临床试验、监管批准以及将我们的任何候选产品推向市场的时间和成本,以及与我们的合作者的努力相关的风险; |
| ● |
我们的商业产品和开发中的产品的产品需求和市场接受度,如果获得批准; |
|
| ● |
与我们从私人付款人或政府付款人(包括Medicare和Medicaid)获得保险报销的能力相关的风险,以及与市场或政治接受我们的任何候选产品的任何潜在或实际定价有关的类似风险,如果获得批准,我们将尝试将其商业化; |
|
| ● |
我们的一些产品正在开发中,我们可能无法获得监管部门的批准或成功地将此类产品商业化; |
|
| ● |
与我们在将当前产品或潜在未来产品商业化时开发或使用的任何潜在新远程医疗平台相关的风险,包括围绕此类平台的潜在监管不确定性,以及市场对我们开发或使用的任何远程医疗平台的认知和接受程度; |
|
| ● |
由于远程医疗行业整合和大型远程医疗客户的破产,在最近几个时期大幅下降后,与我们增加FC2销售的能力有关的风险; |
|
| ● |
与知识产权有关的风险,包括获得和执行知识产权保护的不确定性、侵犯第三方知识产权的可能性以及许可风险; |
|
| ● |
来自现有竞争对手和新竞争对手的竞争,包括潜在的销售减少、定价压力和营销支出增加; |
|
| ● |
与合规和监管事项有关的风险,包括政府广泛监管和报销造成的成本和延误,医疗保险和监管下的覆盖范围,以及潜在的医疗改革措施; |
|
| ● |
我们将受到监管和法律发展的影响的风险,包括产品的重新分类或部分或全部患者保护和平价医疗法案的废除或修改; |
|
| ● | 如果付款人对我们产品的承保范围被取消或减少,如果患者的自付费用高得令人无法接受,或者获得远程医疗服务或支付远程医疗费用受到不利影响,我们产生产品收入的能力将受到影响; | |
| ● |
在国际上做生意所固有的风险,包括货币风险、监管要求、政治风险、出口限制和其他贸易壁垒; |
|
|
|
● |
由于原材料短缺、劳动力短缺、制造合作伙伴业务变更、对我们或第三方设施的实际损坏、产品测试、运输延误或监管或其他政府行动,以及任何此类中断的持续时间和影响,我们所依赖的制造设施或第三方设施的生产中断的风险和/或我们供应产品的能力的中断; |
| ● |
我们对主要客户的依赖以及与主要客户延迟或未能支付应收账款相关的风险; |
|
| ● |
原材料成本上涨以及我们将增加的成本转嫁给客户的能力带来的风险; |
|
| ● |
与我们的增长战略相关的风险; |
|
| ● |
我们继续有能力吸引和留住高技能和合格的人才; |
|
| ● |
与重述截至2023年6月30日及截至2023年6月30日的三个月及九个月的未经审计简明综合财务报表及重述截至2023年9月30日及截至2022年9月30日的经审计综合财务报表有关的风险; |
|
| ● | 我们有净亏损的历史,我们可能无法预测未来亏损的程度; | |
| ● |
诉讼、政府调查、法律和行政案件及诉讼、和解和调查的费用和其他影响; |
|
| ● |
我们可能在未来的财务报告内部控制中发现重大弱点或其他不足之处,或未能维持有效的内部控制制度的风险; |
|
| ● |
政府订约风险,包括拨款程序和供资优先次序、授予合同方面可能出现的官僚拖延、程序错误、政治或其他压力,以及政府招标和合同可能被取消、拖延、重组或大幅延迟付款的风险; |
|
| ● |
政府招标授予表明接受投标人的价格,而不是订购或保证购买任何最低数量的单位,因此,政府各部委或其他公共卫生部门客户可以订购和购买少于全部最高投标金额的单位; |
|
| ● | 我们面临网络安全风险,我们所依赖的信息技术系统可能受到数据安全或隐私事件的影响; | |
| ● |
我们有能力识别、成功谈判和完成适当的收购、对外许可交易、内部许可交易或其他战略举措,并实现此类交易或举措的任何潜在好处;以及 |
|
| ● |
我们成功整合收购的业务、技术或产品的能力。 |
这些因素并非包罗万象。本报告中的所有前瞻性陈述都应在上述风险和其他因素的背景下以及在项目1A中的“风险因素”中加以考虑。这份报告的。其他我们尚不知道或我们目前认为不重要的因素也可能损害我们的业务运营,可能会不时出现新的风险因素。*无法预测所有此类风险因素,本公司也无法评估所有此类风险因素对其业务的影响,或任何因素或因素组合可能导致实际结果与任何前瞻性陈述中包含的结果存在重大差异的程度。前瞻性陈述并不是业绩的保证。您不应过分依赖这些声明,这些声明仅说明截至本声明的日期。所有属于公司或代表公司行事的人的前瞻性陈述都明确地受到前述警示声明的限制。除非适用法律要求,否则公司没有义务对本报告中包含的前瞻性陈述进行任何修改或对其进行更新,以反映本报告日期后发生的事件或情况。
此外,“我们相信”的声明和类似声明反映了我们对相关主题的信念和观点。这些声明基于截至本报告日期我们可用的信息,虽然我们相信此类信息构成了此类声明的合理基础,但此类信息可能是有限的或不完整的,并且我们的声明不应被解读为表明我们已经对所有潜在可用的相关信息进行了详尽的调查或审查。
这份Form 10-k年度报告包括我们从行业出版物和第三方进行的研究、调查和研究中获得的统计数据和其他行业和市场数据,以及我们自己基于对这些数据的分析、研究、调查和研究而对潜在市场机会的估计。本年报以Form 10-k格式使用的所有市场数据均涉及多项假设及限制,敬请阁下切勿过份重视此类数据。行业出版物和第三方研究、调查和研究一般表明,它们的信息是从据信可靠的来源获得的,尽管它们不保证此类信息的准确性或完整性。我们对候选产品的潜在市场机会的估计包括一些基于我们的行业知识、行业出版物和第三方研究、调查和研究的关键假设,这些假设可能基于小样本,未能准确反映市场机会。虽然我们认为我们的内部假设是合理的,但没有独立消息来源核实过这些假设。
第一部分
概述
我们是一家临床晚期生物制药公司,专注于开发治疗代谢性疾病、肿瘤学和ARDS的新药。我们的药物开发计划包括两个晚期新化学实体,enobosarm和sabizulin。Enobosarm是一种口服选择性雄激素受体调节剂(“SARM”),正在开发用于两个适应症:(I)作为一种治疗方法,用于增加脂肪损失,防止接受GLP-1RA治疗的患有骨肉增生性肥胖或超重的老年患者的瘦体重(肌肉)减少,这些患者有发生肌肉萎缩和肌肉无力的风险;(Ii)如果有足够的资金可用,作为治疗二线试验中雄激素受体阳性(AR+)、雌激素受体阳性(ER+)和人类表皮生长因子受体2阴性(HER2-)转移性乳腺癌的方法。沙比布林是一种微管干扰剂,正在开发中用于治疗由病毒引起的ARDS住院患者。在我们从政府拨款、制药公司合作伙伴关系或其他类似的第三方外部来源获得资金之前,我们不打算进一步开发用于治疗病毒引起的ARDS的萨比布林。我们还有FDA批准的商业产品FC2女性避孕套®(内部避孕套),用于预防意外怀孕和性传播感染的双重保护。
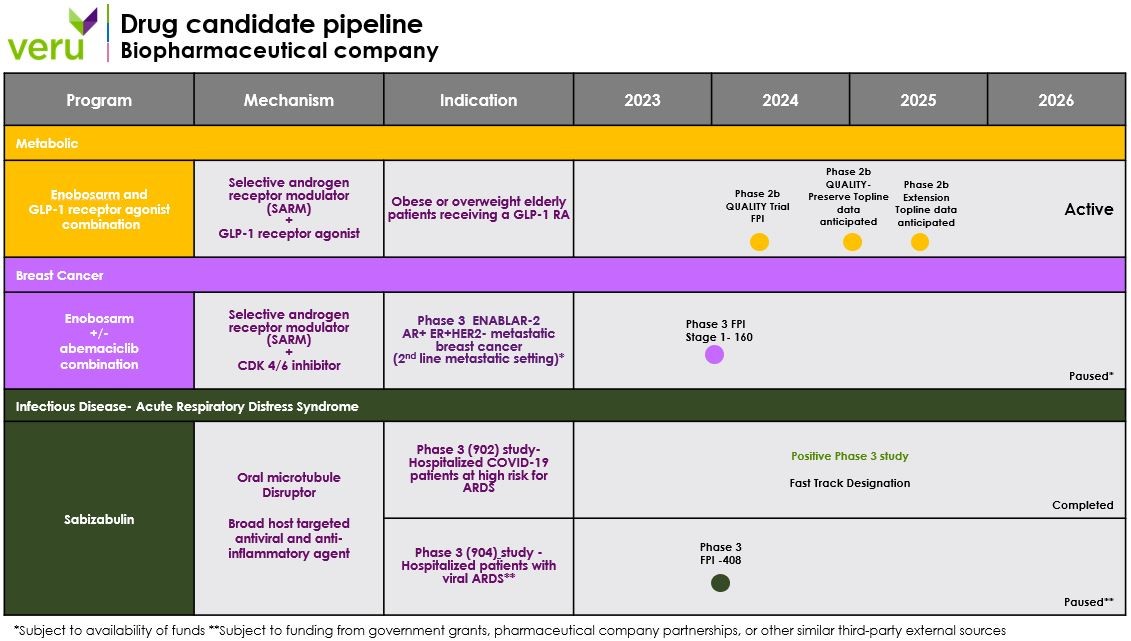
以下图表显示了截至本报告发布之日我们当前的候选药物管道。此图表基于我们当前的计划,可能会发生变化。 请参阅“前瞻性陈述”。

公司历史
Veru是威斯康星州的一家公司,是威斯康星州Pharmacal Company,Inc.的继承者。(“威斯康星Pharmacal”),一家生产和销售不同的特种化学品和品牌消费品的公司。Wisconsin Pharmacal最初成立于1971年。1996年,我们完成了一系列行动,导致我们获得了第一代女性避孕套的全球版权,剥离了威斯康星Pharmacal的其他业务,并将我们的名称更改为“女性健康公司”。2016年10月31日,我们完成了对阿斯彭帕克制药公司的收购。(the“APP收购”),这使我们从一家销售FC 2的单一产品公司转变为一家拥有强大药物开发计划的生物制药公司。2017年7月31日,我们将公司名称从“女性健康公司”更改为“Veru Inc.”反映了我们对生物制药产品开发和商业化的关注。
我们的战略
我们的战略主要侧重于治疗代谢性疾病、肿瘤学和急性呼吸窘迫综合征的新药的临床开发和商业化。此外,我们寻求运营和发展我们的性健康计划,以帮助资助我们的临床开发工作。我们将需要大量资金来支持我们的药物开发以及候选药物的任何相关商业化努力。我们战略的关键要素是:
| ● |
开发针对肥胖的enobosarm。 |
我们的代谢药物管道专注于enobosarm(一种口服SARM)的临床开发,最初是作为一种治疗方法,以增加脂肪损失并预防接受GLP-1 RA的肌肉减少性肥胖或超重老年患者的瘦质量(肌肉)损失,这些患者有发展为肌肉萎缩和肌肉无力的风险。
据报道,在评估目前批准的GLP-1 RA用于肥胖患者的第三方临床试验中,试验参与者显示出显著的体重减轻,包括脂肪和瘦(肌肉和骨骼)质量的减少。在某些第三方临床试验中报告的总体重下降中,20-50%的总体重下降可归因于瘦体重(肌肉)的下降。肌肉对新陈代谢、肌肉力量和身体功能(活动能力)以及预防受伤(跌倒)至关重要,尤其是在老年人群中。根据疾病控制和预防中心(CDC)的数据,41.5%的老年人患有肥胖症,可以从减肥药中受益。然而,服用目前批准的GLP-1RA时可能发生的大量肌肉损失有可能将患者的肌肉质量减少到石质形成,或极低的量。骨肉源性肥胖患者是指同时患有肥胖和与年龄相关的低肌肉质量的患者,在服用目前批准的GLP-1 RA时,他们可能面临发展为极度低肌肉质量的最大风险。在美国,60岁以上的肥胖患者中高达34.4%患有骨质源性肥胖症,在服用目前批准的GLP-1 RA治疗肥胖症时,他们可能面临极大的肌肉质量过低和功能限制的风险。因此,我们认为迫切需要一种药物,既能增加脂肪损失,又能防止接受GLP-1 RA治疗的石膏性肥胖或超重老年患者的瘦质量损失,这些患者有发生肌肉萎缩和肌肉无力导致虚弱的风险。
我们相信,enobosarm(SARM)可以解决这种紧迫的未满足的医疗需求,它可以有效地防止肌肉质量损失,并增加接受治疗肥胖的GLP-1 RA的老年患者所经历的脂肪损失。使用GLP-1 RA药物观察到的瘦肉质量下降使患有肌肉减少性肥胖的老年超重或肥胖患者面临风险,因为他们的肌肉质量储备已经较低,并且可能会出现肌肉无力、功能限制、行动障碍和跌倒。Veru正在进行一项20亿期多中心、双盲、安慰剂对照、随机化和剂量探索QUALITY临床研究,以在大约168名随机化的超重或肥胖老年患者中评价enobosarm 3毫克、enobosarm 6毫克或安慰剂,并正在接受用于减肥的GLP-1 RA。
| ● |
开发enobosarm治疗晚期乳腺癌。 |
我们的肿瘤药物管道专注于enobosarm 9毫克的临床开发,用于治疗AR+ ER+ HER 2-转移性乳腺癌。由于我们将临床项目的优先顺序集中在enobosarm治疗肥胖症上,enobosarm用于治疗转移性乳腺癌的持续临床开发取决于是否有足够的资金,超过我们用于enobosarm治疗肥胖症或其他用途的任何资金。我们于2023年10月完成了3期临床试验的1a阶段部分。然而,在获得足够的资金之前,我们不会开始三期临床试验。
| ● |
在获得政府或制药合作伙伴资金的情况下,开发用于病毒引起的急性呼吸窘迫综合征的萨比他布林。 |
我们正在开发萨比布林9 mg,它具有宿主靶向抗病毒和广泛的抗炎特性,作为一种双管齐下的方法,用于治疗具有ARDS和死亡高风险的病毒性肺部感染住院患者。我们已经完成了新冠肺炎阳性2期和阳性3期临床试验,这些试验已经证明,在住院的中重度新冠肺炎病毒性肺部感染患者中,萨比布林的治疗降低了死亡率,这些患者具有急性呼吸窘迫综合征和死亡的高风险。美国食品和药物管理局于2022年1月授予我们的新冠肺炎项目快车道称号。2022年5月10日,我们与美国食品和药物管理局举行了欧盟审批前会议,讨论下一步行动,包括提交新冠肺炎的萨比布林欧盟审批申请。2022年6月,我们提交了FDA紧急使用授权申请。2023年2月,FDA拒绝批准我们对萨比布林的紧急使用授权。2023年9月,我们从FDA收到了关于评估萨比布林治疗病毒诱导的ARDS的3期临床试验设计的积极反馈。
我们目前计划优先使用内部现金和未来任何融资的净收益用于enobosarm的开发,近期的主要重点是资助20亿期临床试验,以评估enobosarm最初作为一种治疗方法的安全性和有效性,以增加接受GLP-1 RA的肌肉减少性肥胖或超重老年患者的脂肪损失并预防瘦质量损失-出现肌肉萎缩和肌肉无力的风险,并通过政府拨款、制药公司合作伙伴关系或类似来源寻求外部资金,以推进萨比沙布林治疗病毒诱导的急性呼吸窘迫综合征的开发。如果没有此类外部资金,我们不计划推进萨比扎布林作为病毒诱导的急性呼吸窘迫综合征治疗方法的开发,也不会开始评估萨比扎布林在病毒诱导的急性呼吸窘迫综合征中的治疗方法的III期临床试验。
| ● |
发展我们的性健康计划,将收益投资于我们药物管道的临床开发。 |
我们仍然专注于通过我们建立的专门直接面向患者的远程医疗和药房服务门户增加美国市场FC 2的收入,同时利用我们与远程医疗和互联网药房提供商和分销商的关系。我们还在寻求额外的商业合作机会,同时通过与区域分销商/参与者的合作伙伴/分销协议继续增加美国和全球主要市场公共卫生部门的收入。
| ● |
利用我们管理团队和董事会成员的专业知识和声誉。 |
我们的管理团队在泌尿学、肿瘤学、内分泌、心脏代谢和传染病以及药物开发、监管事务、营销和销售以及业务发展方面拥有丰富的专业知识和经验,我们相信这有助于有效管理我们的临床前研究和候选药物临床试验、潜在的发布规划、有效的合作活动和产品商业化。此外,我们打算利用我们的管理层和董事会成员在学术机构、医院、医生、药剂师和分销商中的良好声誉,以扩大我们的客户群并推出潜在的新产品。
我们的产品和候选产品
下表总结了公司当前的产品和开发组合:
| 产品 |
指示 |
发展 相 |
||
| 心脏代谢肥胖计划 |
||||
| Enobosarm -选择性雄激素受体调节剂 |
一种用于增加脂肪损失并防止接受GLP-1 RA且有出现肌肉萎缩和肌肉无力风险的肌肉减少肥胖或超重老年患者瘦质量损失的治疗方法 |
正在进行的20亿期QUALITY临床研究 |
||
| 肿瘤学候选药物-乳腺 | ||||
| Enobosarm -选择性雄激素受体调节剂,含或不含abemaciclib CDk 4/6抑制剂 | AR+ ER+ HER 2-转移性乳腺癌(二线转移性环境) | 计划的第3阶段启用-2 | ||
| 病毒相关的急性呼吸窘迫综合征 | ||||
| 萨比扎布林-口腔微管破坏剂,广泛宿主靶向抗病毒和抗炎剂 | 轻度至重度病毒诱导的急性呼吸窘迫综合征住院患者 | 计划的3期 | ||
| 性健康计划商业产品 |
||||
| FC 2女性避孕套®(内部避孕套) |
意外怀孕并预防性传播感染 |
销售 |
||
我们的临床试验计划和代谢性疾病、肿瘤学和急性呼吸窘迫综合征候选药物:
肥胖和超重计划- Enobosarm
科学概述。据报道,在评估目前批准的GLP-1 RA用于肥胖患者的第三方临床试验中,试验参与者显示出显著的体重减轻,包括脂肪和瘦(肌肉和骨骼)质量的减少。在某些第三方临床试验中报告的总体重下降中,20-50%的总体重下降可归因于瘦体重(肌肉)的下降。根据疾控中心的数据,41.5%的老年人患有肥胖症,可以从减肥药中受益。在美国60岁以上的肥胖患者中,高达34.4%的人患有骨质源性肥胖。骨肉源性肥胖患者是同时患有肥胖和低肌肉质量的患者,在服用目前批准的GLP-1RA时,他们可能面临发展为极度低肌肉质量的最大风险。严重肌肉质量不足的患者可能会经历肌肉无力导致平衡不良、步态速度减慢、行动不便、摔倒、骨折和死亡率增加。因此,我们认为迫切需要一种药物,可以改善目前批准的GLP-1 RA疗法的肌肉萎缩效应,并允许有风险的骨脂性肥胖和超重的老年患者优先减少脂肪质量。虽然老年人患骨质疏松症和骨质疏松症的风险更高,但在与FDA的讨论中,Veru打算最终寻求在所有年龄段都能受益的最广泛人群中获得批准,而不是将适应症限制在60岁以上的患者身上,因为服用GLP-1受体激动剂的年轻肥胖症患者(包括有生育潜力的女性)可以受益于enobosarm的潜在肌肉保护作用。
Enobosarm是一种口服新型SARM,已证明身体成分具有组织选择性、剂量依赖性改善,增加瘦质量和减少脂肪质量,改善肌肉力量和身体功能,改善胰岛素抵抗,对女性没有临床相关的男性化作用,并且在之前的临床试验中对男性具有中性前列腺作用。
晚期癌症会导致食欲不振,精瘦体重和脂肪体重都会显著减少。Enobosarm已经在五个独立的第三方临床试验中进行了评估,在这些试验中,瘦质量测量是主要或共同的主要终点。这些第三方临床试验包括两项针对健康老年人或肌肉量减少受试者的2期临床试验(168名受试者)和1项针对因癌症导致肌肉萎缩的受试者(800名受试者)的20期亿临床试验和2项3期临床试验,总共产生了968名患者的瘦体重和安全性数据。在这些试验中的某些试验中,Enobosarm显示出剂量依赖性的身体成分改善,瘦质量增加,脂肪质量减少。例如,在评估60岁以上男性和绝经后女性治疗12周的第二阶段临床试验中,服用3 mg剂量的Enobosarm的患者(n=24)表现出统计上显著的(I)总瘦体重增加(平均增加1.25公斤(p=<0.001))和(Ii)总脂肪重量减少(平均减少0.32公斤(p=0.049))。当通过阶梯攀登试验测量身体功能时,在这项试验中,使用试验方案中规定的第二种统计分析方法,接受3毫克剂量的enobosarm的患者也显示出与安慰剂(p=0.049)相比的统计显著改善。基于一个大型安全数据库,其中包括1581名男性和女性,治疗持续时间长达3年,到目前为止,在完成的临床试验中,Enobosarm总体上耐受性良好。然而,到目前为止,还没有完成评估Enobosarm和GLP-1 RA组合的临床前研究或临床试验。根据田纳西大学研究基金会的委托,所有关于enobosarm的非临床和临床疗效和安全性数据,包括由这五个第三方临床试验产生的数据,都归Veru所有。
我们相信,我们拥有的临床数据是在老年患者以及食欲不振引起的初始和持续肌肉萎缩的患者中进行的enobosarm第三方临床试验中产生的,为在高危肌肉减少性肥胖或超重老年患者中联合给药enobosam和GLP-1 RA提供了强有力的临床依据,有可能改善目前批准的GLP-I引起的肌肉损失。1 RA疗法,并且还允许更好地优先减少脂肪质量。
2024年1月,我们为20期亿临床研究提交了Enobosarm的研究性新药申请(IND)。2024年2月,该公司获得美国食品和药物管理局的批准,可以启动20期赛马路德(Wegoy®)的亿多中心、双盲、安慰剂对照、随机、剂量发现的高质量临床试验,旨在评估Enobosarm 3 mg、Enobosarm 6 mg或安慰剂作为一种增加脂肪损失和防止肌肉丢失的治疗方法的安全性和有效性。主要终点是总瘦身质量与基线的百分比变化,关键次要终点是16周时通过爬楼梯试验测量的总体脂肪质量、总体重和身体功能与基线的百分比变化。2024年4月,该公司宣布其首批患者参加了20期亿质量临床研究,2024年8月,该公司在美国14个临床站点完成了168名受试者的登记,预计2025年1月试验的TOPLINE临床结果。20期肥胖质量临床试验的目的是选择最佳剂量的enobosarm与赛马路德(wegoy®)联合治疗16周后最能保存肌肉和减少脂肪的亿,以进入肥胖症3期临床试验。
在完成20亿期QUALITY临床试验的疗效剂量探索部分后,预计参与者将继续进入200亿期扩展试验,所有患者将停止接受索马鲁肽(Wegovy®)治疗,但将继续服用安慰剂、3毫克埃诺波沙姆或6毫克埃诺波沙姆盲法12周。这项200亿期扩展临床试验将评估enobosarm是否可以维持肌肉并防止脂肪和体重的恢复,而脂肪和体重的恢复通常会发生在停止GLP-1 RA后。另一项盲法200亿期扩展临床研究的总体结果预计将于2025年第二季度公布。
新型埃诺博斯姆缓释口服制剂。 Veru目前正在开发一种新型的、可获得专利的enobosarm改释制剂,可在24小时给药期内多次释放。 我们预计实际配方、药代动力学释放曲线和制造方法将成为未来专利的主题。 修改的目的是创建一致的释放曲线,其最大暴露量显着降低,并延长释放曲线,以最大限度地减少任何剂量相关不良事件,同时促进患者在整个24小时内在剂量之间充分暴露于制剂。 该配方目前正在进行动物试验,预计将于2025年上半年用于I期生物利用度临床试验。我们预计口服enobosarm缓释药物制剂将用于任何3期肥胖临床研究。
市场。在美国,37%的成年男性和40.4%的成年女性患有肥胖症(CDC 2022)。在评估目前批准的GLP-1 RA用于肥胖患者的第三方临床试验中,试验参与者显示出显著的体重减轻,包括脂肪和瘦(肌肉)质量的减少,患者报告的总体重减少的20%-50%可归因于瘦质量减轻。正在开发Enobosarm,通过优先增加脂肪损失,防止接受GLP-1受体激动剂药物治疗的高危患者的瘦体重和身体功能损失来优化体重减轻。因此,enobosarm针对的是可能已经有低肌肉质量的老年肥胖或超重患者,也称为肌源性肥胖,所有重要肌肉的肌肉质量进一步下降会增加肌肉无力、功能受限、行动不便、跌倒、住院和死亡率增加的风险。在美国,高达41.5%的老年人(>60岁)患有肥胖症(CDC),其中高达34.4%的患者还患有骨质疏松症或肌肉储备不足。在美国,肥胖和低瘦肌肉质量的总体流行率几乎是3,000万成年人。
肿瘤学项目 – 乳腺癌:Enobosarm
科学概述。乳腺癌是女性最常诊断的癌症,根据美国癌症协会2024年乳腺癌事实和数据,预计2024年美国将有313,510例新病例和42,780例女性和男性因侵袭性乳腺癌死亡。乳腺癌是一种异源性疾病,具有多种临床和分子特征。雌激素是乳腺癌扩散、肿瘤进展和转移的主要驱动因素之一。高达85%的乳腺癌为ER+,因此,雌激素是乳腺癌增生、肿瘤进展和转移的主要驱动因素之一。因此,靶向雌激素受体(ER)的治疗一直是乳腺癌治疗的主流,但不幸的是,随着肿瘤进展,几乎所有女性的乳腺癌最终都会对内分泌疗法产生耐药性,并且需要替代治疗方法,包括静脉化疗。
针对AR有可能成为乳腺癌女性的下一个重要内分泌疗法。1)AR是乳腺癌中表达最丰富的类固醇受体,在70%至95%的乳腺癌样本中检测到; 2)雄激素受体激动剂抑制细胞增生并在ER+人类乳腺癌模型中具有抗肿瘤功效;和3)乳腺癌样本中AR的存在预示着有利的无病生存期和总体生存期。
Enobosarm是一种治疗晚期乳腺癌的新型内分泌疗法。Enobosarm是一种口服新化学实体、选择性雄激素受体调节剂,旨在激活AR+ ER+ HER 2-转移性乳腺癌中的AR,从而抑制肿瘤生长,而不会产生不必要的雄性化副作用。Enobosarm拥有丰富的非临床和临床经验,已在约1,581名接受治疗的受试者中进行了27项单独的临床研究中进行了评估,其中包括涉及超过191名患者的3项晚期乳腺癌II期临床试验。在一项针对AR+ ER+ HER 2转移性乳腺癌女性进行的II期临床试验中,enobosarm在经过大量预治疗的队列中表现出显着的抗肿瘤功效,这些队列使用雌激素阻断剂、化疗和/或CDk 4/6抑制剂失败,并且耐受性良好,安全性良好。
目前对ER+HER2转移性乳腺癌一线治疗的标准是联合使用CDK4/6抑制剂和雌激素阻滞剂。一旦患者在接受这种联合治疗时病情恶化,FDA批准的治疗选择仅限于另一种雌激素阻滞剂或化疗。由于高达95%的ER+HER2转移性乳腺癌有雄激素受体,我们正在开发Enobosarm作为另一种不同的激素疗法,用于ER+HER2转移性乳腺癌的二线治疗。在临床前研究中,从对CDK4/6抑制剂和雌激素阻滞剂产生抗药性的ER+HER2转移性乳腺癌患者身上采集的转移性乳腺癌组织样本在小鼠中培养。在这些小鼠中,依诺单抗与CDK4/6抑制剂联合治疗对人类转移性乳腺癌的生长抑制作用强于单独使用CDK4/6抑制剂。此外,单用Enobosarm治疗也能有效地抑制CDK4/6抑制剂和雌激素阻滞剂耐药的人转移性乳腺癌小鼠肿瘤的生长。
Enobosarm用于治疗AR+ ER+ HER 2-转移性乳腺癌。 在针对AR+ ER+ HER 2转移性乳腺癌女性进行的两项II期临床研究中,enobosarm在接受大量预治疗的队列中表现出显着的抗肿瘤功效,并且耐受性良好,安全性良好。
第二阶段临床试验(G200802)是一项双臂研究,评估了136名AR+ER+HER2转移性乳腺癌患者每天口服9毫克和18毫克依诺波的疗效。这项研究中的患者也接受了大量的预治疗,平均3.7次内分泌治疗失败,90%的患者之前接受过化疗,12%的患者之前接受过CDK4/6抑制剂的治疗。依诺单抗在6个月时CBR为32%(95%可信区间19.5%,46.7%),18 mg队列为29%(95%可信区间17.1%,43.1%)。9 mg组未达到临床受益持续时间的中位数(8.2个月-未达到),18 mg组为14.1个月(11个月-16.5个月)。在已知AR状态和可测量疾病的人群(n=84)中,也进行了使用G200802中使用的AR测试测量的后自组织AR表达子集分析。目的肿瘤反应与%AR染色程度相关。以40%AR染色为界值,≥患者24周时40%AR为52%,<40%AR为14%(P<0.0004)。≥40%AR染色受试者总有效率为34%,AR<40%受试者为2.7%(P=0.0003)。≥40%AR组的中位无进展生存期为5.47个月(95%CI2.83~11.13),而<40%AR组的中位无进展生存期为2.73个月(95%CI2.63~2.80)(P<0.001)。Enobosarm治疗耐受性良好,对生活质量测量有显著的积极影响。9毫克组的安全性略好于18毫克组。
总而言之,在接受大量预治疗的AR+ ER-HER 2转移性乳腺癌女性人群中,使用一种新型口服选择性雄激素受体调节剂enobosarm治疗产生了具有临床意义的客观肿瘤反应、生活质量改善和良好的安全性。AR核染色%越高,抗肿瘤活性越大。通过靶向和激活具有足够AR表达的乳腺癌肿瘤中的AR,可以确定最有可能对enobosarm治疗产生反应的转移性乳腺癌女性。总体而言,这些enobosarm研究清楚地确立了用选择性AR激动剂靶向AR的临床相关性。Enobosarm为已经用尽靶向ER的内分泌疗法但在静脉化疗之前使用过的乳腺癌患者推出了一种新型内分泌疗法。
发展计划:当前和计划中的临床试验。如果有足够的资金可用,我们计划完成与雌激素阻滞剂(主动对照)相比,与阿贝西利联合使用的Enobosarm暂停临床开发的第10阶段亿。如果enobosarm+abemaciclib联合治疗在ORR方面有显著改善,这被认为是临床受益的替代终点,那么我们可能会与FDA会面,根据来自3期临床试验的临床数据考虑加快批准监管路径。加速批准研究产品是FDA的自由裁量权。因此,即使我们认为我们的候选产品之一符合这一批准途径的标准,FDA也可能不同意,而是决定不进行此类指定。此外,即使我们收到了指定,对候选产品的指定可能不会比根据FDA传统程序考虑批准的产品更快的开发或监管审查或批准过程,也不能确保FDA的最终批准。此外,即使我们的一个或多个候选产品有资格获得这些认证,FDA可能会在以后决定这些候选产品不再符合资格条件,或决定FDA审查或批准的时间段不会缩短。不能保证FDA将接受我们提议的试验设计,不能保证我们能够以经济高效的方式继续开发Enobosarm,也不能保证Enobosarm将获得FDA的批准或将其商业化。
市场。Enobosarm代表了第一类治疗晚期乳腺癌的新型靶向内分泌疗法,因为它不针对雌激素。Enobosarm针对AR+ ER+ HER 2-转移性乳腺癌中的AR,作为潜在的二线每日口服内分泌治疗。对于激素受体阳性转移性乳腺癌患者来说,无论是否使用CDk 4/6抑制剂,Enobosarm都可能成为一种新的重要选择,这些患者已经用尽了针对雌激素或ER的内分泌疗法,但在静脉化疗之前。
传染病计划 – 萨比沙布林治疗轻度至重度病毒诱导的急性呼吸窘迫综合征住院患者
我们正在开发萨比布林9 mg,它具有宿主靶向抗病毒和广泛的抗炎特性,作为一种双管齐下的方法,用于治疗具有ARDS和死亡高风险的病毒性肺部感染住院患者。我们已经完成了新冠肺炎阳性2期和阳性3期临床试验,这些试验已经证明,在住院的中重度新冠肺炎病毒性肺部感染患者中,萨比布林的治疗降低了死亡率,这些患者具有急性呼吸窘迫综合征和死亡的高风险。美国食品和药物管理局于2022年1月授予我们的新冠肺炎项目快车道称号。2022年5月10日,我们与美国食品和药物管理局举行了欧盟审批前会议,讨论下一步行动,包括提交新冠肺炎的萨比布林欧盟审批申请。2022年6月,我们提交了FDA紧急使用授权申请。2023年2月,FDA拒绝批准我们对萨比布林的紧急使用授权。2023年9月,我们从FDA收到了关于评估萨比布林治疗病毒诱导的ARDS的3期临床试验设计的积极反馈。
然而,我们目前计划优先使用内部现金和任何未来融资的净收益用于enobosarm的发展,近期的主要重点是资助临床开发计划,以评估enobosarm作为一种治疗方法的安全性和有效性,以增加接受GL-1 RA的肌肉减少性肥胖或超重老年患者的脂肪损失并预防瘦质量损失-出现肌肉萎缩和肌肉无力的风险,并通过政府拨款、制药公司合作伙伴关系或类似来源寻求外部资金,以推进萨比沙布林治疗病毒诱导的急性呼吸窘迫综合征的开发。如果没有此类外部资金,我们不计划推进萨比扎布林作为病毒诱导的急性呼吸窘迫综合征治疗方法的开发,也不会开始评估萨比扎布林在病毒诱导的急性呼吸窘迫综合征中的治疗方法的III期临床试验。
无法保证我们能够通过政府拨款、制药公司合作伙伴关系或类似来源获得外部资金,无法保证我们能够以经济有效的方式继续开发萨比沙布林,或者萨比沙布林将获得FDA的批准或商业化。
性健康计划
该公司的性健康计划由FC 2组成,这是唯一一款获得FDA批准的、女性控制的、不含杀虫剂且不含乳胶的女性避孕套,用于预防怀孕和性传播感染(包括艾滋病毒/艾滋病)。
产品. FC 2是FDA批准的唯一一次性内部避孕套,用于预防怀孕、性传播感染(STIs),包括艾滋病毒/艾滋病。它是预先润滑的,也是女性唯一可用的非激素、无乳胶避孕药选择,可以单独使用或与大多数其他形式的避孕药结合使用,提供“分层”好处。由于《平价医疗法案》,它易于使用,并且由大多数保险公司承保,自付费用为零。
FC 2比天然橡胶乳胶(男性避孕套中最常用的原材料)具有多个优点。FC 2的丁胶聚合物比乳胶更坚固,降低了女性避孕套在使用过程中撕裂的可能性。与乳胶不同,FC 2的丁聚糖聚合物能够快速传递热量。FC 2在插入后可以立即升温至体温,这可以增强用户的感觉和愉悦感。与男用避孕套不同,FC 2可以在性交前插入,从而消除性亲密期间的干扰。FC 2也是乳胶敏感使用者的替代方案,这些使用者无法在不刺激的情况下使用避孕套。据公司所知,目前尚无对丁氧聚合物过敏的报告。预计到2030年,全球避孕套市场的非乳胶部分增长速度将快于乳胶部分,累计年增长率为10%。
FC 2由该公司专有的丁胶聚合物配方制成,由一个柔软、宽松的外皮和两个环组成:一个由轧制丁胶制成的外环和一个由柔性聚氨酯制成的松散的内环。FC 2的柔软外皮衬在阴道上,防止性交过程中皮肤与皮肤接触。它的外环保留在阴道外,部分覆盖外生殖器。内部环用于插入,并有助于在使用过程中将设备保持就位。
在美国,FC 2可通过远程医疗和互联网药房渠道以及零售药房按处方购买。该公司推出了自己的专门直接面向患者的远程医疗和药房服务门户/平台,以继续推动销售增长。FC 2也适用于州卫生部门和501(c)(3)组织等公共卫生部门实体。
目前,该公司的大部分净收入来自商业和公共卫生领域的FC 2销售。
美国市场. 由于FC 2具有预防怀孕和/或性传播感染和艾滋病毒/艾滋病的双重适应症,约有5400万18-49岁女性代表目标市场。据疾病预防控制中心称,数据显示,2021年美国的性传播感染人数持续增加,连续第六年达到250万,创历史新高。2022年,利率总体保持水平。
FC 2是FDA唯一批准上市的女性使用产品,可预防意外怀孕和性传播感染(包括艾滋病毒/艾滋病)的传播。虽然我们相信市场条件有利于持续增长,但由于行业整合导致数字远程医疗客户的销量下降,该品牌的销售额有所下降。因此,公司建立了自己的专用直接面向患者的数字远程医疗(远程医疗是通过电信技术对患者进行远程诊断和治疗)平台,以高性价比且高度便捷的方式将我们急需的FC 2产品带给患者。我们仍然专注于通过我们专用的远程医疗解决方案在未来几个季度增加FC 2销售额和收入,同时利用机会帮助夫妇更好地了解FC 2如何帮助他们控制自己的性健康和生殖健康。
根据《平价医疗法案》(ACA),FC 2目前可以通过处方报销。ACA指南要求健康计划以100%的价格支付FDA在其当前的避孕指南中确定的16种不同类别中的每一种避孕措施,其中FC 2属于自己的一个独立类别。由于FC 2不含激素,因此对于许多对激素避孕的副作用不满或正在寻求FC 2提供的分层(即预防性传播感染)好处的美国女性来说,它是一个可行的替代方案,因为它可以与许多其他形式的避孕药一起使用。
我们已经建立了基础设施,以便在美国各地广泛使用。因此,FC 2现在可以通过多种访问渠道获得,包括:95%的主要零售药店、社区组织、处方、大学、直接购买和3400亿合格医疗保健诊所,并直接向公共卫生部门提供。此外,我们正在执行数字和社交营销策略,旨在提高品牌兴趣、意识和教育;解决对品牌的误解;最终,帮助确保女性知道她们可以轻松访问FC 2并且可以全额报销。
全球公共卫生部门市场. 在全球公共部门,FC 2已获得世界卫生组织(WHO)批准供联合国机构购买,因为它是一种多用途预防技术,可以预防意外怀孕和包括艾滋病毒/艾滋病在内的性传播感染。该公司向卫生部、政府卫生机构、联合国机构、非营利组织和商业合作伙伴等实体推销FC 2,这些实体致力于支持和改善世界各地女性的生活、健康和福祉,因为各国政府和组织免费或低成本地向那些需要但无力购买此类产品的人提供FC 2等关键产品。
该公司目前在全球公共卫生领域拥有数量有限的客户,其中包括大型全球机构,例如联合国人口基金(人口基金)和美国国际开发署(USAID)、巴西卫生部,以及公司在巴西的分销商Semina Indústria e Comércio Ltda(Semina),以及通过该公司的各个当地分销商进行采购的南非共和国卫生当局。全球公共卫生部门的其他客户包括卫生部或其他政府机构,它们直接或通过国内分销商、当地性健康分销商和非政府组织(NGO)购买。
该公司已在全球销售超过75000万个女性避孕套,FC 2已在美国和其他149个国家分销。需求潜力最大的国家相当一部分位于发展中国家。这些国家的艾滋病毒/艾滋病、其他性传播感染和意外怀孕的发病率代表着一种产品的巨大销售潜力,该产品造福世界上一些最贫困的人。然而,这些国家的情况可能不稳定,导致项目开发、投标申请和处理订单出现不可预测的延迟。
该公司与商业合作伙伴签订了分销协议和其他安排,通过巴西、西班牙、法国和英国等多个国家的分销商和零售商将FC 2作为消费者健康产品进行销售。这些协议通常仅限于单个国家。根据这些协议,该公司将FC 2出售给分销商合作伙伴,后者在既定地区向消费者营销和分销产品。
出售ENTADFI®
该公司还有另一种FDA批准的产品,ENTADFI®(非那雄胺和他达拉非)口服胶囊,这是一种治疗良性前列腺增生症的新药物,于2021年12月获得FDA批准。该产品是该公司性健康计划的一部分。于2023年4月19日,本公司与前称Blue Water Vaccines Inc.(“ONCO”)订立资产购买协议(“资产购买协议”),出售实质上与ENTADFI有关的所有资产。这笔交易于2023年4月19日完成。交易的收购价为2,000万美元,其中包括成交时支付的6,000万美元,根据2023年9月30日到期的本票支付的4,000万美元,根据2024年4月19日到期的本票(“2024年4月本票”)应付的500万美元,以及根据2024年9月30日到期的本票(“2024年9月本票”和2024年4月的本票,“万期票”)支付的5,000万美元,以及根据ONCO成交后的ENTADFI净收入计算的至多8,000万美元(“里程碑付款”)。该公司目前无法确定收到任何里程碑式付款的可能性。
2023年9月29日,公司对资产购买协议进行了修订。该修正案对资产购买协议进行了修改,规定2023年9月30日到期的400万美元购买价格分期付款的期票被视为已支付并完全满足:(1)于2023年9月29日向公司支付了100万美元的立即可用资金,以及(2)在10月3日之前向公司发行,2023年发行3,000股ONCO A系列可转换优先股(“ONCO优先股”)。该公司于2023年9月29日收到100万美元的付款,并于2023年10月3日收到ONCO优先股。公司持有的ONCO优先股股份于2024年9月24日转换为142,749股ONCO普通股。
于2024年4月24日,本公司与ONCO订立了一份忍让协议,该协议于2024年9月19日修订及重述(经修订及重述的“忍耐协议”),涉及ONCO本票的若干违约事项。根据忍耐协议,(A)ONCO同意不迟于2024年4月29日支付2024年4月29日本票项下应付本金的50,000美元,并于2024年4月25日付款;及(B)本公司同意,在忍耐协议所载条款和条件的规限下,因ONCO未能于2024年4月19日到期支付2024年4月本票项下到期款项,本公司同意不再行使其权利和补救办法。由于ONCO未能根据ONCO本票支付可能已到期或可能到期的与ONCO收购Proteomedex AG有关的某些交易的任何强制性偿还,在每种情况下,自2024年4月24日开始至(A)至2025年3月31日及(B)违约事件(定义见容忍协议)发生之日止的期间(“2024年4月宽限期”)。本公司还同意,在宽限期内,ONCO本票中关于ONCO资不抵债的违约条款将不适用。
ONCO在容忍协议中同意在2024年4月的宽限期内首先支付2024年4月本票下的应计和未付利息,然后支付2024年4月本票未偿还本金的任何余额:(1)ONCO或其子公司从某些销售或许可收入或付款中获得的现金收入的每月付款相当于25%(从最初的2024年4月24日宽容协议中的15%增加),这一增加的金额从2024年10月20日开始;及(2)支付ONCO或其任何附属公司在2024年4月宽限期内完成的某些融资或其他交易所得款项净额的20%(较最初的2024年4月24日宽限期协议中的10%为高),这笔款项从2024年9月19日后收到的任何净收益开始增加。2024年4月期票的剩余余额将在2024年4月宽限期结束时到期。本公司与ONCO于二零二四年十一月二十六日订立豁免及容忍协议第1号修正案,(X)延长ONCO每月支付本段第(1)款所述其现金收入某个百分比的时间,并以ONCO能够筹集至少97,000元资本为条件支付该等款项;及(Y)将应付予本公司的若干融资所得款项净额的百分比由20%提高至25%。
ONCO和公司还同意在容忍协议中对2024年9月本票进行以下修订:(1)2024年9月本票的到期日延长至2025年6月30日;(2)2024年9月本票的任何未偿还本金余额从2024年10月1日开始至2024年9月本票未偿还本金余额全额支付之日按10%的年利率计息;(3)2024年9月本票的任何欠款,包括但不限于未付本金和应计利息,将以现金支付,或经ONCO和本公司双方书面同意,以ONCO普通股或现金和ONCO普通股的组合支付;(4)在全额偿还2024年4月本票的所有本金和利息后,ONCO将首先支付2024年9月本票的应计和未付利息,然后支付2024年9月本票应支付的剩余本金余额;以及(5)如果2024年4月本票和2024年9月本票项下的未偿还本金总额及其所有应计和未付利息在2024年12月31日或之前以现金偿还,则ONCO为履行2024年9月本票项下的义务而应支付的2024年9月本票项下的本金余额总额将从5,000,000美元减少到3,500,000美元。
无法保证(1)我们是否以及何时将收到资产购买协议项下的购买价格或销售里程碑付款的未来分期付款,以及(2)我们是否以及何时将能够从我们可能不时持有的ONCO普通股股份中收到任何现金收益。
在交易进行时和2024年9月30日,公司确定不太可能收回资产购买协议下承诺的几乎所有对价。因此,公司将已收到的不可退还对价与资产的公允价值之间的差额确认为收益。2023财年,该公司在该交易中录得约570万美元的收益。截至2024年9月30日止年度,该公司根据收到ONCO优先股时的公平市场价值以及根据《克制协议》和修订后的《克制协议》从ONCO收到的现金的确定,确认了120万美元的销售收益。如果收到额外对价或认为有可能收取几乎所有承诺对价,则可以在未来期间确认额外收益。
政府监管
FDA以及州和地方司法管辖区以及外国的类似监管机构对药品和医疗器械的临床开发、制造和营销提出了严格要求。这些机构和其他联邦、州和地方实体监管我们产品的研发活动以及测试、制造、质量控制、安全性、有效性、标签、存储、记录保存、跟踪、批准、进口、出口、广告和促销。
FDA对女性避孕套的监管. FC 2于2009年通过上市前批准申请(PMA)获得FDA批准,作为III类医疗器械上市。2018年9月21日,FDA发布最终命令,将女性避孕套从第三类医疗器械重新分类为第二类医疗器械,将其重新命名为“一次性内部避孕套”,并要求该类别的新器械提交510(k)上市前通知并遵守各种“特殊控制”。特殊控制是一系列产品临床测试,包括但不限于确定产品对怀孕和性传播感染传播的有效性以及产品耐受性。寻求新一次性内部避孕套获得批准的公司现在可以通过在510(k)提交材料中向FDA证明拟议的避孕套在预期用途和技术方面实质上等同于FC 2来实现这一目标。
所有经FDA批准或批准的上市设备都受到FDA的持续监管。例如,我们被要求向FDA注册我们的制造企业,并向FDA将FC2列为商业分发设备。我们必须遵守FDA的质量体系法规(QSR),该法规要求在制造、测试和控制活动等方面以规定的方式制造设备并保持记录。我们必须遵守医疗器械报告(MDR)法规,该法规要求,只要有证据合理地表明我们的FC2设备之一可能导致或促成了死亡或严重伤害,或者如果故障再次发生,很可能会导致或促成死亡或严重伤害,我们就必须向FDA提供信息。我们还必须维护FC2的任何更正或移除的记录,并向FDA报告某些更正或移除。此外,我们还必须遵守FDA在标签、促销和广告方面的要求。未来对FC2的设计、组件、制造方法或标签的任何修改,如果可能显著影响其安全性或有效性,或将构成其预期用途的重大变化,则需要新的510(K)许可。不遵守这些要求,除其他外,可能导致罚款、禁令、民事处罚、召回、完全或部分停产以及刑事起诉。
由于FC 2是一种商业分销的医疗器械,因此制造和测试FC 2的设施定期接受FDA检查,以确保符合监管要求,包括QSR和MDR法规。该公司最近对其英国进行了FDA检查和马来西亚设施分别于2010年9月和2019年11月竣工。我们还根据医疗器械单一审计计划(MDSAP)进行审计,该计划是FDA认可的审计标准。我们持有CE市场的MDR认证和ISO 13485。
FDA对处方药产品的监管。 候选药品在美国上市之前,FDA要求的流程通常包括以下内容:
| ● |
非临床实验室和动物测试,包括一些必须按照药物非临床研究质量管理规范进行的测试; |
| ● |
提交IND,该IND必须在临床试验开始前生效; |
| ● |
充分且控制良好的人体临床试验,以确定拟议候选药物用于其预期用途的安全性和有效性; |
| ● |
对生产设施和选定的临床研究者进行批准前检查,以确定其是否符合现行药品生产质量管理规范(GMP)和现行药品临床质量管理规范(cGCP);以及 |
| ● |
FDA批准NDA,允许特定适应症的商业营销。 |
测试和审批过程需要大量的时间、精力和财力。在开始候选药物的第一次临床试验之前,我们必须向FDA提交IND。IND在FDA收到后30天自动生效,除非FDA在30天内通过强制临床搁置对临床试验的进行提出安全担忧或问题。在这种情况下,IND赞助商和FDA必须在临床试验开始之前解决任何悬而未决的问题。提交IND可能不会导致FDA授权开始临床试验。在产品开发期间进行的每一项后续临床试验都必须单独提交给现有的IND。此外,建议进行临床试验的每个医学中心的独立机构审查委员会(IRB)必须在该中心临床试验开始之前审查和批准任何临床试验的计划及其知情同意书。监管当局、IRB或赞助商可随时以各种理由暂停临床试验,包括发现受试者或患者面临不可接受的健康风险。一些研究还包括数据安全监测委员会(DSMB)或独立数据监测委员会(IDMC),该委员会在临床试验期间接受对非盲目数据的特殊访问,如果确定对受试者存在不可接受的安全风险或其他原因,如没有疗效证明,可能会停止临床试验。
一般来说,为了获得NDA批准,人体临床试验通常分三个可能重叠的连续阶段进行。
| ● |
第一阶段-研究最初是为了测试候选药物在健康志愿者或患者中的安全性、剂量耐受性、吸收、代谢、分布和排泄。 |
| ● |
第二阶段-对患有特定疾病或病症的患者组进行研究,以提供足够的数据来评估初步疗效、最佳剂量和给药方案以及扩大的安全性证据。在开始更大、更昂贵的3期临床试验之前,可能会进行多项2期临床试验以获取信息。 |
| ● |
第三阶段--这些临床试验在更大的患者群体中进行,以进一步评估剂量,提供临床疗效的统计显著证据,并在多个临床试验地点进一步在扩大的患者群体中测试安全性。这些临床试验旨在确定产品的总体风险/收益比,并为产品标签提供充分的基础。这些试验可以在全球范围内进行,以支持全球注册。在极少数情况下,单一的3期或2期试验可能就足够了,包括(1)试验是一项大型的多中心试验,表明内部一致性,并在统计学上有说服力地发现对死亡率、不可逆转的发病率或疾病的预防具有临床意义的影响,并具有潜在的严重后果,而在第二次试验中确认结果实际上或在伦理上是不可能的,或(2)结合其他确认性证据。在单一试验的基础上批准可能需要进行额外的批准后研究。 |
产品获得批准后,FDA可能会要求或公司可能会进行额外的临床试验。这些4期研究在批准后可能会成为满足的条件。4期研究的结果可以确认候选药物的有效性,并可以提供重要的安全性信息。
在临床试验的同时,公司通常会完成额外的动物研究,并且还必须开发有关候选药物化学和物理特征的额外信息,并根据GMP要求最终确定商业批量生产产品的工艺。生产工艺必须能够稳定地生产候选药物的优质批次,并且必须开发测试最终产品的同一性、强度、质量和纯度的方法。此外,必须选择和测试适当的包装,并进行稳定性研究,以证明候选药物在保质期内不会发生不可接受的变质。
紧急使用授权。卫生与公众服务部部长可授权未经批准的医疗产品在政府指定的实际或潜在紧急情况下制造、营销和销售。紧急状态宣布后,卫生与公共服务部部长可根据法规确立的标准授权EUA使用特定产品,包括当没有足够、批准和可用的替代产品时,所涉产品可能在诊断、治疗或预防严重或危及生命的疾病方面有效。EUA受到其他条件和限制的约束,例如有义务为管理该产品的医疗保健提供者和接受该产品管理的人提供情况说明书,不良事件监测和报告,以及产品制造商的记录保存和报告要求。FDA还可以设立FDA认为对保护公众健康必要或适当的额外酌情授权条件,包括与产品分销、产品管理和数据收集以及有关产品安全性和有效性的分析有关的条件。在发布EUA时,FDA考虑关于质量、安全性和有效性的所有可用科学证据,包括此类产品的已知和潜在风险,以及经批准的替代品的充分性和可用性等因素。EUA不能替代获得FDA批准、许可或产品使用许可。欧盟协议在紧急决定终止时终止,在其他情况下,欧盟协议可被撤销,其时间可能意外发生或难以预测。在FDA拒绝了该公司用于治疗新冠肺炎的萨比布林的EUA申请之后,该公司预计不会为其目前正在开发的任何候选药物申请EUA。
在美国以外,医疗产品的紧急使用须遵守与美国不同的监管流程和要求。这些流程和要求因国家而异、地区而异、监管机构而异。
505(B)(2)审批流程。 联邦食品、药物和化妆品法案(FDCA)第505(B)(2)节是1984年《药品价格竞争和专利期限恢复法》(又称《哈奇-瓦克斯曼法案》)的一部分,它为FDA批准以前批准的药物产品的新配方或改进配方或新用途提供了一个快速的监管途径。具体地说,第505(B)(2)条允许在至少部分批准所需的信息来自不是由申请人或为申请人进行的研究,并且申请人没有获得参考权的情况下,提交保密协议。申请人可以依赖FDA对作为参考上市药物(RLD)的批准产品的安全性和有效性的调查结果。FDA可以要求505(B)(2)申请者进行额外的研究或提供其他数据来支持RLD的任何变化。然后,FDA可以为参考产品已被批准的所有或部分标签适应症以及第505(B)(2)节申请人寻求的任何新适应症批准新药候选。该公司目前正在开发的候选药物预计都不会遵循第505(B)(2)条的批准途径。
橙色图书清单。在通过保密协议(包括505(B)(2)保密协议)寻求药物批准时,申请人被要求向FDA列出其权利要求涵盖申请人产品的某些专利。一旦获得保密协议的批准,药物申请中列出的每一项专利都将在经批准的药物产品及其治疗等效性评价,通常被称为橙色书。任何申请人提交涉及橙皮书中所列药物的505(B)(2)保密协议,必须向FDA证明:(I)尚未提交所需的专利信息;(Ii)所列专利已到期;(Iii)所列专利尚未到期,但将在特定日期到期,且直到专利到期后才寻求批准;或(Iv)所列专利无效、不可强制执行或不会受到拟议新产品的侵犯。这最后一项认证被称为第四段认证。如果竞争对手已经向FDA提供了第IV段认证,一旦申请被FDA接受备案,竞争对手还必须向RLD的NDA持有人和专利所有者发送关于第IV段认证的通知。保密协议持有人或专利权人随后可以针对第(4)款证明的通知提起专利侵权诉讼。在收到第四款认证后45个月内提起专利侵权诉讼,将阻止FDA在诉讼日期、专利到期、诉讼和解或侵权案件中做出有利于申请人的裁决之日起30个月内批准申请。申请人也可以选择提交一份“第八节声明”,证明其建议的标签不包含或刻出任何与专利使用方法有关的语言,而不是证明所列出的使用方法专利。
505(b)(1)批准流程。 根据FDCA第505(b)(1)条进行的药物开发通常用于之前尚未获得FDA批准在美国商业销售的新药,或之前获得FDA批准在美国商业销售的药物的新适应症。505(b)(1)药物开发规定,批准所需的所有研究均由公司或为公司进行。Enobosarm作为一种治疗方法,可增加接受GLP-1 RA的肌肉减少性肥胖或超重老年患者的脂肪损失并预防肌肉损失,Enobosarm治疗AR+ ER+ HER 2-转移性乳腺癌,而sabazabulin治疗某些住院患者预计将遵循这一调节途径。
食品和药物管理局提交的保密协议和审查。产品开发、非临床研究和临床试验的结果作为NDA的一部分提交给FDA。提交保密协议需要向FDA支付一笔可观的使用费。FDA可能会召集一个咨询委员会,就申请审查问题提供临床见解。FDA审查申请,以确定产品对于其预期用途是否安全有效,以及制造控制是否足以确保和保持产品的特性、强度、质量和纯度。在批准保密协议之前,FDA将检查生产该产品的一个或多个设施。FDA将不会批准申请,除非它确定制造工艺和设施符合cGMP要求,并足以确保产品在所要求的规格下一致生产。一旦NDA提交被接受以供备案,这发生在NDA提交后60天内,FDA的目标是完成对第505(B)(2)或505(B)(1)项下的NDA的非优先审查的审查程序,自提交非新化学实体起十个月,提交新的化学实体起十个月,提交优先审查的时间为提交非新的化学实体起六个月,提交新的化学实体起六个月,以完成申请的审查程序并对申请人作出回应。它可以采取完整的回复信或批准的形式。一封完整的回复信通常会概述提交文件中的不足之处,并可能需要大量额外的测试或信息,以便FDA重新考虑申请。如果或何时,在重新提交NDA时,这些缺陷已得到FDA满意的解决,FDA将签发批准信。FDA对补充信息、研究或澄清的要求通常会大大延长审查过程。如果不符合适用的监管标准,FDA可以推迟或拒绝批准NDA,要求额外的测试或信息,和/或要求上市后测试和监督以监测产品的安全性或有效性。FDA将在FDA选择的时间批准我们提交的任何NDA。
此外,如果产品获得监管机构批准,此类批准可能会限制该产品可能上市的指定用途。一旦获得批准,如果未能保持对上市前和上市后监管标准的遵守,或者如果产品上市后出现问题,FDA可能会撤回产品批准。此外,FDA可能要求进行第四期上市后研究来监测已批准产品的效果,并可能根据这些上市后研究的结果限制产品的进一步营销。
药品的批准后要求。 我们根据FDA批准生产或分销的任何药品都将受到FDA的持续监管,包括记录保存要求和不良经历报告。药物和生物制造商及其分包商必须向FDA和某些州机构注册其机构,并定期接受FDA和某些州机构的突击检查,以确保其是否符合GMP,这对我们和我们的第三方制造商提出了某些程序和文件要求。我们无法确定我们或我们现在或未来的供应商是否能够遵守GMP法规和其他FDA监管要求。如果我们现在或未来的供应商无法遵守这些要求,FDA可能会停止我们的临床试验、要求我们召回分销产品或撤回对NDA的批准。
FDA密切监管药物的营销和推广。公司只能提出与安全性和有效性、纯度和效力相关且有适当证据支持的声明。通常,这些可在批准的处方信息中找到。不遵守这些要求可能会导致不利宣传、警告或无标题信件、纠正性广告以及潜在的民事和刑事处罚。医生可能会开出合法可用的产品用于产品标签中未描述的用途以及与我们测试并经FDA批准的用途不同的用途。这种标签外使用在医学专业中很常见。医生可能认为,对于不同情况下的许多患者来说,这种超说明书使用是最好的治疗方法。FDA不规范医生选择治疗的行为。然而,FDA确实限制制造商就标签外使用主题进行沟通。
《药品供应链安全法》对成品药物人类药物产品的制造商规定了与产品跟踪和追踪有关的义务。在这项立法的要求中,制造商必须向产品所有权转让的个人和实体提供有关药品的某些信息,在药品上贴上产品标识,并保留有关药品的某些记录。制造商向随后的产品所有者传递信息最终将被要求以电子方式完成。制造商还被要求核实购买制造商产品的人是否获得了适当的许可。此外,根据这项立法,制造商将承担与假冒、转移、盗窃和故意掺假的产品以及作为欺诈交易对象的产品有关的药品产品调查、检疫、处置和通知责任,这些产品以其他方式不适合分销,从而合理地可能导致严重的健康后果或死亡。
联邦贸易委员会(FTC)的广告法规。 联邦贸易委员会根据联邦贸易委员会法案(FTC Act)对非处方药和非限制性医疗器械的广告和宣传材料进行监管,该法案禁止不公平或欺骗性的行为或做法,以及传播任何可能导致购买药品和非限制性医疗器械的虚假广告。联邦贸易委员会要求所有明示和默示的索赔都必须得到证实。联邦贸易委员会历来对与健康有关的主张采用称职和可靠的科学证据标准。这一标准的一般定义是要求由合格人员以客观方式进行和评估并为行业普遍接受的测试、分析、研究或研究,以产生准确和可靠的结果。在某些情况下,FTC将这一标准解释为要求进行随机、双盲、安慰剂对照的临床试验。联邦贸易委员会被授权发布可通过禁令、民事处罚和违反联邦贸易委员会法案的刑事藐视法庭程序执行的停止和停止令,以及直接向联邦法院提起禁令救济和获得辅助消费者赔偿。
其他医疗保健法规。 我们的业务活动,包括但不限于研究、销售、促销、分销、医学教育和其他活动,将受到美国众多监管和执法机构的监管,除FDA外,可能包括司法部、卫生与公众服务部及其各个部门,包括医疗保险和医疗补助服务中心,以及州和地方政府。我们的业务活动必须遵守众多医疗保健法,包括但不限于联邦医疗保健计划反回扣法规(“AKS”)和州同等法律、联邦虚假索赔法和州同等法律、联邦和州医疗保健从业者支付阳光法、联邦和州健康信息隐私法、州价格增加透明度法、以及要求向政府报告价格或折扣定价的各种联邦法律。
除其他事项外,AKS禁止任何个人或实体故意或故意以现金或实物形式直接或间接、公开或隐蔽地提供、支付、索取或接收任何报酬,以诱导或作为购买、租赁、订购或安排购买、租赁、订购或安排购买、租赁或订购根据Medicare、Medicaid或其他联邦医疗保健计划可报销的任何物品或服务的回报。薪酬一词被广泛解读为包括任何有价值的东西。有一些法定例外和监管避风港保护一些常见的活动不被起诉。例外和安全港的范围很窄,涉及可能被指控旨在诱使开处方、购买或推荐的报酬的做法,如果不符合例外或安全港的资格,可能会受到审查。没有满足特定适用的法定例外或监管安全港的所有要求,并不意味着这种行为本身就是《反回扣条例》所规定的非法行为。取而代之的是,将根据对其所有事实和情况的累积审查,逐案评估这一安排的合法性。
联邦《虚假索赔法》除其他外,禁止任何个人或实体故意提交或导致提交向联邦政府付款或获得联邦政府批准的虚假索赔,或故意制作、使用或导致制作或使用虚假记录或陈述材料向联邦政府提出虚假或欺诈性索赔。
我们和我们的业务活动受医疗保险/医疗补助民事罚款法规的约束,该法规对任何被确定已向联邦健康计划提出或导致提出索赔的个人或实体实施处罚,该人知道或应该知道是针对未按声称提供的物品或服务或虚假或欺诈性的。
此外,ACA及其实施法规中的联邦从业者付款阳光要求某些药品和医疗设备制造商根据医疗保险、医疗补助或儿童健康保险计划付款(除某些例外)报告与向医生支付或分配的某些付款或其他价值转移有关的信息,某些其他医疗保健从业者和教学医院,或应此类从业者或教学医院的要求或代表此类从业者或教学医院指定的实体或个人,并每年报告医生及其直系亲属持有的某些所有权和投资权益。
此外,我们可能受到联邦政府和我们开展业务所在州的数据隐私和安全法规的约束。经《健康信息技术促进经济和临床健康法》(HITECH)及其实施条例修订的1996年《健康保险可携带性和责任法》(HIPAA)对个人可识别健康信息的隐私、安全和传输提出了某些要求。除其他事项外,HITECH使HIPAA的隐私和安全标准直接适用于商业伙伴--代表覆盖实体提供服务而接收或获取受保护健康信息的独立承包商或代理。HITECH还创建了四个新的民事罚款等级,修订了HIPAA,使民事和刑事处罚直接适用于商业伙伴和可能是其他人,并赋予州总检察长新的权力,可以向联邦法院提起民事诉讼,要求损害赔偿或禁制令,以执行联邦HIPAA法律,并寻求与提起联邦民事诉讼相关的律师费和费用。此外,州法律在某些情况下管理健康信息的隐私和安全,其中许多法律在很大程度上彼此不同,可能不会产生相同的效果,从而使合规工作复杂化。
在美国以外,我们受到国际、国家和地区层面以及特定行业隐私和数据安全要求的影响。我们开展业务的国家/地区与个人数据和潜在知识产权的收集、存储、处理和转让相关的法律要求随着执法制度日益严格而不断发展。越来越多的隐私和安全法律法规正在被采用,更多法律法规正在得到执行,可能会受到重大经济处罚。在欧盟,《一般数据保护条例》(GDPR)于2018年5月生效,并实施了越来越严格的数据保护和隐私规则。
根据具体情况,不遵守这些法律可能会导致处罚,包括刑事、民事和/或行政刑事处罚、损害赔偿、罚款、没收、将产品排除在政府计划下的报销之外、个人举报人以政府名义提起的“qui tam”诉讼、拒绝允许我们签订供应合同(包括政府合同)、声誉损害、利润和未来收益减少,以及我们的业务缩减或重组,其中任何一项都可能对我们的业务产生不利影响。
美国和一些外国司法管辖区正在考虑或已经颁布了一系列立法和监管提案,旨在改变医疗保健系统,从而可能影响我们销售产品盈利能力。美国和其他地区的政策制定者和付款人对促进医疗保健系统的变革有着浓厚的兴趣,其既定目标是控制医疗保健成本、提高质量和/或扩大医疗机会。在美国,制药行业一直是这些努力的特别重点,并受到重大立法举措的显着影响。
反腐败法。 《反海外腐败法》(FCPA)禁止任何美国个人或企业直接或间接向任何外国官员、政党或候选人支付、提议或授权支付或提议任何有价值的东西,以影响外国实体的任何行为或决定,以帮助个人或企业获得或保留业务。FCPA还规定,证券在美国上市的公司有义务遵守会计规定,要求公司保存准确、公平地反映公司所有交易的账簿和记录,包括国际子公司,并为国际业务设计和维护适当的内部会计控制系统。该公司开展业务的其他国家/地区也有类似的反腐败法,包括英国的《贿赂法》。
外国和其他法规。 除了美国的法规外,只要我们选择在美国境外开发或销售任何产品,我们将遵守各种外国法规,这些法规管理我们的产品的临床试验、商业销售和分销。批准流程因国家而异,并且时间可能比获得FDA批准所需的时间更长或更短。各国对临床试验进行、产品许可、定价和报销的要求差异很大。
FC 2已获得监管机构的MSAP和ISO 13485批准,监管机构涵盖澳大利亚TGA、巴西ANVISA、加拿大卫生部和其他司法管辖区。此外,FC 2还获得了CE标志,使其能够在整个欧盟范围内销售。
该公司的设施还可能接受人口基金、美国国际开发署、国际标准化组织(ISO)和特定国家卫生部的检查。
知识产权;监管排他性
只有在有效且可执行的专利涵盖或作为商业秘密有效保存或在我们的技术具有监管排他性的情况下,我们才能保护我们的技术免受第三方未经授权的使用。专利和其他专有权利是我们业务的重要组成部分。
Enobosarm知识产权和监管排他性。
监管排他性。 Enobosarm有资格成为新化学实体(NSO),因为Enobosarm尚未在世界任何地方获得任何适应症的批准。在美国,FDA授予首个批准的PSE药物适应症五年的独家市场准入。此外,美国专利商标局(“USPTO”)可以在FDA药物批准后向任何单一enobosarm专利授予最多5年的专利期限延长(DTE),无论是物质成分还是使用方法,如下更详细描述。在美国之外,作为NSO,enobosarm有资格在欧盟国家获得长达10年的监管市场独占权,在日本获得长达7.5年的监管市场独占权。
独家许可专利。 Veru拥有16项已发布的美国专利、6项正在审批的美国专利申请、59项专利和美国以外国家的专利申请的全球独家许可,以及一项未决的PCt申请,包括在美国、欧盟和日本已发布的分子和多晶型物质组成以及使用方法专利,与我们的enobosarm候选药物和相关化合物有关。物质组成专利的最新到期日期为2029年(如果DTE适用,则延长至2034年),涉及enobosarm多形体物质组成。该许可证包含要求向许可方(田纳西大学研究基金会)支付里程碑和特许权使用费的条款。如果我们未能遵守这些义务或对许可人的其他义务,许可人可能有权终止许可,在这种情况下,我们将无法将我们的enobosarm候选药物商业化。
拥有的专利.另外,该公司还拥有两项正在审批的使用方法专利申请,一项美国申请和一项PCt申请,涉及将埃诺波瑟姆与肠促胰岛素和减肥药物联合用于慢性体重管理,专利将于2044年到期。此外,该公司正在开发一种新型的缓释enobosarm制剂,用于3期临床开发和商业化,该制剂利用专有的第三方制剂专利,这可能会导致额外的制剂成分具有额外的专利条款。
Sabizabulin知识产权和监管排他性。
监管排他性。 萨比沙布林有资格被评为NSO,因为萨比沙布林尚未在世界任何地方获得任何适应症的批准。在美国,FDA可以授予该NCO首个批准的药物适应症五年的独家市场准入。此外,在FDA药物批准后,USPTO可以对任何单一萨比沙布林专利(无论是物质组成还是使用方法)授予长达5年的GPT(下文将详细描述)。在美国之外,作为NSO,萨比扎布林有资格在欧盟国家获得长达10年的监管市场独占权,在日本获得长达7.5年的监管市场独占权。
独家许可专利。 Veru拥有13项已发布的美国专利、1项正在审批的美国专利申请以及美国以外国家的14项专利和专利申请的全球独家许可,包括欧盟和日本已发布的专利,与我们的萨比沙布林候选药物和相关化合物以及使用方法有关。最新的物质分子成分专利到期日期为2031年(如果DTE适用,则延长至2036年)。该许可证包含要求向许可方(俄亥俄州创新基金会)支付里程碑和特许权使用费的条款。如果我们未能遵守这些义务或对许可人的其他义务,许可人可能有权终止许可,在这种情况下,我们将无法将我们的萨比扎布林候选药物商业化。
拥有专利。 另外,该公司拥有1项美国专利、5项美国申请以及70项美国以外国家的专利和专利申请,包括但不限于美国正在申请的物质组成专利,欧盟和日本与我们的萨比沙布林候选药物的多形物以及我们的萨比沙布林候选药物和相关化合物的使用方法有关。萨比扎布林多晶型物质组合物专利申请正在等待中,专利有效期至2043年(如果DTE适用,则延长至2048年)。
商标的 该公司在美国注册了“FC 2女避孕套”商标和FC 2女避孕套风格化标志。该公司已在美国申请了“Veru”和“Veru”商标以及V字形。该公司已在全球40个国家或司法管辖区提交申请或获得注册,以保护营销其女性避孕套中使用的各种名称和符号。
我们不能确定我们的任何未决专利申请或我们许可方的专利申请是否会导致已颁发的专利。此外,由于生物制药公司的专利地位高度不确定,涉及复杂的法律和事实问题,我们拥有和许可的专利,或者我们可能拥有或许可的任何其他专利,可能不会阻止其他公司开发类似或治疗等同的产品。如果竞争对手设计出在不侵犯我们专利的情况下制造或使用这些候选产品的方法,专利也不会保护我们的候选产品。近年来,几家公司在挑战涵盖制药产品的专利方面非常积极,挑战往往是成功的。我们不能保证我们的专利不会受到第三方的挑战,也不能保证我们会在我们进行的任何辩护中取得成功。如果不能成功地抗辩专利挑战,可能会对我们的业务造成实质性的不利影响。
此外,专利法、规则或法规的变化或美国和其他国家法院对其解释或执行的变化可能会大幅降低我们知识产权的价值或缩小我们专利保护的范围,这可能会对我们的业务和财务状况产生重大不利影响。
一项专利的期限取决于获得该专利的国家的专利法律期限。在包括美国在内的大多数国家,专利期为非临时专利申请最早提交之日起20年。在美国,专利期限的延长可以通过专利期限调整来延长,这可以补偿专利权人因美国专利商标局在审查和授予专利时的行政拖延,或者如果一项专利因之前提交的专利而被最终放弃,则可以缩短。此外,涵盖药物或生物制品的专利的期限也有资格在FDA批准药品后和FDA确定的最长五年内获得PTE,并进一步满足某些法定和监管要求。未来,如果我们的候选产品获得FDA或外国监管机构的批准,我们预计将根据每种药物的临床试验时间和其他因素,申请延长涵盖这些产品的已颁发专利的专利期限。不能保证我们的任何未决专利申请将会发布,或我们将从任何专利期限的任何延长或有利的调整中受益。
与其他生物制药公司一样,我们维持和巩固我们候选产品的专有和知识产权地位的能力,将取决于我们能否成功获得有效的专利主张,并在获得批准后执行这些主张。然而,我们已经或可能提交的某些专利申请,或者我们已经或可能从第三方获得许可的某些专利申请,可能不会导致相应专利的颁发。我们也无法预测在我们的专利中可能允许或执行的权利要求的广度。我们未来可能获得的任何已颁发的专利都可能受到挑战、无效或规避。例如,我们不能确定未决的第三方专利申请所涵盖的发明的优先权。如果第三方在美国准备和提交的专利申请也声称拥有我们有权拥有的知识产权,我们可能不得不参加美国专利商标局的诉讼程序以确定发明权,这可能会给我们带来巨额成本,即使最终结果对我们有利。此外,由于我们可能开发的候选产品的临床开发和监管审查需要大量时间,任何相关专利可能在商业化后短期内保持有效,从而削弱任何此类专利的任何优势。
除了专利外,我们还依赖非专利的商业秘密和专业知识以及持续创新来发展和维持我们的竞争地位。我们试图通过与任何未来的合作者、科学顾问、员工和顾问签订保密协议以及与我们的员工签订发明转让协议来保护我们的专有信息。我们还签订了要求与选定的顾问、科学顾问和合作者分配发明的协议。保密协议旨在保护我们的专有信息,并且在要求发明转让的协议或条款的情况下,授予我们通过与第三方的关系开发的知识产权的所有权。
重要客户
该公司2024财年的四大客户占公司净收入的60%。
由于FC 2是一种多用途预防技术,可预防怀孕和性传播感染(包括艾滋病毒/艾滋病)的传播,因此它是世界各地艾滋病毒/艾滋病预防和计划生育计划的组成部分。这些计划通常由全球公共卫生部门买家提供,他们以低成本或免费购买产品,分发给那些需要但无力购买此类产品的人。全球公共卫生部门内有大型全球机构,例如人口基金、美国国际开发署、英国。外交、联邦和发展办公室(FCDO)、民主党和人口服务国际(ISI)、其他社会营销团体、各种政府卫生机构和非政府组织。在全球公共卫生领域,该公司最重要的客户要么是全球公共卫生部门机构、特定国家的卫生部,要么是那些促进其采购和/或分发的机构。
人力资本管理
截至2024年10月31日,公司拥有全职员工210名,其中26名位于美国,9在英国,马来西亚有174人,另一个国家有1人实施培训和项目。公司目前未与员工签订任何集体谈判协议,公司相信员工关系良好。
我们的主要人力资本管理目标是识别、招聘、整合、保留和激励我们的新员工和现有员工。我们致力于营造一个所有员工都能成长和茁壮成长的环境。多元化的员工队伍带来了更广泛的视角,有助于推动我们的增长承诺。我们相信,我们的薪酬和福利计划旨在吸引和留住合格人才。为了创造和维护成功的工作环境,我们提供年度基本工资和一系列全面的额外福利,以支持所有员工及其家人的身心健康和福祉。此外,我们还可能授予股权奖励以吸引和促进员工留任,此类奖励目前在三年内授予,并允许员工分享公司的业绩。
我们致力于为员工提供安全的工作场所,并已在我们的运营中实施健康和安全管理流程。为了应对COVID-19大流行,我们已实施额外的安全措施来保护员工,包括针对适用员工的在家工作措施以及额外的清洁和保护措施。
环境规制
公司相信,公司遵守环境法不存在任何重大问题或重大成本。该公司在2024财年或2023财年没有产生环境费用,也不会预计在可预见的未来产生环境费用。该公司在马来西亚的业务经过了ISO 14001的审计和认证,这是国际标准化组织(ISO)制定的环境管理标准,旨在帮助组织管理其流程、产品和服务对环境的影响。
原材料
用于生产FC2的主要原料是一种丁腈聚合物。虽然许多供应商都有丁腈配方,但该公司选择与合成聚合物的技术市场领先者密切合作,开发一种非常适合女性避孕套的生物兼容性和功能需求的等级。因此,该公司的FC2主要原材料依赖于一家供应商的供应,该供应商可以从其组织内的多个供应点生产原材料。用于生产FC2的主要部分成品成分是浸渍的丁腈聚合物护套。该公司从一家领先的丁腈外科手套制造商那里采购其组件护套。供应商表示,它打算关闭生产我们特种丁腈的工厂。供应商关闭了工厂,我们成功地在他们在马来西亚的另一家工厂进行了重新验证。我们正在测试一种替代等级的丁腈,这将需要我们产生成本来制定和测试替代等级,并寻求FDA对替代等级的批准。供应商表示,在我们转移到替代丁腈等级的同时,它将帮助提供供应的连续性,目前正在利用其控制的另一生产设施生产当前特种等级的丁腈。已经进行了适当的工厂试验和测试,以表明新设施能够供应我们目前的丁腈等级,我们现在正在测试新材料。
制造业
我们在雪兰戈尔特区的一个租赁工厂内生产和储存FC 2,该工厂占地约45,800平方英尺,马来西亚该工厂的年产能约为1亿台FC 2。该设施定期接受FDA以及德国公告机构(负责CE(MDR)和ISO 13485和MDSAP认证)的定期检查,以确保符合GMP要求。
竞争
FC 2与男用避孕套参与同一市场;然而,它并不被视为与男用避孕套直接竞争。相反,研究表明,提供FC 2会增加女性和男性避孕套的使用。男用避孕套价格更低,并且可以拥有比FC 2更广泛认可的品牌名称。此外,男用避孕套通常由财务资源明显多于公司的公司制造和销售。
其他政党也开发和销售了女用避孕套。这些由其他方销售或正在开发的女用避孕套都没有获得FDA的市场批准。在美国销售女性避孕套需要FDA的市场批准。美国政府资助的机构美国国际开发署倾向于从FDA采购产品批准上市;然而,也可能有例外。在美国以外,该公司经历了FC2日益激烈的竞争和定价压力。除FC2外,三个女用避孕套已成功完成世卫组织资格预审程序,并由人口基金批准供联合国机构购买:丘比特女用避孕套(2012年7月通过世卫组织资格预审,随后经人口基金批准);印度斯坦乳胶有限公司销售的天鹅绒女用避孕套(经世卫组织预审,2016年3月通过人口基金批准);PATH销售的女用避孕套(经世卫组织资格预审,2016年3月经人口基金批准)。Path女用避孕套在2019年失去了预审资格,这使得除了FC2之外,只剩下另外两个竞争对手的女用避孕套获得了WHO的预审资格。我们目前不知道有任何其他女用避孕套目前在世卫组织资格预审程序中。印度斯坦乳胶有限公司是该公司在印度的前独家经销商,该公司销售的女性避孕套在设计上与FC2基本相似,只是它是由乳胶制成的。FC2也一直在与其他女性避孕套在不需要FDA市场批准或世卫组织资格预审的市场上竞争,特别是在欧盟。由于竞争加剧,竞争对手获得了最近三次南非招标和最后两次巴西招标的一部分。FC2 S在美国以外市场的竞争日益激烈,已经并可能继续给FC2的定价带来压力,也可能对FC2的销售产生不利影响。一些客户,特别是在全球公共卫生部门,优先考虑价格,而不是FC2可能具有优势的其他功能。FDA于2018年将女用避孕套从三类医疗器械重新分类为二类医疗器械,这可能会降低其他类型的女用避孕套进入美国市场的门槛。如果其他女用避孕套进入美国市场,我们可能会在美国面临更激烈的竞争,这可能会给FC2的定价带来下行压力,并对FC2在美国的销售产生不利影响。
制药行业竞争激烈,研究工作广泛、技术进步迅速。我们制药产品的成功将取决于我们获取、开发和商业化产品的能力,以及我们为获得营销批准的任何产品建立和维护市场的能力。北美、欧洲和其他地区的潜在竞争对手包括大型制药公司、特种制药公司和生物技术公司、大学和其他研究机构和政府机构。与我们正在开发的药品产品相比,许多竞争对手拥有比我们现有或将要拥有的更强的研发和监管能力和经验,以及更丰富的管理、制造、分销、营销和财务资源。
Enobosarm是一种口服、一流的新型选择性雄激素受体调节剂,正在与减肥药物(GLP-1受体激动剂)联合开发,旨在增加脂肪的优先损失,同时防止瘦体重和骨骼损失。有肌肉减少的肥胖或超重的老年人。目前,FDA还没有批准任何药物用于长期体重管理,以保留瘦质量(肌肉)和骨骼,无论是单独使用还是与GLP-1受体激动剂联合使用。
可用信息
该公司为投资者维护了一个公司网站https://verupharma.com/investors/,并通过该网站免费提供其10-k表格年度报告、10-Q表格季度报告、8-k表格当前报告以及公司向美国证券交易委员会(SEC)提交或向美国证券交易委员会(SEC)提供的报告的修订案,并在合理可行的范围内尽快向美国证券交易委员会(SEC)提供此类材料。公司网站上的信息不包含在本报告中。
我们的业务面临多种风险,您在做出投资决定之前应该了解这些风险。以下摘要强调了您应该考虑的与我们的业务和前景有关的一些风险。此总结并不完整,下面总结的风险并不是我们面临的唯一风险。为了更全面地了解与我们的业务和普通股投资相关的风险,我们鼓励您阅读并考虑对这些突出风险的更详细讨论,这些讨论紧随本摘要之后。可能影响我们业务、经营业绩和财务状况的重大风险总结包括但不一定限于与以下方面相关的风险:
与我们的产品和候选药物的监管和商业化相关的风险
| ● |
我们在获得药物监管批准或紧急使用授权方面经验有限。 |
| ● |
我们计划的临床试验可能会出现延误。 |
| ● |
我们的临床试验可能会暂停或停止。 |
| ● |
我们计划的enobosarm临床开发项目可能会出现延误或意外成本,该项目是一种治疗方法,以增加接受GLP-1 RA的肌肉减少性肥胖或超重患者的脂肪损失并预防瘦质量(肌肉)损失。 |
| ● |
我们不时宣布或发布的临床前研究和临床试验的中期、初步和总体数据可能会随着更多数据的可用而发生变化,并且需要接受审计和验证程序,这可能会导致最终数据发生重大变化。 |
| ● |
我们可能面临与第三方合作相关的风险。 |
| ● |
我们依靠CROs来开展研究和开发活动。 |
| ● |
我们依赖第三方制造商来提供候选药物。 |
| ● |
与我们产品的运输和其他分销渠道相关的成本中断或显着增加可能会对我们的利润率和盈利能力产生不利影响。 |
| ● |
法律的变化可能会对我们候选药物的批准产生负面影响。 |
| ● |
我们可能无法或选择不将我们的候选药物或我们已批准或授权的产品商业化。 |
| ● |
我们开发萨比沙布林治疗急性呼吸窘迫综合征的商业化将取决于我们通过政府拨款、制药公司合作伙伴关系或类似外部来源获得大量资金的能力。 |
| ● |
我们受到广泛且成本高昂的政府监管,包括可能对FC 2的销售产生负面影响的医疗改革措施。 |
| ● |
我们可能会遇到员工的不当行为。 |
| ● |
我们的产品可能无法提供保险和报销。 |
| ● |
我们可能无法获得并保留候选药物的市场接受度。 |
| ● |
我们的药品可能受到政府定价控制。 |
| ● |
第三方可能会获得FDA的监管排他性,这对我们不利。 |
与我们的财务状况和资本需求相关的风险
| ● |
我们在最近一财年出现了净亏损,预计在可预见的未来将继续出现亏损。 |
| ● |
我们的独立注册会计师事务所在其关于截至2024年9月30日财年的10-k表格年度报告中包含的我们已审计财务报表的报告中包含了一个与我们继续持续经营能力有关的解释段落。 |
| ● |
我们需要筹集额外资本来资助我们未来的运营。如果我们未能吸引新资本,我们可能无法继续运营,或者可能被迫出售资产。或者,我们可能无法以优惠的条件获得资本,或者即使没有。如果有的话,融资条款可能会导致我们的股东权益大幅稀释。 |
| ● |
我们支持我们的开发和商业化活动所需的额外融资金额尚不确定。 |
| ● |
由于我们未能及时向SEC提交两份报告,我们目前没有资格在S-3表格上提交新的注册声明,也没有资格在2025年3月1日之前使用S-3表格上当前有效的货架注册声明,这可能会损害我们以对我们有利的条款筹集资金的能力,及时或根本。 |
| ● |
我们可能不会收到ONCO因出售我们的ENTADFI资产而提供的任何额外付款,也可能不会收到我们可能不时持有的ONCO普通股股份的任何价值。 |
与我们的业务相关的风险
| ● |
我们的FC 2业务可能会受到与政府和其他国际卫生机构风险的影响。 |
| ● |
FDA发布最终命令,将女性避孕套重新分类为II类医疗器械,这可能会导致美国市场对FC 2的竞争加剧。 |
| ● |
我们可能会经历竞争,特别是作为代谢疾病治疗药物的enobosarm(如果获得批准)和FC 2。 |
| ● |
我们的FC 2销售净收入可能无法恢复到过去的水平。 |
| ● |
我们可能无法通过我们自己的远程医疗门户成功实施我们的战略,以增加FC 2在美国市场的销量。 |
| ● |
无法识别或完成未来的收购可能会对我们未来的增长产生不利影响。 |
| ● |
我们在整合战略收购时可能会遇到困难。 |
| ● |
我们可能会受到与The Pill Club在FC 2销售方面的商业行为相关的索赔或调查。 |
| ● |
我们不太可能收回The Pill Club的任何应收账款。 |
| ● |
根据与供应商的争议的解决,我们负有重大付款义务。 |
| ● |
由于我们在国外市场销售FC 2,因此我们面临着可能对我们的经营业绩产生不利影响的国际业务风险。 |
| ● |
用于制造FC 2的原材料、劳动力和其他成本的增加可能会增加我们的销售成本并降低我们的毛利率。 |
| ● |
货币汇率波动可能会增加我们的开支。 |
| ● |
我们依赖单一设施来生产FC 2,以及某些原材料的单一来源供应商,这使我们面临供应中断的风险。 |
| ● |
我们可能会因需要过渡FC 2的丁胶聚合物供应而产生成本或经历供应中断。 |
| ● |
总体经济状况的不确定性和不利变化可能会对我们的业务产生负面影响。 |
| ● |
重大不利或不可预见的法律判决、罚款、处罚或和解可能会对我们的利润和现金流产生不利影响。 |
| ● |
我们已被列为股东集体诉讼的被告。这些以及潜在的类似或相关诉讼或调查可能会导致巨额法律费用、罚款、处罚或损害赔偿,并可能分散管理层对我们业务的时间和注意力。 |
| ● |
如果我们遭受网络攻击或其他导致安全漏洞的隐私或数据安全事件,我们的业务和运营将受到影响。 |
| ● |
任何未能遵守《FCPA》和非美国司法管辖区的类似反贿赂法的行为都可能会对我们的业务产生重大不利影响,并导致民事和/或刑事制裁。 |
| ● |
未来我们需要扩大组织的规模和复杂性,并且我们在执行增长战略和管理任何增长时可能会遇到困难。 |
| ● |
我们经营所在的各个司法管辖区税务规则的解释和应用不一致可能会对我们的递延所得税资产、税务义务和实际税率产生重大影响。 |
| ● |
如果我们无法实现递延所得税资产或我们经营所在司法管辖区的税法未来发生变化,我们的有效税率可能会受到负面影响。 |
| ● |
我们使用净营业亏损结转和某些其他税收属性的能力可能受到限制。 |
与我们的知识产权有关的风险
| ● |
我们可能无法保护涵盖我们产品的知识产权的专有性质。 |
| ● |
我们或我们的许可人的专利可能会过期或无效、被发现无法执行、范围缩小或以其他方式受到限制,或者我们或我们的许可人的专利申请可能不会导致已颁发的专利,或者可能导致具有狭隘、过于宽泛或无法执行的权利要求的专利。 |
| ● |
我们可能没有足够的知识产权保护enobosarm作为一种治疗方法,以增加脂肪流失和预防接受GLP-1 RA的肌肉减少性肥胖或超重老年患者的肌肉流失,这些患者有出现肌肉萎缩和肌肉无力的风险。 |
| ● |
我们部分依赖于一些许可关系。 |
| ● |
我们可能会面临我们的知识产权侵犯第三方知识产权的指控。如果我们侵犯第三方的知识产权,可能会增加我们的成本或阻止我们将候选产品商业化。 |
| ● |
我们可能会被指控我们的员工错误地使用或披露我们竞争对手的所谓商业秘密。 |
| ● |
我们可能需要提起诉讼或采取其他行动来保护或执行我们的知识产权。 |
| ● |
我们可能无法保护商业敏感信息的机密性。 |
与我们普通股所有权相关的风险
| ● |
我们普通股的所有权高度集中,因此您影响公司事务的能力可能会受到限制。 |
| ● |
我们已收到纳斯达克退市通知。 |
| ● |
由于APP收购,我们在2020财年和2023财年产生了盈利费用,而未来因APP收购而产生的额外盈利费用可能会导致我们的经营业绩受到影响。 |
| ● |
重述我们之前的财务报表可能会影响股东和投资者对我们的信心或损害我们的声誉,并可能使我们面临额外的风险和不确定性,包括成本增加以及法律诉讼和监管调查、制裁或调查的可能性增加。 |
| ● |
截至2023年9月30日,我们之前发现了财务报告内部控制中的两个重大弱点,并确定这些弱点导致我们对财务报告和披露控制和程序的内部控制无效。尽管我们已经纠正了这些重大弱点,但我们未来可能会发现额外的重大弱点或其他缺陷,或者无法维持有效的内部控制系统,包括披露控制和程序,这可能会导致我们的财务报表出现重大错误陈述或导致我们未能履行我们的报告义务。 |
| ● |
我们是一家“较小的报告公司”,将能够利用适用于较小的报告公司的较低披露要求,这可能会降低我们的普通股对投资者的吸引力。 |
| ● |
我们的章程文件、威斯康星州法律和剩余特许权使用费协议中的条款可能会阻止或推迟我们公司控制权的变更。 |
| ● |
我们普通股的交易价格一直波动,我们普通股的投资者可能会遭受重大损失。 |
| ● |
市场上可能会出售大量股票,这可能会压低我们普通股的市场价格。 |
| ● |
由于我们预计在可预见的未来不会对普通股支付任何现金股息,因此资本增值(如果有的话)将是我们股东的唯一收益来源。 |
投资我们的普通股涉及很高的风险。在考虑我们的业务和前景时,您应仔细考虑以下风险,以及本年度报告和我们向SEC提交的其他文件中包含的所有其他信息。以下描述的风险并不是我们面临的唯一风险。我们尚不知道或我们目前认为不重要的其他风险也可能损害我们的业务运营。如果发生以下风险中描述的任何事件或情况,我们的业务、财务状况、经营业绩或前景可能会受到重大不利影响。在这种情况下,我们普通股的交易价格可能会下降。
与我们的产品和候选药物的监管和商业化相关的风险
我们在获得药物监管批准或紧急使用授权方面经验有限。
我们只获得了一种口服药物ENTADFI(他达拉非和非那雄胺)胶囊的监管批准,我们于2023年4月将其出售给ONCO。我们从未在美国或任何其他司法管辖区获得过EUA。FDA或其他监管机构可能会拒绝接受我们计划中的任何或全部NDA进行实质性审查,或者在审查我们的数据后得出结论,认为我们的申请不足以获得监管部门的授权或对我们的任何候选药物的批准。FDA还可能要求我们进行额外的临床或生产验证研究,这可能是昂贵和耗时的,并在重新考虑我们的申请之前提交数据。根据这些或任何其他FDA要求进行的研究的程度,我们提交的任何保密协议的批准或任何EUA申请的授权可能会大幅推迟,可能会推迟数年,或者可能需要我们花费比我们现有或能够获得的资源更多的资源。在获得监管批准方面的任何拖延或无法获得批准,都将推迟或阻止我们将候选药物商业化,从这些拟议的产品中产生收入,并实现和保持盈利。FDA也有可能认为,如果进行并完成额外的研究,可能不足以批准我们提交的任何NDA或EUA。如果这些结果中的任何一种发生,我们可能被迫放弃我们计划的NDA或EUA,转而使用我们的一个或多个候选药物,这将对我们的业务产生实质性的不利影响。
临床试验涉及一个漫长而昂贵的过程,结果不确定,早期研究和试验的结果可能不能预测未来的试验结果。在临床试验过程中,由于药物性能不佳、患者或研究人员对临床试验方案的坚持不足或其他因素,随时可能发生失败。尽管在早期的临床试验中取得了进展,但临床试验后期的新药可能无法显示出预期的安全性和有效性特征。生物制药行业的一些公司由于缺乏疗效或不良安全性而在高级临床试验中遭受重大挫折,尽管在早期试验中取得了令人振奋的结果。我们未来的临床试验可能不会成功,或者可能比我们目前预期的更昂贵或更耗时。如果我们的任何候选药物的临床试验不能证明令FDA满意的安全性或有效性,FDA将不会批准该药物,我们将无法将其商业化,这将对我们的业务、财务状况、运营结果和前景产生重大不利影响。
我们计划的临床试验可能会出现延误。
我们可能会在需要对我们的候选药物进行的任何临床试验中遇到延误。我们计划的临床试验可能无法按时开始;一旦开始,可能会中断、延迟、暂停或终止;可能需要重新设计;可能无法招募足够数量的患者;或者可能无法按计划完成(如果有的话)。临床试验可能会因多种原因而推迟,包括以下原因:
| ● |
延迟获得监管机构批准以开始试验; |
| ● |
FDA或其他监管机构对我们的临床试验运营或试验地点进行检查后实施临床搁置; |
| ● |
FDA、DSMb或IDMC、临床试验中心的IRb或我们因安全性或有效性担忧而实施临床搁置; |
| ● |
延迟与潜在合同研究组织(CROs)和临床试验中心就可接受的条款达成协议; |
| ● |
延迟获得每个地点所需的IRb批准; |
| ● |
识别、招募和培训合适的临床研究者方面的延误; |
| ● |
延迟招募合适的患者参加试验; |
| ● |
延迟患者完成试验或返回接受治疗后随访; |
| ● |
临床研究中心退出试验,影响入组; |
| ● |
添加新网站所需的时间; |
| ● |
延迟获得足够的临床试验材料供应,包括合适的活性药物成分; |
| ● |
由于DSMb或IDMC的阴性或可疑结果导致试验延迟;或 |
| ● |
因大流行或其他原因导致的停工、隔离或人员短缺而造成的延误。 |
患者入组是临床试验时间的一个重要因素,受到许多因素的影响,包括患者人群的规模和性质、患者与临床中心的接近程度、试验的资格标准、临床试验的设计、大流行、竞争性临床试验、以及临床医生和患者对正在研究的药物相对于其他可用疗法的潜在优势的看法,包括任何可能被批准用于我们正在调查的适应症的新药。完成临床试验的任何延迟都可能会增加我们的成本,减慢我们的产品开发和批准流程,并危及我们开始产品销售和为受影响候选药物创造收入的能力。
我们的临床试验可能会暂停或停止。
在我们获得候选药物商业销售的监管批准之前,我们可能需要完成此类候选药物的临床前开发和/或广泛的人体临床试验,以证明候选药物的安全性和有效性。迄今为止,我们的任何候选药物尚未获得监管机构的批准。
临床前研究或临床试验的不利结果可能导致正在进行的或未来的临床试验的延迟、修改或放弃。临床结果往往容易受到不同解释的影响,这些解释可能会推迟、限制或阻止监管部门的批准。临床试验期间的阴性或不确定的结果或不良医疗事件可能会导致临床试验延迟、重复或终止。此外,我们可能会不定期报告一线数据,这是基于对关键疗效和安全性数据的初步分析。在对与适用的临床试验相关的数据进行更全面的审查后,这些主要数据可能会发生变化。如果我们推迟或放弃与我们的任何候选药物相关的开发努力,我们可能会遇到潜在的重大延误,或者被要求放弃该候选药物的开发。如果我们推迟或放弃与我们的任何候选药物相关的开发努力,我们的业务、财务状况、运营结果和前景可能会受到实质性的不利影响。
由于多种原因,我们的临床试验可能会在任何时候暂停或终止。由于以下原因,我们、我们的合作者、FDA或其他监管机构可能会暂停或终止临床试验:未能按照监管要求或我们的临床规程进行临床试验;出现不可预见的安全问题或不良反应;未能证明使用研究药物有益处;政府法规或行政措施发生变化;缺乏足够的资金来继续临床试验,或者临床试验的DSMB、IDMC或IRB的阴性或模棱两可的结果。IRB还可以因未能保护患者安全或患者权利而暂停或终止我们的临床试验。如果我们认为临床试验对参与者构成不可接受的风险,我们可以在任何时候自愿暂停或终止临床试验。此外,如果监管机构认为我们的临床试验没有按照适用的法规要求进行,或者给参与者带来了不可接受的安全风险,他们可以随时下令暂时或永久停止我们的临床试验。如果我们选择或被迫暂停或终止我们正在开发的任何候选药物的任何临床试验,该候选药物的商业前景将受到损害,我们从该候选药物获得收入的能力将被推迟或取消。这些情况中的任何一种都可能对我们的业务、财务状况、运营结果和前景造成实质性损害。
我们在enobosarm的20期NPS临床试验中可能会出现延误或意外成本,该试验是一种治疗方法,以增加接受GLP-1 RA的肌肉减少性肥胖或超重老年患者的脂肪损失并预防肌肉损失。
我们的未来前景在很大程度上取决于我们能否成功地推进enobosarm的开发,作为一种治疗方法,以增加脂肪损失,并防止接受GLP-1 RA治疗的石膏性肥胖或超重老年患者的肌肉丢失。我们目前正在进行一项20期亿多中心、双盲、安慰剂对照、随机、剂量发现临床试验,旨在评估Enobosarm作为一种治疗方法的安全性和有效性,以增加脂肪损失和防止肌肉丢失,这些患者接受GLP-1 RA治疗,有发生肌肉萎缩和肌肉无力的风险,试验的第一批数据预计将于2025年第二季度公布。计划中的20期亿临床试验的任何延误或意外更改都可能会增加我们的成本,减缓我们的产品开发和审批流程,并危及我们为Enobosarm开发Enobosarm的能力,并最终从Enobosarm中产生收入,以此作为一种治疗方法,用于增加脂肪损失和防止接受GLP-1 RA治疗的石膏型肥胖或超重老年患者的肌肉损失,这些患者有发生肌肉萎缩和肌肉无力的风险,这可能导致我们的发展策略发生变化。额外的成本还可能需要我们筹集额外的资本,而这些资本在需要时或在我们可以接受的条件下可能无法获得。因此,我们可能被迫放弃开发Enobosarm作为一种治疗方法,以增加脂肪损失,并防止接受GLP-1 RA治疗的石膏性肥胖或超重老年患者的肌肉丢失,这些患者有发生肌肉萎缩和肌肉无力的风险。不能保证我们将能够经济高效地继续开发enobosarm,或者enobosarm将获得FDA的批准或商业化,适用于任何应用。
我们不时宣布或发布的临床前研究和临床试验的中期、初步和总体数据可能会随着更多数据的可用而发生变化,并且需要接受审计和验证程序,这可能会导致最终数据发生重大变化。
我们可能会公开披露我们的临床前研究和临床试验的中期、初步或背线数据。这些临时更新是基于对当时可用数据的初步分析,在对与特定研究或试验有关的数据进行更全面的审查后,结果以及相关的调查结果和结论可能会发生变化。例如,我们可能会报告某些患者的反应,这些反应在当时未经证实,并且在后续评估后最终没有导致确认的治疗反应。我们还作出假设、估计、计算和结论,作为我们数据分析的一部分,我们可能没有收到或没有机会全面和仔细地评估所有数据。因此,我们报告的中期、初步或背线结果可能与相同研究或试验的未来结果不同,或者一旦收到更多数据并进行充分评估,不同的结论或考虑因素可能会使这些结果合格。临时数据、初步数据和背线数据仍需遵守审计和核查程序,这可能会导致最终数据与我们之前公布的临时、初步或背线数据存在实质性差异。因此,在最终数据可用之前,应谨慎地查看中期、初步和背线数据。此外,我们可能只报告某些终端的中期分析,而不是所有终端的中期分析。来自临床试验的中期、初步和背线数据面临这样的风险,即随着患者登记的继续和更多患者数据的获得,一个或多个临床结果可能会发生实质性变化。中期数据、初步数据或背线数据与最终数据之间的不利变化可能会严重损害我们的业务和前景。此外,我们或我们的竞争对手未来额外披露中期、初步或背线数据可能会导致我们普通股的价格波动。
此外,我们选择公开披露的有关特定研究或试验的信息通常从更广泛的可用信息中选择。投资者可能不同意我们确定包含在公开披露中的重要信息或其他适当信息,并且我们确定不披露的任何信息最终可能被视为对于未来的决策、结论、观点、活动或有关特定候选产品或我们业务的其他方面具有重要意义。如果我们报告的中期、初步或总体数据与后期、最终或实际结果不同,或者如果包括监管机构在内的其他人不同意得出的结论,我们获得任何候选产品批准和商业化的能力可能会受到损害,这可能会损害我们的业务、财务状况、运营结果和前景。
我们可能面临与第三方合作相关的风险。
作为我们商业战略的一部分,我们可能会与战略合作伙伴达成合作安排,以开发和商业化我们的候选药物,或者为我们的候选药物开发配套的诊断方法。为了使我们的协作努力取得成功,我们必须确定其能力与我们的能力互补的合作伙伴。我们可能无法与可接受的合作伙伴达成合作协议或谈判这些协议中的有利条款。此外,我们可能无法成功地将这些合作者的资源和能力与我们自己的资源和能力进行整合。此外,我们在寻求与潜在合作伙伴进行合作或与之谈判时可能会面临劣势,因为其他潜在的合作伙伴可能比我们拥有更多的管理和财务资源。我们的合作者可能难以合作或技能低于最初的预期,或者可能需要更多时间来实现任何此类合作的计划目标(如果真的实现了)。对于伴随诊断,任何这样的合作者可能无法成功地获得对计划的诊断的监管批准,并且即使获得批准,也可能无法成功地将诊断商业化或实现医生对诊断的广泛采用。如果我们的合作努力不成功,我们开发和销售候选药物的能力可能会受到严重限制。
我们依靠CROs来开展研究和开发活动。
我们没有足够的资源独立开展研发活动。因此,我们打算并确实依赖CRO为我们的候选药物进行研究和开发活动,并执行我们的临床研究。虽然我们将只控制我们CRO活动的某些方面,但我们将负责确保我们的每项研究都按照适用的协议和法律、法规和科学标准进行,并且我们对CRO的依赖不会免除我们的监管责任。我们不能确定CRO将及时或在成本效益的基础上进行适当的研究,或者结果将是可重现的。我们和我们的CRO必须遵守FDA的cGCP,这是FDA对我们临床开发中的所有药物产品执行的法规和指导方针。FDA通过定期检查试验赞助商、主要研究人员和临床试验地点来执行这些cGCP。如果我们或我们的CRO未能遵守适用的CCCP,在我们的临床试验中产生的临床数据可能被认为是不可靠或无效的,FDA可能会要求我们在批准我们的候选药物之前进行额外的临床试验。此外,为了在统计上显著地评估我们候选药物与安慰剂相比的安全性和有效性,我们的临床试验将需要足够多的测试对象。CRO代表我们在国外进行的任何临床试验都受到类似的监管。因此,如果我们的CRO未能遵守这些规定或招募到足够数量的患者,我们可能会被要求重复临床试验,这将推迟监管批准过程。
此外,我们不会雇用我们的CRO的人员,除了我们与这些组织达成的协议中提供的补救措施外,我们无法控制他们是否会将足够的时间和资源投入到我们的研发和临床研究中。我们的CRO还可能与其他商业实体有关系,包括我们的一个或多个竞争对手,他们可能还在为这些实体进行临床研究或其他药物开发活动,这可能会阻碍他们将适当的时间投入我们的临床项目的能力。如果我们的CRO未能成功履行其合同职责或义务或在预期期限内完成,如果他们需要更换,或者如果他们获得的临床数据的质量或准确性因未能遵守我们的临床方案或法规要求或其他原因而受到影响,我们的临床试验可能会被延长、推迟或终止,我们可能无法获得监管部门对我们寻求开发的候选药物的批准或成功将其商业化。因此,我们寻求开发的候选药物的财务业绩和商业前景将受到损害,我们的成本可能会增加,我们从此类候选药物获得收入的能力可能会推迟或终止。
如果我们与这些第三方的任何关系终止,我们可能无法与替代CROs达成安排或以商业上合理的条款这样做。切换或与CROs建立新的关系涉及巨额成本,并且需要大量的管理时间和重点。此外,当新的合同研究人员开始工作时,还有一个自然的过渡期。因此,会出现延迟,这可能会严重影响我们满足预期临床开发时间表的能力,并可能会显着增加我们的成本。我们在建立或维持这些关系时可能会遇到挑战或延迟,任何此类延迟或挑战都可能对我们的业务、财务状况、运营业绩和前景产生重大不利影响。
我们依赖第三方制造商来提供候选药物。
在可预见的未来,我们预计并确实依赖第三方制造商和其他第三方来生产、包装和存储足够数量的候选药物,用于我们的临床试验。这些候选药物和产品制造起来既复杂又昂贵。如果我们的第三方制造商未能及时、以足够的质量和合理的商业价格交付我们的候选药物供临床使用,我们可能会被要求推迟或暂停临床试验,或以其他方式停止我们的候选药物的开发和生产。虽然我们可能能够确定替代第三方制造商或为这些候选药物或产品开发我们自己的制造能力,但这一过程可能会导致我们候选药物或产品供应的延迟和成本的增加。此外,第三方制造商用于生产我们的候选药物或产品的设施可能数量有限,如果这些设施因设备故障或故障或自然灾害损坏等事件而中断运营,可能会导致发货取消、生产过程中的产品损失或现有候选药物或产品的短缺。
此外,监管要求可能会对我们的候选药物的生产构成障碍。第三方制造商被要求遵守FDA的cGMP。因此,我们候选药物的任何制造商使用的设施必须保持FDA可接受的合规状态。NDA或其他形式的FDA批准或许可的持有者,或以自己的名义分销受监管产品的持有者,负责制造,即使制造是由第三方合同制造组织(CMO)进行的。我们的第三方制造商将被要求根据FDA的cGMP生产我们的候选药物,以达到可接受的标准。我们的第三方制造商可能不会履行他们与我们达成的协议规定的义务,或者可能在我们为我们的候选药物获得批准或将其商业化所需的时间之前停止他们的业务。此外,我们的制造商将接受FDA以及相应的州和外国机构的持续定期突击检查,以确保符合cGMP和类似的监管要求。如果我们的任何制造商未能遵守适用的cGMP,可能会导致对我们施加制裁,包括罚款、禁令、民事处罚、延误、暂停或撤回审批、运营限制、供应中断、召回、撤回、发布安全警报和刑事起诉,其中任何一项都可能对我们的业务、财务状况、运营结果和前景产生重大不利影响。最后,如果我们的CMO比我们的产品更重视其他产品的供应,或者在其他方面不能令人满意地履行他们与我们协议的条款,我们也可能遇到制造延迟。
如果我们候选药物的任何供应商在其制造过程中遇到任何重大困难,不遵守我们之间的协议条款或没有投入足够的时间、精力和关怀来满足我们的制造需求,我们可能会出现候选药物供应的重大中断,这可能会损害我们按临床试验或商业化所需水平供应候选药物的能力,并阻止或推迟其成功开发和商业化。
与我们产品的运输和其他分销渠道相关的成本中断或显着增加可能会对我们的利润率和盈利能力产生不利影响。
我们希望依靠第三方物流公司的不间断、高效运营来运输、储存和交付我们的产品,包括FC 2。这些第三方物流公司可能会经历用于分销我们产品的运输渠道中断,包括流行病造成的中断、机场和航运港口拥堵加剧、运输能力不足、燃料费用和储存成本增加、人力或资本短缺或其他业务中断。我们的第三方物流公司遇到的运输渠道中断可能会导致成本增加,包括额外使用空运来满足需求。例如,如果业绩未能达到我们的预期,这种业务模式或我们与第三方的关系中断可能会损害我们的业务。
法律的变化可能会对我们候选药物的批准产生负面影响。
FDA已经制定了管理药品开发和审批过程的法规、指导方针和政策,外国监管机构也是如此。由于采用新的法律、法规或政策而导致的监管要求的任何变化可能要求我们修改现有的临床试验方案或增加新的临床试验以符合这些变化。对现有方案或临床试验申请的这些修改或对新方案的需要,可能会对我们候选药物的临床试验的成本、时间和完成产生重大和不利的影响。此外,FDA的政策可能会改变,可能会发布额外的政府法规,以阻止、限制或推迟对我们的候选药物的监管批准,或者实施更严格的产品标签和上市后测试和其他要求。美国的政治环境可能会导致立法、法规和政府政策的重大变化和不确定性,这可能会对我们的业务和医疗保健行业产生重大影响。虽然无法预测是否以及何时会发生任何此类变化,但已经讨论或实施的可能对我们产生实质性影响的具体建议包括但不限于对ACA的潜在变化,最近发布的法规,允许雇主在宗教和道德上免除ACA提供节育保险的要求,以及制定21世纪治疗法案。如果我们缓慢或无法适应任何此类变化,我们的业务、前景和实现或维持盈利的能力将受到不利影响。
我们可能无法或选择不将我们的候选药物或我们已批准或授权的产品商业化。
我们不能确定,如果我们的任何候选药物的临床试验成功完成,我们是否能够向FDA提交保密协议,或者我们提交的任何保密协议是否会及时获得FDA的批准,或者提交的任何保密协议是否在商业上可行。类似的风险也适用于美国和其他司法管辖区的EUA申请。在完成候选药物的人体临床试验后,将准备药物档案并作为NDA提交给FDA,其中包括与该产品在建议适应症下的建议剂量和使用持续时间下的安全性和有效性相关的所有临床前研究和临床试验数据以及生产信息,以便FDA审查此类药物档案并考虑批准在美国商业化的候选药物。如果我们无法提交任何当前候选药物的保密协议,如果我们提交的任何保密协议没有得到FDA的批准,或者我们选择不提交保密协议,或者如果我们无法获得任何所需的州和当地分销许可证或类似授权,我们将无法将该产品商业化。FDA可以而且确实拒绝NDA,并要求进行额外的临床试验,即使候选药物在第三阶段临床试验中取得了有利的结果。
如果我们未能将任何这些候选药物或批准或授权的产品商业化,我们的业务、财务状况、运营业绩和前景可能会受到重大不利影响,并且我们在行业和投资界的声誉可能会受到损害。
我们开发萨比沙布林治疗急性呼吸窘迫综合征的商业化将取决于我们通过政府拨款、制药公司合作伙伴关系或类似外部来源获得大量资金的能力。
我们目前计划优先使用我们的内部现金和未来任何融资的净收益来开发Enobosarm,近期的主要重点是资助20期亿临床试验,以评估Enobosarm的安全性和有效性,最初是一种治疗方法,用于增加脂肪损失和防止瘦体重减轻,这些患者接受GLP-1 RA治疗,有发生肌肉萎缩和肌肉无力的风险,并通过政府拨款、制药公司合作伙伴或类似来源寻求外部资金,以促进Sabizumin作为病毒诱导的ARDS的治疗方法。这样的资金可能不能及时获得,或者根本不能获得,这可能会导致我们将萨比布林作为治疗病毒引起的ARDS的药物的开发显著延迟或暂停。政府为私营部门研究和开发活动提供的资金可能很难获得,而且可能会限制其使用。例如,在2023年10月,我们接到通知,我们没有被选中参加由BARDA赞助的计划中的ARDS临床试验。我们通过与制药公司的伙伴关系获得资金的能力也存在不确定性,包括在寻找适当合作伙伴方面的激烈竞争,以及潜在合作伙伴可能不认为萨比布林具有展示安全性和有效性或充分的知识产权保护所需的潜力。
我们受到广泛且成本高昂的政府监管,包括可能对FC 2的销售产生负面影响的医疗改革措施。
我们的上市产品FC2和我们的候选药物受到广泛而严格的国内政府监管,包括FDA、联邦贸易委员会、医疗保险和医疗补助服务中心(CMS)、美国卫生与公众服务部其他部门(包括其监察长办公室、美国司法部、国防部和退伍军人事务部)的监管,前提是我们的产品直接或间接由这些部门、州和地方政府及其相应的外国同行支付费用。FDA根据各种监管规定对药品和医疗器械的研究、开发、临床前和临床试验、制造、安全性、有效性、记录保存、报告、标签、储存、批准、广告、促销、销售、分销、进出口等方面进行监管。FDA的处方药推广办公室(OPDP)部门也对该公司产品的广告、营销和推广进行监管。许多州和地方政府需要分销许可证或类似的授权才能在其管辖范围内销售产品。我们在美国境外测试或销售的任何产品也受到外国政府的广泛监管,无论我们是否已获得FDA对特定产品及其用途的批准。这种外国监管可能与美国相应的监管要求相同或更高。
ACA要求美国健康保险计划承保FC 2。ACA定期受到法律挑战,并持续受到政治努力限制其范围,甚至可能废除它。我们预计不会立即进行任何此类修改或废除,但我们无法保证ACA的政治局势不会在未来发生变化,从而可能对我们在美国将FC 2作为处方药商业化的能力产生重大不利影响。
具体到避孕保险任务,ACA条例为符合条件的宗教雇主和反对根据真诚持有的宗教信仰提供保险的个人和非政府实体提供豁免,使其不受这一要求的影响。特朗普政府于2017年10月发布了两项临时最终规定,将豁免范围扩大到那些以宗教和道德信念为基础反对这一要求的实体,这两项规定于2018年11月敲定。宾夕法尼亚州和加利福尼亚州的联邦法院法官分别阻止了这些豁免规定的执行,上诉法院维持了这些决定。2020年7月8日,最高法院推翻了下级法院的裁决,允许规则生效。尽管美国劳工部于2022年1月10日发布了一份声明,提醒符合这些要求的计划和发行商他们有责任完全遵守PHS法案第2713条和HRSA指南下的要求,但削弱避孕授权的挑战或未来的监管努力可能会持续下去。如果成功,这些挑战可能会对FC2在没有单独规定FC2报销的州的销售产生不利影响。
对于一个或多个特定的预期用途和性能声明,FC2等医疗设备已获得批准或批准,这些要求必须得到充分证实。宣传一种设备用于非标签用途或做出误导性或未经证实的声明可能会导致政府采取执法行动。对设备的任何更改,包括标签、批准后或批准,都必须进行评估,以确定是否需要新的批准或批准。此外,我们制造FC2的工厂受到FDA以及其他联邦、州和外国政府机构的定期检查,这要求医疗器械制造商遵守某些法规,包括FDA的质量体系法规,该法规要求定期审计、设计控制、质量控制测试和文档程序,以及投诉评估和调查。FDA还要求报告某些不良事件和产品故障,并可能要求报告召回或其他更正或拆除商业分销中的设备。通过此类检查和报告发现的问题可能会导致FDA采取执法行动。此外,通过这种视察和报告查明的问题可能需要大量资源才能解决。
FDA可能会定期检查我们的设施,以确定是否符合《FD法案》和FDA法规的规定。FDA还要求报告某些不良事件和产品故障,并可能要求报告召回或其他现场安全纠正行动。通过此类检查和报告发现的问题可能会导致FDA采取执法行动。此外,通过此类检查和报告发现的问题可能需要大量资源来解决。
不遵守适用法律和法规可能会导致以下行为:
| ● |
部分暂停或完全关闭制造; |
| ● |
产品短缺; |
| ● |
产品制造延误; |
| ● |
FDA警告信或其他违法通知; |
| ● |
罚款或民事处罚; |
| ● |
延迟或限制获得新的监管许可或批准; |
| ● |
撤销或暂停所需的许可、批准或许可证; |
| ● |
产品扣押或召回; |
| ● |
禁令; |
| ● |
刑事起诉; |
| ● |
咨询或其他现场行动; |
| ● |
运营限制,包括无法在某些州或地方司法管辖区销售产品;以及 |
| ● |
禁止向美国以外的国家出口或进口产品 |
任何这些行为都可能对我们的业务产生重大不利影响。
我们在国外测试或销售的任何产品也受到外国政府的广泛监管,无论我们是否已获得FDA对特定产品及其用途的批准。此类外国监管可能与美国监管同等或更繁重。
我们须遵守联邦政府和我们开展业务的州的额外医疗保健监管和执法。可能影响我们运营能力的法律包括以下内容:
| ● |
联邦反回扣法规,除其他外,禁止任何人故意直接或间接索取、接受、提供或支付报酬,以换取或引诱个人转介、购买、订购或推荐任何可以根据政府医疗保健计划(例如医疗保险和医疗补助计划)付款的商品或服务; |
| ● |
联邦《虚假索赔法》禁止个人或实体故意提出或导致提出虚假或欺诈性的医疗保险、医疗补助或其他政府医疗保健计划付款索赔; |
| ● |
联邦刑法禁止执行欺诈任何医疗保健福利计划或做出与医疗保健事务相关的虚假陈述的计划;以及 |
| ● |
上述每项联邦法律的州法律相当于,例如可能适用于任何第三方付款人(包括商业保险公司)报销的物品或服务的反回扣和虚假索赔法。 |
此外,最近出现了联邦和州对药品和设备制造商向医疗保健从业者支付的付款加强监管的趋势。加利福尼亚州、康涅狄格州、马萨诸塞州和内华达州等一些州强制实施企业合规计划,而其他州法律禁止或要求跟踪和报告向医生和其他医疗保健从业者提供的某些礼物、补偿和其他报酬。
近年来,加利福尼亚州、明尼苏达州、俄勒冈州、德克萨斯州和华盛顿州等多个州都颁布了法律,要求制造商提交有关药品清单价格在规定时期内上涨超过一定百分比的药品和/或正在以超过规定金额的价格上市的新药的报告。除其他外,报告必须解释价格或涨价的理由。
这些法律的范围和执行是不确定的,并且在当前的医疗改革环境中可能会发生变化,特别是考虑到缺乏适用的先例和法规。我们无法预测这些法律的任何变化对我们业务的影响。联邦或州监管机构可能会根据这些法律质疑我们当前或未来的活动。任何此类挑战都可能对我们的声誉、业务、运营业绩和财务状况产生重大不利影响。任何州或联邦监管审查,无论结果如何,都将是昂贵且耗时的。
我们可能会遇到员工的不当行为。
我们将面临员工欺诈或其他不当行为的风险。员工的不当行为可能包括未能遵守FDA法规、营销和促销法律、规则和政策,未能向FDA提供准确的信息,未能遵守联邦和州医疗欺诈和滥用法律法规,未能遵守反腐败法,包括《反海外腐败法》,未能准确报告财务信息或数据,或未向我们披露未经授权的活动。特别是,卫生保健行业的销售、营销和商业安排受到旨在防止欺诈、不当行为、回扣、自我交易和其他滥用行为的广泛法律和法规的约束。这些法律法规可能会限制或禁止广泛的定价、折扣、营销和促销、销售佣金、客户激励计划和其他商业安排。员工不当行为还可能涉及不当使用在临床试验过程中获得的信息,这可能导致监管制裁和对我们的声誉造成严重损害。并非总是能够识别和防止员工的不当行为,我们为检测和防止此类行为而采取的预防措施可能无法有效控制未知或未管理的风险或损失,或保护我们免受因未能遵守这些法律或法规而引起的政府调查或其他行动或诉讼。如果对我们采取任何此类行动,而我们未能成功地为自己辩护或维护自己的权利,这些行动可能会对我们的业务产生重大影响,包括施加巨额罚款或其他制裁。
我们的产品可能无法提供保险和报销。
我们已上市的产品FC 2和候选药物的市场接受度和销售将取决于覆盖范围和报销政策,并可能受到医疗改革措施的影响。政府当局和第三方支付者(例如私人健康保险公司和健康维护组织)决定他们将为哪些产品付费并制定报销水平。如果获得批准,我们无法确定我们的候选药物是否可以获得保险和报销。我们也无法确定可用的报销金额(如果有的话)不会减少对我们产品的需求或价格。如果无法报销或仅在有限的水平上报销,我们可能无法成功将我们的候选药物商业化。
我们可能无法获得并保留候选药物的市场接受度。
如果获得适当的监管机构批准进行营销和销售,医生不得开出我们的候选药物,这将阻止任何此类候选药物产生收入。医生、患者和付款人对我们上市的产品FC 2和候选药物的市场接受度将取决于多种因素,其中许多因素超出了我们的控制范围,包括以下因素:
| ● |
我们的候选药物获得批准的临床适应症(如果有的话); |
| ● |
医生和付款人接受每种产品作为安全有效的治疗; |
| ● |
与替代治疗相关的治疗成本; |
| ● |
我们的产品在治疗预期疾病时相对方便和易于使用; |
| ● |
竞争药物的可用性和有效性; |
| ● |
我们销售和营销工作的有效性; |
| ● |
该产品获准纳入医院和管理式护理组织处方集的程度; |
| ● |
第三方(例如保险公司和其他医疗保健支付者)或政府医疗保健计划(包括医疗保险和医疗补助)提供保险和充分报销; |
| ● |
产品FDA或其他适用监管机构批准的标签中包含的限制或警告;和 |
| ● |
不良副作用的发生率和严重程度。 |
即使医学界承认我们的候选药物对于其批准的适应症是安全有效的,医生也可能不会立即接受使用,或者可能会缓慢采用此类产品作为治疗其预期疾病的可接受治疗。如果没有正面比较数据,我们也无法宣传我们的产品优于竞争产品。如果我们的候选药物(如果获得批准)没有获得医生和付款人的足够接受,我们可能无法从这些产品中产生足够的收入。此外,我们向医疗界和第三方付款人宣传我们产品的好处的努力可能需要大量资源,并且可能永远不会成功。
此外,即使我们的候选药物获得了市场接受度,如果出现以下情况,我们也可能无法随着时间的推移保持市场接受度:
| ● |
引入的新产品或技术比我们的产品更受欢迎、更具成本效益或使我们的产品过时; |
| ● |
使用我们的产品时出现不可预见的并发症;或 |
| ● |
没有足够的第三方保险范围或报销。 |
我们的药品可能受到政府定价控制。
在许多外国市场,包括欧盟国家,药品的定价受到政府控制。在美国,联邦和州已经提出了许多实施类似政府定价管制的提案,我们预计还会继续提出。虽然我们无法预测此类立法或监管提案是否会被采纳,但此类提案的采用可能会对我们推出产品的可能性以及任何已上市产品的盈利能力产生重大不利影响。
第三方可能会获得FDA的监管排他性,这对我们不利。
我们计划为我们的候选药物和我们未来开发的任何其他候选药物寻求市场独家经营权。在专利保护不可用或已过期的情况下,FDA的营销排他性可能是这些拟议产品唯一可用的排他性形式。营销排他性可能会推迟某些营销申请的提交或批准。潜在的竞争产品也可能寻求市场排他性,并可能处于不同的开发阶段,包括一些比我们的候选药物更先进的产品。我们不能肯定地预测FDA批准的时间或FDA是否会批准,我们也不能肯定地预测FDA批准竞争产品的时间或是否会批准这样的批准。竞争对手的产品可能会在我们之前获得FDA的市场独家批准,这可能会推迟我们提交营销申请或获得必要的监管批准的能力,导致与我们的候选药物相关的市场机会丧失,并对我们的业务、财务状况和运营结果产生重大不利影响。
与我们的财务状况和资本需求相关的风险
我们在最近一财年出现了净亏损,预计在可预见的未来将继续出现亏损。
在截至2024年9月30日的一年中,我们发生了3780万美元的净亏损。医药产品开发是一项投机性的工作,涉及很大程度的风险,是一项资本密集型业务。我们预计将产生巨额费用,直到我们能够获得监管部门的批准,然后大量销售我们正在开发的一个或多个候选药物,但这可能不会发生。我们预计将把大部分财务资源投入研发,包括我们的非临床开发活动和临床试验。我们的候选药物将需要完成监管审查、重大的营销努力和大量投资,然后才能为我们提供任何收入。我们不确定何时或是否能够实现或维持盈利。如果我们在未来实现盈利,我们可能无法在随后的时期保持盈利。如果不能盈利并保持盈利,将削弱我们维持运营的能力,并对我们普通股的价格和我们筹集资金的能力产生不利影响。
我们的独立注册会计师事务所在其关于截至2024年9月30日财年的10-k表格年度报告中包含的我们已审计财务报表的报告中包含了一个与我们继续持续经营能力有关的解释段落。
我们独立注册会计师事务所截至2024年9月30日的年度报告包括一段说明,指出我们的运营亏损和为我们的运营提供资金所需的额外资金使人对我们作为一家持续经营的企业在财务报表发布后一年内继续经营的能力产生了极大的怀疑。如果我们不能获得足够的资金,我们的业务、前景、财务状况和经营结果将受到重大和不利的影响,我们可能无法继续作为一家持续经营的企业。如果我们无法继续经营下去,我们可能不得不清算我们的资产,并可能获得低于该等资产在我们经审计的财务报表上的列报价值,投资者很可能会损失他们的全部或部分投资。如果我们寻求额外的资金来资助我们未来的业务活动,而我们作为一家持续经营的企业的能力仍然存在很大的疑问,投资者或其他融资来源可能不愿以商业合理的条款或根本不愿意向我们提供额外的资金。我们不能保证目前的运营计划将在我们预期的时间框架内实现,也不能保证我们的现金资源将为公司预期时期的运营计划提供资金,也不能保证我们将以我们可以接受的条款获得额外资金,或者根本不能。
我们需要筹集额外资本来资助我们未来的运营。如果我们未能吸引新资本,我们可能无法继续运营,或者可能被迫出售资产。或者,我们可能无法以优惠的条件获得资本,或者即使没有。如果有的话,融资条款可能会导致我们股东的严重稀释’ 股权
我们没有盈利,并且运营现金流为负。我们将需要大量资金来支持我们对候选药物的开发和商业化工作,包括20期NPS临床试验,以评估enobosarm在预防接受治疗肥胖的肥胖患者出现严重肌肉萎缩方面的有效性和安全性。截至本报告日期,我们现有的现金和现金等值物可能不足以满足我们的运营资金需求和运营费用。为了获得为我们的运营提供资金所需的资本,我们希望通过公开或私募股权发行、债务融资和/或其他资本来源来满足我们的现金需求。可能无法在我们需要的时间或金额提供额外资本。
即使有资本,也可能只有在不利的条件下才能获得。我们参与的任何额外的股权或可转换债务融资都可能稀释我们现有股东的权益。我们未来参与的任何债务融资可能会对我们施加限制我们业务的契约,包括限制我们产生留置权或额外债务、支付股息、回购我们的股票、进行某些投资以及从事某些合并、合并或资产出售交易的能力。我们筹集的任何债务融资或额外股本可能包含对我们或我们的股东不利的条款。如果我们通过与第三方的合作和许可安排筹集更多资金,我们可能需要放弃对我们的技术或产品的权利,或者以对我们不利的条款授予许可。如果在需要时无法获得足够的资本,我们的业务将受到严重损害,我们可能被要求停止运营、削减一个或多个产品开发或商业化计划、缩减或取消商业机会的开发、或大幅削减开支、出售资产、寻求合并或合资伙伴、申请债权人保护或清算我们的所有资产。这些因素中的任何一个都可能损害我们的经营业绩。
我们支持我们的开发和商业化活动所需的额外融资金额尚不确定。
我们预计在未来几年内将投入大量支出来支持我们的临床前和临床开发活动,特别是在某些候选药物的临床试验方面,并开始候选药物的商业化。这可能需要我们为我们的业务获得额外的融资,直到我们当前商业运营的收入独立资助我们的药物开发计划。我们可能还需要获得额外的融资来完成我们可能获得的任何额外候选药物的开发或支付其他运营费用。
我们未来的资本要求将取决于多种因素,包括:
| ● |
我们开发计划和临床试验的规模、复杂性、结果和时间; |
| ● |
如果获得批准,我们有能力成功将候选药物商业化; |
| ● |
我们有能力以合理的成本获得候选药物所需的充足化合物供应; |
| ● |
获得监管批准所涉及的时间和成本; |
| ● |
为我们的任何候选产品(包括enobosarm)开发任何所需的配套诊断所涉及的时间和成本; |
| ● |
我们可能建立的任何潜在未来合作、许可或其他安排的条款和时间; |
| ● |
任何未来收购、许可证或其他候选药物开发的现金需求; |
| ● |
我们从其他潜在来源收到资金,包括许可证和销售的现金流以及未偿应收账款的付款; |
| ● |
准备、提交、起诉、维护、辩护和执行专利主张所涉及的费用; |
| ● |
生产和商业化我们的候选药物所涉及的成本; |
| ● |
我们可能商业化的候选药物的销售额或其他收入(如果有的话),包括此类候选药物的售价以及足够的第三方保险和报销的可用性; |
| ● |
监管变化; |
| ● |
联邦、州或地方医疗保健或处方药计划的变更; |
| ● |
市场和经济状况;以及 |
| ● |
相互竞争的技术和市场发展。 |
这些因素可能会导致当前预计的运营和流动性需求发生变化。
由于我们未能及时向SEC提交两份报告,我们目前没有资格在S-3表格上提交新的注册声明,也没有资格在2025年3月1日之前使用S-3表格上当前有效的货架注册声明,这可能会损害我们以对我们有利的条款筹集资金的能力,及时或根本。
表格S-3允许符合资格的发行人使用简短的登记声明进行登记发行,该声明允许发行人通过引用纳入其根据修订的1934年证券交易法(“交易法”)编制的过去和未来的备案和报告。此外,S-3表格使符合资格的发行人能够根据《证券法》第415条进行首次发行。货架注册流程,加上转发合并信息的能力,使发行人能够避免发行过程中的延误和中断,并以比根据S-1表格上的注册声明在标准注册发行中筹集资金更快捷和有效的方式进入资本市场。由于失去有关此类登记的S-3表格资格,重新登记证券进行转售的能力也可能受到限制。
由于我们未能及时提交截至2023年12月31日的10-Q表格季度报告和2024年2月27日到期的当前8-k表格报告,我们没有资格在2025年3月1日之前提交新的S-3表格登记声明或使用我们有效的S-3表格登记声明(文件编号333-270606)。我们的S-3表格不符合资格,可能会严重削弱我们筹集业务所需资金的能力。若吾等根据S表格新注册声明寻求透过注册发售进入资本市场,吾等将被要求在发售开始前披露建议发售及其重大条款。由于此类披露以及美国证券交易委员会可能对S-1表格中的此类注册声明进行审核,我们可能会在发售过程中遇到延迟,并且我们可能会招致更多的发售和交易成本以及此类发售的其他障碍。如果我们无法通过注册发行筹集资金,我们将被要求以私募方式筹集资金,这可能会受到纳斯达克规则规定的定价、规模和其他限制,或者寻求其他资金来源。在2025年3月1日之前,我们将不能根据当前的货架登记声明出售任何证券,包括根据我们目前与林肯公园资本基金有限责任公司(“林肯公园”)达成的普通股购买协议。
我们可能不会收到ONCO因出售我们的ENTADFI资产而提供的任何额外付款,也可能不会收到我们可能不时持有的ONCO普通股股份的任何价值。
2023年4月,我们将我们的ENTADFI资产出售给了ONCO,并于2023年9月29日,我们签订了一项新资产购买协议修正案,其中规定,2023年9月30日到期的购买价400美元万分期付款的本票被视为已支付,并在以下条件下完全偿付:(1)于2023年9月29日向我们支付了100美元万的即时可用资金,(2)于2023年10月3日向我们发行了3,000股ONCO优先股。本公司持有的ONCO优先股股份于2024年9月24日转换为142,749股ONCO普通股。虽然ONCO的普通股目前在纳斯达克资本市场交易,但交易量有限,我们可能会发现很难以可接受的价格出售我们可能不时持有的ONCO普通股,因此我们可能无法获得我们可能不时持有的ONCO普通股的任何价值。根据ONCO资产购买协议,根据ONCO本票,ONCO有责任在我们的2024财年额外支付1,000美元的万分期付款,以及根据ONCO完成交易后ENTADFI业务的净销售额计算的额外8,000美元的里程碑付款。
吾等是否及何时会收到ONCO本票项下的任何购买价款的分期付款或资产购买协议项下的销售里程碑付款存在不确定性,而ONCO在履行其付款义务时存在未来违约的风险,而吾等对ONCO的任何资产并无担保权益,因此在ONCO违约的情况下,吾等将成为无抵押债权人。我们在2023年9月29日收到了ONCO的100万付款,并根据ONCO本票收到了ONCO在截至2024年9月30日的年度内的总付款30万。吾等已与ONCO订立宽免协议,内容涉及ONCO本票的某些违约情况,其中包括2024年4月本票的宽限期,宽限期将于(A)2025年3月31日及(B)违约事件(定义见宽免协议)发生时终止,并将2024年9月本票的到期日延长至2025年6月30日。在此期间,ONCO须就未偿还的本票余额支付若干所需款项。本公司不能保证(1)吾等是否及何时将根据宽免协议的条款或根据ONCO本票或资产购买协议项下的任何销售里程碑付款收取任何款项;(2)ONCO在履行宽免协议及ONCO本票项下的付款或其他责任时未来违约的风险程度;及(3)吾等是否及何时能够从吾等不时持有的ONCO普通股股份收取任何现金收益。如果ONCO在到期时未能支付未偿还的ONCO本票,或发生ONCO本票或容忍协议下的违约事件,我们可以宣布全部未偿还的金额到期并起诉收回ONCO本票,这可能会迫使ONCO破产。我们不能保证,如果ONCO申请破产,我们是否能够收回ONCO本票项下的任何到期金额,在这种情况下,我们持有的ONCO普通股很可能没有价值。
与我们的业务相关的风险
我们的FC 2业务可能会受到与政府和其他国际卫生机构风险的影响。
购买和分销FC2用于计划生育和艾滋病毒/艾滋病预防计划的大型国际机构和政府卫生机构历来购买了大量FC2。对这类机构的销售可能受到政府承包风险的影响,包括拨款过程和资金优先顺序、在根据政府招标授予合同时可能出现的官僚拖延、流程错误、政治或其他压力,以及合同可能被取消、延迟或重组的风险。政府招标表明接受投标人的价格,而不是订购或保证购买任何最低数量的单位。许多政府招标标明“最多”达到最大单位数量,这使适用的政府机构有权购买少于全部最高投标金额的标书。因此,政府机构订购和购买的单位可能少于全部最高投标金额,而且不能保证政府招标下的实际订单或发货的时间或数量。根据供应商供应能力、质量检查和需求变化等一系列因素,收到的订单可能与中标金额有所不同。这些收缩风险可能导致我们的经营业绩在每个季度之间发生重大变化,并可能对我们的净收入和盈利能力产生不利影响。影响政府卫生机构的预算问题、开支削减和全球卫生支出优先事项也可能对FC2的需求和我们的净收入产生不利影响。
FDA发布最终命令,将女性避孕套重新分类为II类医疗器械,这可能会导致美国市场对FC 2的竞争加剧。
2018年9月21日,FDA发布最终命令,将女性避孕套从第三类医疗器械重新分类为第二类医疗器械,将其重新命名为“一次性内部避孕套”,并要求该类别的新器械提交510(k)上市前通知并遵守各种“特殊控制”。特殊控制是一系列产品临床测试,包括但不限于确定产品对怀孕和感染传播的有效性以及产品耐受性。虽然FC 2是目前唯一获得FDA批准在美国上市的女性避孕套,FDA的这一重新分类可能会减少其他类型的女性避孕套进入美国市场的障碍。如果其他女性避孕套进入美国市场,我们可能会在美国面临更激烈的竞争,这可能会给FC 2的定价带来下行压力,并对FC 2在美国的销售产生不利影响
我们可能会经历竞争,特别是作为代谢疾病治疗药物的enobosarm(如果获得批准)和FC 2。
我们从事竞争激烈的行业(包括制药行业)产品的营销和开发。制药行业还具有研究广泛、技术进步迅速的特点。我们在北美、欧洲和其他地区候选药物的潜在竞争对手包括大型制药公司、特种制药公司和生物技术公司、大学和其他研究机构和政府机构。我们的许多竞争对手拥有比我们更强的研发和监管能力和经验,以及比我们更丰富的管理、制造、分销、营销和财务资源。我们可能无法与当前和未来的竞争对手成功竞争,竞争压力可能会对我们的净收入和利润率产生负面影响。
与肥胖相关的治疗市场,包括与接受GLP-1 RA的患者的肌肉萎缩和肌肉无力相关的治疗,竞争激烈,其中包括大型制药公司。此类竞争对手可能拥有比我们更强大的研发和监管能力和经验,以及比我们更多的管理、制造、分销、营销和财务资源。我们可能无法与当前和未来的竞争对手成功竞争,竞争压力可能会对我们的净收入和利润率产生负面影响。此外,如果我们认为竞争对手的开发活动侵犯了我们与enobosarm相关的知识产权,我们可能缺乏提出侵权索赔的资源,这可能会昂贵且耗时。
其他缔约方已经开发和销售了女用避孕套,尽管目前只有两种此类产品具有世卫组织的预审资格,而且这些女用避孕套都没有得到FDA的批准上市。在美国销售女性避孕套需要FDA的市场批准,向联合国机构销售女性避孕套需要世卫组织的资格预审。FDA将女用避孕套从三类医疗器械重新分类为二类医疗器械,这可能会降低其他类型的女用避孕套进入美国市场的门槛。FC2也一直在与其他女性避孕套在不需要FDA市场批准或世卫组织资格预审的市场上竞争。中国的其他聚氨酯品牌也获得了CE认证。我们经历了全球公共卫生部门日益激烈的竞争,竞争对手获得了最近三次南非招标和最近一次巴西招标的一部分。FC2 S市场日益激烈的竞争给FC2的定价带来了压力,并对FC2的销售造成了不利影响,一些客户,特别是在全球公共卫生部门,可能会优先考虑价格,而不是FC2可能具有优势的其他功能。其他公司也有可能开发女性避孕套,这样的公司可能比我们拥有更多的财力和客户联系。此外,其他避孕和艾滋病毒预防和治疗方法与FC2争夺全球公共卫生部门的资金和关注。
我们的FC 2销售净收入可能无法恢复到过去的水平。
近几年来,FC2的销售净收入大幅下降,特别是在美国的处方药渠道。尽管我们正在努力恢复未来的订购和使用模式,但FC2的销售净收入可能不会回到过去的水平。如果我们在远程医疗领域的分销合作伙伴遇到问题,我们或我们的分销合作伙伴不能或不愿意花费足够的资金来营销和推广FC2,或者对FC2的潜在需求下降,订购模式可能不会反弹或可能继续下降。特别是,由于Pill Club于2023年4月18日根据破产法第11章申请破产,以及我们与Pill Club的合同终止,对我们最大的远程医疗客户Pill Club的销售已被取消。此外,我们可能缺乏资源来增加FC2营销努力,使其足以增加收入并提高我们独立的、FC2专用的直接面向患者的远程医疗和药房服务门户的知名度。任何未能实现或维持FC2在美国市场的销售增长的情况都可能对我们的经营业绩产生重大不利影响。
我们可能无法通过我们自己的远程医疗门户成功实施我们的战略,以增加FC 2在美国市场的销量。
我们已经开发并继续完善自己的远程医疗门户,以增加美国处方渠道的收入。我们以前从未开发过远程医疗平台。运营和继续完善该平台所需的成本和监管复杂性,包括帮助我们完善该平台以及帮助我们营销远程医疗平台和FC 2的合作者的成本,可能会超过这一努力带来的任何销售额增长。患者还可能需要支付远程医疗医生咨询费用。任何这些风险都可能损害患者对该平台的接受度以及我们继续增长FC 2销售的能力。我们平台的市场接受度可能发展缓慢,而且迄今为止,我们还没有通过我们的平台经历过重大销售。
无法识别或完成未来的收购可能会对我们未来的增长产生不利影响。
我们打算收购新产品、技术和/或业务,使我们能够利用我们的竞争优势。虽然我们继续评估潜在的收购,但我们可能无法识别并成功谈判合适的收购、以令人满意的条款为未来收购获得融资、在需要时获得监管机构对收购的批准,或在未来以其他方式完成收购。无法识别或完成未来的收购可能会限制我们未来的增长。同样,在任何收购中使用我们的股权或可转换债务证券都会稀释我们的股东,并可能影响我们股票的市场价格。
我们在整合战略收购时可能会遇到困难。
将被收购的公司及其运营整合到我们的运营中涉及许多风险,包括:
| ● |
被收购的业务可能会遭受损失,或者我们可能会承担被收购公司的负债,这可能会对我们的盈利能力产生不利影响; |
| ● |
与收购企业整合相关的意外成本可能会增加我们的费用; |
| ● |
可能无法实现收购的战略目标; |
| ● |
被收购企业关键人员的流失; |
| ● |
难以实现计划的成本节约和协同效应可能会增加我们的费用或减少我们的净收入; |
| ● |
转移管理层的注意力可能会损害他们有效管理我们业务运营的能力; |
| ● |
收购的业务可能需要大量支出用于产品开发或监管批准; |
| ● |
被收购的企业可能缺乏足够的内部控制或其财务系统存在其他问题; |
| ● |
可能存在与所收购企业的商业实践相关的监管合规性或其他问题; |
| ● |
我们可能会记录定期接受减损测试的善意和不可摊销无形资产以及潜在的减损费用,我们还可能会产生与无形资产相关的摊销费用;和 |
| ● |
意外的管理或运营问题或负债可能会对我们的盈利能力和财务状况产生不利影响。 |
此外,我们可能会借入资金或发行股权为战略收购提供资金。未来收购产生的债务杠杆可能会对我们的营业利润率产生不利影响,并限制我们利用未来商业机会的能力。此类借款也可能受到利率波动的影响。股票发行可能会稀释我们的现有股东并对我们股票的市场价格产生不利影响。
我们可能会受到与The Pill Club相关的索赔或调查的影响’有关FC 2销售的商业实践。
Pill Club是我们最大的客户之一,占我们2022财年净收入的44%,占2021财年净收入的43%。2023年2月7日,加州总检察长宣布与The Pill Club就The Pill Club涉嫌的多项不当行为达成和解,包括涉嫌对FC 2多付账单。尽管我们没有参与加州总检察长指控对象的商业行为,但加州总检察长或其他政府当局可能会就The Pill Club在FC 2销售方面的行为进行调查或对我们提出索赔。任何此类索赔或调查都可能对我们的声誉、业务、运营业绩和财务状况产生重大不利影响。任何此类主张或调查,无论结果如何,都将是昂贵且耗时的。
我们不太可能收回The Pill Club的任何应收账款。
The Pill Club的应收账款集中,截至2024年9月30日,应收账款为390万美元。2023年4月18日,The Pill Club根据第11章申请破产,其资产于2023年6月出售,以满足有担保债权人的要求。我们已向The Pill Club破产财产提起针对该等应收账款的索赔,我们将继续寻求尽可能多的应收账款付款,但根据其他无担保债权人的索赔金额和The Pill Club破产财产中剩余的有限资产,我们不太可能收回任何这些应收账款。由于The Pill Club于2023年4月申请第11章破产,我们在2023财年进行了记录,并截至2024年9月30日维持了3.9亿美元的信用损失备抵。
根据与供应商的争议的解决,我们负有重大付款义务。
一家供应商声称,我们欠万大约1,000美元的产品和服务,这些产品和服务与我们根据欧盟协议将萨比布林商业化的努力有关。我们对所欠金额存在争议,为了解决这一争议,我们同意向供应商支付总计830万,包括2024年2月支付的230美元万,在2024年3月31日至2028年1月31日期间分48次平均每月支付的350美元万,以及根据ONCO本票支付的相当于付款25%的250美元万本票,条件是如果这笔金额没有在2025年12月31日之前全额支付,我们必须从2026年1月开始分24次每月平均支付余额。如果我们没有足够的现金来支付到期应付该供应商的金额,我们可能需要筹集额外的资本,削减一个或多个产品开发或商业化计划,缩减或消除商业机会的开发,或者大幅减少费用,出售资产,寻求合并或合资伙伴,申请债权人保护或清算我们的所有资产。
由于我们在国外市场销售FC 2,因此我们面临着可能对我们的经营业绩产生不利影响的国际业务风险。
我们的国际业务使我们面临风险,包括:
| ● |
经济和政治不稳定; |
| ● |
货币波动; |
| ● |
全球流行病,因为各国政府将其卫生或发展预算重新分配到其他卫生领域; |
| ● |
国际监管要求、进口关税或出口限制的变化,包括对收入汇回的限制; |
| ● |
全球运输网络中断和价格上涨,例如停工、罢工或入境口岸或其他运输来源关闭,或产品清关延误或困难; |
| ● |
人员配备和管理海外业务方面的困难; |
| ● |
应收账款收款难度加大,收款期限延长; |
| ● |
一些国家知识产权保护的不确定性; |
| ● |
多种相互冲突且不断变化的法律法规,例如隐私法规,包括GDPR、税法、进出口限制、就业法、移民法、劳动法、监管要求和其他政府批准、许可和许可证; |
| ● |
遵守贸易和外国税法方面的复杂性,以及外国员工、分销商或其他代理人未能遵守美国和外国法律的风险更大,包括反垄断法规、《反海外腐败法》和其他反贿赂或腐败法以及贸易法规; |
| ● |
价格管制和对外币的其他限制;以及 |
| ● |
我们执行合法权利和补救措施的能力存在困难。 |
任何这些风险都可能扰乱我们产品的供应、增加我们的费用或减少我们的净收入。遵守贸易和外国税法的成本增加了我们的费用,实际或涉嫌违反此类法律的行为可能会导致执法行动或经济处罚,从而导致巨额成本。
用于制造FC 2的原材料、劳动力和其他成本的增加可能会增加我们的销售成本并降低我们的毛利率。
我们可能会遇到原材料(包括FC 2中使用的丁胶聚合物)成本增加以及劳动力成本增加的情况。我们可能无法将此类成本增加转嫁给客户。因此,与制造FC 2相关的原材料、劳动力或其他成本的增加可能会增加我们的销售成本并降低我们的毛利率。我们看到用于制造FC 2润滑剂的关键成分在全球范围内短缺,这可能会给未来的定价压力和库存供应带来压力。已订购战略供应库存以降低这一风险,但我们的供应可能不足以满足全球或任何特定市场对FC 2的需求。
货币汇率波动可能会增加我们的开支。
由于我们在位于马来西亚的租赁设施中生产FC 2,因此我们的一部分运营成本以外币计价。虽然我们未来FC 2销售的很大一部分可能来自国外市场,但FC 2的所有销售均以美元计价。制造成本受到与马来西亚林吉特(MYR)相对于美元汇率波动相关的正常货币风险的影响。从历史上看,我们没有对冲外汇风险。
我们依赖单一设施来生产FC 2,以及某些原材料的单一来源供应商, 这使我们面临供应中断的风险。
我们在位于马来西亚的单一租赁工厂中生产FC 2,并从单一供应商采购某些原材料。该设施或这些供应商遇到的困难,例如火灾、事故、自然灾害、劳动力中断或传染病的爆发,可能会停止或中断我们设施或供应商设施的生产,延迟订单的完成,或导致订单的取消。任何这些风险都可能增加我们的费用或减少我们的净收入。
我们可能会因需要过渡FC 2的丁胶聚合物供应而产生成本或经历供应中断。
我们依赖FC 2主要原材料的唯一供应商。供应商已表示,打算在本日历年结束时关闭目前生产我们特种级丁胶的工厂。我们打算转向替代等级的丁氨,这将需要我们承担制定和测试替代等级并寻求FDA对替代等级的批准的成本。我们不确定这一过渡涉及的时间或成本。此外,供应商表示,在我们转向标准化等级的丁胶时,它将协助提供供应的连续性,并确认将利用其控制的另一家生产设施来生产当前的特种等级。已经进行了适当的工厂试验和测试,以表明新工厂能够供应我们当前的丁质等级。
总体经济状况的不确定性和不利变化可能会对我们的业务产生负面影响。
如果总体经济状况,包括持续或恶化的通胀或供应链挑战、衰退压力、不断上升的利率、劳动力短缺和不断上升的失业率,在我们开展业务的美国和其他全球市场出现下滑,或者如果消费者担心经济状况将会下降,消费者可能会减少对我们现有和潜在产品等产品的支出。不利的变化可能是由于不利的全球或区域经济状况、油价波动、供应链问题、通货膨胀、政治不稳定、消费者信心下降、流行病、失业、股票市场波动、信贷供应收缩或其他影响总体经济状况的因素造成的。这些变化可能会对我们现有产品的销售或未来产品的开发产生负面影响,增加成本,减少融资的可获得性,或者增加与生产和分销我们的产品和潜在候选药物相关的成本。此外,FC2的很大一部分销售是在公开市场上向政府机构销售的,包括美国国际开发署和世界各地的其他政府机构。经济状况恶化以及预算赤字和紧缩措施可能对政府预算造成压力,并导致政府机构购买FC2的数量或价格减少。
FC 2的销量波动,导致我们的经营业绩季度有所不同。FC 2的销量根据我们商业合作伙伴和公共卫生部门的需求以及政府采购流程的性质而波动。从历史上看,由于这种购买模式,我们的净收入季度各不相同。经营业绩的季度变化可能会导致我们无法满足市场对经营业绩的预期,并可能在这些季度压低我们的股价。
重大不利或不可预见的法律判决、罚款、处罚或和解可能会对我们的利润和现金流产生不利影响。
我们可能会不时成为我们业务附带法律程序的一方,包括但不限于与产品责任、环境合规、专利侵权、商业纠纷、证券法、反垄断法和竞争法、监管或行政行动、公司事务和雇佣事务有关的指控。我们和潜在合作者在临床试验中目前和未来对我们候选药物的使用,以及未来任何经批准的产品的销售,可能会使我们面临产品责任索赔。由于我们候选药物的临床测试,我们将面临固有的产品责任索赔风险,如果我们获得FDA批准并在美国或其他其他司法管辖区将我们的候选药物商业化,或者如果我们参与拟议新产品的临床测试或将任何其他产品商业化,我们将面临更大的风险。任何此类产品责任索赔可能包括对制造缺陷、设计缺陷、未能就产品固有危险发出警告、疏忽、严格责任或违反保修的指控。根据州消费者保护法,索赔也可以主张。如果我们不能成功地在产品责任索赔中为自己辩护,如果获得批准,我们可能会招致重大责任或被要求限制我们现有产品或候选药物的商业化。无论是非曲直或最终结果如何,产品责任索赔都可能导致以下任何一种情况:
| ● |
无法将我们的候选药物商业化; |
| ● |
难以招募受试者进行临床试验或在试验完成前退出这些受试者; |
| ● |
标签、营销或促销限制; |
| ● |
产品召回或撤回; |
| ● |
对我们的产品或我们未来可能开发的产品的需求减少; |
| ● |
收入损失; |
| ● |
声誉受损; |
| ● |
监管机构启动调查; |
| ● |
相关诉讼辩护的费用; |
| ● |
向试验参与者或患者提供大量金钱奖励;以及 |
| ● |
我们的股票价值下跌。 |
诉讼可能要求我们记录准备金或付款,这可能对我们的利润和现金流产生不利影响。即使成功辩护法律诉讼也可能导致我们承担巨额法律费用,可能会转移管理层的注意力和资源对我们业务的注意力和资源,可能会阻止我们或我们的合作伙伴实现或维持受影响产品的市场接受度,并可能大幅增加我们未来产品商业化的成本,并损害我们或通过这些产品商业化产生收入的能力我们的战略联盟合作伙伴。
我们目前维持有限的一般商业责任保险范围。然而,我们可能无法以合理的成本或足够的金额维持保险范围来保护我们免受损失。如果因未保险负债或超过保险限额的负债而对我们提出成功的产品责任索赔或一系列索赔,我们的资产可能不足以支付此类索赔,并且我们的业务运营可能会受到损害。
我们已被列为股东集体诉讼的被告。这些,以及潜在的类似或相关诉讼或调查,可能会导致巨额法律费用、罚款、处罚或损害赔偿,并可能转移管理层的注意力’这是我们业务的时间和注意力。
2022年12月5日,佛罗里达州南区联邦地区法院对我们的某些现任高管和董事提出了推定的证券集体诉讼投诉。修改后的诉状称,2021年3月1日至2023年3月2日期间,某些公开声明将萨比扎布林作为COVID-19的治疗方法违反了《交易法》第10(b)和20(a)条以及据此颁布的100亿.5条规则,并寻求金钱赔偿。我们和我们的某些办事处和董事也是四项衍生诉讼的当事人,这些诉讼主张主要与证券集体诉讼中主张的问题和主张有关的州法律主张。
这些法律程序和任何其他类似或相关的法律程序受到固有的不确定因素的影响,与这些事项有关的实际费用将取决于许多未知因素。这些法律程序的结果是不确定的,我们可能会被迫花费大量资源来为这些行动辩护,我们可能不会获胜。虽然我们有这些行动的保险,但我们有500美元的万保留额,这意味着我们要对与这些行动相关的第一个$500万的成本或损害负责,因此在申请任何保险之前,我们必须自己支付不超过该保留额的任何辩护费用。监督和防范法律行动对管理层来说是耗时的,并损害了我们将内部资源充分集中在我们的业务活动上的能力。此外,我们可能会产生与这些事项相关的大量法律费用和费用。在法律允许的范围内,我们一般也有义务对在这些和类似行动中被点名为被告的我们的现任和前任董事和官员进行赔偿。我们目前无法估计这些问题给我们带来的可能成本,因为这些行动目前还处于早期阶段,我们不能确定解决这些问题可能需要多长时间,或者我们可能需要支付的任何损害赔偿金额。我们有可能在将来作出判决或就金钱损害索赔达成和解。在这些诉讼中做出有损我们利益的决定可能会导致支付巨额损害赔偿金,并可能对我们的现金流、运营结果和财务状况产生重大不利影响。这些和额外的法律程序也可能增加我们的董事和高级职员保险范围的成本,或导致不利的变化,如果我们未来无法获得可接受的董事和高级职员保险范围,我们可能在招聘或保留合格的独立董事或高级职员方面面临挑战。
我们的业务和运营将受到影响 如果我们遭受网络攻击或其他导致安全漏洞的隐私或数据安全事件。
我们的信息技术可能会受到网络攻击、安全漏洞或计算机黑客攻击。经验丰富的计算机程序员和黑客可能能够渗透我们的安全控制并挪用或损害敏感的个人、专有或机密信息,造成系统中断或导致关闭。他们还可能能够开发和部署攻击我们的系统或以其他方式利用任何安全漏洞的恶意软件程序。我们的系统和存储在这些系统上的数据也可能容易受到安全事件或安全攻击、破坏或盗窃行为、数据放错地方或丢失、人为错误或其他可能对我们的系统和数据以及我们业务合作伙伴的数据产生负面影响的类似事件。此外,向我们提供服务的第三方(例如托管解决方案提供商)在其自身的安全系统和基础设施发生故障时也可能成为安全风险的来源。
在网络事件之前或之后消除或解决上述安全威胁和漏洞的成本可能是巨大的。我们的补救努力可能不会成功,并可能导致服务中断、延误或停止,以及失去现有或潜在的供应商或客户。此外,违反我们的安全措施以及未经授权传播有关我们、我们的业务合作伙伴、我们临床试验参与者或其他第三方的敏感个人、专有或机密信息可能会使我们面临重大的潜在责任和声誉损害。此外,由于数据安全事件或其他系统故障而导致已完成或正在进行或计划中的临床试验中的临床试验数据丢失,可能会导致我们的监管审批工作延迟,并显著增加我们恢复或复制数据的成本。随着与网络攻击相关的威胁的发展和增长,我们可能还会发现有必要进行额外的投资来保护我们的数据和基础设施,这可能会影响我们的盈利能力。作为一家全球企业,我们还可能受到现有和拟议的法律法规以及与网络安全、数据隐私、数据本地化和数据保护相关的政府政策和做法的负面影响,如GDPR和加州消费者隐私法案。
任何未能遵守《FCPA》和非美国司法管辖区的类似反贿赂法的行为都可能会对我们的业务产生重大不利影响,并导致民事和/或刑事制裁。
《反海外腐败法》和非美国司法管辖区的类似反贿赂法律一般禁止公司及其中间人为获得或保留业务的目的向非美国政府官员支付不正当的款项。由于全球公共卫生部门对FC2销售的重要性,我们在美国以外的许多客户关系都是与政府实体的,因此可能受到此类法律的约束。近年来,全球反腐败法律的执行工作大幅增加,公司更频繁地自愿披露自己,美国和非美国政府机构进行积极的调查和执法程序,并对公司和个人的巨额罚款和处罚进行评估。我们的国际业务造成了我们的员工、顾问、销售代理或分销商之一未经授权付款或提供付款的风险,因为这些各方并不总是受我们的控制。任何涉嫌或实际违反这些规定的行为都可能使我们面临政府审查、严厉的刑事或民事制裁和其他责任,包括被排除在政府合同之外,并可能扰乱我们的业务,并对我们的声誉、运营结果和财务状况造成重大不利影响。
未来我们需要扩大组织的规模和复杂性,并且我们在执行增长战略和管理任何增长时可能会遇到困难。
我们目前的管理、人员、系统和设施可能不足以支持我们的业务计划和未来的增长。我们需要进一步扩大我们的科学、销售和营销、管理、运营、财务和其他资源,以支持我们计划中的研究、开发和商业化活动。
有效管理我们的运营、增长和各种项目的需要要求我们:
| ● |
改进我们的运营、财务、管理和监管合规控制以及报告系统和程序; |
| ● |
吸引和留住足够数量的有才华的员工; |
| ● |
以具有成本效益的方式有效地管理候选药物的商业化活动; |
| ● |
管理我们与与候选药物商业化相关的合作伙伴的关系; |
| ● |
有效管理我们的临床试验; |
| ● |
以具有成本效益的方式有效管理我们的内部制造运营,同时将我们当前候选药物的生产能力提高到商业水平;以及 |
| ● |
有效管理我们的开发工作,同时履行我们对合作伙伴和其他第三方的合同义务。 |
此外,从历史上看,我们一直并将继续利用兼职外部顾问的服务为我们执行许多任务,包括与临床前和临床试验相关的任务。我们的增长战略还可能需要扩大我们对顾问的使用,以执行这些任务和未来的其他任务。由于我们业务的某些职能依赖于顾问,我们需要能够有效地管理这些顾问,以确保他们成功地履行合同义务,并在预期的最后期限内完成。我们不能保证,我们将能够管理现有的顾问或找到其他称职的外部顾问,如有需要,以经济合理的条件,或根本没有。如果我们不能通过雇佣新员工和扩大顾问的使用来有效地扩大我们的组织,我们可能无法成功地执行有效执行我们计划的研究、开发和商业化活动所需的任务,因此可能无法实现我们的研究、开发和商业化目标。
我们经营所在的各个司法管辖区税务规则的解释和应用不一致可能会对我们的递延所得税资产、税务义务和实际税率产生重大影响。
我们在美国和其他司法管辖区都要缴纳各种税收以及税收和汇款义务。此外,在任何时候,我们都可能接受增值税、基于销售的税、工资税、产品税、进口税或其他非所得税的审查。我们可能会因法律、法规、行政做法、原则、当局的评估和与税收相关的解释(包括不同司法管辖区的税收规则)的变化而确认额外的税收支出、承担额外的税收责任、招致损失和处罚。我们根据业务所在国家制定的税率计算所得税拨备。由于各国的税率不同,可归因于我们运营的各个司法管辖区的收益的变化可能会导致我们的整体税收拨备发生不利的变化。制定的税率、我们所作的假设和估计以及我们可能采取的行动的变化,可能导致递延税项资产的减记,或以其他方式对我们的纳税义务或实际税率产生重大影响,从而可能对我们的财务状况和经营业绩产生负面影响。
如果我们无法实现递延所得税资产或我们经营所在司法管辖区的税法未来发生变化,我们的有效税率可能会受到负面影响。
我们在美国和英国都要缴纳所得税。和其他全球司法管辖区。我们的有效税率可能会受到递延税项资产和负债估值变化的不利影响。我们根据合并财务报表账面金额与资产和负债的计税基础之间的差异来确认递延税项资产和负债。在确定我们的所得税拨备时,需要做出重大判断。我们定期审查我们的递延税项资产的可回收性,并在部分或全部递延税项资产更有可能无法变现的情况下建立估值拨备。如果我们无法产生足够的未来应税收入,如果实际实际税率发生重大变化,或者如果基本临时差异成为应税或可扣除的时间段发生变化,我们可能被要求增加我们的递延税项资产的估值拨备,这可能导致我们的实际税率大幅上升。税法或税收裁决的变化可能会对我们的有效税率产生实质性影响。我们开展业务的司法管辖区,包括美国和英国,可能会考虑修改现有税法。这样的变化可能会增加我们在业务所在国家的纳税义务。对我们在这些司法管辖区的活动征税的任何变化都可能导致我们的实际税率大幅上升。
我们使用净营业亏损结转和某些其他税收属性的能力可能受到限制。
截至2024年9月30日,我们的联邦和州净营业亏损结转分别约为1.642亿美元和7000亿美元,其中分别为2,860万美元和3,560万美元,如果不用于抵消未来时期的应税收入,将于2025年开始到期,并将于2044年完全到期。根据经修订的1986年《国内税收法》(“该法”)及其颁布的法规,包括但不限于综合所得税申报表法规,各种企业所有权变更可能会限制我们使用净营业亏损结转和其他税收属性来抵消我们收入的能力。
《守则》第382条下的“所有权变更”(通常三年内股权变更50%)可能会限制我们在变更后抵消美国联邦应税收入的能力。该法典第382条对公司可以通过所有权变更前净营业亏损结转和某些已确认的固有亏损抵消的所有权变更后应税收入金额施加了年度限制。
与我们的知识产权相关的风险
我们可能无法保护涵盖我们产品的知识产权的专有性质。
我们的商业成功在一定程度上取决于我们获得和维护我们的产品、候选药物和技术的知识产权,以及成功地保护这些权利免受第三方挑战的能力。如果我们不充分保护我们的知识产权,竞争对手可能会使用我们的技术,侵蚀或否定我们可能拥有的任何竞争优势,这可能会损害我们的业务和盈利能力。医药产品的专利地位高度不确定。由于法院先例和立法行动的改变,适用于专利的法律原则正在过渡,我们不能确定围绕有效性问题的历史法律标准是否将继续适用,或者目前与这些领域已颁发专利有关的辩护在未来是否足够。美国专利法的变化,例如2011年的《美国发明法》,可能会影响我们专利权的范围、强度和可执行性,或者我们可能提起的与我们专利权相关的诉讼的性质。此外,一些外国的法律对所有权的保护程度不如美国的法律,我们在这些国家保护我们的所有权可能会遇到重大问题。我们在保护我们的专有权利不被第三方未经授权使用方面受到限制,因为我们的专有技术受到有效和可强制执行的专利的保护,或被有效地作为商业秘密保留。
这些风险包括以下可能性:
| ● |
我们提交的专利申请可能无法在美国或外国获得授予专利; |
| ● |
向我们或我们的合作伙伴颁发或许可的专利可能会受到质疑或被发现是基于不充分、不完整或不正确的信息而颁发的,因此被认定无效或不可执行; |
| ● |
任何专利保护的范围可能过于狭窄,无法排除竞争对手围绕这些专利进行开发或设计; |
| ● |
我们或我们的许可人并不是第一个将发明纳入已发布的专利或正在审批的专利申请的人; |
| ● |
我们或我们的许可人不是第一个在美国提交该技术专利申请的发明人,也不是第一个在国外提交针对该技术的专利申请的发明人; |
| ● |
我们在专利申请过程中可能未能遵守程序、文件、费用支付和其他类似规定,这可能导致专利或专利申请的放弃或失效,导致专利权部分或全部丧失; |
| ● |
未来的候选药物或我们的专有技术可能无法获得专利,或者法律决定可能会限制符合专利资格的主题; |
| ● |
其他人可能对我们持有或许可的专利和其他专有权主张权利或所有权; |
| ● |
开发、测试、临床试验和监管审查的延迟可能会缩短我们在专利保护下销售候选药物的时间; |
| ● |
我们可能无法及时申请我们的技术或产品专利;以及 |
| ● |
无法控制任何在许可中知识产权的专利起诉、维护或执行。 |
我们无法预测第三方是否会对我们或我们的战略合作伙伴或向我们授权的技术的许可方提出这些索赔,或者这些索赔是否会损害我们的业务。此外,知识产权诉讼的结果还存在无法预先充分量化的不确定性。如果我们或我们的合作伙伴面临与我们的候选药物相关的第三方侵权索赔或挑战,不利结果可能会使我们对此类第三方承担重大责任,并迫使我们或我们的合作伙伴减少或停止开发部分或所有候选药物,这可能会对我们的业务、财务状况、运营业绩和前景产生不利影响。
我们的或我们的许可人’ 专利可能会过期或无效、被发现无法执行、缩小范围或以其他方式受到限制或我们的许可人’ 专利申请可能不会产生已颁发的专利,也可能产生具有狭隘、过于宽泛或无法执行的权利要求的专利。
我们的商业成功将在一定程度上取决于获得和维护我们候选药物的专利和商业秘密保护,以及使用这些候选药物治疗处方适应症患者的方法。只有在我们或我们的许可人拥有或控制此类有效且可执行的专利或商业秘密的情况下,我们才能够保护我们的候选药物以及使用这些候选药物治疗适应症患者的方法免受第三方未经授权的使用。
即使我们的候选药物和使用这些候选药物治疗指定适应症患者的方法被有效和可执行的专利覆盖,并在规范中具有足够的范围、披露和支持,这些专利也只能在有限的时间内提供保护。我们和我们的许可方获得专利的能力可能非常不确定,涉及复杂的、在某些情况下尚未解决的法律问题和事实问题。此外,不同的国家有不同的专利程序,不同国家颁发的专利提供不同程度的保护,防止他人使用专利发明。因此,如果在特定国家向我们或我们的许可人颁发了涵盖一项发明的专利之后,没有在其他国家颁发涵盖同一发明的专利,或者如果对在一个国家颁发的专利的有效性、可执行性或范围、或在一个国家颁发的专利的书面描述或启用的任何司法解释与对另一个国家颁发的相应专利的解释不同,我们在这些国家保护我们知识产权的能力可能会受到限制。美国和其他国家专利法或专利法解释的变化可能会极大地降低我们知识产权的价值或缩小我们专利保护的范围。
虽然我们将在我们认为适当的情况下申请涵盖我们技术和产品的专利,但许多第三方可能已经在我们的产品开发领域提交了专利申请或获得了专利。这些实体的申请、专利和其他知识产权可能与我们的专利申请或其他知识产权相冲突,可能会阻止我们获得专利,可能会质疑我们的任何专利的有效性,或者可能以其他方式对我们的产品开发、制造、商业化或营销的能力产生不利影响。此外,如果第三方提交的专利申请包括我们拥有权利的任何技术的权利主张,我们可能不得不参与美国专利商标局或外国专利监管机构的干扰、派生或其他程序,以确定我们在该技术上的权利,这可能既耗时又昂贵。此外,已颁发的专利可在法院或在美国专利商标局的授权后程序中受到挑战,或在外国的类似程序中受到挑战。这些诉讼程序可能导致专利权利要求的丧失或权利要求范围的不利变化。
如果我们或我们的许可方或战略合作伙伴未能为我们的产品或我们的专有技术及其用途获得和维持专利保护,公司可能会被劝阻与我们合作。在这种情况下,我们将候选药物或未来候选药物商业化的能力(如果获得批准)可能会受到威胁,我们可能会失去竞争优势,我们面临的竞争可能会加剧,所有这些都可能对我们的业务、财务状况、经营业绩和前景产生不利影响。
此外,世界上大部分地区都存在机制,允许仿制药营销人员在任何监管排他性到期之前或之后立即对专利提出某种形式的挑战,仿制药公司越来越多地采用激进的策略,例如“有风险”的上市和强制许可来挑战相关专利权。
我们的业务还可能依赖于未经专利的专有技术、专业知识和商业秘密。如果该知识产权的机密性被泄露,可能会对我们的业务产生不利影响。
我们可能没有足够的知识产权保护enobosarm作为一种治疗方法,以增加脂肪流失和预防接受GLP-1 RA的肌肉减少性肥胖或超重老年患者的肌肉流失,这些患者有出现肌肉萎缩和肌肉无力的风险。
Enobosarm作为一种治疗方法来增加脂肪损失和防止接受GLP-1 RA治疗的肌肉源性肥胖或超重老年患者的肌肉损失的价值,这些患者有发生肌肉萎缩和肌肉无力的风险,这在一定程度上将取决于我们获得和维护该候选药物的知识产权以及成功捍卫这些权利对抗第三方挑战的能力。我们有物质组成和物质多形组成的现有专利已颁发,最后一项专利期限将于2028年和2029年到期,以及与使用enobosarm在体重管理中的使用有关的未决临时专利使用方法申请,如果发布,最长的专利期限是关于使用方法的申请,如果发布,将于2044年到期。这种使用方法专利申请可能不会产生已颁发的专利,可能会受到挑战,或者可能会导致专利保护过于狭隘,无法排除竞争对手围绕任何已颁发的专利进行开发或设计。如果我们不充分保护我们的知识产权,竞争对手可能会使用我们的技术,侵蚀或否定我们可能拥有的任何竞争优势,这可能会损害我们的业务和盈利能力。
我们部分依赖于一些许可关系。
我们已通过许可获得与萨比沙布林和埃诺博斯姆候选药物相关的知识产权和技术,并可能在未来获得额外许可。我们作为一方的许可包含,我们预计未来的许可都将包含要求向许可方支付预付款、里程碑款和特许权使用费的条款。如果我们未能遵守对许可人的这些义务或其他义务,该许可人可能有权在相对短的时间内终止许可,在这种情况下,我们将无法将许可证涵盖的候选药物商业化。此外,与这些许可证相关的里程碑和其他付款将降低我们开发候选药物的利润。
我们可能会面临我们的知识产权侵犯第三方知识产权的指控。如果我们侵犯第三方的知识产权,可能会增加我们的成本或阻止我们将候选产品商业化。
我们的成功在一定程度上取决于不侵犯其他各方的专利和专有权利,以及不违反我们就我们的技术和产品达成的任何许可、合作或其他协议。在我们打算开发药物的治疗领域和治疗目标领域,也存在着许多美国和外国颁发的专利以及其他国家拥有的未决专利申请。专利申请在提交时是保密的,在首次提交后大约18个月后发表之前一直保密,而一些专利申请在发布之前仍未公布。因此,对于与使用或制造我们的产品或候选药物相关的物质组成、配方、制造方法或治疗方法,可能存在我们不知道的其他第三方专利和未决申请。因此,我们不能肯定地知道每一项第三方专利申请的性质或存在。我们不能确保我们或我们的合作伙伴将按计划自由制造或销售我们的候选药物,也不能确保我们或我们的许可人和合作伙伴的专利不会受到第三方的反对或诉讼。如果有管辖权的法院持有任何第三方专利,以涵盖我们的材料、配方、制造方法或治疗方法中与使用或制造我们的任何候选药物相关的方面,则任何此类专利的持有者可能能够阻止我们开发适用候选药物并将其商业化的能力,除非我们获得了许可证,或者直到该专利到期或最终被确定为无效或不可执行。我们可能无法以优惠条款或根本不能获得此类专利的许可。如果不能获得这样的许可证,可能会对我们的业务产生重大不利影响。
我们有侵犯第三方专有权的风险,因为在我们的开发和制造努力的重点领域,存在着大量由第三方拥有的美国和外国颁发的专利和未决的专利申请。其他人可能是第一个提出我们或我们许可人的每一项未决专利申请所涵盖的发明,并颁发了专利和/或可能是第一个为这些发明提交专利申请的人。此外,由于专利申请需要数月时间才能发布,专利申请可能需要数年时间才能发布,因此可能存在我们或我们的许可方不知道的当前正在处理的申请,这些申请可能会在以后导致已颁发的涵盖我们候选产品的生产、制造、合成、商业化、配方或使用的专利。此外,我们候选产品的生产、制造、合成、商业化、配方或使用可能会侵犯我们不知道的现有专利。在第三方索赔中为自己辩护,特别是诉讼,将是昂贵和耗时的,并将转移管理层对我们业务的注意力,这可能会导致我们的开发或商业化努力的延迟。如果第三方索赔成功,我们可能不得不支付巨额损害赔偿金或采取其他对我们的业务不利的行动。
制药行业存在大量涉及知识产权的诉讼。如果第三方声称我们侵犯了其专利或其他专有权,我们可能面临一系列可能对我们的业务、财务状况、运营业绩和前景产生不利影响的风险,包括以下风险:
| ● |
无论我们最终是否成功,侵权和其他知识产权索赔的辩护都将是昂贵且耗时的,并且可能会延迟监管审批过程、消耗我们的资本并转移管理层对我们业务的注意力; |
| ● |
如果法院确定我们的产品或技术侵犯了竞争对手的专利或其他专有权,我们可能必须为过去的侵权行为支付巨额赔偿金; |
| ● |
法院可能会禁止我们销售或许可我们的技术或未来的产品,除非第三方以商业上合理的条款向我们许可其专利或其他专有权,但法院并不要求这样做; |
| ● |
如果许可证可从第三方获得,我们可能必须支付大量特许权使用费或一次性付款或授予我们的专利或其他专有权交叉许可才能获得该许可证;或 |
| ● |
我们可能需要重新设计我们的产品,以便它们不会侵权,这可能是不可能的,或者可能需要大量的金钱支出和时间。 |
我们无法预测第三方是否会对我们或我们的战略合作伙伴或向我们授权的技术或其他知识产权的许可方提出这些索赔,或者这些索赔是否会损害我们的业务。此外,知识产权诉讼的结果还存在无法预先充分量化的不确定性。如果我们或我们的合作伙伴面临与我们的候选药物相关的第三方侵权索赔或挑战,不利结果可能会使我们对此类第三方承担重大责任,并迫使我们或我们的合作伙伴减少或停止开发部分或所有候选药物,这可能会对我们的业务、财务状况、运营业绩和前景产生不利影响。
我们可能会被指控我们的员工错误地使用或披露我们竞争对手的所谓商业秘密。
正如制药行业常见的那样,我们将雇用以前在其他生物技术或制药公司(包括我们的竞争对手或潜在竞争对手)雇用的个人。我们可能会声称这些员工或我们无意中或以其他方式使用或披露了其前雇主的商业秘密或其他专有信息。可能需要提起诉讼来抵御这些索赔。此类索赔可能会给我们带来重大成本,或者无法保护或使用宝贵的知识产权,这可能会对我们的业务、财务状况、运营业绩和前景产生不利影响。
我们可能需要提起诉讼或采取其他行动来保护或执行我们的知识产权。
在我们没有专利保护的那些司法管辖区,我们可能会受到来自第三方的竞争,这些产品的产品类别与我们的候选药物相同,或者产品的有效药物成分与我们的候选药物相同。即使向我们或我们的许可方颁发了关于我们的候选药物或其使用方法的专利,这些专利也可能受到我们的竞争对手的挑战,他们可能会辩称此类专利无效或不可执行、缺乏实用性、缺乏充分的书面描述或实施,或者认为应限制或狭隘地解释已颁发专利的权利要求。如果竞争对手设计出在不侵犯我们专利的情况下制造或使用这些候选产品的方法,专利也不会保护我们的候选产品。联邦食品、药物和化妆品法案以及FDA的法规和政策创造了一个监管环境,鼓励公司挑战品牌药物专利或创造专利产品的非侵权版本,以促进非专利替代品的简短新药申请的批准。这些相同类型的激励措施鼓励竞争对手提交新药申请,这些申请依赖于不是为药物赞助商准备的或不是由药物赞助商准备的文献和临床数据,从而提供了另一种不那么繁琐的审批途径。
竞争对手可能会侵犯我们的专利或我们许可者的专利。为了对抗侵权或未经授权的使用,我们可能会被要求提出侵权索赔,这可能既昂贵又耗时。此外,我们可能没有足够的财务或其他资源来提出和追究此类侵权索赔,这些索赔通常会持续数年才能得出结论。某些国家,特别是某些发展中国家的法律体系不支持执行专利和其他知识产权保护,特别是与药品相关的专利和其他知识产权保护,这可能使我们难以阻止侵犯我们的专利或销售竞争产品侵犯我们的专有权。
此外,在侵权诉讼中,法院可以裁定我们的一项专利或我们许可人的一项专利无效或不可强制执行,或以我们或我们许可人的专利不涵盖所涉技术或其他理由为由拒绝阻止另一方使用相关技术。任何诉讼或辩护程序中的不利结果可能会使我们的一项或多项专利或我们许可人的专利面临被宣布无效、无法强制执行或被狭隘地解释的风险,并可能使我们或我们许可人的专利申请面临无法颁发的风险。此外,我们可能无法单独或与许可人一起防止盗用我们的专有权,特别是在那些法律可能不如美国或我们没有提交国家阶段专利申请的国家/地区那样充分保护这些权利的国家/地区。此外,由于知识产权诉讼需要大量的披露,在这类诉讼期间,我们的一些机密信息可能会因披露而被泄露。上述任何情况的发生都可能对我们的业务、财务状况、经营结果和前景产生不利影响。
我们可能无法保护商业敏感信息的机密性。
我们还依赖商业秘密来保护我们的技术,尤其是在我们认为专利保护不合适或不可获得的情况下。然而,商业秘密很难保护。我们的员工、顾问、承包商、外部科学合作者和其他顾问可能会无意或故意向竞争对手披露我们的机密信息,并且在未经授权披露机密信息的情况下,保密协议可能无法提供充分的补救措施。强制执行第三方非法获取并使用我们的商业秘密的指控是昂贵且耗时的,而且结果是不可预测的。此外,我们的竞争对手可以独立开发等效的知识、方法和诀窍。未能获得或维持商业秘密保护可能会对我们的竞争业务地位产生不利影响。
与我们普通股所有权相关的风险
我们普通股的所有权高度集中,因此您影响公司事务的能力可能会受到限制。
截至2024年12月12日,我们的高管和董事共同实益拥有我们普通股流通股的约14.9%,其中约6.6%由我们的董事长兼首席执行官Mitchell Steiner万.D.实益拥有,6.2%由我们的副董事长兼首席执行官Harry Fisch万.D.实益拥有。这些股东可能有能力对股东投票的结果施加重大影响,包括关于董事选举、我们修订和重新修订的公司章程的投票以及其他重大公司交易。此外,这种所有权集中可能会延迟、推迟或阻止控制权的变更,阻碍涉及我们的合并、合并、收购或其他业务合并,或者阻止潜在的收购者提出收购要约或以其他方式试图获得对我们业务的控制权,即使这样的交易将使其他股东受益。这类股东的利益可能并不总是与您的利益或其他股东的利益一致,他们的行动方式可能会促进他们的最大利益,而不一定是其他股东的利益。
我们已收到纳斯达克退市通知。
2024年8月29日,我们收到了纳斯达克证券市场有限责任公司(“纳斯达克”)的一封信函,通知我们,我们的普通股收盘买入价在过去30个连续交易日期间跌破每股1.00美元,因此我们未能遵守纳斯达克上市规则第5550(a)(2)条规定的持续上市标准。
根据纳斯达克上市规则第5810(C)(3)(A)条,我们有180个历日的期限,自通知之日起,或至2025年2月25日,重新遵守最低投标价要求。在此期间,我们的普通股将继续在纳斯达克资本市场交易。如果在2025年2月25日之前的任何时间,我们普通股的投标价格在至少连续10个交易日内收于每股1.00美元或以上(纳斯达克全权决定可以延长到超过连续10个交易日),纳斯达克将提供书面通知,表明我们已经达到了这一最低投标价格要求。如果我们在2025年2月25日之前没有重新获得合规,我们可能有资格获得额外的180天合规期,以证明我们遵守了投标价格要求。为了有资格获得额外的180天宽限期,我们将被要求满足公开持有的股票市值的继续上市要求和纳斯达克的所有其他初始上市标准,但投标价格要求除外,并将需要向纳斯达克提供书面通知,说明我们打算在第二个合规期内通过进行反向股票拆分来弥补不足之处(如有必要)。如果我们没有资格进入第二个合规期,或未能在第二个180天合规期内重新合规,则纳斯达克将通知我们其决定将我们的普通股退市。
如果纳斯达克因未能达到纳斯达克上市标准而将我们的普通股股票从其交易所的交易中退市,我们和我们的股东可能会面临重大的不利后果,包括:
| ● |
我们股票的市场报价有限; |
| ● |
我们股票的流动性减少; |
| ● |
确定我们的普通股是“细股”,这将要求交易我们普通股的经纪人遵守更严格的规则,并可能导致我们股票二级交易市场的交易活动水平下降; |
| ● |
有限的新闻和分析师报道;以及 |
| ● |
未来发行更多证券或获得更多融资的能力下降。 |
由于APP收购,我们在2020财年和2023财年产生了盈利费用,而未来因APP收购而产生的额外盈利费用可能会导致我们的经营业绩受到影响。
根据ASC 805的收购会计法, 业务合并,我们根据APP收购日期各自的公允价值将APP收购的总购买价分配至APP的净有形资产和无形资产,并将购买价超过该等公允价值的部分记录为善意。管理层对此类资产公允价值的估计基于他们认为合理但本质上不确定的假设。除其他因素外,除其他因素外,善意的减损可能会导致重大费用,从而导致我们的财务业绩受到负面影响。
重述我们之前的财务报表可能会影响股东和投资者对我们的信心或损害我们的声誉,并可能使我们面临额外的风险和不确定性,包括成本增加以及法律诉讼和监管调查、制裁或调查的可能性增加。
在我们于2023年8月10日提交了截至2023年6月30日的季度Form 10-Q(“原始Form 10-Q”)后,我们决定在之前发布的合并财务报表中以原始Form 10-Q重述某些财务信息和相关脚注披露。此外,在于2023年12月8日提交截至2023年9月30日止年度的原始10-K表格后,吾等决定以原始10-K表格在我们先前发布的合并财务报表中重述某些财务信息及相关脚注披露。由于重述,我们已经并可能继续招致与该等重述有关或与之相关的意外会计及法律费用。此外,此类重述可能会使我们面临许多额外的风险和不确定因素,包括美国证券交易委员会或其他监管机构提起法律程序和进行调查、制裁或调查的可能性增加,如果两次重述非常接近,可能会加剧这些影响。上述任何一项都可能对我们的声誉、我们财务报告的准确性和时机、或我们的业务、经营结果、流动性和财务状况产生不利影响,或导致股东、投资者、会员和客户对我们财务报告的准确性和完整性失去信心,或导致我们普通股的市场价格下跌。
截至2023年9月30日,我们之前发现了财务报告内部控制中的两个重大弱点,并确定这些弱点导致我们对财务报告和披露控制和程序的内部控制无效.尽管我们已经纠正了这些重大弱点,但我们未来可能会发现额外的重大弱点或其他缺陷,或者无法维持有效的内部控制系统,包括披露控制和程序,这可能会导致我们的财务报表出现重大错误陈述或导致我们未能履行我们的报告义务。
SEC规则将重大缺陷定义为财务报告内部控制的缺陷或控制缺陷的组合,因此有合理的可能性无法及时预防或发现注册人财务报表的重大错误陈述。我们必须每年提供管理层对财务报告内部控制的证明。我们还被要求每季度披露内部控制程序的重大变更,以及管理层在相关评估过程中发现的财务报告内部控制中的任何重大弱点。
管理层此前已发现截至2023年9月30日我们对财务报告的内部控制存在重大缺陷,涉及:(1)其对非经常性事件和交易应用技术会计指南的控制,特别是对交易或事件发生时已知或可知的信息的评估,和(2)其管理层审查对其与第三方服务提供商开展的活动相关的研究和开发费用估计的控制。管理层确定,此类重大缺陷导致公司对财务报告和披露控制和程序的内部控制截至2023年9月30日尚未生效。在截至2024年9月30日的季度内,我们成功完成了必要的测试,以得出这些重大弱点已得到纠正的结论。
有效的内部控制对于我们提供可靠的财务报表并防止或发现欺诈是必要的。尽管上述财务报告内部控制中的重大弱点已得到纠正,但未来发现的任何新的重大弱点或其他缺陷,或者我们的披露控制和程序中的任何缺陷,如果不及时纠正,可能会限制我们预防或检测账目或披露错误陈述的能力,从而导致我们的年度或中期财务报表出现重大错误陈述。我们无法保证我们所采取的补救措施将有效防止或避免我们内部控制中未来潜在的重大缺陷或重大弱点。
如果我们未来发现任何新的缺陷,我们财务报告的准确性和时间可能会受到不利影响,投资者可能会对我们财务报告的准确性和完整性失去信心,我们普通股的市场价格可能会下跌,我们可能会受到美国证券交易委员会或其他监管机构的制裁或调查,我们可能无法以可接受的条件或根本无法为我们的资本需求寻求外部融资。上述每一项都可能对我们的业务、经营业绩、财务状况以及我们普通股的市场价格和波动性产生不利影响。此外,我们已经并预计将继续花费大量资源,包括会计相关成本和大量管理监督,以评估、实施、维护、补救和提高我们对财务报告和一般控制环境的内部控制的有效性。
此外,由于上述重大弱点以及SEC提出或未来可能提出的其他事项,我们面临诉讼或其他纠纷的可能性,其中可能包括援引联邦和州证券法的索赔、合同索赔或因上述财务报告内部控制缺陷而产生的其他索赔,编制我们的财务报表和上述重述。任何此类诉讼或纠纷,无论是否成功,都可能对我们的业务、经营业绩、流动性和财务状况产生重大不利影响。
我们是一个 “小型上市公司” 并且将能够利用适用于小型报告公司的降低披露要求,这可能会降低我们的普通股对投资者的吸引力。
根据《证券交易法》的定义,我们是一家“较小的报告公司”,我们打算利用适用于不是“较小的报告公司”的其他上市公司的各种报告要求的某些豁免,包括在我们的定期报告和委托书中减少关于高管薪酬的披露义务。我们无法预测投资者是否会因为我们可能依赖这些豁免而发现我们的普通股吸引力下降。如果一些投资者因此发现我们的普通股吸引力下降,我们的普通股可能会有一个不那么活跃的交易市场,我们的股价可能会更加波动。我们可能会利用这些报告豁免,直到我们不再是一家“较小的报告公司”。我们仍将是一家“较小的报告公司”,直至(A)在我们最近完成的第二财季的最后一个营业日,非关联公司持有的已发行普通股的总市值为2.5亿美元或更多,并且我们截至最近完成的财年的年度净收入为1亿美元或更多,或(B)截至我们最近完成的第二财季的最后一个工作日,非关联公司持有的已发行普通股的总市值为70000美元或更多,无论年度收入如何。
我们的章程文件、威斯康星州法律和剩余特许权使用费协议中的条款可能会阻止或推迟我们公司控制权的变更。
我们遵守章程文件、威斯康星州法律以及与SWk Funding LLC达成的剩余特许权使用费协议中的多项条款,这些条款可能会阻止、推迟或阻止股东可能认为有利的合并或收购。这些规定包括以下内容:
| ● |
经修订和重述的公司章程赋予我们董事会发行优先股的权力,无需股东采取进一步行动; |
| ● |
威斯康星州法律规定,只有在股东一致同意的情况下,股东才能通过书面同意行事; |
| ● |
威斯康星州法律的规定要求像我们这样在1973年1月1日之前成立的公司,至少有三分之二的已发行股份的持有人投赞成票批准我们公司章程的修正案、提交我们股东投票的合并或出售我们几乎所有资产; |
| ● |
提名选举董事候选人和在股东大会上审议的股东提案的预先通知程序; |
| ● |
威斯康星州控制权股份收购法规和威斯康星州的“公平价格”和“业务合并”条款限制了收购人在某些情况下参与某些交易或行使所收购股份的全部投票权的能力;和 |
| ● |
我们与SWk Funding LLC达成的剩余特许权使用费协议要求在Veru控制权变更或出售我们的FC 2业务时强制预付款。 |
我们普通股的交易价格一直波动,我们普通股的投资者可能会遭受重大损失。
我们普通股的交易价格一直波动,并且可能会继续波动。我们普通股的交易价格可能会因多种因素而下降或波动,包括:
| ● |
未能达到市场对我们业绩的预期; |
| ● |
我们或我们的竞争对手就重大产品开发、收购或财务业绩发布公告的时间; |
| ● |
候选药物的临床试验出现不良结果或延迟; |
| ● |
适用于我们业务的法律或法规的变更; |
| ● |
可能出现的新产品的竞争; |
| ● |
我们财务状况或经营业绩的实际或预期波动; |
| ● |
大量销售我们的普通股; |
| ● |
证券分析师发布新的或更新的研究报告; |
| ● |
宣布或预期额外债务或股权融资; |
| ● |
关键人员的增加或离职; |
| ● |
一般股市状况; |
| ● |
卖空者的攻击或对我们普通股的大量空头兴趣;或 |
| ● |
其他经济或外部因素。 |
您可能无法以或高于购买价格出售您的股票。
市场上可能会出售大量股票,这可能会压低我们普通股的市场价格。
大量出售我们普通股,或预期可能发生此类出售,可能会显着降低我们普通股的市场价格。这些出售,或这些出售可能发生的可能性,也可能使我们更难在未来以我们认为合适的时间和价格出售股票证券。我们还登记了根据股权补偿计划可能发行的所有普通股股份的要约和出售,包括在行使股票期权时,我们根据与林肯公园的当前普通股购买协议可能发行的普通股股份,包括3,025,截至本报告日期,我们根据与林肯公园的当前普通股购买协议发行的000股普通股。这些股票发行后可以在公开市场自由出售。
此外,我们的高管或董事出售我们的普通股,即使是在根据我们的内幕出售政策的开放交易窗口内进行的,也可能会对我们普通股的交易价格产生不利影响。尽管我们预计此类销售相对较小的数量本身不会显着影响我们普通股的交易价格,但市场可能会对此类销售的公告做出负面反应,这反过来又可能影响我们普通股的交易价格。
由于我们预计在可预见的未来不会对普通股支付任何现金股息,因此资本增值(如果有的话)将是我们的股东’ 唯一的收益来源。
自2014年5月以来,我们没有宣布或支付普通股现金股息。我们目前打算保留所有未来收益(如果有的话),为我们业务的增长和发展提供资金。因此,我们普通股的资本增值(如果有的话)将成为我们股东在可预见的未来唯一收益来源。
不适用
风险管理和策略
我们制定并实施了网络安全风险管理计划,旨在从实质上保护我们关键系统和信息的机密性、完整性和可用性。我们的网络安全风险管理计划包括评估、识别和管理网络安全威胁风险的政策和流程以及网络安全事件响应计划。我们的网络安全风险管理计划集成到我们的整体风险管理系统和流程中,并共享适用于整个企业风险管理计划的通用方法、报告渠道和治理流程,适用于其他战略、运营、法律、合规和财务风险领域。
我们的网络安全政策和程序旨在确保在第三方服务提供商的协助下制定、实施和维护适当的网络安全措施和控制。这些政策和程序以及由此产生的保障措施是根据我们的风险评估设计和评估的。我们实施了访问控制、防火墙、入侵检测和预防系统、漏洞和补丁管理流程,并且我们还使用各种其他自动化工具和手动流程来保护我们的信息系统。我们维持业务连续性和灾难恢复计划,旨在加强我们的事件响应准备工作。我们还要求员工在受聘时并根据定期网络钓鱼测试接受安全意识培训。
截至本10-k表格年度报告之日,我们尚未发现已知网络安全威胁的风险,包括或由于任何之前的网络安全事件而造成的,这些威胁对我们产生重大影响或合理可能对我们产生重大影响,包括我们的运营、业务战略、运营结果或财务状况。
有关网络安全威胁对我们造成的风险的更多信息,请参阅第1A项中的“风险因素”。本报告的。
Governance
One of the key functions of our board of directors is risk oversight, including risks from cybersecurity threats. Our board of directors is responsible for monitoring and assessing strategic risk exposure, and our executive officers are responsible for the day-to-day management of the material risks we face. Our board of directors administers its cybersecurity risk oversight function directly and through the audit committee.
Our Chief Financial Officer is primarily responsible for assessing and managing our material risks from cybersecurity threats with assistance from a third-party service provider. Our Chief Financial Officer supervises efforts to prevent, detect, mitigate, and remediate cybersecurity risks and incidents through various means, which include quarterly briefings from our third-party service provider and alerts and reports produced by security tools deployed in the IT environment. Our Chief Financial Officer has over 10 years of experience in overseeing our cybersecurity and information technology programs. We also rely on our third-party service provider for advice and expertise on monitoring evolving industry standards and best practices.
Our Chief Financial Officer provides periodic briefings to the board of directors regarding the Company's cybersecurity risks and activities, including any recent cybersecurity incidents and related responses, cyber security systems testing, and activities of third parties.
该公司总部位于佛罗里达州迈阿密,办公空间约为12,000平方英尺。公司于2021年6月执行了该办公空间的租赁。该租约为期八年,自2022年3月1日开始,至2030年2月28日结束。
该公司在英国伦敦租赁了约6,400平方英尺的办公空间。该租约为期五年,将于2025年8月到期。
该公司在雪兰戈尔特区的一个租赁设施内生产和仓库FC 2,面积约为45,800平方英尺,马来西亚该工厂的年产能约为1亿台FC 2。该公司于2019年8月执行了该空间的租赁,为期三年,从2019年9月1日开始,到2022年8月31日结束。该公司有权选择将租赁期限延长三年,并已执行,使租赁有效期至2025年8月31日。该设施接受FDA的定期检查,以确保符合GMP以及英国总部位于公告机构,负责CE和ISO认证。
我们相信上述设施适合并足够满足我们当前的需求。
有关我们未决法律诉讼的描述,请参阅中的诉讼 注13,或有负债,适用于本报告中包含的财务报表,并通过引用并入本文。
不适用
第二部分
我们的普通股股票在纳斯达克资本市场交易,代码为“VERU”。2024年12月12日,我们普通股的记录保持者数量约为148人。
概述
我们是一家临床晚期生物制药公司,专注于开发治疗代谢性疾病、肿瘤学和病毒诱导的ARDS的新药。我们的药物开发计划包括两个晚期新化学实体,enobosarm和sabizulin。Enobosarm是一种选择性雄激素受体调节剂(“SARM”),正在通过两个不同的计划进行开发:(I)肥胖-enobosarm联合GLP-1RA以增加脂肪损失、防止肌肉损失和维持身体功能以实现更高质量的减肥;(Ii)乳腺癌-enobosarm加abemaclib用于二线治疗雄激素受体阳性(AR+)、雌激素受体阳性(ER+)和人类表皮生长因子受体2阴性(HER2-)转移性乳腺癌,条件是有足够的资金可用。沙比布林是一种微管干扰剂,正在开发中用于治疗由病毒引起的ARDS住院患者。我们不打算进一步开发用于治疗病毒引起的ARDS的萨比布林,除非我们从政府赠款、制药公司合作伙伴关系或其他类似的第三方外部来源获得资金。我们还有FDA批准的商业产品FC2女性避孕套®(内部避孕套),用于预防意外怀孕和性传播感染的双重保护。
肥胖计划
据报道,在评估目前批准的GLP-1 RA用于肥胖患者的第三方临床试验中,试验参与者显示出显著的体重减轻,包括脂肪和瘦(肌肉和骨骼)质量的减少。在某些第三方临床试验中报告的总体重下降中,患者报告的总体重下降的20%-50%可归因于瘦体重(肌肉)的下降。根据美国疾病控制与预防中心的数据,41.5%的老年人患有肥胖症,可以从减肥药中受益。在美国60岁以上的肥胖人群中,高达34.4%的人患有骨性肥胖症。骨肉源性肥胖患者是同时患有肥胖和低肌肉质量的患者,在服用目前批准的GLP-1RA时,他们可能面临发展为极度低肌肉质量的最大风险。因此,我们认为迫切需要一种药物,可以改善目前批准的GLP-1 RA疗法的肌肉萎缩效应,并允许有风险的骨脂性肥胖和超重的老年患者优先减少脂肪质量。虽然老年人患骨质疏松症和骨质疏松症的风险更高,但在与FDA的讨论中,Veru打算最终寻求在所有年龄段都能受益的最广泛人群中获得批准,而不是将适应症限制在60岁以上的患者身上,因为服用GLP-1受体激动剂的年轻肥胖症患者(包括有生育潜力的女性)可以受益于enobosarm的潜在肌肉保护作用。
Enobosarm是一种口服新型SARM,已证明身体成分具有组织选择性、剂量依赖性改善,增加瘦质量和减少脂肪质量,改善肌肉力量和身体功能,对女性没有临床相关的男性化作用,并且在之前的临床试验中对男性具有中性前列腺作用。
晚期癌症会导致食欲不振,精瘦体重和脂肪体重都会显著减少。Enobosarm已经在五个独立的第三方临床试验中进行了评估,在这些试验中,瘦质量测量是主要或共同的主要终点。这些第三方临床试验包括两项针对健康老年人或肌肉量减少受试者的2期临床试验(168名受试者)和1项针对因癌症导致肌肉萎缩的受试者(800名受试者)的20期亿临床试验和2项3期临床试验,总共产生了968名患者的瘦体重和安全性数据。在这些试验中的某些试验中,Enobosarm显示出剂量依赖性的身体成分改善,瘦质量增加,脂肪质量减少。例如,在评估60岁以上男性和绝经后女性治疗12周的第二阶段临床试验中,服用3 mg剂量的Enobosarm的患者(n=24)表现出统计上显著的(I)总瘦体重增加(平均增加1.25公斤(p=<0.001))和(Ii)总脂肪重量减少(平均减少0.32公斤(p=0.049))。
基于一个包含1,581名治疗持续时间长达3年的男性和女性的大型安全数据库,enobosarm在迄今为止完成的临床试验中总体耐受良好。然而,迄今为止,尚未完成评估enobosarm和GLP-1 RA组合的临床前研究或临床试验。根据田纳西大学研究基金会的委托,有关enobosarm的所有非临床和临床疗效和安全性数据,包括这五项第三方临床试验产生的数据,均归Veru所有。
我们相信,我们拥有的临床数据是在老年患者以及食欲不振引起的初始和持续肌肉萎缩的患者中进行的enobosarm第三方临床试验中产生的,为enobosarm和GLP-1 RA联合给药提供了强有力的临床依据减少肌萎缩性肥胖或超重老年患者的风险,因为该组合有可能改善目前批准的肌肉萎缩效应GLP-1 RA疗法还允许优先减少脂肪质量。
2024年1月,我们为20期亿临床研究提交了Enobosarm的研究性新药申请(IND)。2024年2月,该公司获得美国食品和药物管理局的批准,可以启动20期赛马路德(Wegoy®)的亿多中心、双盲、安慰剂对照、随机、剂量发现的高质量临床试验,旨在评估Enobosarm 3 mg、Enobosarm 6 mg或安慰剂作为一种增加脂肪损失和防止肌肉丢失的治疗方法的安全性和有效性。主要终点是总瘦身质量与基线的百分比变化,关键次要终点是16周时通过爬楼梯试验测量的总体脂肪质量、总体重和身体功能与基线的百分比变化。2024年4月,该公司宣布其首批患者已纳入20期亿质量临床研究,2024年8月,该公司在美国14个临床地点完成了168名受试者的登记,预计2025年1月试验的临床结果为背线临床结果。20期肥胖质量临床试验的目的是选择最佳剂量的enobosarm与赛马路德(wegoy®)联合治疗16周后最能保存肌肉和减少脂肪的亿,以进入肥胖症3期临床试验。
在完成20亿期QUALITY临床试验的疗效剂量探索部分后,预计参与者将继续进入200亿期扩展试验,所有患者将停止接受索马鲁肽(Wegovy®)治疗,但将继续服用安慰剂、3毫克埃诺波沙姆或6毫克埃诺波沙姆盲法12周。这项200亿期扩展临床试验将评估enobosarm是否可以维持肌肉并防止脂肪和体重的恢复,而脂肪和体重的恢复通常会发生在停止GLP-1 RA后。另一项盲法200亿期扩展临床研究的总体结果预计将于2025年第二季度公布。
Veru目前还在开发一种新型的、可获得专利的enobosarm改释制剂,可在24小时给药期内多次释放。 我们预计实际配方、药代动力学释放曲线和制造方法将成为未来专利的主题。 修改的目的是创建一致的释放曲线,其最大暴露量显着降低,并延长释放曲线,以最大限度地减少任何剂量相关不良事件,同时促进患者在整个24小时内在剂量之间充分暴露于制剂。 该配方目前正在进行动物试验,预计将于2025年上半年用于I期生物利用度临床试验。我们预计口服enobosarm缓释药物制剂将用于任何3期肥胖临床研究。
肿瘤学项目
我们的肿瘤学药物管道专注于enobosarm(一种口服选择性雄激素受体调节剂)的临床开发,用于治疗转移性乳腺癌。由于我们将临床项目的优先顺序集中在enobosarm治疗肥胖症上,因此enobosarm治疗转移性乳腺癌的持续临床开发取决于是否有足够的资金。我们于2023年10月完成了3期临床试验的1a阶段部分。然而,在获得足够的资金之前,我们不会开始10亿阶段部分或以其他方式推进我们的试验3期临床试验。
Enobosarm是一种治疗晚期乳腺癌的新型内分泌疗法。Enobosarm是一种口服新化学实体、选择性雄激素受体调节剂,旨在激活AR+ ER+ HER 2-转移性乳腺癌中的AR,从而抑制肿瘤生长,而不会产生不必要的雄性化副作用。Enobosarm拥有丰富的非临床和临床经验,已在27项独立临床研究中对1,581名接受治疗的受试者进行了评估,其中包括涉及超过191名患者的3项晚期乳腺癌II期临床试验。在一项针对AR+ ER+ HER 2转移性乳腺癌女性进行的II期临床试验中,enobosarm在经过大量预治疗的队列中表现出显着的抗肿瘤功效,这些队列使用雌激素阻断剂、化疗和/或CDk 4/6抑制剂失败,并且耐受性良好,安全性良好。
目前对ER+HER2转移性乳腺癌一线治疗的标准是联合使用CDK4/6抑制剂和雌激素阻滞剂。一旦患者在接受这种联合治疗时病情恶化,FDA批准的治疗选择仅限于另一种雌激素阻滞剂或化疗。由于高达95%的ER+HER2转移性乳腺癌有雄激素受体,我们正在开发Enobosarm作为另一种不同的激素疗法,用于ER+HER2转移性乳腺癌的二线治疗。在临床前研究中,从对CDK4/6抑制剂和雌激素阻滞剂产生抗药性的ER+HER2转移性乳腺癌患者身上采集的转移性乳腺癌组织样本在小鼠中培养。在这些小鼠中,依诺单抗与CDK4/6抑制剂联合治疗对人类转移性乳腺癌的生长抑制作用强于单独使用CDK4/6抑制剂。此外,单用Enobosarm治疗也能有效地抑制CDK4/6抑制剂和雌激素阻滞剂耐药的人转移性乳腺癌小鼠肿瘤的生长。
2023年3月30日和2023年11月3日,我们与FDA会面,讨论我们在AR+ ER+ HER 2转移性乳腺癌患者中进行的III期临床试验的设计,这些患者在接受Palbociclib(一种CDk 4/6抑制剂)加雌激素阻断剂(非甾体芳香化酶抑制剂或选择性雌激素受体降解剂)治疗期间肿瘤进展。在我们于2023年11月3日与FDA会面后,对3期临床试验的设计进行了修改,以实施FDA提供的建议。3期临床试验第1阶段部分的主要终点是客观肿瘤缓解率(“ORR”)。
我们于2022年4月开始招募患者。截至2023年8月,我们已经完成了3名患者的3期ENABBAR-2临床试验第1a阶段部分的目标入组,以评估abemaciclib和enobosarm组合的安全性和药代动力学。截至数据截止日期,三名患者中没有报告abemaciclib和enobosarm之间的药物间相互作用,也没有新的安全性结果。此外,早期初步临床结果显示,基于当地评估,前三名患者出现两种部分缓解和一种稳定疾病。
如果有足够的资金可用,我们预计将在2026年初重新启动我们的第三阶段ENABLAR-2临床试验的第10阶段亿。如果与雌激素阻滞剂(主动对照)相比,enobosarm+abemaciclib联合治疗在ORR方面有显著改善,这被认为是临床受益的替代终点,那么我们可能会与美国食品和药物管理局会面,考虑基于3期临床试验第10阶段亿部分的临床数据加快批准监管途径。加速批准研究产品是FDA的自由裁量权。因此,即使我们认为我们的候选产品之一符合这一批准途径的标准,FDA也可能不同意,而是决定不进行此类指定。此外,即使我们收到了指定,对候选产品的指定可能不会比根据FDA传统程序考虑批准的产品更快的开发或监管审查或批准过程,也不能确保FDA的最终批准。此外,即使我们的一个或多个候选产品有资格获得这些认证,FDA可能会在以后决定这些候选产品不再符合资格条件,或决定FDA审查或批准的时间段不会缩短。不能保证FDA将接受我们提议的试验设计,不能保证我们能够以经济高效的方式继续开发Enobosarm,也不能保证Enobosarm将获得FDA的批准或将其商业化。
传染病计划
我们正在开发萨比布林9 mg,它具有宿主靶向抗病毒和广泛的抗炎特性,作为一种双管齐下的方法,用于治疗具有ARDS和死亡高风险的病毒性肺部感染住院患者。我们已经完成了新冠肺炎阳性2期和阳性3期临床试验,这些试验已经证明,在住院的中重度新冠肺炎病毒性肺部感染患者中,萨比布林的治疗降低了死亡率,这些患者具有急性呼吸窘迫综合征和死亡的高风险。美国食品和药物管理局于2022年1月授予我们的新冠肺炎项目快车道称号。2022年5月10日,我们与美国食品和药物管理局举行了欧盟审批前会议,讨论下一步行动,包括提交新冠肺炎的萨比布林欧盟审批申请。2022年6月,我们提交了FDA紧急使用授权申请。2023年2月,FDA拒绝批准我们对萨比布林的紧急使用授权。2023年9月,我们收到了FDA的同意,同意设计一项3期临床试验,以评估萨比布林在任何病毒诱导的ARDS中的广泛应用。
然而,我们目前计划优先使用内部现金和未来任何融资的净收益用于开发enobosarm,近期的主要重点是资助20亿期临床试验,以评估enobosarm作为肥胖治疗的安全性和有效性,并通过政府拨款、制药公司合作伙伴关系寻求外部资金。或类似来源来推进萨比沙布林作为病毒诱导的急性呼吸窘迫综合征治疗方法的开发。如果没有此类外部资金,我们不计划推进萨比沙布林治疗病毒诱导的急性呼吸窘迫综合征的第三阶段开发。
无法保证我们能够通过政府拨款、制药公司合作伙伴关系或类似来源获得外部资金,无法保证我们能够以经济有效的方式继续开发萨比沙布林,或者萨比沙布林将获得FDA的批准或商业化。
性健康计划
我们的性健康计划由FC 2组成,这是唯一一款经FDA批准的、女性控制的、不含杀虫剂和不含乳胶的女性避孕套,用于双重保护,防止意外怀孕和性传播感染(包括艾滋病毒/艾滋病)。
我们在美国的处方渠道和公共卫生领域销售FC 2,在全球公共领域销售FC 2。
在美国处方渠道中,FC 2可通过多个远程医疗和远程药房渠道以及零售药房获得。尽管远程医疗行业最近出现了整合,但我们仍然相信,鉴于医疗保健行业的动态和我们的产品概况,远程医疗将成为美国获得包括FC 2在内的节育产品的重要商业策略。为了最大限度地扩大其影响范围并更直接地控制FC 2的推广、分销和销售,我们于2022年4月推出了自己的远程医疗门户网站。
我们预计,随着我们继续完善该门户的基础设施,美国处方渠道的收入将显示我们专用的FC 2远程医疗门户的增长。我们打算继续利用与美国公共卫生部门实体的关系,例如州卫生部门和501(c)(3)组织。
在美国以外的全球公共卫生领域,我们向致力于支持和改善世界各地女性生活、健康和福祉的实体(包括卫生部、政府卫生机构、联合国机构、非营利组织和商业合作伙伴)推销FC 2。我们目前正在为南非供应大型女性避孕套多年期招标,预计将持续到2025年,并且已通过巴西的新招标成功确保供应,我们于2024财年第四季度开始供应。
出售ENTADFI
2023年4月19日,本公司与美国食品药品监督管理局于2021年12月批准的治疗良性前列腺增生症的新药®(非那雄胺和他达拉非)胶囊签订资产购买协议(“资产购买协议”),出售与ENTADFI ONCO(非那雄胺和他达拉非)胶囊相关的几乎所有资产。这笔交易于2023年4月19日完成。交易的收购价为2,000万美元,其中包括成交时支付的600万美元,根据2023年9月30日到期的本票支付的400万美元,根据2024年4月19日到期的本票(“2024年4月本票”)应付的500万美元,以及根据2024年9月30日到期的本票(“2024年9月本票”和2024年4月的本票,即“ONCO本票”)支付的500万美元,以及根据ONCO在成交后的净收入计算的至多8000万(“里程碑付款”)。该公司认为收到任何里程碑式付款的可能性微乎其微。
2023年9月29日,该公司签订了资产购买协议修订案,规定2023年9月30日到期的400万美元购买价格分期付款的期票将被视为已支付并完全偿还(1)于9月29日以立即可用资金向公司支付100万美元,2023年和(2)在2023年10月3日之前向公司发行3,000股ONCO A系列可转换优先股(“ONCO优先股”)。该公司于2023年9月29日收到100万美元的付款,并于2023年10月3日收到ONCO优先股。公司持有的ONCO优先股股份于2024年9月24日转换为142,749股ONCO普通股。
于2024年4月24日,本公司与ONCO订立宽免协议,该协议于2024年9月19日修订及重述(经修订及重述,称为“宽免协议”),涉及ONCO本票项下的若干违约事项。根据忍耐协议,(A)ONCO同意不迟于2024年4月29日支付2024年4月29日本票项下应付本金的50,000美元,并于2024年4月25日付款;及(B)本公司同意,在忍耐协议所载条款和条件的规限下,因ONCO未能于2024年4月19日到期支付2024年4月本票项下到期款项,本公司同意不再行使其权利和补救办法。由于ONCO未能根据ONCO本票支付可能已到期或可能到期的与ONCO收购Proteomedex AG有关的某些交易的任何强制性偿还,在每种情况下,自2024年4月24日开始至(A)至2025年3月31日及(B)违约事件(定义见容忍协议)发生之日止的期间(“2024年4月宽限期”)。本公司还同意,在宽限期内,ONCO本票中关于ONCO资不抵债的违约条款将不适用。
ONCO在容忍协议中同意在2024年4月的宽限期内向Veru支付以下必需的付款(“必需的付款”),首先是2024年4月本票项下的应计和未付利息,然后是2024年4月本票未偿还本金余额的任何剩余部分:(1)ONCO或其子公司从某些销售或许可收入或付款中获得的相当于25%(从最初的2024年4月24日宽容协议中的15%增加)的每月付款,从2024年10月20日开始增加的金额用于2024年9月的现金收入;以及(2)支付ONCO或其任何附属公司在4月24日宽限期内完成的某些融资或其他交易所得款项净额的20%(较最初的2024年4月24日宽限期协议中的10%为高),这笔款项从2024年9月19日之后收到的任何净收益开始增加。2024年4月期票的剩余余额将在2024年4月宽限期结束时到期。本公司与ONCO于2024年11月26日订立豁免及第1号宽免及修正案,延长本段第(1)款所述ONCO每月支付现金收入的百分率的时间,并以ONCO能够筹集至少97,000元资本为条件支付该等款项,及(Y)将应付予本公司的若干融资所得款项净额的百分比由20%提高至25%。
ONCO和公司还同意在容忍协议中对2024年9月本票进行以下修订:(1)2024年9月本票的到期日延长至2025年6月30日;(2)2024年9月本票的任何未偿还本金余额从2024年10月1日开始至2024年9月本票未偿还本金余额全额支付之日按10%的年利率计息;(3)2024年9月本票的任何欠款,包括但不限于未付本金和应计利息,将以现金支付,或经ONCO和本公司双方书面同意,以ONCO普通股或现金和ONCO普通股的组合支付;(4)在全额偿还2024年4月本票的所有本金和利息后,ONCO将首先支付2024年9月本票的应计和未付利息,然后支付2024年9月本票应支付的剩余本金余额;以及(5)如果2024年4月本票和2024年9月本票项下的未偿还本金总额及其所有应计和未付利息在2024年12月31日或之前以现金偿还,则ONCO为履行2024年9月本票项下的义务而应支付的2024年9月本票项下的本金余额总额将从5,000,000美元减少到3,500,000美元。
合并运营
收入. 该公司的收入主要来自美国处方渠道和全球公共卫生领域的FC 2销售。根据合同条款,这些销售在向客户运送或交付产品时确认。
我们已经开发并继续完善自己的远程医疗门户,以增加美国处方渠道的收入。该公司正在探索额外的商业分销策略,并预计将继续从全球公共卫生部门机构获得收入,这些机构购买和分销用于艾滋病毒/艾滋病预防和计划生育的FC 2。该公司通过与客户的关系实现了美国和全球公共部门的收入增长,并将继续与这些客户合作以确定未来的增长机会。
Pill Club历来是我们FC 2最大的远程医疗客户,占我们2023财年净收入的24%(包括美国处方渠道收入的67%)。我们根据The Pill Club不时收到的采购订单以批发价将FC 2出售给The Pill Club。Pill Club获得了FC 2的所有权,然后担任FC 2的分销商。Pill Club全权负责其与医疗保健提供者和患者的互动(包括但不限于远程医疗医患互动的进行)、其分销的FC 2产品的定价以及法律和监管合规性。我们对药丸俱乐部的运营没有监督。
2023年2月7日,加州总检察长宣布与The Pill Club就The Pill Club涉嫌的多项不当行为达成和解,包括涉嫌对FC 2多付账单。尽管加州总检察长的新闻稿中做出了声明,但根据截至2023年1月18日执行的公开和解协议,加州对The Pill Club的指控不仅涉及与FC 2相关的账单,还涉及与紧急避孕药相关的账单、非同步远程医疗就诊的编码不当,以及对德克萨斯州药房向加州患者发送的处方进行计费,该药房当时没有获得向加州患者提供药房服务的许可。
虽然加州总检察长的指控包括The Pill Club有关The Pill Club销售FC 2的行为,但我们并未参与此类商业行为,加州总检察长也没有对Veru提出任何索赔。
我们还集中了The Pill Club的应收账款,截至2024年和2023年9月30日,应收账款总额为390万美元。2023年3月,由于The Pill Club是否或何时支付这些款项的不确定性,公司为这些应收账款的全部金额记录了信用损失拨备。Pill Club于2023年4月18日根据第11章申请破产,其资产已被出售以满足有担保债权人的要求。我们已向The Pill Club破产财产提出索赔,并就合同损害赔偿提出了140万美元的额外索赔。目前尚不确定有哪些资产可以满足Veru等无担保债权人的要求。截至2024年9月30日,公司对全额应收账款保持信用损失拨备。
由于The Pill Club最近根据第11章破产以及我们与The Pill Club的合同终止,我们未来将不会从The Pill Club获得任何收入。
2022年2月,该公司获得招标,将在三年内在南非共和国供应多达12000万个女性避孕套的57%(“2022年南非招标”)。该公司于2023财年第二季度开始根据2022年南非招标发货。
该公司在位于雪兰戈尔特区的租赁工厂中生产FC 2,马来西亚,导致公司部分运营成本以外币计价。虽然该公司未来单位销售的很大一部分可能会在国外市场,但所有销售都以美元计价。自2009年10月1日起,公司在英国和马来西亚子公司采用美元作为功能货币,进一步降低了公司的外币风险。
该公司依赖一家合成聚合物领域技术市场领导者的供应商供应FC 2的主要原材料。我们打算转向替代等级的丁氨,这将需要我们承担制定和测试替代等级并寻求FDA对替代等级的批准的成本。供应商表示,在我们转向标准化等级的丁胶时,它将协助提供供应的连续性。
运营费用. 该公司在其马来西亚工厂生产FC 2。公司的销售成本主要包括直接材料成本、直接劳动力成本以及间接生产和分销成本。直接材料成本包括用于生产FC 2的原材料,主要是丁质聚合物。间接生产成本包括物流、质量控制和维护费用,以及电力和其他公用事业费用。FC 2制造的所有关键组件基本上可以从多个来源或一个来源内的多个地点获得。
我们已经看到用于生产FC 2的丁胶聚合物的成本以及运输成本的增加,并且由于通货膨胀的影响,其他材料成本也可能增加。此外,该公司推出远程医疗门户的决定可能会导致与获取新FC 2用户相关的费用增加。因此,如果公司无法将这些增加转嫁给客户,可能会对公司的销售费用和运营收入产生不利影响。
进行研究和开发是我们药物开发计划的核心。该公司有几种正在开发和管理的产品,并定期评估其产品组合中的每一种产品。进展仅限于可用的营运资金和管理层对每种产品前景的了解。如果未来的前景不符合管理层的战略目标,晋升可能会中断。我们已经并预计将继续在我们的研发业务上投入大量的时间和资金。2024财年和2023财年,我们的研发支出分别为1280万美元和5120万美元。费用的减少是因为该公司更新了战略,将开发工作的重点重新放在它认为最有机会带来长期成功和创造股东价值的候选药物上,从而在2023财年终止了各种试验。我们预计未来将继续在研究和开发方面投入大量资源,以推进我们的候选药物。
经营成果
止年度 2024年9月30日 与年终相比 2023年9月30日
该公司2024财年净收入为1,690万美元,净亏损为3,780万美元,即每股基本和稀释普通股(0.28美元),而2023财年净收入为1,630万美元,净亏损为9,320万美元,即每股基本和稀释普通股(1.10美元)。净收入同比增长4%。
该公司几乎所有的净收入都来自FC2在美国处方药渠道和全球公共卫生部门的销售。在美国处方药渠道,该公司的客户主要包括远程医疗服务提供商。在全球公共卫生部门,该公司的客户主要是购买和分销用于艾滋病毒/艾滋病预防和计划生育计划的FC2的保健分销商、大型全球机构、非政府组织、卫生部和其他政府机构。该公司在2024财年和2023财年来自美国处方药渠道的净收入分别为240万美元和580万美元,在2024财年和2023财年来自全球公共卫生部门的净收入分别为1450万美元和1050万美元。销售组合发生了变化,本年度美国处方药渠道占FC2总净收入的14%,而上一年为36%;全球公共卫生部门占本年度FC2总净收入的86%,而上一年为。
美国处方渠道FC 2净收入下降是由于上一年向The Pill Club的销售额为390万美元,占上一年美国处方渠道净收入的67%。药丸俱乐部于2023年4月申请第11章破产。我们在2023财年记录了3.9亿美元的信用损失拨备,抵消了上一年The Pill Club的净收入。
全球公共卫生领域FC 2净收入的增长主要归因于订单的时机和发货。该公司业绩的显着差异历来是由于大额订单的时间和发货造成的,而不是业务的任何根本性变化或FC 2的潜在需求。该公司目前还面临着大型全球机构和向这些全球机构捐款的政府对FC 2定价的压力。因此,该公司在全球公共卫生领域的FC 2销售收入可能会继续面临挑战。
销售成本从2023财年的870万美元增加到2024财年的1100万美元,主要是由于销量增加以及与美国处方渠道库存相关的120万美元过时库存拨备增加,部分被产量增加导致的单位销售成本下降所抵消。
毛利润从2023财年的760万美元降至2024财年的590万美元。2024财年毛利率为净收入的35%,而2023财年毛利率为净收入的46%。毛利润和毛利率的下降主要是由于我们的销售结构发生变化,其中包括由于The Pill Club第11章破产而导致美国处方渠道的FC 2净收入下降,因为美国处方渠道的销售毛利率更高。
2024财年,研发支出从2023财年的5120万美元降至1280万美元。减少的原因是该公司更新了战略,将开发工作的重点重新放在它认为最有机会带来长期成功和创造股东价值的候选药物上。该公司在2024财年减少了研发活动,原因是公司准备为2024年4月启动的20期亿减肥临床研究提交Enobosarm的IND,这是由于其药物计划的开发暂停。该公司上一年发生了2,620万美元的费用,与新冠肺炎的萨比布林和公司相关的紧急使用授权申请有关。该公司还有其他正在进行的药物开发计划,如前列腺癌和乳腺癌,这些计划在2023财年暂停或取消,但在2023财年产生了巨额成本。该公司现在有一个正在进行的临床开发计划,并计划进行第二个临床计划。
2024财年的销售、一般和行政费用为3,120万美元,低于2023财年的4,810万美元。这一减少主要是由于在FDA对公司EUA申请做出撤销决定之前,上一年与可能推出用于COVID-19的萨比沙布林相关的准备相关的商业化成本为1,340万美元,以及上一年与ENTADFI相关的销售成本为1.2亿美元,该产品于2023年4月出售。
该公司在2023财年就因第11章破产而应收The Pill Club的应收账款总额为390万美元的信用损失拨备。2024财年没有记录信用损失拨备。
2023财年,该公司记录了与治疗前列腺癌的萨比扎布林和祖克洛米芬的在过程中研发(“IPR & D”)资产相关的390万美元的减损费用,这是由于该公司的战略决定,将其药物开发工作重新集中在那些它认为最有机会实现长期成功和股东价值创造的候选药物上。2024财年没有记录任何减损费用。
该公司在2024财年出售ENTADFI资产的收益为120万美元,而2023财年为570万美元。公司在收到不可退还对价时确认出售ENTADFI资产的收益。有关更多信息,请参阅本报告所包含的财务报表注释15。
与剩余特许权使用费协议负债增加相关的利息费用2024财年为60万美元,低于2023财年的240万美元。这一下降与预计FC 2销量的下降有关。
2024财年,与剩余特许权使用费协议相关的嵌入式衍生品公允价值变化相关的损失为20万美元,而2023财年的收益为300万美元。与嵌入式衍生品相关的负债指剩余特许权使用费协议中控制权变更条款的公允价值。嵌入式衍生工具公允价值增加是由于控制权变更的可能性增加和贴现率下降。有关更多信息,请参阅本报告财务报表注3和注9。
2024财年,与股权证券公允价值变化相关的损失为20万美元。这是由于2024财年从ONCO收到的股份的公允价值发生变化。有关更多信息,请参阅本报告所包含的财务报表注释3。
2024财年的所得税费用为70万美元,而2023财年的所得税费用为50万美元。所得税费用的变化主要是由于英国确认的收入增加,本年度记录的税收费用增加了20万美元。子公司美国继续对其递延税资产享有全额估值津贴;因此,美国的活动不会对所得税费用产生重大影响。
流动性和资本来源
流动性
截至2024年9月30日,我们的手头现金和现金等值物为2,490万美元,而2023年9月30日为960万美元。截至2024年9月30日,该公司的运营资金为2,340万美元,股东权益为3,230万美元,而截至2023年9月30日,该公司的运营资金为510万美元,股东权益为1,970万美元。流动资金增加主要是由于手头现金增加和应付账款减少。
该公司不盈利,运营现金流为负。我们将需要大量资金来支持我们的药物开发以及候选药物的任何相关商业化努力。根据公司当前的经营计划,预计截至本报告财务报表发布日其现金及现金等值物不足以满足公司在本报告财务报表发布日后十二个月内的运营、投资和融资现金流需求。为了获得为我们的运营提供资金所需的资本,我们希望通过公开或私募股权发行、债务融资交易和/或其他资本来源来满足我们的现金需求。在我们所需的时间和金额可能无法获得额外资本来及时资助我们的活动。
这些不确定性对我们在本报告包含的财务报表发布日期后十二个月内继续经营的能力产生了重大怀疑。我们运营计划中旨在缓解引发重大疑问的条件的某些要素,包括但不限于我们获得股权融资或其他融资替代方案的能力,超出了我们的控制范围,并且不能根据ASC 205-40的要求纳入管理层的评估,实体持续经营能力的不确定性披露。因此,我们得出的结论是,对我们在本报告所包含的财务报表发布日期后至少十二个月内继续经营的能力存在重大疑问。
经营活动
2024财年,我们的运营活动使用了2,170万美元的现金。经营活动中使用的现金包括净损失3,780万美元、净损失与经营活动中使用的净现金总额增加1,590万美元的调整以及经营资产和负债的变化(净金额不重大)。净亏损的调整主要包括1,360万美元的股份薪酬和160万美元的废弃库存拨备。经营资产和负债的变化包括应付账款减少540万美元,但被应计费用和其他负债增加390万美元以及库存减少100万美元部分抵消。
2023财年,我们的经营活动使用了8800万美元的现金。经营活动中使用的现金包括净损失9,320万美元、净损失与经营活动中使用的净现金的调节总计增加2,030万美元以及经营资产和负债的变化总计减少1,520万美元。净亏损的调整主要包括1,790万美元的股份薪酬、390万美元的信用损失拨备和390万美元的无形资产减损,部分被出售ENTADFI资产的收益570万美元所抵消。经营资产和负债变化产生的现金减少包括应计费用和其他流动负债减少1,170万美元,应付账款减少910万美元,应收账款增加420万美元,部分被预付费用和其他资产减少980万美元所抵消。
投资活动
2024财年,投资活动提供的净现金为10万美元,这归因于出售公司ENTADFI®资产收到的30万美元,部分被20万美元的财产和设备资本支出所抵消,主要是在我们马来西亚的地点。
2023财年,投资活动提供的净现金为630万美元,这归因于出售公司ENTADFI®资产收到的700万美元,部分被制造设备和租赁权改进的资本支出70万美元所抵消。
融资活动
2024财年融资活动提供的净现金为3,680万美元,主要包括公开发行股票出售收益(扣除佣金和成本)3,520万美元以及根据与林肯公园(见下文讨论)的普通股购买协议出售股票的收益170万美元。
2023财年融资活动提供的净现金为1,110万美元,主要包括根据普通股购买协议出售股份的收益480万美元、出售公开股权私募投资股份的收益500万美元以及根据杰富瑞销售协议出售股份的收益100万美元。
资本来源
SWk信贷协议和剩余版税协议
2018年3月5日,该公司与不时的金融机构(“贷款人”)和SWk Funding LLC(作为贷款人的代理人)就合成特许权使用费融资交易签订了信贷协议(经修订,“信贷协议”)。根据信贷协议条款,贷方向公司提供了1000万美元的定期贷款,该贷款于信贷协议之日预付给公司。公司于2021年8月偿还了信贷协议中规定的贷款和回报溢价,因此无需承担信贷协议项下的进一步义务。代理人已解除其先前为担保其在信贷协议下义务而承诺的公司抵押品的担保权益。
就信贷协议而言,Veru和代理人还于2018年3月5日签订了一份剩余特许权使用费协议(经修订,“剩余特许权使用费协议”),其中规定持续支付FC 2净销售产品收入的5%的特许权使用费,该费用在偿还信贷协议项下的贷款和返还溢价后继续。剩余特许权使用费协议将于(i)FC 2业务的控制权变更或出售以及公司根据剩余特许权使用费协议支付相关款项后终止,或(ii)双方共同同意。
截至2024年9月30日和2023年9月30日止年度,该公司根据剩余特许权使用费协议支付的付款总额分别为70万美元和60万美元。该公司目前估计,根据剩余特许权使用费协议,2024年9月30日之后的12个月期间应付的季度收入付款总额约为100万美元。
普通股发行
2023年12月18日,我们完成了52,708,332股普通股的承销公开发行,其中包括全面行使承销商购买额外股份的选择权,公开发行价格为每股0.72美元。扣除承保折扣以及公司支付的佣金和成本后,此次发行给公司带来的净收益约为3520万美元。此次发行中出售的所有股份均由该公司出售。此次发行是根据公司表格S-3中的货架登记声明(文件号333-270606)进行的。
Aspire资本购买协议
于二零二零年六月二十六日,本公司与Aspire Capital Fund,LLC(“Aspire Capital”)订立普通股购买协议(“Aspire购买协议”),该协议规定,在Aspire购买协议的36个月期限内,本公司有权不时全权酌情指示Aspire Capital购买合共最多2,390万美元的本公司普通股。于签署Aspire收购协议后,本公司根据Aspire收购协议向Aspire Capital发行及出售1,644,737股普通股,每股价格为3.04美元,总购买价为5,000,000美元。除作为订立Aspire收购协议的代价而向Aspire Capital发行的212,130股普通股及初步出售1,644,737股普通股外,本公司并无责任根据Aspire收购协议出售任何普通股,而任何有关出售的时间及金额由本公司全权酌情决定,须受Aspire收购协议所载条件及条款的规限。
截至2023年9月30日的一年内,在Aspire购买协议于2023年6月26日到期之前,我们根据Aspire购买协议向Aspire Capital出售了2,779,713股普通股,为公司带来340万美元的收益。在Aspire购买协议的36个月期限内,我们向Aspire Capital出售了4,424,450股普通股,为公司带来了840万美元的收益。2023年6月26日,Aspire购买协议的期限到期,不会根据该协议出售额外的普通股。
私募股权投资
2023年4月12日,公司签订股票购买协议与Frost Gamma Investments Trust(“FGI”)签订的《股票购买协议》(“股票购买协议”),根据该协议,公司于协议日期以每股1.00美元的价格向FGI发行并出售了5,000,000股公司普通股,总投资为5,000,000美元,通过私募股权融资投资。根据股票购买协议向FGI发行的普通股股份并未根据《证券法》登记,可以根据《证券法》第144条转售。
林肯公园资本基金有限责任公司购买协议
2023年5月2日,本公司与林肯公园资本基金有限责任公司(下称“林肯公园”)签订了普通股购买协议(经修订后的“林肯公园购买协议”),该协议规定,在林肯公园购买协议的36个月期限内,本公司有权但无义务向林肯公园出售不超过10000万的公司普通股(“购买股份”)。在本公司签署林肯公园购买协议之日,我们也向林肯公园发行了800,000股公司普通股,作为林肯公园根据林肯公园购买协议承诺购买本公司普通股的初始费用,当林肯公园购买的股票累计达到5,000万时,我们有义务发行100万的公司普通股(该等股票统称为“承诺股”)。于2023年12月13日,本公司与林肯公园订立修正案(“林肯公园修正案”),将须登记的普通股股份数额由10000万减至5,000万,直至本公司根据林肯公园购买协议售出至少5,000万的普通股为止。根据本公司有效的S-3表格货架登记声明(文件第333-270606号),以及于2023年5月3日提交给美国证券交易委员会的相关招股说明书补编,以及于2023年12月13日进一步补充以反映林肯公园修正案的相关招股说明书补充资料,登记了不超过5,000美元万的购买股份和林肯公园购买协议下的承诺股份。
截至2024年9月30日的一年内,我们根据林肯公园购买协议向林肯公园出售了1,800,000股普通股,为公司带来了170万美元的收益。自林肯公园购买协议生效至2024年9月30日以来,我们已根据林肯公园购买协议向林肯公园出售了3,025,000股普通股,为公司带来310万美元的收益。在2025年3月1日之前,我们将无法根据林肯公园购买协议出售任何证券。
与Jefferies LLC的公开市场销售协议
于2023年5月12日,本公司订立公开市场销售协议SM(“杰富瑞销售协议”)与杰富瑞有限责任公司(“杰富瑞”)作为销售代理,据此,吾等可不时透过杰富瑞发行及出售公司普通股,总价值高达7,500美元万(在任何时间不超过39,609,072股普通股或授权、未发行及可供购买的普通股数目中较小者)。2024年8月19日,公司向杰富瑞发出通知,要求终止于2024年9月3日生效的杰富瑞销售协议。根据杰富瑞销售协议的条款,本公司可不时透过杰富瑞或向杰富瑞发行及出售杰富瑞销售协议所载的普通股股份,总价值最高可达7,500元万。由于杰富瑞销售协议终止,本公司将不会根据杰富瑞销售协议发行或出售任何额外普通股。
截至2024年9月30日的一年内,我们根据杰富瑞销售协议出售了90,156股普通股,为公司带来净收益67,000美元。自Jefferies销售协议生效以来,截至Jefferies销售协议终止之日,我们出售了1,367,415股普通股,公司净收益为110万美元。
关键会计估计
公司按照美国普遍接受的会计原则编制财务报表。公司在编制财务报表时必须采用各种会计政策,并做出影响资产、负债、净收入和费用报告金额的估计和假设。公司持续评估其估计和假设。公司在可行的范围内基于历史经验以及其认为在当时情况下合理的各种其他假设进行估计。如果公司的假设被证明不准确,或者未来的结果与历史经验不一致,公司可能需要对其影响报告结果的政策进行调整。公司的重要会计政策在本报告财务报表附注1中披露。
公司最关键的会计估计包括:税收资产和负债的估值、公允价值的计量以及善意和无形资产的估值。该公司还有其他主观性较低的关键会计政策,因此,其应用较少受到对公司报告的经营业绩产生重大影响的变化的影响。以下是对公司最关键政策以及所涉及的估计和判断的讨论。
所得税
该公司为其外国子公司单独提交所得税申报表。ASC主题740要求就财务报表或纳税申报表中包含的事件的预期未来税务后果确认递延所得税资产和负债。根据该方法,递延所得税资产和负债是根据财务报表与资产和负债税基之间的差异,使用预期差异将逆转的年度生效的已颁布税率确定的。还为所得税目的结转提供递延所得税资产。此外,任何未来税收优惠的金额将通过估值津贴减少,但前提是此类优惠预计不会实现。
公司采用负债法核算所得税,要求就财务报告与资产和负债税基之间的税收影响暂时差异以及净营业亏损和税收抵免结转确认递延所得税资产或负债。
本公司每年或更频繁地完成对其递延所得税估值免税额的详细分析,如果其注意到信息表明有必要对其估计进行修订。在评估本公司实现其递延税项资产的能力时,管理层会按国家/地区考虑所有可用的正面和负面证据,包括过去的经营业绩和对未来应纳税收入的预测,以及第382条对因控制权变更而结转的净营业亏损的潜在限制。在确定未来的应税收入时,管理层做出假设,以预测美国联邦和州、英国。和马来西亚的营业收入,扭转暂时性的差异,以及实施任何可行和审慎的税务筹划战略。这些假设要求对每个税务管辖区未来应纳税收入的预测做出重大判断,并与用于管理公司业务的预测保持一致。应该指出的是,该公司在合并的基础上实现了2005年的重大亏损。从2006财年到2015财年,公司在合并的基础上产生了应纳税所得额。然而,该公司在2024财年和之前三个财年在美国的累计税前亏损。在有重大负面证据的情况下,例如最近几年的累计损失,很难得出不需要估值津贴的结论。管理层预计,在研发投资的推动下,美国未来将出现税前亏损,并根据他们的分析得出结论,截至2024年9月30日,与联邦和州净营业亏损结转相关的美国递延税资产应计入730万美元的额外估值准备金。此外,该公司的英国非美国运营公司的控股公司Female Health Company Limited继续拥有320万美元的全额估值津贴。运营中的英国。由于对未来10年的应税收入的预测,女性健康公司(英国)plc没有估值津贴。Veru Biophma UK Limited拥有40万美元的全额估值津贴。
尽管管理层使用了可用的最佳信息,但公司使用的估计有可能与实际结果存在重大差异。这些差异可能会对公司未来的经营业绩和财务状况产生重大影响。
我们的有效税率与法定税率不同,主要是由于海外业务的税收影响、州税以及NOL结转的估值备抵的增加。我们未来的有效税率可能会受到以下因素的不利影响:在法定税率较低的国家/地区,盈利低于预期;在法定税率较高的国家/地区,盈利高于预期;递延所得税资产或负债的估值变化;或者税法、法规和会计原则的变化。此外,我们可能会接受国税局和其他税务机关对我们的所得税申报表的审查。我们评估这些检查产生不利结果的可能性,以确定我们的所得税拨备是否充足。
公平值计量
截至2024年9月30日,公司按经常性公允价值计量的金融负债,包括嵌入式衍生品,代表剩余特许权使用费协议中控制权变更条款的公允价值。请参阅本报告财务报表附注9。
这些负债的公允价值是根据不可观察到的投入(第三级计量)估计的,这需要高度主观的判断和假设。本公司使用基于情景的方法估计剩余特许权使用费协议内嵌入衍生工具的公允价值,从而对不同的情景进行估值和概率加权。基于情景的估值模型纳入了交易细节,如工具的合同条款和假设,包括预计的FC2收入、预期的现金流出、控制权变更的可能性和估计日期、无风险利率和适用的信用风险。因此,使用不同的估计或假设将导致公允价值更高或更低,并在公司的财务报表中记录不同的金额。这些投入中任何一项的重大变化可能导致公允价值在未来报告日期大幅上升或下降,这可能对我们的运营结果产生重大影响。见本报告所列财务报表附注3。
截至2024年9月30日,嵌入式衍生品的公允价值为160万美元,而2023年9月30日为130万美元。该公司确认了30万美元的非营业费用,以调整这些工具的公允价值。嵌入式衍生工具公允价值增加主要是由于FC 2控制权变更的可能性增加。
商誉及无形资产
截至2024年9月30日和2023年9月30日,该公司有690万美元记录为善意。该公司在每个财年的第四季度每年评估其声誉的公允价值,或者在存在损害迹象时更频繁地评估其公允价值。如果报告单位的公允价值超过该报告单位的公允价值,则可能会发生善意的损失。报告单位的估计公允价值对预测和假设的变化高度敏感;因此,在某些情况下,这些假设的变化可能会导致损害。我们围绕我们的假设进行敏感性分析,以评估假设和测试结果的合理性。该公司的声誉分配给研发报告部门,该部门截至2024年9月30日的公允价值为负。
无形资产极易受到减值费用的影响,尤其是知识产权与发展。这些资产最初按公允价值计量,因此估值中使用的任何预期的降低都可能导致减值。导致减值的一些更常见的潜在风险包括竞争、比预期更早地失去排他性、定价压力、不利的监管变化或临床试验结果、延迟或未能获得监管批准、额外的开发成本、无法实现预期的协同效应、更高的运营成本、税法变化和其他宏观经济变化。评估与减值测试相关的无形资产公允价值的复杂性与初始估值相似。在2023财年,公司记录了390万美元的与知识产权和研发有关的减值费用。这一费用主要是由于公司做出战略决定,将药物开发工作的重点重新放在它认为最有机会带来长期成功和创造股东价值的候选药物上,这导致公司无限期停止开发用于前列腺癌和zuclomiphen的萨比布林。在计入减值费用后,公司于2024年、2024年和2023年9月的知识产权研发无形资产余额为零。
研发成本
研究和开发成本在发生时计入费用,包括工资和福利、进行临床试验的成本和合同服务。这些成本是公司研发费用的重要组成部分。本公司在确定各报告期的应计负债余额时作出重大判断和估计。由于实际成本已知,公司对其应计负债进行了调整。本公司的应计成本与实际发生的成本之间并无任何重大差异。这些估计的变化导致公司应计项目发生重大变化,可能会对公司的经营业绩产生重大影响。
近期会计公告
有关最近采用的会计公告和最近发布的尚未采用的会计公告的更多信息,请参阅本报告所包含的财务报表注释1。
通货膨胀和价格变化的影响
尽管该公司无法准确确定通货膨胀的确切影响,但该公司的产品、用品、工资和福利成本增加,以及一般和管理费用增加。该公司已在可能的情况下提高售价以抵消成本的增加。
该公司面临的市场风险仅限于原材料商品价格的波动,特别是用于制造FC2的丁腈聚合物,以及与该公司海外业务相关的外币汇率风险。本公司并无利用金融工具进行交易或对冲风险,亦不持有会令其面临重大市场风险的衍生金融工具。自2009年10月1日起,公司的英国子公司和马来西亚子公司均采用美元作为其功能货币。在整个公司范围内,一直使用美元作为功能货币,降低了公司的外币风险,稳定了公司的经营业绩。该公司的经销商面临汇率风险,因为他们的订单是以美元计价的,而且他们通常以当地货币向客户销售。如果汇率波动对分销商有实质性影响,它可能会要求公司提供定价优惠或其他财务便利。该公司目前对利率风险没有重大风险敞口。
对该项目的答复在本报告的单独部分中提交。有关此处提交的财务报表列表,请参阅“合并财务报表索引”。
没有。
控制和程序有效性的限制
在设计和评估我们的披露控制和程序时,管理层认识到,任何控制和程序,无论设计和操作如何良好,只能为实现预期的控制目标提供合理的保证。此外,披露控制和程序的设计必须反映这样一个事实,即存在资源限制,并且管理层在评估可能的控制和程序相对于其成本的好处时需要运用判断。
披露控制和程序的评估
在首席执行官和首席财务官的监督和参与下,我们的管理层评估了截至本年度报告所涵盖的时期结束时我们的披露控制和程序(定义见《交易法》第13 a-15(e)条)的设计和运作的有效性,表格10-k(“评估日期”)。根据该评估,我们的首席执行官兼首席财务官得出的结论是,截至评估日,我们的披露控制和程序有效,可确保我们根据《交易法》提交或提交的报告中要求披露的信息(i)记录、处理、总结和报告,在委员会规则和表格指定的时间内,并(ii)酌情积累并传达给我们的管理层,包括我们的首席执行官和首席财务官,以便及时就所需的披露做出决定。
财务报告内部控制的重大缺陷得到纠正
如先前在第二部分第9A项中所披露的。截至2023年9月30日的公司10-k表格年度报告中的“控制和程序”,经2024年4月1日向美国证券交易委员会提交的公司10-K/A表格年度报告第1号修正案修订,我们发现了财务报告内部控制中的缺陷,我们认为这些缺陷已达到重大缺陷的水平。重大缺陷是指财务报告内部控制的缺陷或缺陷组合,因此有合理的可能性无法及时预防或发现年度或中期财务报表的重大错误陈述。
对于非经常性事件和交易,具体到对交易或事件发生时已知或可知的信息的评估,我们对财务报告的内部控制并非旨在充分积累和评估当时已知或可知的所有信息,并将该信息应用于适用的会计指南。这导致我们重报了截至2023年6月30日的三个月和九个月的财务报表。
为了解决与非重复性事件和交易相关的重大缺陷,公司对流程进行了变更,包括加强对复杂和非重复性事件和交易的控制,以及针对公司在执行复杂和非重复性事件或交易时已知或可知的信息的评估制定额外审查程序,包括制定审查清单。在截至2024年9月30日的季度内,我们成功完成了必要的测试,以得出这一重大弱点已得到纠正的结论。
对于与第三方服务提供商开展的活动相关的研发费用的估计,我们的内部控制没有定义控制活动运作的精确度,因此控制没有适当设计来检测或防止计算中使用的输入中的重大错误。这导致我们重报了截至2023年9月30日和2022年9月30日的财务报表以及2023财年内每个季度的财务报表。
为了解决与公司对与第三方服务提供商开展的活动相关的研发费用估计相关的重大弱点,公司对流程进行了变更,包括通过定义控制活动运作的精确度来加强对输入审查的控制,以及额外的程序,包括获得对第三方完成工作的确认,或在无法获得确认的情况下执行替代程序。在截至2024年9月30日的季度内,我们成功完成了必要的测试,以得出这一重大弱点已得到纠正的结论。
财务报告内部控制的变化
除上述有关公司补救工作外,公司财务报告内部控制未发生变化(如交易法规则13 a-15(f)和15 d-15(f)中的定义)在本10-k表格年度报告涵盖期间对或合理可能对公司对财务报告的内部控制。
管理’财务报告内部控制报告
我们的管理层负责建立和维护对财务报告的充分内部控制,该术语的定义见《交易法》第13 a-15(f)条。根据《交易法》第13 a-15(c)条的要求,我们的管理层在首席执行官和首席财务官的参与下,对其截至上一财年末的财务报告内部控制的有效性进行了评估。该评估所依据的框架包含在特雷德韦委员会赞助组织委员会于2013年发布的题为“内部控制综合框架”的报告(“COSO报告”)中。
我们的财务报告内部控制系统旨在根据公认的会计原则,为财务报告的可靠性和为外部目的编制财务报表提供合理保证。由于其固有的局限性,财务报告的内部控制可能无法防止或发现错误陈述。此外,对未来时期有效性的任何评估的预测都可能面临这样的风险:控制可能因条件变化而变得不充分,或者对政策或程序的遵守程度可能会恶化。
根据评估,管理层得出的结论是,根据COSO 2013年发布的“内部控制-综合框架”中的标准,截至2024年9月30日,我们对财务报告保持了有效的内部控制。
独立注册会计师事务所报告
由于我们是非加速申报人,因此我们的独立注册会计师事务所无需对我们对财务报告的内部控制的有效性发表意见。
不 适用因
第三部分
有关本项目的信息通过参考“提案1:董事选举”、“执行官”、“违法第16(a)条报告”、“公司治理事项-董事提名,““公司治理事项-内幕交易政策”和“审计委员会事项-审计委员会财务专家”在公司2025年年度股东大会的委托声明中,该声明将于2025年1月28日或之前向SEC提交。有关公司商业道德准则的信息参考公司2025年年度股东大会代理声明中“公司治理事项-商业道德准则”项下的讨论纳入本文,该声明将于2025年1月28日或之前向SEC提交。
根据《交易法》第3(a)(58)(A)条,公司董事会审计委员会是“审计委员会”。审核委员会成员为Lucy Lu. D。(主席),迈克尔·L兰科维茨和洛伦·马克·卡佐维茨。
与此相关的信息参考公司2025年年度股东大会代理声明中“董事薪酬和福利”和“高管薪酬”标题下的讨论纳入本文,该声明将于2025年1月28日或之前向SEC提交。
项目12.某些受益所有人和管理层的证券所有权以及相关股东事宜
有关此项目的信息参考公司2025年年度股东大会代理声明中“证券所有权”和“股权补偿计划信息”标题下的讨论纳入本文,该声明将于2025年1月28日或之前向SEC提交。
有关此项目的信息参考公司2025年年度股东大会委托声明中“某些关系和相关交易”标题下的讨论纳入本文,该代理声明将于2025年1月28日或之前向SEC提交。有关董事独立性的信息参考公司2025年年度股东大会代理声明中“公司治理事项-董事独立性”项下的讨论纳入,该声明将于2025年1月28日或之前向SEC提交。
有关此项目的信息参考公司2025年年度股东大会委托声明中“审计委员会事项-独立注册会计师事务所的费用”标题下的讨论纳入本文,该声明将于2025年1月28日或之前向SEC提交。
第四部分
(a)以下文件作为本报告的一部分归档:
| 1. |
财务报表 |
| 本报告第8项包含以下公司合并财务报表: |
| 独立注册会计师事务所报告 |
| 截至2024年9月30日和2023年9月30日的合并资产负债表 |
| 截至2024年9月30日和2023年9月30日止年度合并经营报表 |
| 截至2024年9月30日和2023年9月30日止年度合并股东权益报表 |
| 截至2024年9月30日和2023年9月30日止年度合并现金流量表 |
| 合并财务报表附注 |
| 2. |
财务报表附表 |
SEC适用会计法规中规定的所有附表均不是相关指示所要求的、不适用的或所需信息显示在财务报表或其注释中,因此已被省略。
| 3. |
展览指数 |
| 31.2 |
|
| 32.1 |
|
| 97.1 | Veru Inc.追回政策(参考公司于2023年12月8日向SEC提交的10-k表格(文件编号1-13602)的附件97.1合并)。 |
| 101 |
公司截至2024年9月30日止年度的10-k表格年度报告中的以下材料,采用iDatabRL(在线可扩展商业报告语言)格式:(i)合并资产负债表,(ii)合并经营报表,(iii)合并股东权益报表,(iv)合并现金流量表,(v)合并财务报表注释。 |
| 104 |
封面交互式数据文件(格式为iDatabRL,包含在附件101中)。 |
| * |
管理合同或补偿计划或安排 |
| ** |
一起提交 |
| *** |
本证明并非出于修订后的1934年证券交易法第18条的目的而“提交”,也未通过引用并入根据修订后的1933年证券法或修订后的1934年证券交易法的任何提交中。 |
不适用。
根据1934年证券交易法第13或15(d)条的要求,登记人已正式促使以下签署人代表其签署本报告,并经正式授权。
| 日期:2024年12月16日 |
VERU Inc. |
|
| 作者: |
/s/米切尔S.施泰纳 |
|
| 米切尔·S施泰纳 董事长、首席执行官兼总裁 |
||
| 作者: |
/s/米歇尔·格雷科 |
|
| 米歇尔·格雷科 首席财务官兼首席行政官 |
||
以下签名的每个人特此任命Mitchell S。施泰纳和米歇尔·格雷科,以及他们中的每一个人,作为他或她的真实合法的事实律师和代理人,有权与对方一起或不与对方一起行事,并拥有完全的替代和重新替代权力,以任何和所有身份签署表格10-k的任何或所有修正案,并将其连同所有证据以及与之相关的其他文件一起归档,与证券交易委员会合作,授予上述事实律师和代理人充分的权力和授权,以尽可能充分地履行他或她可能或能够亲自履行的所有意图和目的,在该场所内和周围进行和执行所需的每一项行为和事情,特此批准并确认上述事实律师和代理人或其替代者根据本协议可能合法促成的所有事情。
根据1934年《证券交易法》的要求,本报告已由以下人员代表注册人以所示的身份和日期签署。
| 签名 |
标题 |
日期 |
| /s/米切尔S.施泰纳 |
董事会主席、首席执行官、总裁兼董事 |
2024年12月16日 |
| 米切尔·S施泰纳 |
(首席执行官) |
|
| /s/米歇尔·格雷科 |
首席财务官兼首席行政官 |
2024年12月16日 |
| 米歇尔·格雷科 |
(首席会计和财务官) |
|
| /s/马里奥·艾森伯格 |
主任 |
2024年12月16日 |
| 马里奥·艾森伯格 |
||
| /s/哈里·菲施 |
董事会副主席兼董事 |
2024年12月16日 |
| 哈里·菲施 |
||
| /s/ Grace S. Hyun |
主任 |
2024年12月16日 |
| 格蕾丝·S Hyun |
||
| /s/露西·卢 |
主任 |
2024年12月16日 |
| 卢露西 |
||
| /s/ Loren Mark Katzovitz |
主任 |
2024年12月16日 |
| 洛伦·马克·卡佐维茨 |
||
| /s/迈克尔·L.兰科维茨 |
主任 |
2024年12月16日 |
| Michael L.兰科维茨 |
Veru Inc.
合并财务报表索引
| 页码 | |
| 经审计的合并财务报表。 | |
| RSm US LLP,独立注册会计师事务所的报告。(PCAOb ID No. 49) | F-3 |
致Veru Inc.董事会和股东
对合并财务报表的几点看法
我们审计了Veru Inc.(统称为“公司”)截至2024年9月30日的综合资产负债表,以及截至该年度的相关综合经营报表、股东权益和现金流量,以及相关附注(统称为综合财务报表)。我们认为,综合财务报表在所有重要方面都公平地反映了本公司截至2024年9月30日的财务状况及其截至该年度的经营结果和现金流量,符合美国公认的会计原则。
解释性段落–持续经营的企业
随附的综合财务报表的编制假设公司将继续作为一家持续经营的企业。正如综合财务报表附注2所述,该公司没有盈利,运营现金流为负,将需要大量资本来支持其药物开发业务。这使人对该公司作为一家持续经营的公司继续经营的能力产生了极大的怀疑。附注2也说明了管理层在这些事项上的计划。合并财务报表不包括可能因这种不确定性的结果而产生的任何调整。
意见基础
这些合并财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的综合财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们是按照PCAOB的标准进行审计的。这些准则要求我们计划和执行审计,以获得关于合并财务报表是否没有重大错报的合理保证,无论是由于错误还是舞弊。本公司并无被要求对其财务报告的内部控制进行审计,我们也没有受聘进行审计。作为我们审计的一部分,我们被要求了解财务报告的内部控制,但不是为了对公司财务报告内部控制的有效性发表意见。因此,我们不表达这样的意见。
我们的审计包括执行评估合并财务报表重大错报风险的程序,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查关于合并财务报表中的金额和披露的证据。我们的审计还包括评价管理层使用的会计原则和作出的重大估计,以及评价合并财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
关键审计 事务
下文所述的关键审计事项是指向审计委员会传达或要求传达给审计委员会的当期综合财务报表审计所产生的事项:(1)涉及对综合财务报表具有重大意义的账目或披露;(2)涉及我们特别具有挑战性的、主观的或复杂的判断。关键审计事项的传达不会以任何方式改变我们对综合财务报表的整体意见,我们也不会通过传达以下关键审计事项,就关键审计事项或与其相关的账目或披露提供单独意见。
应计和预付的临床试验费用
对物质的描述
截至2024年9月30日,公司的应计研发成本总计120,448美元,计入合并资产负债表的应计费用和其他流动负债,截至2024年9月30日,公司的预付研发成本总计419,371美元。
如综合财务报表附注1所述,本公司记录由第三方服务供应商进行的研发活动的估计成本,包括进行临床前研究、临床试验及合约制造活动。这些费用是该公司临床试验费用的重要组成部分。本公司根据已完成工作的估计数等因素,并根据根据服务协议与其第三方服务提供商达成的协议,应计这些费用。实际提供的服务的状态和时间、登记的患者数量以及患者登记的比率可能与公司的估计不同,从而导致对未来期间的费用进行调整。
审计公司的应计和预付临床试验费用尤其具有挑战性,因为从代表公司提供服务的多个第三方服务提供商那里收到了大量信息。虽然公司对应计和预付临床试验费用的估计主要是基于从第三方服务提供商那里收到的与每个试验项目相关的信息,但公司可能需要对发生的额外成本进行估计。此外,由于临床试验持续时间较长以及从第三方服务提供商收到发票的时间安排,在发布财务报表时通常不知道实际发生的金额。
我们是如何在审计中解决这个问题的
我们的审计程序包括以下内容:
| ● | 了解公司在确定应计和预付研发成本的完整性和存在方面所使用的流程和内部控制。 |
| ● | 测试用于确定应计和预付研发成本的基础数据的完整性和准确性。我们与监督临床试验的公司第三方合同研究机构确认了应计计算中使用的基础数据。为了评估应计项目的完整性,我们还测试了收到的后续发票,以评估对应计项目的影响。 |
| ● | 检查与第三方签订的某些合同以及公司从第三方收到的相关信息,以测试对迄今发生的成本的正确记录。 |
| ● | 通过与公司研发人员,特别是项目监督人员的讨论,证实了研发活动的进展。 |
/s/
自2024年以来,我们一直担任公司的审计师。
2024年12月16日
致Veru Inc.的股东和董事会。
对财务报表的几点看法
我们审计了Veru Inc.(本公司)截至2023年9月30日的综合资产负债表、截至该年度的相关综合经营报表、股东权益和现金流量以及相关附注(统称为财务报表)。我们认为,这些财务报表在所有重要方面都公平地反映了该公司截至2023年9月30日的财务状况,以及截至该年度的经营结果和现金流量,符合美国公认的会计原则。
重述2023年财务报表
如2023年财务报表附注18所述,重报了2023年财务报表,以纠正一项错报。
对公司作为持续经营企业的持续经营能力有很大的怀疑
随附的2023年财务报表的编制假设公司将继续作为一家持续经营的企业。正如2023年财务报表附注2所述,该公司没有盈利,运营现金流为负,需要大量资本来支持其药物开发业务。这引发了人们对该公司作为一家持续经营企业的持续经营能力的极大怀疑。2023年财务报表附注2也说明了管理层在这些事项上的计划。2023年财务报表不包括这一不确定性结果可能导致的任何调整。
意见基础
这些财务报表由公司管理层负责。我们的责任是根据我们的审计对公司的财务报表发表意见。我们是一家在美国上市公司会计监督委员会(PCAOB)注册的公共会计师事务所,根据美国联邦证券法以及美国证券交易委员会和PCAOB的适用规则和法规,我们必须与公司保持独立。
我们是按照PCAOB的标准进行审计的。这些标准要求我们计划和执行审计,以获得关于财务报表是否没有重大错报的合理保证,无论是由于错误还是舞弊。我们的审计包括执行评估财务报表重大错报风险的程序,无论是由于错误还是欺诈,以及执行应对这些风险的程序。这些程序包括在测试的基础上审查与财务报表中的数额和披露有关的证据。我们的审计还包括评价管理层使用的会计原则和作出的重大估计,以及评价财务报表的整体列报。我们相信,我们的审计为我们的观点提供了合理的基础。
/S/RSM US LLP
我们从1996年到2024年担任公司的审计师。
伊利诺伊州芝加哥
2023年12月8日,除2023年财务报表附注18和19外,日期为2024年4月1日
合并资产负债表
截至 2024年9月30日和2023年9月30日
| 2024 | 2023 | |||||||
| 资产 | ||||||||
| 流动资产: | ||||||||
| 现金和现金等价物 | $ | $ | ||||||
| 应收账款,净额 | ||||||||
| 库存,净 | ||||||||
| 预付研发费用 | ||||||||
| 预付费用和其他流动资产 | ||||||||
| 流动资产总额 | ||||||||
| 设备及器材的 | ||||||||
| 经营租赁使用权资产 | ||||||||
| 递延所得税 | ||||||||
| 无形资产,净额 | ||||||||
| 商誉 | ||||||||
| 其他资产 | ||||||||
| 总资产 | $ | $ | ||||||
| 负债和股东权益 | ||||||||
| 流动负债: | ||||||||
| 应付账款 | $ | $ | ||||||
| 应计报酬 | ||||||||
| 应计费用和其他流动负债 | ||||||||
| 剩余特许权使用费协议,短期部分(注9) | ||||||||
| 经营租赁负债,短期部分 | ||||||||
| 流动负债总额 | ||||||||
| 剩余特许权使用费协议,长期部分(注9) | ||||||||
| 经营租赁负债,长期部分 | ||||||||
| 其他负债 | ||||||||
| 总负债 | ||||||||
| 承诺和或有事项(注13) | ||||||||
| 股东权益: | ||||||||
| 优先股, 分别于2024年9月30日和2023年9月30日发行和发行的股票 | ||||||||
| 普通股,面值美元 每股; 授权股份, 和 发行及 和 分别于2024年9月30日和2023年9月30日发行的股票 | ||||||||
| 追加实缴资本 | ||||||||
| 累计其他综合损失 | ( | ) | ( | ) | ||||
| 累计赤字 | ( | ) | ( | ) | ||||
| 国库股票, 股份,按成本计算 | ( | ) | ( | ) | ||||
| 股东权益总额 | ||||||||
| 负债和股东权益总额 | $ | $ | ||||||
请参阅合并财务报表附注。
综合经营报表
止年度 2024年9月30日和2023年9月30日
| 2024 | 2023 | |||||||
| 净收入 | $ | $ | ||||||
| 销售成本 | ||||||||
| 毛利 | ||||||||
| 运营费用: | ||||||||
| 研发 | ||||||||
| 销售,一般和行政 | ||||||||
| 信用损失拨备(收回) | ||||||||
| 无形资产减值 | ||||||||
| 总运营支出 | ||||||||
| 出售ENTADFI®资产的收益 | ||||||||
| 经营亏损 | ( | ) | ( | ) | ||||
| 营业外收入(费用): | ||||||||
| 利息开支 | ( | ) | ( | ) | ||||
| 衍生负债公允价值变化 | ( | ) | ||||||
| 股权证券公允价值变化 | ( | ) | ||||||
| 其他净收入 | ||||||||
| 营业外收入(费用)总额 | ( | ) | ||||||
| 所得税前损失 | ( | ) | ( | ) | ||||
| 所得税开支 | ||||||||
| 净亏损 | $ | ( | ) | $ | ( | ) | ||
| 每股基本和稀释已发行普通股净亏损 | $ | ( | ) | $ | ( | ) | ||
| 基本和稀释加权平均已发行普通股 | ||||||||
请参阅合并财务报表附注。
股东权益合并报表
止年度 2024年9月30日和2023年9月30日
| 累计 | ||||||||||||||||||||||||||||
| 其他内容 | 其他 | 财政部 | ||||||||||||||||||||||||||
| 普通股 | 实收 | 全面 | 累计 | 股票, | ||||||||||||||||||||||||
| 股份 | 量 | 资本 | 损失 | 赤字 | 按成本 | 总 | ||||||||||||||||||||||
| 2022年9月30日余额 | $ | $ | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ||||||||||||||||
| 基于股份的薪酬 | — | |||||||||||||||||||||||||||
| 根据股份奖励发行股份 | ||||||||||||||||||||||||||||
| 与普通股购买协议相关发行的股份 | ||||||||||||||||||||||||||||
| 根据普通股购买协议出售股份 | ||||||||||||||||||||||||||||
| 根据杰富瑞销售协议发行股份,扣除佣金和成本 | ||||||||||||||||||||||||||||
| 递延成本摊销 | ( | ) | ( | ) | ||||||||||||||||||||||||
| 以私募股权投资方式发行股票,扣除成本 | ||||||||||||||||||||||||||||
| 净亏损 | — | ( | ) | ( | ) | |||||||||||||||||||||||
| 2023年9月30日余额 | ( | ) | ( | ) | ( | ) | ||||||||||||||||||||||
| 基于股份的薪酬 | — | |||||||||||||||||||||||||||
| 根据股份奖励发行股份 | ||||||||||||||||||||||||||||
| 根据普通股购买协议出售股份 | ||||||||||||||||||||||||||||
| 根据杰富瑞销售协议发行股份,扣除佣金和成本 | ||||||||||||||||||||||||||||
| 递延成本摊销 | — | ( | ) | ( | ) | |||||||||||||||||||||||
| 与公开发行普通股相关发行的股份,扣除费用和成本 | ||||||||||||||||||||||||||||
| 净亏损 | — | ( | ) | ( | ) | |||||||||||||||||||||||
| 2024年9月30日余额 | $ | $ | $ | ( | ) | $ | ( | ) | $ | ( | ) | $ | ||||||||||||||||
请参阅合并财务报表附注。
综合现金流量表
止年度 2024年9月30日和2023年9月30日
| 2024 | 2023 | |||||||
| 经营活动 | ||||||||
| 净亏损 | $ | ( | ) | $ | ( | ) | ||
| 将净亏损与经营活动中使用的净现金进行调节的调整: | ||||||||
| 折旧及摊销 | ||||||||
| 无形资产减值 | ||||||||
| 信贷损失准备金 | ||||||||
| 出售ENTADFI®资产的收益 | ( | ) | ( | ) | ||||
| 使用权资产的非现金变化 | ||||||||
| 非现金利息费用,扣除已付利息 | ( | ) | ||||||
| 基于股份的薪酬 | ||||||||
| 递延所得税 | ||||||||
| 过时库存拨备 | ||||||||
| 衍生负债公允价值变化 | ( | ) | ||||||
| 股权证券公允价值变化 | ||||||||
| 出售固定资产亏损 | ||||||||
| 经营资产和负债变化: | ||||||||
| 应收账款减少(增加) | ( | ) | ||||||
| 库存减少 | ||||||||
| 预付费用和其他资产减少 | ||||||||
| 应付账款减少 | ( | ) | ( | ) | ||||
| 应计费用和其他负债增加(减少) | ( | ) | ||||||
| 经营租赁负债减少 | ( | ) | ( | ) | ||||
| 经营活动所用现金净额 | ( | ) | ( | ) | ||||
| 投资活动 | ||||||||
| 出售ENTADFI®资产的现金收益 | ||||||||
| 资本支出 | ( | ) | ( | ) | ||||
| 投资活动提供的现金净额 | ||||||||
| 融资活动 | ||||||||
| 股票期权行使的收益 | ||||||||
| 公开发行股票出售收益,扣除佣金和成本 | ||||||||
| 根据杰富瑞销售协议出售股份的收益,扣除佣金和成本 | ||||||||
| 根据普通股购买协议出售股份的收益 | ||||||||
| 支付延期股权融资发行费用 | ( | ) | ||||||
| 出售私募股权投资股份的收益,扣除成本 | ||||||||
| 溢价融资协议收益 | ||||||||
| 保费融资协议的分期付款 | ( | ) | ( | ) | ||||
| 融资活动提供的现金净额 | ||||||||
| 现金及现金等值物净增加(减少) | ( | ) | ||||||
| 年初现金和现金等值 | ||||||||
| 年终现金和现金等值 | $ | $ | ||||||
| 现金流量信息补充披露: | ||||||||
| 缴纳所得税的现金 | $ | $ | ||||||
| 支付利息的现金 | $ | $ | ||||||
| 非现金投资和融资活动一览表: | ||||||||
| 出售ENTADFI®资产而收到的股权证券 | $ | $ | ||||||
| 与普通股购买协议相关发行的股份 | $ | $ | ||||||
| 与普通股购买协议相关的递延成本摊销 | $ | $ | ||||||
| 使用权资产以换取租赁负债 | $ | $ | ||||||
请参阅合并财务报表附注。
合并财务报表附注
注意事项1 – 业务性质和重要会计政策
合并原则和业务性质:Veru Inc.在这些笔记中与其子公司统称为“我们”、“Veru”或“公司”。合并财务报表包括Veru及其全资子公司Veru International Holdco Inc.、Aspen Park PharmPharmticals,Inc.(APP)和Female Health Company Limited;Female Health Company Limited的全资子公司Female Health Company(UK)plc(Female Health Company(UK)plc)(Female Health Company Limited和Female Health Company(UK)plc,统称为“UK.);女性健康(英国)有限公司的全资子公司女性健康公司(M)SDN.BHD(“马来西亚子公司”);以及Veru International Holdco Inc.‘S的全资子公司Veru Biophma UK Limited、Veru Biophma Europe Limited和Veru Biophma Holdma Holdco B.V.。该公司是一家临床晚期生物制药公司,专注于开发治疗代谢性疾病、肿瘤学和ARDS的新药。我们的药物开发计划包括Enobosarm,一种口服选择性雄激素受体调节剂,用于增加脂肪损失和防止瘦体重下降,与GLP-1RA,和晚期乳腺癌的管理,以及用于治疗病毒引起的ARDS住院患者的微管干扰剂萨比布林。该公司还拥有FC2女性避孕套/FC2内置避孕套®(FC2),一种FDA批准的商业产品,用于预防意外怀孕和性传播感染的双重保护。该公司拥有ENTADFI®(非那雄胺和他达拉非)口服胶囊(ENTADFI),这是一种治疗良性前列腺增生症的新药物,于#年获得美国食品和药物管理局批准2021年12月。我们出售了几乎所有与ENTADFI相关的资产2023年4月19日。请参阅备注15了解更多信息。公司在本财年的大部分净收入2024和2023是来自于销售FC2。
FC2 已分布在商业(私营部门)和公共卫生部门市场或两者中
重新分类:随附综合财务报表中的某些前期金额已重新分类,以符合本期列报方式。重新分类已经 没有 对所列任何期间的经营业绩或财务状况的影响。
使用估计:按照美国普遍接受的会计原则(美国公认会计原则)编制财务报表要求管理层做出影响资产和负债报告金额、财务报表日期或有资产和负债的披露以及报告期内收入和费用的报告金额的估计和假设。实际结果可能与这些估计不同。
细分市场:我们定期审查我们的运营部门以及管理层评估绩效和分配资源所使用的方法。该公司作为单一经营部门运营。我们将我们作为单一部门运营的确定与首席运营决策者(CODM)定期审查的财务信息一致,该财务信息旨在评估绩效、分配资源、设定激励薪酬目标以及规划和预测未来时期。我们的CODx在综合基础上分配资源并评估财务表现。
现金和现金等值物和集中度:现金及现金等值物主要包括金融机构存款现金和高流动性货币市场基金,按成本(接近公允价值)计入合并资产负债表。该公司处理短期、高流动性资金,这些资金可以随时转换为已知金额的现金,并且原始到期日为 三 月或更短的时间作为现金等值物。公司的现金主要存放在 三 金融机构,位于伊利诺伊州芝加哥;英国伦敦;和马来西亚吉隆坡。
股权证券投资:股权证券投资包括
应收账款和信用风险集中:应收账款按原始发票金额减去根据定期审查所有未偿金额而做出的退货、折扣和信用损失估计值计算。
库存:库存按成本或可变现净值中较低者估值。成本使用 第一- 在, 第一-out(FIFA)方法。库存也被减记以供管理层对产品的估计,这将 不 在到期日之前出售。库存减记建立了新的成本基础,即 不 因库存可变现净值未来增加或估计报废的变化而增加。
当认为未来可能商业化并且预计将实现未来经济利益时,该公司在监管机构批准后将与其药品相关的库存成本资本化。在监管机构对我们正在临床开发的药品进行初步批准之前,我们在发生期间将与库存生产相关的成本作为公司综合运营报表中的研发费用。
固定资产:我们按历史成本记录设备、家具和固定装置以及租赁权改进。维护和维修的支出计入费用。折旧和摊销主要使用直线法在资产的估计使用寿命内计算。租赁改善按剩余租赁期或资产估计使用寿命中较短者按直线法折旧。
租赁:租赁在开始时被归类为经营性租赁或融资租赁。使用权(ROU)资产及相应的租赁负债按起始日期租赁期内固定租赁付款的现值确定。ROU资产包括在生效日期或之前发生的任何初始直接成本和支付的租赁付款,并在租赁奖励付款中减去。公司已经选择了不将所有类别标的资产的租赁和非租赁组成部分分开。公司使用其递增借款利率作为贴现率,以确定租赁付款的现值不具有易于确定的隐含贴现率。递增借款利率是指在类似经济环境下,在类似期限和金额下,本公司将被收取以抵押为基础借款的利率。本公司以与本公司信用评级相对应的信用风险溢价调整无风险利率,以确定其租赁的递增借款利率。
经营租赁成本在租赁期内以直线法确认固定租赁付款。融资租赁成本是使用适用贴现率计算的ROU资产摊销费用和未偿还租赁负债利息费用的组合。可变租赁付款在发生时根据发生或使用情况确认。初始期限为 12 月或以内 不 记录在资产负债表上;我们在租赁期内以直线法确认短期租赁的租赁费用。
专利和商标:专利和商标的成本在发生时计入费用。
商誉及无形资产:公司的商誉和无形资产,主要是开发的技术和正在进行的研发(IPR&D),来自于于2016年10月31日。商誉和无限期无形资产是不摊销。知识产权研发在基础项目停止之前一直作为无限期无形资产入账,在这一点上无形资产被注销。商誉和无限期存续资产每年都要进行减值审查,第四在每个财政年度的每个季度,更频繁的是在存在减值指标时。如果报告单位的账面价值超过该报告单位的公允价值,则可能发生商誉减值。如果无形资产的公允价值低于账面价值,将发生无限期无形资产的减值。当事件或环境变化表明具有有限寿命的无形资产的账面价值时,对此类资产进行减值测试可能不是可以追回的。这些无形资产是按成本减去累计摊销列账的。
商誉包括被收购企业的成本超过被收购净资产的公允价值。公司的商誉被分配给预计将从业务合并的协同效应中受益的报告单位。该公司已确定ITS内的报告单位运营部门。公司通过以下方式测试商誉和无限期无形资产的减值第一评估定性因素,以确定是否更有可能不公允价值低于其账面价值。如果公司得出结论,它更有可能是不如果公允价值小于其账面价值,则进行量化减值测试。在进行量化减值测试时,公司采用估计未来现金流量法,需要对未来数量、收入和费用增长率、营运资本使用的变化、适当折现率的选择、资产分组以及其他假设和估计作出重大判断。所使用的估计和假设与公司的业务计划和一位市场参与者的观点一致。使用替代估计和假设可能会增加或减少资产的估计公允价值,并可能对公司的经营业绩造成不同的影响。实际效果可能与公司的估计不同。报告单位的公允价值与其账面价值进行比较,并将就账面价值超过报告单位公允价值的金额确认减值费用。
关于善意,报告单位的估计公允价值对预测和假设的变化高度敏感;因此,在某些情况下,这些假设的变化可能会导致损害。我们围绕我们的假设进行敏感性分析,以评估假设和测试结果的合理性。未来基本假设条件发生变化 可能影响报告单位的估计公允价值并导致报告单位的公允价值低于其公允价值。我们相信我们的估计与市场参与者在估计公允价值时使用的假设一致;但是,如果实际结果是 不 与我们的估计和假设一致,我们 可能面临可能重大的减损费用。
无形资产极易受到减值费用的影响,尤其是知识产权与发展。这些资产最初按公允价值计量,因此估值中使用的任何预期的降低都可能导致减值。导致减值的一些更常见的潜在风险包括竞争、比预期更早地失去排他性、定价压力、不利的监管变化或临床试验结果、延迟或未能获得监管批准、额外的开发成本、无法实现预期的协同效应、更高的运营成本、税法变化和其他宏观经济变化。评估与减值测试相关的无形资产公允价值的复杂性与初始估值相似。在财政期间2023,公司记录的减值费用为#美元。
递延融资成本:与注中讨论的普通股购买协议和市场销售协议相关的费用 10 已计入随附合并资产负债表的其他资产 2024年9月30日和 2023.当公司普通股根据普通股购买协议或市场销售协议出售时,递延成本的按比例部分计入额外实缴资本。
公平值计量:财务会计准则委员会(FASB)会计准则法典化(ASC)主题 820 – 公允价值计量和披露, 将公允价值定义为在计量日市场参与者之间的有序交易中出售资产所收到的价格或转让负债所支付的价格。FASb ASC主题 820 要求披露所有金融工具的公允价值,无论是 不 为财务报表目的确认。有关金融工具公允价值的披露基于截至报告日期我们可用的相关信息。因此,随附综合财务报表中呈列的估计为 不 必然指示处置金融工具时可以实现的金额。见附注 3 讨论公允价值计量。
根据这些工具的短期性质,随附综合资产负债表中报告的现金、应收账款、应付账款和其他应计负债的公允价值接近其公允价值。考虑到相关衍生工具,剩余特许权使用费协议负债的公允价值估计接近公允价值。
衍生工具:公司确实如此 不 使用衍生工具对冲现金流、市场或外币风险。公司审查其签订的债务工具的条款,以确定是否存在嵌入式衍生工具,这些工具需要分开并单独作为衍生金融工具核算。的嵌入式衍生工具 不 与主合同明确且密切相关的资产被分成两部分,并按公允价值确认,公允价值的变化被确认为收益的收益或损失。与嵌入式衍生品相关的负债在注释中讨论 9.
收入确认:当承诺商品的控制权转移给客户时,确认收入的金额反映了公司预计有权换取这些产品的对价。见附注 4 以进一步讨论收入问题。
研发成本:研究和开发成本在发生时计入费用,包括工资和福利、进行临床试验的成本以及合同服务。为用于研发活动的商品或服务支付的不可退还预付款被推迟并资本化,直至商品交付或相关服务已履行。如果货物 没有 预计交付时间更长或服务 没有 预计执行时间较长,公司将被要求支付相关资本化预付款。本公司 不 截至日期,有任何重大资本化的不可退还预付款 2024年9月30日或2023.
该公司记录了由以下公司进行的研究和开发活动的估计成本第三-缔约方服务提供商,包括进行临床前研究和临床试验以及合同制造活动。这些成本是公司研发费用的重要组成部分。公司根据已完成工作的估计等因素,并根据与其建立的协议,对这些费用进行应计第三-服务协议项下的第三方服务提供者。本公司在确定各报告期的应计负债余额时作出重大判断和估计。由于实际成本已知,公司对其应计负债进行了调整。该公司拥有不在应计成本和实际发生的成本之间有任何实质性差异。然而,实际提供的服务的状态和时间、登记的患者数量以及患者登记的比率可能与公司的估计不同,导致对未来期间的费用进行调整。这些估计的变化导致公司应计项目发生重大变化,可能会对公司的经营业绩产生重大影响。
基于股份的薪酬:公司根据授予日期奖励的估计公允价值,在归属期内以直线法确认与其股份奖励相关的股份报酬费用。计算股份薪酬费用需要输入高度主观的判断和假设,包括对股份奖励的预期寿命、股价波动性和无风险利率的估计。
广告:该公司的政策是在发生时承担广告费用。广告费用为美元
所得税:该公司为其外国子公司单独提交所得税申报表。FASb ASC主题 740 要求就财务报表或纳税申报表中包含的事件的预期未来税务后果确认递延所得税资产和负债。根据该方法,递延所得税资产和负债是根据财务报表与资产和负债税基之间的差异,使用预期差异将逆转的年度生效的已颁布税率确定的。还为所得税目的结转提供递延所得税资产。此外,任何未来税收优惠的金额都会通过估值津贴减少,以此类优惠的范围内 不 有望实现。
外币兑换和操作:有效 十月 1, 2009, 公司确定事实和情况发生重大变化,引发对其子公司功能货币的评估,导致所有外国子公司采用美元作为功能货币。公司一致使用美元作为功能货币,降低了外币风险并稳定了经营业绩。计入累计其他综合损失的累计外币换算损失为美元
其他综合损失:会计原则一般要求将已确认的收入、费用、损益计入净损失。尽管资产和负债的某些变化(例如外币兑换调整)作为随附综合资产负债表权益部分的单独组成部分报告,但这些项目与净亏损一起属于其他全面亏损的组成部分。
美国母公司及其英国子公司定期购买其马来西亚子公司生产的库存以出售给各自的客户。这些公司间贸易账户在合并中被删除。该公司的政策和意图是按当前方式结算公司间贸易账户。自英国以来和马来西亚子公司采用美元作为其有效功能货币 十月 1, 2009,
最近的会计声明不尚未被采纳:in十一月2023,FASB发布会计准则更新(ASU)2023-07, 细分市场报告(主题280):对可报告部门披露的改进。ASU扩大了公共实体的分部披露,要求披露由CODM定期审查并包括在每个报告的分部损益计量中的重大分部支出、其他分部项目的金额和构成说明,以及对应报告分部的损益和资产的中期披露。除了与美国公认会计原则最一致的衡量标准外,ASU还允许披露CODM在评估部门业绩和决定如何分配资源时使用的其他部门损益衡量标准。ASU规定的所有披露要求2023-07对于具有单一可报告部分的公共实体也是必需的。ASU2023-07对公司年报的表格有效10-k截至以下财年:九月30, 2025,以及随后的过渡期,允许及早采用。该公司目前正在评估采用ASU的影响2023-07关于其合并财务报表和披露。
在 2023年12月, FASB发布的ASO 2023-09, 所得税(主题 740):所得税披露的改进,其中包括进一步加强所得税披露的修正案,主要通过标准化和细分税率调节类别和司法管辖区缴纳的所得税。ASU 2023-09 自财年结束之日起,公司年度有效 九月30, 2026, 允许提前采用,并且应前瞻性或追溯性地应用。该公司目前正在评估采用ASO的影响 2023-09 关于其披露的信息。
在 2024年11月, FASB发布的ASO 2024-03, 收入报表报告综合收入表分解披露(子主题 220-40):利润表费用分解, 这要求更详细地披露经营报表正面列出的某些费用标题中包含的特定费用类别(包括员工薪酬、折旧和销售费用)。ASU 2024-03 自本财年开始的公司年度报告期有效 2028年9月30日, 以及随后的过渡期,允许提前采用。该公司目前正在评估采用ASO的影响 2024-03 其合并财务报表和披露。
我们已经审查了所有其他最近发布的会计公告,并确定此类准则 不 但有效的意志 不 对我们的财务报表产生重大影响或确实 不 否则适用于我们的运营。
注意事项2 –持续经营的企业
该公司正在 不 盈利且运营现金流为负。我们将需要大量资金来支持我们的药物开发以及候选药物的任何相关商业化努力。根据公司当前的经营计划,预计截至财务报表发布日其现金和现金等值物不足以满足公司的运营、投资和融资现金流需求 十二 这些财务报表发布日期后的几个月。为了获得为我们的运营提供资金所需的资本,我们希望通过公开或私募股权发行、债务融资交易和/或其他资本来源来满足我们的现金需求。额外资本 可能不 根据我们需要的时间和金额提供资金,以及时资助我们的活动。
These uncertainties raise substantial doubt regarding our ability to continue as a going concern for a period of twelve months subsequent to the issuance date of these financial statements. Certain elements of our operating plan to alleviate the conditions that raise substantial doubt, including but not limited to our ability to secure equity financing or other financing alternatives, are outside of our control and cannot be included in management’s evaluation under the requirement of ASC 205-40, Disclosure of Uncertainties about an Entity’s Ability to Continue as a Going Concern. Accordingly, we have concluded that substantial doubt exists about our ability to continue as a going concern for a period of at least twelve months subsequent to the issuance date of these financial statements.
Note 3 – Fair Value Measurements
FASB ASC Topic 820 specifies a hierarchy of valuation techniques based on whether the inputs to those valuation techniques are observable or unobservable. Observable inputs reflect market data obtained from independent sources, while unobservable inputs reflect market assumptions.
The three levels of the fair value hierarchy are as follows:
Level 1 – Quoted prices for identical instruments in active markets.
Level 2 – Quoted prices for similar instruments in active markets; quoted prices for identical or similar instruments in markets that are not active; and model-derived valuations whose inputs are observable or whose significant value drivers are observable.
Level 3 – Instruments with primarily unobservable value drivers.
There were no transfers between Level 1, Level 2 and Level 3 during fiscal 2024 and 2023.
Amounts capitalized as IPR&D are subject to impairment testing until the completion or abandonment of the associated research and development efforts. We use probability-adjusted discounted cash flow calculations using Level 3 fair value measurements and inputs including estimated revenues, costs, probability of technical and regulatory success and discount rates to measure impairment, if any. During the second quarter of fiscal 2023, we recognized an impairment charge of $
As of September 30, 2024 and 2023, the Company’s financial liabilities measured at fair value on a recurring basis, which consisted of embedded derivatives, are also classified within Level 3 of the fair value hierarchy.
The Company determines the fair value of hybrid instruments based on available market data using appropriate valuation models, considering all of the rights and obligations of each instrument. The Company estimates the fair value of hybrid instruments using various techniques (and combinations thereof) that are considered to be consistent with the objective of measuring fair value. In selecting the appropriate technique, the Company considers, among other factors, the nature of the instrument, the market risks that it embodies and the expected means of settlement. Estimating the fair value of derivative financial instruments requires the development of significant and subjective estimates that may, and are likely to, change over the duration of the instrument with related changes in internal and external market factors. Increases in fair value during a given financial quarter result in the recognition of non-cash derivative expense. Conversely, decreases in fair value during a given financial quarter would result in the recognition of non-cash derivative income.
The following table provides a reconciliation of the beginning and ending liability balance associated with embedded derivatives measured at fair value using significant unobservable inputs (Level 3) for the years ended September 30, 2024 and 2023:
| 2024 | 2023 | |||||||
| Beginning balance | $ | $ | ||||||
| Change in fair value of derivative liabilities | ( | ) | ||||||
| Ending balance | $ | $ | ||||||
The expense or income associated with the change in fair value of the embedded derivatives is presented as a separate line item in the accompanying consolidated statements of operations.
The liabilities associated with embedded derivatives represent the fair value of the change of control provisions in the Residual Royalty Agreement. See Note 9 for additional information. There is no current observable market for these types of derivatives. The Company estimates the fair value of the embedded derivative within the Residual Royalty Agreement by using a scenario-based method, whereby different scenarios are valued and probability weighted. The scenario-based valuation model incorporates transaction details such as the contractual terms of the instrument and assumptions including projected FC2 revenues, expected cash outflows, probability and estimated dates of a change of control, risk-free interest rates and applicable credit risk. Material changes in any of these inputs could result in a significantly higher or lower fair value measurement at future reporting dates, which could have a material effect on our results of operations. The increase in the fair value of derivative liabilities in fiscal 2024 was driven by an increase in the probability of a change of control and decreases in the discount rates used, due primarily to external market factors. The decrease in the fair value of derivative liabilities in fiscal 2023 was driven by a decrease in the expected cash outflows under the Residual Royalty Agreement, due to decreases in projected FC2 net revenues in future periods, and increases in the discount rates used, due primarily to external market factors.
The following table presents quantitative information about the inputs and valuation methodologies used to determine the fair value of the embedded derivatives classified in Level 3 of the fair value hierarchy as of September 30, 2024 and 2023:
| Valuation Methodology | Significant Unobservable Input | 2024 | 2023 | ||||||
| Scenario-Based | Estimated change of control dates | March 2025 to March 2027 | December 2024 to December 2026 | ||||||
| Discount rate | |||||||||
| Probability of change of control |
The Company also has an investment in equity securities consisting of
On September 24, 2024, the Company converted all of the shares of ONCO Preferred Stock it holds into
Note 4 – Revenue from Contracts with Customers
The Company generates all its revenue from direct product sales. Revenue from direct product sales is generally recognized when the customer obtains control of the product, which occurs at a point in time, and may be upon shipment or upon delivery based on the contractual shipping terms of a contract. Sales taxes and other similar taxes that the Company collects concurrent with revenue-producing activities are excluded from revenue.
The amount of consideration the Company ultimately receives varies depending upon sales discounts, and other incentives that the Company may offer, which are accounted for as variable consideration when estimating the amount of revenue to recognize. The estimate of variable consideration requires significant judgment. The Company includes estimated amounts in the transaction price to the extent it is probable that a significant reversal of cumulative revenue recognized will not occur when the uncertainty associated with the variable consideration is resolved. The estimates of variable consideration and determination of whether to include estimated amounts in the transaction price are based largely upon an assessment of current contract sales terms and historical payment experience.
Product returns are typically not significant because returns are generally not allowed unless the product is damaged at time of receipt.
The Company’s revenue is primarily from sales of FC2 in the U.S. prescription channel and direct sales of FC2 in the global public health sector, and also included sales of ENTADFI through the date the ENTADFI assets were sold on April 19, 2023. The following table presents net revenues by product and sector for the years ended September 30, 2024 and 2023:
| 2024 | 2023 | |||||||
| FC2 | ||||||||
| Global public health sector | $ | $ | ||||||
| U.S. prescription channel | ||||||||
| Total FC2 | ||||||||
| Other | ||||||||
| Net revenues | $ | $ | ||||||
The following table presents net revenue by geographic area for the years ended September 30, 2024 and 2023:
| 2024 | 2023 | |||||||
| United States | $ | $ | ||||||
| South Africa | ||||||||
| Brazil | * | |||||||
| Mozambique | * | |||||||
| Other | ||||||||
| Net revenues | $ | $ | ||||||
*Less than 10% of total net revenues
The Company’s performance obligations consist mainly of transferring control of products identified in the contracts which occurs either when: i) the product is made available to the customer for shipment; ii) the product is shipped via common carrier; or iii) the product is delivered to the customer or distributor, in accordance with the terms of the agreement. Some of the Company’s contracts require the customer to make advanced payments prior to transferring control of the products. These advanced payments create a contract liability for the Company. The balances of the Company’s contract liability, included in accrued expenses and other current liabilities on the accompanying consolidated balances sheets, was approximately $
The amount of revenue recognized that was included in the contract liabilities and unearned revenues balance at the beginning of the period was $
Note 5 – Accounts Receivable and Concentration of Credit Risk
The Company’s standard credit terms vary from 30 to 120 days, depending on the class of trade and customary terms within a territory, so accounts receivable is affected by the mix of sales within the period. As is typical in the Company’s business, extended credit terms may occasionally be offered as a sales promotion or for certain sales. For sales to the Company’s distributor in Brazil, the Company has agreed to credit terms of up to one year.
The components of accounts receivable consist of the following at September 30, 2024 and 2023:
| 2024 | 2023 | |||||||
| Trade receivables, gross | $ | $ | ||||||
| Less: allowance for credit losses | ( | ) | ( | ) | ||||
| Less: allowance for sales returns and payment term discounts | ( | ) | ( | ) | ||||
| Accounts receivable, net | $ | $ | ||||||
The opening balance of the Company's net accounts receivable at October 1, 2022 was $
At September 30, 2024, customers had an accounts receivable balance greater than 10% of net accounts receivable, representing
For the year ended September 30, 2024, there were customers whose individual net revenue to the Company exceeded 10% of the Company’s net revenues, representing
The Company maintains an allowance for credit losses for estimated losses resulting from the inability of its customers to make required payments on accounts receivable. Management determines the allowance for credit losses by identifying troubled accounts and by using historical experience applied to an aging of accounts. Management also periodically evaluates individual customer receivables and considers a customer’s financial condition, credit history, and the current economic conditions. Accounts receivable are charged-off when deemed uncollectible. During the year ended September 30, 2023, the Company recorded a provision for credit losses of $
The table below summarizes the change in the allowance for credit losses on trade receivables for the years ended September 30, 2024 and 2023:
| 2024 | 2023 | |||||||
| Beginning balance | $ | $ | ||||||
| Charge-offs, net of recoveries | ||||||||
| Ending balance | $ | $ | ||||||
Recoveries of accounts receivable previously charged-off are recorded when received. In the global public health sector, the Company’s customers are primarily health care distributors, large global agencies, non-government organizations, ministries of health and other governmental agencies which purchase and distribute FC2 for use in HIV/AIDS prevention and family planning programs. In the U.S. prescription channel, the Company’s customers include primarily telemedicine providers.
Note 6 – Inventories
Inventories consisted of the following at September 30, 2024 and September 30, 2023:
| 2024 | 2023 | |||||||
| Raw material | $ | $ | ||||||
| Work in process | ||||||||
| Finished goods | ||||||||
| Inventories, gross | ||||||||
| Less: inventory reserves | ( | ) | ( | ) | ||||
| Inventories, net | $ | $ | ||||||
The Company recorded a provision for obsolete inventory of $
Note 7 – Property and Equipment
Property and equipment consisted of the following at September 30, 2024 and 2023:
| Estimated | |||||||||||
| Useful Life (years) | 2024 | 2023 | |||||||||
| Property and equipment: | |||||||||||
| Manufacturing equipment | $ | $ | |||||||||
| Office equipment, furniture and fixtures | |||||||||||
| Leasehold improvements | |||||||||||
| Total property and equipment | |||||||||||
| Less: accumulated depreciation and amortization | ( | ) | ( | ) | |||||||
| Property and equipment, net | $ | $ | |||||||||
Depreciation expense for the years ended September 30, 2024 and 2023 was approximately $
Note 8 –Intangible Assets and Goodwill
Intangible Assets
Intangible assets included IPR&D and covenants not-to-compete. As of September 30, 2024, the net book value of intangible assets was zero.
The gross carrying amounts and net book value of intangible assets, which is included in other assets on the accompanying consolidated balance sheet, were as follows at September 30, 2023:
| Gross Carrying | Accumulated | Net Book | ||||||||||
| Amount | Amortization | Value | ||||||||||
| Intangible asset with finite life: | ||||||||||||
| Covenants not-to-compete | $ | $ | $ | |||||||||
| Indefinite-lived intangible assets: | ||||||||||||
| Acquired in-process research and development assets | — | |||||||||||
| Total intangible assets | $ | $ | $ | |||||||||
Amortization was recorded on a straight-line basis over years for the covenants not-to-compete. The amortization expense was recorded in selling, general and administrative expenses in the accompanying consolidated statements of operations. Amortization expense was approximately $
In March 2023, the Company announced its strategic decision to refocus its drug development efforts on those drug candidates that it believes have the best opportunity to lead to long-term success and shareholder value creation. As part of this strategic decision, the Company has indefinitely ceased development of sabizabulin for prostate cancer and zuclomiphene. The Company has no current plans that would invest funds in the development of these two assets or that would lead to the Company deriving value from these two assets, which has met the criteria for abandonment under the accounting standards. This resulted in writing off the carrying amount of these two acquired in-process research and development assets and recording an impairment charge of $
Goodwill
The carrying amount of goodwill at September 30, 2024 and 2023 was $
Note 9 – Debt
SWK Residual Royalty Agreement
On March 5, 2018, the Company entered into a Credit Agreement (the “Credit Agreement”) with the financial institutions party thereto from time to time (the “Lenders”) and SWK Funding LLC, as agent for the Lenders (the “Agent”), for a synthetic royalty financing transaction. On and subject to the terms of the Credit Agreement, the Lenders provided the Company with a term loan of $
In connection with the Credit Agreement, the Company and the Agent also entered into a Residual Royalty Agreement, dated as of March 5, 2018 (as amended, the “Residual Royalty Agreement”), which provides for an ongoing royalty payment of
For accounting purposes, the $
At September 30, 2024 and 2023, the Residual Royalty Agreement liability consisted of the following:
| 2024 | 2023 | |||||||
| Residual royalty agreement liability, fair value at inception | $ | $ | ||||||
| Add: accretion of liability using effective interest rate | ||||||||
| Less: cumulative payments | ( | ) | ( | ) | ||||
| Residual royalty agreement liability, excluding embedded derivative liability | ||||||||
| Add: embedded derivative liability at fair value (see Note 3) | ||||||||
| Total residual royalty agreement liability | ||||||||
| Residual royalty agreement liability, short-term portion | ( | ) | ( | ) | ||||
| Residual royalty agreement liability, long-term portion | $ | $ | ||||||
As the Company has repaid the original principal of $
Interest expense on the accompanying consolidated statements of operations relates to the accretion of the liability for the Residual Royalty Agreement. The accretion of the liability is based on projected FC2 revenues.
Premium Finance Agreement
On November 1, 2022, the Company entered into an agreement to finance $
Note 10 – Stockholders’ Equity
Preferred Stock
The Company has
Common Stock
We are authorized to issue up to
Shelf Registration Statement
In March 2023, the Company filed a shelf registration statement on Form S-3 (File No. 333-270606) with a capacity of $
Common Stock Offering
On December 18, 2023, we completed an underwritten public offering of
Aspire Capital Purchase Agreement
On June 26, 2020, the Company entered into a common stock purchase agreement (the “Aspire Purchase Agreement”) with Aspire Capital Fund, LLC (“Aspire Capital”) which provided that, upon the terms and subject to the conditions and limitations set forth therein, the Company had the right, from time to time in its sole discretion during the
During the year ended September 30, 2023, we sold
During the
In consideration for entering into the Aspire Purchase Agreement, concurrently with the execution of the Aspire Purchase Agreement, the Company issued to Aspire Capital
Private Investment in Public Equity
On April 12, 2023, the Company entered into a stock purchase agreement (the “Stock Purchase Agreement”) with Frost Gamma Investments Trust (“FGI”), pursuant to which, on the date thereof, the Company issued and sold
Lincoln Park Capital Fund LLC Purchase Agreement
On May 2, 2023, the Company entered into a purchase agreement (as amended, the “Lincoln Park Purchase Agreement”) with Lincoln Park Capital Fund, LLC (“Lincoln Park”), which provides that, upon the terms and subject to the conditions and limitations set forth therein, the Company may sell to Lincoln Park up to $
Under the Lincoln Park Purchase Agreement, the Company has the right, but not the obligation, on any business day selected by the Company (the “Purchase Date”), provided that on such day the closing sale price per share of the Company’s common stock is above the Floor Price, as defined in the Lincoln Park Purchase Agreement, to require Lincoln Park to purchase up to
In addition to Regular Purchases and provided that the Company has directed a Regular Purchase in full, the Company in its sole discretion may require Lincoln Park on each Purchase Date to purchase on the following business day (“Accelerated Purchase Date”) up to the lesser of (i) three (3) times the number of shares purchased pursuant to such Regular Purchase or (ii)
The purchase price of Regular Purchases, Accelerated Purchases and Additional Accelerated Purchases and the minimum closing sale price for a Regular Purchase will be adjusted for any reorganization, recapitalization, non-cash dividend, stock split or other similar transaction occurring during the business days used to compute the purchase price. The aggregate number of shares that the Company can sell to Lincoln Park under the Lincoln Park Purchase Agreement may in no case exceed
In consideration for entering into the Lincoln Park Purchase Agreement, concurrently with the execution of the Lincoln Park Purchase Agreement, the Company issued
We sold
At-the-Market Sale Agreement
On May 12, 2023, the Company entered into an Open Market Sale Agreement℠ (the “Jefferies Sales Agreement”) with Jefferies LLC (“Jefferies”), as sales agent, pursuant to which the Company may issue and sell, from time to time, through Jefferies, shares of the Company’s common stock, with an aggregate value of up to $
We sold
The Company incurred issuance costs related to the Jefferies Sales Agreement of $
Note 11 – Share-based Compensation
We allocate share-based compensation expense to cost of sales, selling, general and administrative expense and research and development expense based on the award holder’s employment function. We recorded income tax benefits for share-based compensation expense of approximately $
| 2024 | 2023 | |||||||
| Cost of sales | $ | $ | ||||||
| Selling, general and administrative | ||||||||
| Research and development | ||||||||
| $ | $ | |||||||
We have issued share-based awards to employees and non-executive directors under the Company’s approved equity plans. Upon the exercise of share-based awards, new shares are issued from authorized common stock.
Equity Plans
In June 2022, the Company’s board of directors adopted the Company’s 2022 Employment Inducement Equity Incentive Plan (the “Inducement Plan”). The Inducement Plan is a non-shareholder approved stock plan adopted pursuant to the “inducement exception” provided under Nasdaq listing rules. The Inducement Plan is used exclusively for the issuance of equity awards to new hires who satisfy the requirements to be granted inducement grants under Nasdaq listing rules as an inducement material to the individual’s entry into employment with the Company. The terms of the Inducement Plan are substantially similar to the terms of our 2018 Plan. The Company has reserved
In March 2018, the Company’s stockholders approved the Company's 2018 Equity Incentive Plan (the “2018 Plan”). On March 29, 2022, the Company’s stockholders approved an increase in the number of shares that may be issued under the 2018 Plan to
In July 2017, the Company’s stockholders approved the Company's 2017 Equity Incentive Plan (the “2017 Plan”). A total of
Stock Options
Each option grants the holder the right to purchase from us one share of our common stock at a specified price, which is generally the closing price per share of our common stock on the date the option is issued. Options generally vest on a pro-rata basis on each anniversary of the issuance date within years of the date the option is issued. Options may be exercised after they have vested and prior to the specified expiry date provided applicable exercise conditions are met, if any. The expiry date can be for periods of up to years from the date the option is issued. The fair value of each option is estimated on the date of grant using the Black-Scholes option pricing model based on the assumptions established at that time. The Company accounts for forfeitures as they occur and does not estimate forfeitures as of the option grant date. The Company recognized a reduction in share-based compensation expense of $
The following table outlines the weighted average assumptions for options granted during fiscal 2024 and 2023:
| 2024 | 2023 | |||||||
| Weighted Average Assumptions: | ||||||||
| Expected Volatility | % | % | ||||||
| Expected Dividend Yield | % | % | ||||||
| Risk-free Interest Rate | % | % | ||||||
| Expected Term (in years) | ||||||||
| Fair Value of Options Granted | $ | $ | ||||||
During the years ended September 30, 2024 and 2023, the Company used historical volatility of our common stock over a period equal to the expected life of the options to estimate their fair value. The dividend yield assumption is based on the Company’s recent history and expectation of future dividend payouts on the common stock. The risk-free interest rate is based on the implied yield available on U.S. treasury zero-coupon issues with an equivalent remaining term.
The following table summarizes the stock options outstanding and exercisable at September 30, 2024:
| Weighted Average | ||||||||||||||||
| Remaining | Aggregate | |||||||||||||||
| Number of | Exercise Price | Contractual Term | Intrinsic | |||||||||||||
| Shares | Per Share | (years) | Value | |||||||||||||
| Outstanding at September 30, 2023 | $ | |||||||||||||||
| Granted | ||||||||||||||||
| Exercised | ( | ) | ||||||||||||||
| Forfeited | ( | ) | ||||||||||||||
| Outstanding at September 30, 2024 | $ | $ | ||||||||||||||
| Exercisable at September 30, 2024 | $ | $ | ||||||||||||||
The aggregate intrinsic values in the table above are before income taxes and represent the number of in-the-money options outstanding or exercisable multiplied by the closing price per share of the Company’s common stock on the last trading day of the year ended September 30, 2024 of $
The total intrinsic value of options exercised was approximately $
As of September 30, 2024, the Company had unrecognized compensation expense of approximately $
Stock Appreciation Rights
In fiscal 2017, the Company issued stock appreciation rights based on
Note 12 – Leases
The Company has operating leases for its office, manufacturing and warehouse space, and office equipment. The Company has a finance lease for office equipment, furniture, and fixtures.
Corporate Headquarters
In June 2021, the Company executed a lease for its new corporate headquarters in Miami, Florida. The Company is leasing approximately
Chicago Lease
The Company leased approximately
International Leases
The Company leases approximately
The Company leases
Certain of our lease agreements include variable lease payments for common area maintenance, real estate taxes, and insurance or based on usage for the office equipment leases. The components of the Company’s lease cost were as follows for the years ended September 30, 2024 and 2023:
| 2024 | 2023 | |||||||
| Operating lease cost | $ | $ | ||||||
| Short-term lease cost | ||||||||
| Variable lease cost | ||||||||
| Sublease income | ( | ) | ( | ) | ||||
| Total lease cost | $ | $ | ||||||
The Company paid cash of $
Other information related to the Company’s leases as of September 30, 2024 and 2023 was as follows:
| 2024 | 2023 | |||||||
| Operating Leases | ||||||||
| Weighted-average remaining lease term | ||||||||
| Weighted-average discount rate | % | % | ||||||
The Company’s lease agreements do provide a readily determinable implicit rate. Therefore, the Company estimates its incremental borrowing rate based on information available at lease commencement in order to discount lease payments to present value.
As of September 30, 2024, maturities of lease liabilities were as follows:
| Operating | ||||
| Leases | ||||
| Fiscal year ended September 30, | ||||
| 2025 | $ | |||
| 2026 | ||||
| 2027 | ||||
| 2028 | ||||
| 2029 | ||||
| Thereafter | ||||
| Total lease payments | ||||
| Less imputed interest | ( | ) | ||
| Total lease liabilities | $ | |||
The Company does not have any leases that have not yet commenced as of September 30, 2024.
The lease liabilities presented above do not include variable lease payments for common area maintenance, real estate taxes, and insurance or based on usage for the office equipment leases. These amounts are not fixed and can fluctuate from year to year.
Note 13 – Contingent Liabilities
The testing, manufacturing and marketing of consumer products by the Company entail an inherent risk that product liability claims will be asserted against the Company. The Company maintains product liability insurance coverage for claims arising from the use of its products. The coverage amount is currently $
Litigation
On December 5, 2022, a putative class action complaint was filed in federal district court for the Southern District of Florida (Ewing v. Veru Inc., et al., Case No. 1:22-cv-23960) against the Company and Mitchell Steiner, its Chairman, CEO and President, and Michele Greco, its CFO (the “Ewing Lawsuit”). The First Amended Class Action Complaint, filed on September 15, 2023 by purported stockholders Dr. Myo Thant and Karen Brounstein, alleges that certain public statements about sabizabulin as a treatment for COVID-19 between March 1, 2021 and March 2, 2023 violated Sections 10(b) and 20(a) of the Securities Exchange Act of 1934 and Rule 10b-5 promulgated thereunder, and seeks monetary damages.
On July 7, 2023, Anthony Maglia, a purported stockholder, filed a derivative action in the Circuit Court for the Eleventh Judicial Circuit, Miami-Dade County, Florida (Maglia v. Steiner et al., Case No. 2023-019406-CA-01), against the Company as a nominal defendant, and Company officers and directors Mitchell S. Steiner, Michele Greco, Harry Fisch, Mario Eisenberger, Grace S. Hyun, Lucy Lu and Michael L. Rankowitz (the “Maglia Lawsuit”). The Maglia lawsuit asserts claims for breach of fiduciary duty, waste of corporate assets, and unjust enrichment primarily in connection with the issues and claims asserted in the Ewing Lawsuit. The Maglia Lawsuit seeks to direct the Company to improve its corporate governance and internal procedures, and also seeks monetary damages, injunctive relief, restitution, and an award of reasonable fees and expenses.
On September 1, 2023, Anthony Franchi, a purported stockholder, filed a derivative action in the United States District Court for the Eastern District of Wisconsin (Franchi v. Steiner et al., Case No. 2:23-CV-01164), against the Company as a nominal defendant, and Company officers and directors Mitchell S. Steiner, Mario Eisenberger, Harry Fisch, Michael L. Rankowitz, Grace Hyun, Lucy Lu, and Michele Greco (the “Franchi Lawsuit”). The Franchi lawsuit asserts claims for breach of fiduciary duty and unjust enrichment primarily in connection with the issues and claims asserted in the Ewing Lawsuit. The Franchi Lawsuit seeks to direct the Company to improve its corporate governance and internal procedures, and also seeks monetary damages, restitution, and an award of reasonable fees and expenses. On November 8, 2023, this action was consolidated with the Renbarger action, discussed below.
On September 28, 2023, Philip Renbarger, a purported stockholder, filed a derivative action in the United States District Court for the Eastern District of Wisconsin (Renbarger v. Steiner et al., Case No. 2:23-CV-01291), against the Company as a nominal defendant, and Company officers and directors Mitchell Steiner, Mario Eisenberger, Harry Fisch, Michael L. Rankowitz, Grace S. Hyun, Lucy Lu, and Michele Greco (the “Renbarger Lawsuit”). The Renbarger lawsuit asserts claims for breach of fiduciary duty, aiding and abetting, gross mismanagement, waste of corporate assets, and unjust enrichment primarily in connection with the issues and claims asserted in the Ewing Lawsuit. The Renbarger Lawsuit seeks to direct the Company to improve its corporate governance and internal procedures, and also seeks monetary damages and an award of reasonable fees and expenses. On November 8, 2023, the Renbarger Lawsuit was consolidated with the Franchi Lawsuit, discussed above.
On October 9, 2023, Mohamed Alshourbagy, a purported stockholder, filed a derivative action in the United States District Court for the Southern District of Florida (Alshourbagy v. Steiner et al., Case No. 1:23-cv-23846), against the Company as a nominal defendant, and Company officers and directors Mitchell S. Steiner, Mario A. Eisenberger, Harry D. Fisch, Michael L. Rankowitz, Grace S. Hyun, Lucy Lu, and Michele Greco (the “Alshourbagy Lawsuit”). The Alshourbagy lawsuit asserts claims for breach of fiduciary duty and contribution primarily in connection with the issues and claims asserted in the Ewing Lawsuit. The Alshourbagy Lawsuit seeks to direct the Company to improve its corporate governance and internal procedures, and also seeks monetary damages, injunctive relief, restitution, and an award of reasonable fees and expenses.
On September 30, 2024, June Ovadias, a purported stockholder, filed a derivative action in the United States District Court for the Western District of Wisconsin (Ovadias v. Steiner et al., Case No. 3:24-cv-00676), against the Company as a nominal defendant, and Company officers and directors Mitchell S. Steiner, Michele Greco, Mario A. Eisenberger, Harry D. Fisch, Grace S. Hyun, Lucy Lu, and Michael L. Rankowitz (the “Ovadias Lawsuit”). The Ovadias lawsuit asserts claims for breach of fiduciary duty, unjust enrichment, abuse of control, gross mismanagement, waste of corporate assets, and contribution primarily in connection with the issues and claims asserted in the Ewing Lawsuit. The Ovadias Lawsuit seeks to direct the Company to improve its corporate governance and internal procedures, and also seeks monetary damages, restitution, and an award of reasonable fees and expenses.
The Ewing Lawsuit, Maglia Lawsuit, Franchi Lawsuit, Renbarger Lawsuit, Alshourbagy Lawsuit and Ovadias Lawsuit are collectively referred to as the “Shareholder Litigation.” At this time, the Company is unable to estimate potential losses, if any, related to the Shareholder Litigation.
License and Purchase Agreements
From time to time, we license or purchase rights to technology or intellectual property from third parties. These licenses and purchase agreements require us to pay upfront payments as well as development or other payments upon successful completion of preclinical, clinical, regulatory or revenue milestones. In addition, these agreements may require us to pay royalties on sales of products arising from the licensed or acquired technology or intellectual property. Because the achievement of future milestones is not reasonably estimable, we have recorded a liability in the accompanying consolidated financial statements for any of these contingencies.
Collaborative Arrangements
On January 31, 2022, the Company entered into a Clinical Trial Collaboration and Supply Agreement (the “Lilly Agreement”) with Eli Lilly and Company (“Lilly”). The Company was sponsoring a clinical trial in which both the Company’s enobosarm compound and Lilly’s compound were being dosed in combination. Under the Lilly agreement, the Company conducts the research at its own cost and Lilly contributes its compound towards the study at no cost to the Company. The parties continue to hold exclusive rights to all intellectual property relating solely to their own respective compounds. The Company would provide to Lilly copies of clinical data relating to the clinical trial and certain rights to use the clinical data. Veru maintains full exclusive, global commercialization rights to the enobosarm compound. As the ENABLAR-2 clinical trial is currently suspended, on August 22, 2024 Lilly sent Veru a notice of expiration effectively terminating the Lilly Agreement.
The terms of the Lilly Agreement met the criteria under ASC Topic 808, Collaborative Arrangements (“ASC 808”), as both parties were active participants in the activity and were exposed to the risks and rewards dependent on the commercial success of the activity. ASC 808 does not provide guidance on how to account for the activities under the collaboration, and the Company determined that Lilly did not meet the definition of a customer under ASC 606, Revenue from Contracts with Customers. The Company has concluded that ASC 730, Research and Development, should be applied by analogy. There is no financial statement impact for the Lilly Agreement as the value of the drug supply received from Lilly would be offset against the drug supply cost within research and development expense.
Resolution of Commercial Dispute
A supplier claimed that we owed approximately $
Note 14 – Income Taxes
The Company accounts for income taxes using the liability method, which requires the recognition of deferred tax assets or liabilities for the tax-effected temporary differences between the financial reporting and tax bases of its assets and liabilities, and for net operating loss (NOL) and tax credit carryforwards.
Within the calculation of the Company’s annual effective tax rate the Company has used assumptions and estimates that may change as a result of future guidance, interpretations, and rule-making from the Internal Revenue Service, the SEC, the FASB and/or various other taxing jurisdictions. For example, the Company anticipates that state jurisdictions will continue to determine and announce their conformity to the Tax Act which would have an impact on the annual effective tax rate. The Company’s calculations are based on the information available, prepared or analyzed (including computations) in reasonable detail.
The Company completes a detailed analysis of its deferred income tax valuation allowances on an annual basis or more frequently if information comes to its attention that would indicate that a revision to its estimates is necessary. In evaluating the Company’s ability to realize its deferred tax assets, management considers all available positive and negative evidence on a country-by-country basis, including past operating results, forecasts of future taxable income, and the potential Section 382 limitation on the NOL carryforwards due to a change in control. In determining future taxable income, management makes assumptions to forecast U.S. federal and state, U.K. and Malaysia operating income, the reversal of temporary differences, and the implementation of any feasible and prudent tax planning strategies. These assumptions require significant judgment regarding the forecasts of the future taxable income in each tax jurisdiction and are consistent with the forecasts used to manage the Company’s business. The Company had a cumulative pretax loss in the U.S. for fiscal 2024 and the two preceding fiscal years. Forming a conclusion that a valuation allowance is not needed is difficult when there is significant negative evidence such as cumulative losses in recent years. Management has projected future pretax losses in the U.S. driven by the investment in research and development and based on our analysis, concluded that a full valuation allowance should be recorded related to federal and state NOL carryforwards as of September 30, 2024. The valuation allowance against U.S. deferred tax assets was increased by $
As of September 30, 2024, the Company had U.S. federal and state NOL carryforwards of approximately $
Loss before income taxes was taxed by the following jurisdictions for the years ended September 30, 2024 and 2023:
| 2024 | 2023 | |||||||
| Domestic | $ | ( | ) | $ | ( | ) | ||
| Foreign | ( | ) | ||||||
| Total | $ | ( | ) | $ | ( | ) | ||
A reconciliation between the effective tax rate and the U.S. statutory rate and the related income tax expense is as follows:
| 2024 | 2023 | |||||||||||||||
| Amount | Tax Rate | Amount | Tax Rate | |||||||||||||
| Income tax benefit at U.S. federal statutory rates | $ | ( | ) | % | $ | ( | ) | % | ||||||||
| State income tax benefit, net of federal benefits | ( | ) | ( | ) | ||||||||||||
| Non-deductible expenses | ( | ) | ( | ) | ||||||||||||
| U.S. research and development tax credit | ( | ) | ( | ) | ||||||||||||
| Effect of foreign income tax rates | ( | ) | ( | ) | ||||||||||||
| Effect of common stock options exercised | ( | ) | ||||||||||||||
| Effect of global intangible low-taxed income | ( | ) | ( | ) | ( | ) | ||||||||||
| Change in valuation allowance | ( | ) | ( | ) | ||||||||||||
| Other, net | ( | ) | ( | ) | ||||||||||||
| Income tax expense | $ | ( | )% | $ | ( | )% | ||||||||||
The federal and state income tax expense (benefit) for the years ended September 30, 2024 and 2023 is summarized below:
| 2024 | 2023 | |||||||
| Deferred – U.S. | $ | $ | ( | ) | ||||
| Deferred – U.K. | ||||||||
| Deferred – Malaysia | ( | ) | ( | ) | ||||
| Subtotal | ||||||||
| Current – U.S. | ( | ) | ||||||
| Current – Malaysia | ||||||||
| Subtotal | ||||||||
| Income tax expense | $ | $ | ||||||
Significant components of the Company’s deferred tax assets and liabilities are as follows:
| 2024 | 2023 | |||||||
| Deferred tax assets: | ||||||||
| Federal net operating loss carryforwards | $ | $ | ||||||
| State net operating loss carryforwards | ||||||||
| Foreign net operating loss carryforwards – U.K. | ||||||||
| Foreign capital allowance – U.K. | ||||||||
| Share-based compensation – U.K. | ||||||||
| U.S. research and development tax credit carryforward | ||||||||
| U.S. research and development expense | ||||||||
| Accrued compensation | ||||||||
| Share-based compensation | ||||||||
| Interest expense | ||||||||
| U.S. credit loss provision | ||||||||
| Other, net – Malaysia | ||||||||
| Other, net – U.K. | ||||||||
| Other, net – U.S. | ||||||||
| Gross deferred tax assets | ||||||||
| Valuation allowance for deferred tax assets | ( | ) | ( | ) | ||||
| Net deferred tax assets | ||||||||
| Deferred tax liabilities: | ||||||||
| Change in fair value of derivative liability | ( | ) | ( | ) | ||||
| Covenant not-to-compete | ( | ) | ||||||
| Net deferred tax liabilities | ( | ) | ( | ) | ||||
| Net deferred tax asset | $ | $ | ||||||
The deferred tax amounts have been classified in the accompanying consolidated balance sheets as follows:
| 2024 | 2023 | |||||||
| Long-term deferred tax asset – U.K. | $ | $ | ||||||
| Long-term deferred tax asset – Malaysia | ||||||||
| Total long-term deferred tax asset | $ | $ | ||||||
ASC Topic 740 prescribes a recognition threshold and measurement attribute for the financial statement recognition and measurement of a tax position taken or expected to be taken in a tax return. ASC Topic 740 developed a two-step process to evaluate a tax position and also provides guidance on de-recognition, classification, interest and penalties, accounting in interim periods, disclosure, and transition. The Company has not recorded a reserve for any tax positions for which the ultimate deductibility is highly certain but for which there is uncertainty about the timing of such deductibility.
The Company files tax returns in all appropriate jurisdictions, including foreign, U.S. federal and state tax returns. The following summarizes open tax years in the relevant jurisdictions:
| ● | For the U.S., a tax return may be audited any time within 3 years from filing date or 3 years after an NOL is utilized. The U.S. open tax years are for fiscal through 2007, fiscal 2015 through fiscal 2019, and fiscal 2022 through fiscal 2023, for which the Company is carrying forward NOLs, which expire in years 2025 through 2038 or are being carried forward indefinitely with no expiration. |
| ● | For Malaysia, a tax return may be audited any time within 5 years from filing date (7 months after the fiscal year end). The Malaysia open tax years are for through 2023, which expire on December 31, 2024 through 2028. |
| ● | For the U.K., a tax return may be audited within 1 year from the later of: the filing date or the filing deadline (1 year after the end of the accounting period). The U.K. open tax year is for which expires in 2025. |
The fiscal 2024 tax returns for all jurisdictions have not been filed as of the date of this filing. As of September 30, 2024 and 2023, the Company has
The Company recognizes interest and penalties related to uncertain tax positions as income tax expense as incurred. No material expense for interest and penalties was recognized for the years ended September 30, 2024 and 2023.
Note 15 – Sale of ENTADFI
On April 19, 2023, the Company entered into an asset purchase agreement (the “Asset Purchase Agreement”) to sell substantially all of the assets related to ENTADFI® (finasteride and tadalafil) capsules for oral use, a new treatment for benign prostatic hyperplasia that was approved by the FDA in December 2021, with ONCO. The transaction closed on April 19, 2023. The purchase price for the transaction was $
On September 29, 2023, the Company entered into an Amendment to the Asset Purchase Agreement (the “Amendment”) providing that the promissory note for the $
On April 24, 2024, the Company entered into a Forbearance Agreement (the "Forbearance Agreement") with ONCO, relating to certain defaults under the ONCO Promissory Notes. Pursuant to the Forbearance Agreement, (a) ONCO agreed to make a payment of $
ONCO agreed in the Forbearance Agreement to make the following required payments during the Forbearance Period towards the remaining principal balance of the April 2024 Promissory Note: (1) monthly payments equal to
On September 19, 2024, the Company entered into an Amended and Restated Forbearance Agreement and Amendment to September 2024 Note (the “Amended Forbearance Agreement”) with ONCO. The Amended Forbearance Agreement amends and restates the entirety of the Forbearance Agreement.
Pursuant to the Amended Forbearance Agreement, the forbearance period relating to the Company’s agreement to forbear from exercising its rights and remedies on account of the failure by the Borrower to pay the amounts due under the April 2024 Promissory Note on the due date of April 19, 2024 continues to end on the earlier of (a) March 31, 2025 and (b) the occurrence of an Event of Default (as defined in the Amended Forbearance Agreement) (such period, the “April 2024 Forbearance Period”). The Amended Forbearance Agreement extends the due date for the September Promissory Note until the earlier to occur of: (i) June 30, 2025 or (ii) the occurrence of any Event of Default under the Amended Forbearance Agreement. The Amended Forbearance Agreement also effected certain modifications to the payment terms in the Forbearance Agreement and amended certain terms of the September 2024 Promissory Note as summarized below.
The Borrower agreed in the Amended Forbearance Agreement to make the following required payments (the “Required Payments”) during the April 2024 Forbearance Period first to accrued and unpaid interest under the April 2024 Promissory Note and then any remainder to the outstanding principal amount of the April 2024 Promissory Note:
| ● | monthly payments equal to | |
| ● | payment of |
The remaining balance of the April 2024 Promissory Note will be due at the end of the April 2024 Forbearance Period.
The Borrower and the Company also agreed to the following amendments to the September 2024 Promissory Note in the Amended Forbearance Agreement:
| ● | As noted above, an extension of the maturity date to June 30, 2025; | |
| ● | The accrual of interest at the rate of | |
| ● | Any amounts owed on the September 2024 Promissory Note, including but not limited to unpaid principal and accrued interest, will be paid in cash or, upon the mutual written consent of the Borrower and the Company, in shares of the Borrower’s common stock or a combination of cash and the Borrower’s common stock. | |
| ● | Following full repayment of all principal and interest under the April 2024 Promissory Note, the Borrower will make the Required Payments first towards accrued and unpaid interest under the September 2024 Promissory Note and then towards the remaining principal balance payable under the September 2024 Promissory Note. | |
| ● | If the aggregate unpaid principal outstanding under the April 2024 Promissory Note and the September 2024 Promissory Note and all accrued and unpaid interest thereon is repaid in cash on or before December 31, 2024, then the total principal balance under the September 2024 Promissory Note that will be payable by the Borrower in satisfaction of its obligations under the September 2024 Promissory Note will be reduced from $ |
The Company and ONCO entered into a Waiver and Amendment No. 1 to the Forbearance Agreement, dated November 26, 2024, that (x) extended the time for the payment by ONCO of the monthly payment of a percentage of its cash receipts referenced above and conditioned the payment of those amounts upon ONCO being able to raise capital of at least $
The Company received payments of $
The Company determined that it was not probable, at the time of the transaction and at September 30, 2024, that substantially all of the consideration promised under the Asset Purchase Agreement would be collected. Therefore, the Company recognized the difference between the nonrefundable consideration received and the carrying amount of the assets as a gain. The Company recorded a gain of approximately $
Note 16 – Loss per Share
Basic net loss per common share is computed by dividing net loss by the weighted average number of common shares outstanding for the period. Diluted net loss per share is computed by dividing net income by the weighted average number of common shares outstanding during the period after giving effect to all dilutive potential common shares that were outstanding during the period. Dilutive potential common shares consist of the incremental common shares issuable upon the exercise of stock options and stock appreciation rights as determined under the treasury stock method. Due to our net loss for the periods presented, all potentially dilutive instruments were excluded because their inclusion would have been anti-dilutive. See Note 11 for a discussion of our potentially dilutive common shares.
Note 17 – Employee Benefit Plans
Effective January 1, 2018, the Company established a 401(k) plan in which substantially all U.S. employees are eligible to participate. Contributions made by employees are limited to the maximum allowable for U.S. federal income tax purposes. The Company matched employee contributions at a rate of
In March 2014, the Company elected to contribute