
挪威三号
NORSE THREE是我们进行的一项开放标签安全性研究,旨在确保向FDA首次提交ONS-5010/LyTENAVA BLA时有足够数量的ONS-5010/LyTENAVA安全暴露。2021年3月,我们报告称,NORSE THREE的结果为ONS-5010/LyTENAVA提供了积极的安全性特征。
北欧七人
NORSE SEVEN的成立是为了支持我们正在进行的使用预填充注射器输送ONS-5010/LyTENAVA的开发计划。这是一项为期三个月的研究,旨在比较瓶装眼用贝伐珠单抗与
7
美国
证券交易委员会
华盛顿特区20549
形式
根据1934年《证券交易所法》第13或15(d)条提交的年度报告 |
日终了的财政年度
或
根据1934年《证券交易所法》第13或15(d)条提交的过渡报告 |
从 到
委员会文件号:
(章程中规定的注册人的确切名称)
| ||
(成立或组织的州或其他司法管辖区) | (国税局雇主识别号) |
(主要行政办公室地址) | (Zip代码) |
(
(注册人的电话号码,包括地区代码)
根据该法第12(b)条登记的证券:
每个班级的标题 |
| 交易符号 |
| 注册的每个交易所的名称 |
根据该法案第12(g)条注册的证券:无
如果注册人是《证券法》第405条所定义的知名经验丰富的发行人,则通过勾选标记进行验证。是的 ☐
如果注册人无需根据该法案第13条或第15(d)条提交报告,则通过勾选标记进行验证。是的 ☐
通过勾选标记标明登记人是否(1)在过去12个月内(或在比登记人提交此类报告要求的更短的期限内)提交了1934年证券交易法第13条或第15(d)条要求提交的所有报告,以及(2)在过去90天内一直遵守此类提交要求。
通过勾选标记检查注册人是否已在过去12个月内(或在注册人被要求提交此类文件的较短期限内)以电子方式提交了根据S-t法规第405条(本章第232.405条)要求提交的所有交互数据文件。
通过勾选标记来确定注册人是大型加速申报人、加速申报人、非加速申报人、小型报告公司还是新兴增长公司
公司请参阅《交易法》第120亿.2条规则中“大型加速备案人”、“加速备案人”、“小型报告公司”和“新兴成长型公司”的定义。
大型加速文件夹 | ☐ | 加速编报公司 | ☐ |
☒ | 小型上市公司 | ||
新兴成长型公司 |
如果是新兴成长型公司,请通过勾选标记表明注册人是否选择不利用延长的过渡期来遵守根据《交易法》第13(a)条规定的任何新的或修订的财务会计准则。 ☐
用复选标记表示注册人是否已提交其管理层的报告和证明’S根据《萨班斯-奥克斯利法案》(《美国法典》第15编第7262(B)节)第404(B)条对其编制或出具审计报告的注册会计师事务所的财务报告内部控制有效性的评估。
如果证券是根据该法案第12(b)条登记的,请通过勾选标记表明文件中包含的登记人的财务报表是否反映了对先前发布的财务报表错误的更正。
通过勾选标记检查这些错误更正是否是需要对任何注册人收到的基于激励的补偿进行恢复分析的重述’在相关恢复期内的执行人员根据 §240.10D-1(b)。 ☐
通过勾选标记检查注册人是否是空壳公司(定义见《交易法》第120亿.2条)。是的
截至2024年3月31日(即注册人最近完成的第二财年的最后一个营业日),注册人的非关联公司持有的注册人普通股的总市值基于该股票在纳斯达克资本市场的收盘价,约为美元
截至2024年12月24日,登记人已逾期
通过引用并入的文献
本报告第三部分引用了公司最终委托书中的信息,该委托书将于2024年9月30日后120天内向美国证券交易委员会提交。
Outlook THERAPETICS,Inc.
表格10-K年度报告
目录
页面 | ||
ii | ||
iii | ||
1 | ||
1 | ||
27 | ||
83 | ||
83 | ||
84 | ||
84 | ||
85 | ||
86 | ||
86 | ||
86 | ||
87 | ||
101 | ||
102 | ||
129 | ||
129 | ||
129 | ||
131 | ||
131 | ||
131 | ||
132 | ||
132 | ||
132 | ||
133 | ||
133 | ||
136 |
在本报告中,除非另有说明或上下文另有要求,否则提及的“Outlook Treateutics”、“Outlook”、“Company”、“We”、“Us”、“Our”和类似的引用指的是Outlook Treateutics,Inc.(以前称为Oncobiologics,Inc.)。及其合并后的子公司。本报告中出现的Outlook徽标、Oncobiologics徽标、LYTENAVA和Outlook Treateutics,Inc.的其他商标或服务标志是Outlook Treateutics,Inc.的财产。本报告还包含其他公司的注册商标、商标和商号。本报告中出现的所有其他商标、注册商标和商号均为其各自所有者的财产。
本文中提供的瑞士法郎和美元之间的货币转换是根据2024年9月30日纽约联邦储备银行为海关目的认证的电汇外币在纽约市的中午买入价,或0.9015瑞士法郎=1美元。我们不代表瑞士法郎曾经、可能或可能以这样的汇率或任何其他汇率兑换成美元。
有关前瞻性陈述和行业数据的警示说明
本年度报告中的10-k表格包含符合1933年证券法第27A条(经修订)和1934年证券交易法第21E条(经修订)的前瞻性陈述。前瞻性陈述是基于我们管理层的信念和假设以及我们管理层目前掌握的信息。就这些规定而言,除历史事实陈述外的所有陈述均为“前瞻性陈述”,包括与未来事件或我们未来财务业绩和财务指引有关的陈述。在某些情况下,您可以通过“预期”、“相信”、“继续”、“估计”、“预期”、“打算”、“可能”、“可能”、“计划”、“项目”、“预测”、“潜在”、“应该”、“将”等术语来识别前瞻性陈述。这些声明只是预测。本年度报告中的10-k表格中包含的所有前瞻性陈述均基于我们在本报告发布之日获得的信息,我们不承担更新任何此类前瞻性陈述的义务。我们在本文中的任何或所有前瞻性陈述都可能被证明是错误的。实际事件或结果可能会有很大不同。我们的前瞻性陈述可能会受到我们可能做出的不准确假设或已知或未知风险、不确定性和其他因素的影响。我们在这份10-k表格年度报告中更详细地讨论了其中的许多风险、不确定因素和其他因素,在标题为“风险因素”的项目1A中。我们提醒投资者,我们的业务和财务业绩受到重大风险和不确定因素的影响。
这份Form 10-k年度报告还包含关于我们的行业、我们的业务和某些疾病的市场的估计、预测和其他信息,包括关于这些市场的估计规模以及某些疾病的发病率和流行率的数据。基于估计、预测、预测、市场研究或类似方法的信息本身就会受到不确定因素的影响,实际事件或情况可能与该信息中反映的事件和情况大不相同。除非另有明确说明,否则我们从报告、研究调查、研究和由市场研究公司和其他第三方准备的类似数据、行业、医疗和一般出版物、政府数据和类似来源获得这些行业、商业、市场和其他数据。
ii
影响我们业务的部分风险
投资我们的普通股涉及许多风险,包括“第一部分,第1A项”中所述的风险。在本10-K表格年度报告中,任何一项风险因素都可能对我们的业务、财务状况、经营结果和前景产生重大不利影响。除其他外,这些风险包括:
| ● | 自公司成立以来,我们的运营出现了重大亏损和负现金流,预计至少在未来12个月内,运营将继续出现重大亏损和负现金流; |
| ● | 我们从未从产品销售中获得任何收入,也可能永远不会盈利; |
| ● | 人们对我们作为一家持续经营的企业继续下去的能力有很大的怀疑。我们将需要筹集大量额外资金来完成ONS-5010/LYTENAVA的开发和商业化™(贝伐单抗在欧盟(“欧盟”)和英国(“英国”)以外的地区),并支持我们的运营,直到我们能够从欧盟和英国的销售中产生足够的收入。这笔额外的资金可能无法以可接受的条款获得,或者根本不能获得。如果不能在需要时获得必要的资本,可能会迫使我们推迟、限制或终止我们的产品开发努力或其他业务; |
| ● | 筹集额外资本,包括修改我们现有的可转换证券,可能会对我们的证券持有人造成稀释,限制我们的运营,或要求我们放弃对我们的技术或候选产品的权利; |
| ● | 我们高度依赖ONS-5010/LYTENAVA的成功,这是我们唯一在欧盟和英国获得批准的产品。如果ONS-5010/LYTENAVA没有获得欧盟和英国以外的监管部门的批准,或者没有成功商业化,我们的业务可能会受到损害; |
| ● | 我们可能需要与其他能够为候选产品的开发和商业化提供能力和资金的公司结成联盟。如果我们不能以有利的条件建立或维持这些联盟,我们的业务可能会受到损害; |
| ● | 由于我们有限的资源和获得资金的途径,我们已经并将继续需要优先开发某些候选产品,这些决定可能被证明是错误的,可能会损害我们的业务; |
| ● | 临床药物开发是一个漫长而昂贵的过程,我们可能会在临床试验中遇到重大延误,或者可能无法证明安全性和有效性,使相关监管机构满意; |
| ● | 如果对我们提起产品责任诉讼,我们可能会招致重大责任,并可能被要求限制我们当前或未来候选产品的商业化,而我们现有的保险覆盖范围可能不足以支付可能出现的任何责任; |
| ● | 药品的开发和商业化受到广泛的监管,我们可能不会在欧盟和英国以外的地区或在我们计划及时或根本不为其开发产品或任何未来候选产品的任何其他适应症上获得ONS-5010/LYTENAVA的监管批准; |
| ● | 我们计划或未来的临床试验的开始或完成的任何延迟,或终止或暂停,都可能导致我们的成本增加,延迟或限制我们创造收入的能力,并对我们的商业前景产生不利影响; |
| ● | 我们面临着激烈的竞争和快速的技术变革,我们的竞争对手可能会开发出与我们类似、更先进或更有效的疗法。其他产品可能在我们之前获得批准并成功商业化,这可能对我们的财务状况和我们成功将我们的候选产品商业化的能力产生不利影响; |
| ● | 我们目前没有营销和销售组织。如果我们无法在我们选择保留商业化权利的司法管辖区建立和维持销售和营销能力,我们可能无法产生任何收入,并将取决于我们的许可合作伙伴的努力(如果有的话); |
| ● | 我们依赖第三方来制造和测试ONS-5010/LYTENAVA,进行临床前和临床试验,并为我们执行其他任务。如果这些第三方未能成功履行其合同职责、在预期期限内完成或遵守监管要求,我们可能无法获得欧盟和英国以外的ONS-5010/LYTENAVA或任何其他 |
iii
| 我们的候选产品,或将ONS-5010/LYTENAVA或任何其他候选产品商业化,我们的业务可能会受到损害; |
| ● | 我们目前为临床试验服务聘请单一来源供应商,并为未来ONS-5010/LYTENAVA的药物物质制造、填充剂制造和产品测试聘请多来源供应商。失去这些供应商中的任何一个或任何未来的单一来源供应商,都可能损害我们的业务; |
| ● | 如果我们侵犯或被指控侵犯第三方的知识产权,我们的业务可能会受到损害。第三方对知识产权侵权的索赔可能会阻碍或推迟我们的开发和商业化努力; |
| ● | 我们可能会卷入保护或强制执行任何未来专利的诉讼,这可能是昂贵、耗时和不成功的; |
| ● | 如果我们无法获得和维护ONS-5010/LYTENAVA或我们的其他候选产品或任何未来候选产品的有效专利权,我们可能无法阻止竞争对手使用我们认为在ONS-5010/LYTENAVA或任何未来候选产品的开发和商业化中重要的技术,从而导致失去我们的专利本来可能为我们提供的任何潜在竞争优势; |
| ● | 如果我们无法维护ONS-5010/LYTENAVA或任何未来候选产品的有效专有权,我们可能无法在我们的市场上有效竞争; |
| ● | 如果我们未能履行我们在协议中的义务,我们根据这些协议从第三方许可知识产权和其他权利,或者我们与许可人的业务关系受到干扰,我们可能会失去对我们的业务非常重要的许可权; |
| ● | 不利的全球经济和政治环境可能会对我们的业务、财务状况或经营结果产生不利影响; |
| ● | 我们高度依赖我们主要高管和人员的服务,如果我们不能留住这些管理层成员或招聘更多的管理、临床和科学人员,我们的业务将受到影响; |
| ● | 在一起悬而未决的证券集体诉讼中,我们和我们的某些官员被列为被告。我们的一些高管和董事也被列为一起悬而未决的股东衍生诉讼的被告。这些诉讼,以及潜在的类似或相关诉讼,可能会导致重大损害赔偿,转移管理层的时间和注意力,并对我们的运营结果产生实质性的不利影响。这些诉讼,以及我们所受的任何其他诉讼,辩护或起诉的代价都将是高昂的,其结果也是不确定的; |
| ● | 如果我们的信息技术系统或数据或我们所依赖的第三方的信息技术系统或数据受到或曾经受到损害,我们可能会因此类损害而遭受不利后果,包括但不限于监管调查或行动;诉讼;罚款和处罚;我们的业务运营中断;声誉损害;收入或利润损失;客户或销售损失;以及其他可能对我们业务产生不利影响的不利后果; |
| ● | 我们证券的交易价格可能会波动,我们证券的购买者可能会遭受重大损失;和 |
| ● | GMS Ventures and Investments(GMS Ventures)实际拥有我们很大一部分普通股,有权指定我们的董事会成员,并能够对须经股东批准的事项施加重大控制,防止新投资者影响重大公司决策。 |
iv
第一部分
项目1.业务
概述
我们是一家生物制药公司,是第一家获得ONS-5010/LYTENAVA眼科配方营销授权的公司™(贝伐单抗),用于治疗湿性老年性黄斑变性,或湿性AMD,在欧盟、欧盟和英国。我们正在开发ONS-5010/LYTENAVA作为玻璃体内注射,用于治疗湿性AMD和其他视网膜疾病。我们还在努力获得批准,并在美国推出ONS-0510/LYTENAVA。我们最初的目标是直接在欧盟和英国推出,如果获得批准,将在美国作为第一个也是唯一一个被批准用于治疗视网膜疾病的眼用贝伐单抗,包括湿性老年性黄斑变性或湿性AMD。我们的计划还包括寻求批准,并在日本和其他市场推出该产品,如果获得批准,可以直接或通过战略合作伙伴。我们已与Cencora(前身为amerisourceBergen Corporation)达成合作协议,以支持ONS-5010/LYTENAVA在欧洲和美国的商业推出.
贝伐单抗是一种全长、人源化的抗血管内皮生长因子重组单抗,可抑制血管内皮生长因子及其相关的血管生成活性。2022年10月,我们向欧洲药品管理局(EMA)提交了ONS-5010/LYTENAVA的营销授权申请(MAA)。2024年5月27日,我们获得了欧盟委员会对治疗湿性AMD的ONS-5010/LYTENAVA的营销授权,该授权在整个欧洲经济区(EEA)有效。欧洲经济区的营销授权提供了8年的数据独占权和10年的市场独占权。2024年7月8日,我们还获得了英国药品和保健品监管机构(MHRA)的批准,用于治疗湿性AMD。此外,2024年12月4日,英国国家健康与护理卓越研究所(NICE)推荐LYTENAVA™(贝伐单抗伽玛)作为湿性AMD的治疗选择。我们预计将于2025年上半年在欧洲经济区和英国开始初步的商业推出。
另外,在2022年3月,我们向美国食品和药物协会或食品和药物管理局提交了一份关于ONS-5010/LYTENAVA™的BLA。2022年5月,我们自愿撤回了我们的BLA,以提供FDA要求的更多信息。我们于2022年8月30日向FDA重新提交了ONS-5010/LYTENAVA的BLA,并于2022年10月收到FDA的确认,即我们的BLA已被接受,目标日期为2023年8月29日,供FDA审查决定。2023年8月29日,我们收到了一封完整的回复信(CRL),FDA在信中得出结论,由于几个化学、制造和控制(CMC)问题、批准前制造检查的公开观察以及缺乏实质性证据,FDA在本审查周期内无法批准BLA。在随后与FDA的A类会议上,我们了解到FDA要求完成一项额外的充分和良好控制的临床试验,证明ONS-5010/LYTENAVA在治疗NAMD方面的有效性,以及CRL中显示的额外要求的CMC数据,以批准ONS-5010/LYTENAVA用于湿性AMD。
在与FDA讨论支持我们的ONS-5010/LYTENAVA的BLA后,我们同意进行另一项充分和良好控制的临床试验。2023年12月,我们向FDA提交了这项试验的特别方案评估(SPA)(挪威八项),寻求确认如果成功,它将满足FDA对第二次充分和良好控制的临床试验的要求,以支持我们计划重新提交ONS-5010/LYTENAVA BLA。2024年1月,我们收到了FDA根据SPA审查并同意挪威八国试验方案的确认,2024年9月,我们成功地完成了挪威八国试验的登记。根据与FDA在SPA中达成的协议,Norse Eight是一项随机、对照、平行分组、掩蔽、非劣势研究,约400名新诊断的湿性AMD受试者按1:1的比例随机接受1.25毫克ONS-5010/LYTENAVA或0.5毫克雷尼比珠单抗玻璃体内注射。受试者在第0天(随机化)、第4周和第8周接受注射,第12周进行最后一次随访。
2024年11月,我们报告说,ONS-5010/LYTENAVA在SPA中规定的第8周没有达到预先指定的非自卑终点。然而,试验的初步数据显示,ONS-5010/LYTENAVA的视力和生物活性有所改善,并继续保持良好的安全性。
1
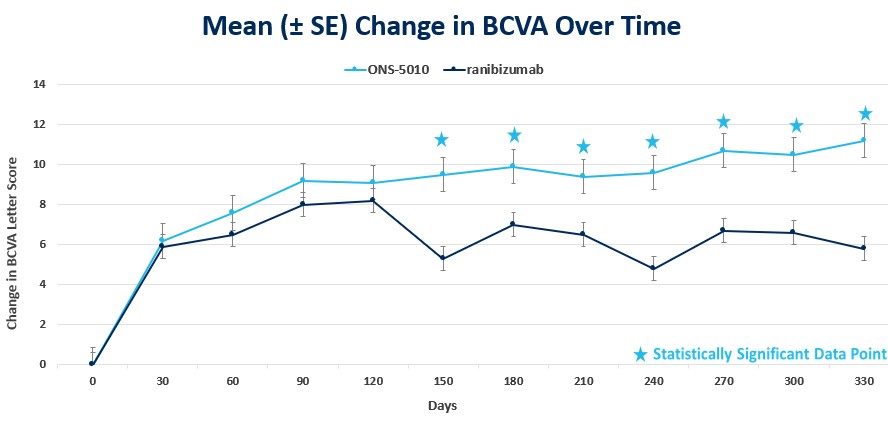
在北欧8个试验中,ONS5010/LYTENAVA和雷比珠单抗之间的平均值差异为-2.257个BCVA字母,95%可信区间为(-4.044,-0.470),而SPA中预先指定的非自卑边缘的下限为-3.5%可信区间为-3.5%。非劣性假设没有被满足(p>0.025)。在意向治疗的原始数据集中,挪威8人在ONS5010/LYTENAVA组中的BCVA平均改善了+4.2LYTENAVA,而在RANSbizumab组中的BCVA平均改善了+6.3LYTENAVA。
| 第8周BCVA的平均变化 | 不自卑 |
ONS-5010/LYTENAVA 1.25 mg | +4.2个字母 | 95%CI:(-4.044,-0.470) |
雷尼比珠单抗0.5 mg | +6.3个字母 |
在北欧8周的第8个时间点,ONS-5010/LYTENAVA总体耐受性良好,总体眼部不良事件发生率与雷尼比单抗相当。北欧8号试验的安全性结果与之前报道的北欧1号、北欧2号和北欧3号临床试验的安全性结果一致,两个研究分支中都没有视网膜脉管炎病例的报道。
对数据的分析正在进行中,正在收集来自北欧八国的第12周数据,预计将于2025年1月提供。在收到北欧8号的3个月全部疗效和安全性结果后,我们计划在2025年第一季度重新提交ONS-5010/LYTENAVA的BLA申请。以前,通过一次A类会议以及与FDA在一系列C类和D类会议中的其他互动,我们确定了解决CRL中CMC意见所需的方法,并相信我们已经解决了这些意见。如果ONS-5010/LYTENAVA的BLA获得批准,我们预计将在美国获得12年的监管排他性。
我们为湿性AMD患者提交的ONS-5010/LYTENAVA的BLA和MAA涉及三项临床试验,我们称之为北欧一号、北欧二号和北欧三号。我们评估ONS-5010/LYTENAVA作为贝伐单抗眼用配方的临床计划的研究设计在2018年4月与FDA的第二阶段会议结束时进行了审查,我们于2019年第一季度向FDA提交了我们的研究新药申请或IND。2020年8月,我们报告了临床经验研究Norse One的概念验证结果达到了预期的安全性和有效性。Norse 2是我们关键的3期临床试验,比较了ONS-5010/LYTENAVA和雷尼比珠单抗(Lucentis)。2021年8月来自Norse Two的TOPLINE结果显示,ONS-5010/LYTENAVA达到了疗效的主要和关键次要终点,并观察到了治疗患者的临床影响变化。挪威人在最佳矫正视力(BCVA)得分中获得至少15个字母的受试者比例的两个主要终点差异被满足,并且具有高度统计学意义和临床相关性。有关北欧两种语言的讨论,请参阅“我们的候选产品组合-眼科用ONS-5010/LYTENAVA-Bevacizumab-临床开发现状-斯堪的纳维亚二号“。在意向治疗(ITT)原始数据集中,接受ONS-5010/LYTENAVA治疗的患者获得至少15个字母的百分比为41.7%,使用雷尼比单抗治疗获得至少15个字母的患者的百分比为23.1%(p=0.0052)。主要终点在统计上也具有显著的统计学意义和临床相关性,在次级PER方案或PP数据集(p=0.04)中,百分比几乎相同,ONS-5010/LYTENAVA为41.0%,ranibizumab为24.7%。在主要的ITT数据集中,关键的次要终点,即从基线到11个月的BCVA评分变化,也具有很高的统计学意义和临床相关性(p=0.0035)。ONS-5010/LYTENAVA组BCVA评分平均变化11.2个字母,雷尼比珠单抗组平均变化5.8个字母。在次级PP数据集中,结果也有统计学意义(p=0.01),ONS-5010/LYTENAVA的平均变化为11.1个字母,而使用ranibizumab的平均变化为7.0个字母。此外,大多数ONS5010/LYTENAVA受试者在研究期间保持或获得了最佳矫正视力(定义为与基线的最佳矫正视力≥0的变化),至少有80%的受试者每月保持最佳矫正视力。其余两个挪威人的结果也是阳性的,其中56.5%(p=0.0016)的挪威人获得了≥10号视力,68.5%(p=0.0116)的人获得了≥5号视力。Norse Three是我们进行的一项开放标签安全研究,以确保向FDA提交初始ONS-5010/LYTENAVA BLA时有足够数量的安全暴露于ONS-5010/LYTENAVA。2021年3月,我们报道了来自北欧的结果
2
其中三人显示ONS-5010/LYTENAVA的安全性状况为阳性。北欧BLA注册计划也被用来支持我们在欧盟和英国成功提交MAA。
此外,在2021年11月,我们开始招募患者参加我们的挪威七号临床试验。这项研究比较了眼用贝伐单抗瓶装和预填充注射器的安全性,这些受试者被诊断为视网膜疾病,将受益于玻璃体内注射贝伐单抗的治疗,包括渗出性老年性黄斑变性,DME,或BRVO。受试者将接受为期三个月的治疗,接受ONS-5010/LYTENAVA瓶装研究的受试者的登记工作已经完成。
我们还从FDA获得了三个SPA的协议,为我们正在进行的ONS-5010/LYTENAVA第三阶段计划进行三个额外的注册临床试验。与FDA就这些SPA达成的协议包括挪威四项协议,一项评估ONS-5010/LYTENAVA治疗BRVO的注册临床试验,以及两项评估ONS-5010/LYTENAVA治疗DME的注册临床试验。启动这些研究的时间尚未确定,等待FDA对湿性AMD的初步批准。
由于美国没有批准的贝伐单抗产品用于治疗视网膜疾病,我们提交了一份标准的BLA,并且没有使用生物相似的药物开发途径,如果有批准的贝伐单抗药物用于靶向疾病的话。如果在美国获得批准,我们相信ONS-5010/LYTENAVA有潜力降低与非标签使用重新包装的贝伐单抗相关的风险。在美国,66.3%的视网膜医生表示,非标签重新包装的贝伐单抗是他们最常用的一线抗血管内皮生长因子药物(ASRS 2022成员调查在ASRS NY 2022上公布)。
我们的战略
我们的目标是将ONS-5010/LYTENAVA作为第一个也是唯一一个被批准在欧盟、英国、美国和其他市场用于眼科的贝伐单抗。我们计划直接在美国、直接或通过欧盟、英国和其他市场的战略合作伙伴做到这一点。为了实现这一目标,我们采取了精简的临床和监管战略,其主要内容包括:
| ● | 利用我们领导团队的眼科药物开发和商业化专业知识。我们的执行团队成员在开发和商业化治疗视网膜疾病方面拥有丰富的专业知识,例如湿性AMD、DME和BRVO。我们打算利用他们的集体经验来进一步开发ONS-5010/LYTENAVA并对其执行最佳商业战略,包括向ONS-5010/LYTENAVA授予商业权 给美国以外的战略合作伙伴。 |
| ● | 与监管机构合作,为ONS-5010/LYTENAVA的潜在批准制定明确的指导方针 在欧盟和英国以外。我们继续与监管机构密切合作,开发和进行临床试验,我们相信这些试验将适当地支持ONS-5010/LYTENAVA在欧盟和英国以外的批准。 |
| ● | 利用生物制药行业大型合作伙伴的专业知识,支持ONS-5010/LYTENAVA在欧盟和英国推出,如果产品在其他地区获得批准,还可以在这些国家以外的地区推出。我们已经签订了经销ONS-5010/LYTENAVA的战略商业化协议,旨在为我们提供大型生物制药公司的杠杆作用和能力。我们使用相同的方法来利用经验丰富的第三方生物制造商的专业知识来生产我们的药物物质和成品。 |
| ● | 降低和管理成本,以最大限度地减少额外投资,以完成我们的开发计划并计划潜在的商业发布。 我们已做出战略决策,将ONS-5010/LyTENAVA和其他候选产品的商业制造和未来临床试验供应制造外包。我们相信这将显着减少与我们的ONS-5010/LyTENAVA计划不直接相关的未来管理费用。 |
3
我们的管道
眼科用ONS-5010/LYTENAVA-Bevacizumab
我们有一种产品,ONS-5010/LYTENAVA,贝伐单抗的眼科配方,在欧盟和英国获得批准。2024年5月27日,欧盟委员会批准了ONS-5010/LYTENAVA的营销授权用于治疗湿性AMD。此授权在整个欧洲经济区内有效。2024年7月8日,MHRA也批准了营销授权适用于ONS-5010/LYTENAVA在英国用于治疗湿性AMD。 ONS-5010/LYTENAVA目前获准瓶装供应。然而,我们也计划寻求对目前的授权进行修改,以允许批准以预先填充的注射器供应该产品。
我们正在积极争取获得FDA的批准ONS-5010/LYTENAVA用于治疗湿性AMD,并预计在2025年第一个日历季度重新提交BLA。我们还计划开发 ONS-5010/LYTENAVA 用于治疗其他视网膜疾病,如DME和BRVO。我们继续持有两种传统生物相似产品的发达市场商业化权利,但目前没有进一步开发这些资产的计划。.
贝伐单抗是一种全长、人源化的抗血管内皮生长因子重组单抗,可抑制血管内皮生长因子及其相关的血管生成(新血管的生长)活性。对于湿性AMD,眼睛中会分泌异常高水平的血管内皮生长因子。血管内皮生长因子是一种促进新的异常血管生长的蛋白质。抗血管内皮生长因子注射疗法阻止了这种生长。自从抗血管内皮生长因子疗法问世以来,它已经成为全球视网膜社区的标准护理治疗选择。
市场机遇
老年性黄斑变性,或称AMD,是一种常见的眼病,也是50岁及以上人群失明的主要原因。湿性AMD是晚期AMD的一种形式,也被称为新生血管性AMD。在湿性AMD中,异常血管在视网膜下生长。这些血管会渗漏液体和血液,这可能会导致黄斑肿胀和损伤,导致视力丧失。对于湿性AMD,眼睛中会分泌异常高水平的血管内皮生长因子。血管内皮生长因子是一种促进新的异常血管生长的蛋白质。抗血管内皮生长因子注射疗法阻止了这种生长。自从抗血管内皮生长因子疗法问世以来,它已经成为全球视网膜社区的标准护理治疗选择。湿性黄斑变性是一种严重的世界性疾病,据估计,2020年仅在美国、欧洲国家和日本就有超过290名万患者被确诊(全球数据)。尽管贝伐单抗目前没有被FDA批准用于治疗湿性AMD,但在美国,大约66.3%的新患者是标签外重新包装的贝伐单抗(ASRS 2022成员调查在ASRS NY 2022上公布)。同样,在ONS-5010/LYTENAVA获得上市授权之前在欧盟和英国,在许多欧洲国家,贝伐单抗通常用于非标签治疗湿性AMD。欧洲国家之间存在差异,但在一些市场,据信高达80%的湿性AMD玻璃体腔内注射使用贝伐单抗。我们相信,ONS-5010/LYTENAVA有潜力降低与标签外重新包装贝伐单抗相关的风险,包括但不限于效力、安全性、无菌不良事件和注射器相关的变化不良事件.
DME是由一种称为糖尿病视网膜病变的糖尿病并发症引起的。糖尿病视网膜病变是最常见的糖尿病眼病,也是美国工作年龄人群不可逆转失明的主要原因。糖尿病视网膜病变通常影响双眼,由视网膜小血管持续受损引起。液体渗入视网膜可能会导致周围组织肿胀,包括黄斑。二甲基醚是糖尿病视网膜病变患者视力丧失的最常见原因。DME可发生在糖尿病视网膜病变的任何阶段,尽管它更有可能发生在疾病的后期。2020年,仅在美国、欧洲国家和日本就有大约860名万患者患有二甲基醚(GlobalData)。
在BRVO中,当输送血液和所需氧气和营养物质的静脉阻塞视网膜神经细胞时,就会发生视网膜静脉阻塞。视网膜主要静脉的阻塞称为视网膜中央静脉阻塞,而较小静脉的阻塞称为BRVO。根据美国眼科学会的数据,视网膜静脉阻塞是仅次于糖尿病视网膜病变的第二大常见视网膜血管疾病。据估计,2020年仅在美国、欧洲国家和日本就有30名万患者患有BRVO(三角测量
4
全球数据、市场范围和投资者预测(2020年))。
2020年,全球抗血管内皮生长因子疗法的年收入估计为131亿美元(亿)。2020年,美国约占这一市场的50%,欧洲约占25%(Global Data)。
临床发展现状
我们评估ONS-5010/LYTENAVA作为贝伐单抗眼用配方的第三阶段临床计划的研究设计在2018年4月第二阶段会议结束时向FDA进行了审查,我们于2019年第一季度向FDA提交了IND。我们的湿性AMD注册计划,即ONS-5010/LYTENAVA的初始适应症计划,包括三个临床试验,我们称之为北欧一、北欧二和北欧三。三项临床试验均已完成。我们报告了2020年8月临床经验研究Norse One的预期安全性和有效性以及TOPLINE的阳性概念验证结果。Norse 2是我们关键的3期临床试验,比较了ONS-5010/LYTENAVA和ranibizumab(Lucentis),该试验在2021年8月报告了具有高度统计学意义的TOPLINE结果。Norse Three是一项开放式标签安全研究,旨在确保向FDA提交ONS-5010/LYTENAVA BLA时有足够数量的安全暴露。在审查了我们的ONS-5010/LYTENAVA的BLA后,FDA发布了CRL,表明它不能在此审查周期内批准BLA,原因是几个CMC问题、批准前制造检查的公开意见以及缺乏实质性证据。我们已经同意进行另一项临床试验(挪威八项),以支持ONS-5010/LYTENAVA在美国用于治疗湿性AMD的批准。FDA同意我们的SPA使用挪威语8,我们在2024年9月成功地完成了试验。Norse Eight是一项随机、对照的非劣势临床试验,旨在评估玻璃体内注射ONS-5010/LYTENAVA与玻璃体内注射雷尼比单抗(Lucentis)治疗新生血管性老年性黄斑变性(NAMD)的安全性和有效性。2024年11月,我们向FDA报告了ONS-5010/LYTENAVA在第8周没有达到SPA中规定的预先指定的非劣势终点。然而,试验的初步数据显示,ONS-5010/LYTENAVA的视力和生物活性有所改善,并继续保持良好的安全性,如上文“概述”部分更详细地描述的那样。对数据的分析正在进行中,因为正在收集北欧八国的第三个月数据,预计将于2025年1月提供。在收到北欧8个月完整的3个月疗效和安全性结果后,我们计划在2025年第一季度重新提交ONS-5010/LYTENAVA的BLA申请(见“-概述”).
我们已经从fda获得了三个spa的协议,为我们正在进行的ons-5010第三阶段计划进行三个额外的注册临床试验。/LYTENAVA。与FDA就这些SPA达成的协议包括挪威四项协议,一项评估ONS-5010/LYTENAVA治疗BRVO的注册临床试验,以及两项评估ONS-5010/LYTENAVA治疗DME的注册临床试验。我们打算在FDA批准我们的BLA治疗湿性AMD后启动这些研究。
2021年11月,我们开始招募患者参加我们的斯堪的纳维亚七号临床试验。这项研究比较了眼用贝伐单抗瓶装和预填充注射器的安全性,这些受试者被诊断为视网膜疾病,将受益于玻璃体内注射贝伐单抗的治疗,包括渗出性老年性黄斑变性,DME,或BRVO。受试者将接受为期三个月的治疗,接受ONS-5010/LYTENAVA瓶装研究的受试者的登记工作已经完成。
5
北欧一号
Norse One被设计为一项随机、掩蔽的临床试验,以支持我们向FDA提交的ONS-5010/LYTENAVA治疗湿性AMD的BLA。在澳大利亚的9个地点,共有61名接受治疗的幼稚和以前接受过治疗的患者参加了这项研究,并随机分配到ONS-5010/LYTENAVA或ranibizumab的治疗组。这项研究的主要终点是每月服用ONS-5010/LYTENAVA的受试者在第330天获得15个BCVA字母的比例与使用Pier替代剂量方案服用雷尼比单抗的比例的差异,Pier替代服药方案为每月服用3剂,然后按季度服用。
2020年8月,我们报告了ONS-5010/LYTENAVA的积极概念验证背线结果,因为它达到了预期的安全性和有效性预期。在对研究开始时基线视力<67个字母(20/50或更低)的天真患者进行的分析中,ONS-5010/LYTENAVA组的4名患者中有2名(50%)和雷尼比珠单抗组的9名患者中的4名(44%)在第330天达到>15个字母。这一亚组是我们的关键临床试验ONS-5010/LYTENAVA(北欧二号)的相关患者群体。此外,在相关患者群体的关键次要终点中,ONS-5010/LYTENAVA患者的BCVA平均改善了8.3个字母.
北欧二号
Norse 2是一项掩蔽、随机、关键的3期临床试验,评估ONS-5010/LYTENAVA与雷尼比珠单抗治疗湿性AMD的疗效。在美国的39个临床试验地点共招募了227名主要治疗幼稚的患者。参加这项研究的患者被随机分配到ONS-5010/LYTENAVA或雷尼比珠单抗治疗11个月。这项研究的主要终点是每月服用ONS-5010/LYTENAVA的受试者在第330天获得15个BCVA字母的比例与使用PIER替代给药方案的雷尼比珠单抗的比例差异。我们在2021年8月报告了北欧二号的背线结果。
2021年8月来自Norse Two的TOPLINE结果表明,ONS-5010/LYTENAVA达到了疗效的主要和关键的次要终点,并观察到了治疗患者的临床影响变化。挪威人在BCVA评分中获得至少15个字母的受试者比例上的两个主要终点差异被满足,并且在统计学上具有高度显着性和临床相关性。在意向治疗的主要数据集中,接受ONS-5010/LYTENAVA治疗的患者获得至少15个字母的百分比为41.7%,使用雷比珠单抗治疗获得至少15个字母的患者的百分比为23.1%(p=0.0052)。主要终点在次级方案或PP数据集中也具有统计学意义和临床相关性(p=0.04),其中百分比几乎相同,ONS-5010/LYTENAVA为41.0%,ranibizumab为24.7%。在主要ITT数据集中,主要次要终点BCVA评分从基线到11个月的变化也具有高度统计学意义和临床相关性(p=0.0035)。ONS-5010/LYTENAVA组BCVA评分平均变化11.2个字母,雷尼比珠单抗组平均变化5.8个字母。在次级PP数据集中,结果也有统计学意义(p=0.01),ONS-5010/LYTENAVA的平均变化为11.1个字母,而使用ranibizumab的平均变化为7.0个字母。其余两个挪威人的结果也是阳性的,其中56.5%(p=0.0016)的挪威人获得了≥10视力,68.5%(p=0.0116)的人获得了≥5视力.
6


挪威三号
NORSE THREE是我们进行的一项开放标签安全性研究,旨在确保向FDA首次提交ONS-5010/LyTENAVA BLA时有足够数量的ONS-5010/LyTENAVA安全暴露。2021年3月,我们报告称,NORSE THREE的结果为ONS-5010/LyTENAVA提供了积极的安全性特征。
北欧七人
NORSE SEVEN的成立是为了支持我们正在进行的使用预填充注射器输送ONS-5010/LyTENAVA的开发计划。这是一项为期三个月的研究,旨在比较瓶装眼用贝伐珠单抗与
7
在被诊断为视网膜疾病的受试者中使用预先填充的注射器,该疾病将受益于玻璃体内注射贝伐单抗,包括渗出性AMD、DME或BRVO。预计共有120名患者参加这项研究,其中60名患者接受瓶装ONS-5010/LYTENAVA治疗,60名患者接受预装注射器包装的ONS治疗。受试者将接受为期三个月的治疗,接受ONS-5010/LYTENAVA瓶装研究的受试者的登记工作已经完成。如果成功,这项研究将支持在ONS-5010/LYTENAVA被批准用于湿性AMD后向FDA提交补充BLA。
北欧八
Norse Eight是一项对新生血管老年性黄斑变性受试者进行的随机、对照、平行组、掩蔽的非劣势研究,按1:1的比例随机接受1.25毫克ONS-5010/LYTENAVA或0.5毫克雷比珠单抗玻璃体内注射。主要终点是BCVA从基线到第8周的平均变化。受试者在第0天(随机)、第4周和第8周就诊时接受注射。2024年1月,我们收到FDA的确认,如果成功,这项研究将满足FDA的要求,即第二次充分和良好控制的临床试验,以支持重新提交ONS-5010/LYTENAVA BLA治疗湿性AMD。
共有400名患者参加了这项研究。我们于2024年9月成功完成登记,并于2024年11月报告称,ONS-5010/LYTENAVA在向FDA提交的SPA中规定的第8周未达到预先指定的非劣势终点。然而,试验的初步数据显示,视力和生物活性的存在有所改善,以及ONS-5010持续良好的安全性。在北欧八项试验中,ONS5010/LYTENAVA和雷尼比珠单抗之间的平均值差异为-2.257个BCVA字母,95%可信区间为(-4.044,-0.470),而SPA中预先指定的非自卑边缘的下限为-3.5%,可信区间为95%;不满足非自卑假设(p>0.025)。在意向治疗(ITT)主要数据集中,挪威8人在ONS-5010/LYTENAVA组的BCVA平均改善+4.2个字母,在RANibizumab组的BCVA改善+6.3个字母。对数据的分析正在进行中,因为正在收集北欧八国的第三个月数据,预计将于2025年1月提供。
商业化、销售化和营销化
我们的商业化战略是为视网膜社区提供安全、有效和负担得起的标签上的贝伐单抗,同时最大限度地增加收入和患者获得ONS-5010/LYTENAVA的机会。作为我们多年商业规划过程的一部分,我们与Cencora达成了一项战略合作协议,以支持ONS-5010/LYTENAVA在全球的商业推出。Cencora将在欧盟和英国提供全面的推出支持,包括药物警戒、监管事务、质量管理、市场准入支持、进口、第三方物流配送和现场解决方案。协作和综合方法旨在支持ONS-5010/LYTENAVA在欧盟和英国以及美国以外的其他地区的市场准入和有效分销。如果获得FDA的批准,我们目前打算自己在美国推出和销售ONS-5010/LYTENAVA。我们目前拥有ONS-5010/LYTENAVA的所有开发和商业化权利,并仅向我们在人民Republic of China或中国的合资企业授予许可权,以开拓更大的中国市场(见“-合作与许可协议-Synone-私募和中国合资企业”)。
ONS-5010/LYTENAVA的上市授权在欧洲经济区提供8年的数据独占和10年的市场独家。如果得到FDA的批准,我们相信ONS-5010/LYTENAVA 将有权在美国获得针对生物相似竞争的12年监管排他性。
多年来,抗血管内皮生长因子治疗一直是许多眼科疾病的标准治疗方法,包括湿性AMD、DME和BRVO。然而,尽管多个品牌的药物已被批准用于这些适应症(例如Lucentis、EYLEA、EYLEA HD、BEOVU、SUSVIMO和VABYSMO),但它们非常昂贵。最近批准的Lucentis和EYLEA的生物相似版本也很昂贵,尽管它们比参考药物有折扣。希望用更便宜的抗血管内皮生长因子药物治疗视网膜患者的医生,报销障碍最小,通常使用标签外的贝伐单抗。然而,由于在美国没有FDA批准的贝伐单抗眼科制剂,在ONS-5010/LYTENAVA获得营销授权之前,欧盟或英国也没有批准贝伐单抗的眼科制剂在欧盟和英国,医生已经使用了由复合药剂师提供的重新包装的贝伐单抗(阿瓦斯丁),该药不需要满足眼科标准
8
批准的产品所必需的用途。尽管临床医生广泛接受和使用贝伐单抗治疗湿性AMD、DME和BRVO等眼科疾病,但此前没有制造商寻求批准贝伐单抗治疗这些疾病。
据主要视网膜协会报道,由复方药店提供的重新包装的贝伐单抗不需要符合眼科药物标准,可能存在污染(包括注射器造成的硅油液滴污染)和效力不一致的已知风险,可能会产生严重后果。出于这些原因,视网膜社区和支付者对开发贝伐单抗的眼用配方表现出兴趣,这可能是复合药剂师重新包装的贝伐单抗的标签上的替代品。在2019年接受调查的152名美国和欧洲视网膜医生中,近84%的人表示他们对批准的贝伐单抗眼科配方感兴趣或高度感兴趣。
为了满足这种视网膜市场需求,我们正在开发ONS-5010/LYTENAVA,作为贝伐单抗在美国的眼科研究配方。ONS-5010/LYTENAVA已在欧盟和英国被批准用于治疗湿性AMD,并在治疗湿性AMD的各种抗血管内皮生长因子眼科药物中提供了一种可行的治疗选择,避免了从复方药店重新包装的贝伐单抗可能出现的安全性、无菌、有效性、可用性和注射器缺陷。如果在其他适应症中获得批准,ONS-5010/LYTENAVA也可能为治疗DME和BRVO提供一种可行的替代方案.
此外,我们预计ONS-5010/LYTENAVA将能够帮助缓解欧盟和英国视网膜疾病的高昂治疗成本,如果该产品在那里获得批准,也将在美国帮助缓解。在美国和全球,治疗湿性AMD、DME和BRVO等视网膜疾病的高昂成本可能会导致患者接受的治疗数量不足,甚至可能根本不接受治疗。我们相信,为患者提供一种负担得起的、FDA和欧盟委员会批准的、安全、有效和在适当指导下生产的选项是有价值的。我们针对ONS-5010/LYTENAVA的商业战略 包括提供标签上的贝伐单抗作为治疗视网膜疾病的一线选择。此外,我们正在与视网膜社区(患者、付款人和提供者)共同制定负责任的价格决定方法,以支持患者访问,保持医生选择,并加快治疗时间。我们致力于将患者置于我们所做工作的核心,以确保我们提供负担得起的选项,从而简化对合规患者支持服务的访问。
ONS-5010/LYTENAVA有可能成为欧盟和英国视网膜疾病护理的抗血管内皮生长因子基石,如果该产品在美国获得批准,也是如此。它还可能与未来的长效剂和辅助疗法协同作用,用于湿性AMD、DME和BRVO的高级治疗。ONS-5010/LYTENAVA 有可能帮助降低欧盟和英国整个医疗系统的视网膜疾病治疗总成本,如果该产品在美国获得批准并商业化的话。
协作和许可协议
我们在正常的业务过程中签订合作和许可协议。我们已经从Selexis SA或Selexis获得了某些技术的内部许可,我们使用这些技术来研究和开发我们的候选产品。对于使用Selexis技术开发的候选产品,我们与Selexis签订商业许可协议,赋予我们商业化、提交研究用新药或IND的权利,并与第三方就进一步开发和商业化此类生物相似候选产品达成合作安排。尽管我们不再致力于我们的生物相似开发计划,但我们在其他市场拥有这些生物相似候选产品(ONS-3010、ONS-1045和ONS-1050)的许可权。
合通-私募与中国合资企业
2020年5月,我们与Synone Ventures LLC或Synone签订了一项股票购买协议,根据该协议,我们于2020年6月以私募方式出售并发行了800,000股普通股,收购价为每股20美元,总收益为1,600万美元。关于订立购股协议,吾等与SynTone的中国联营公司订立合资协议,据此,吾等同意成立一家中国合资公司,由Syntone的中国联营公司拥有80%股权,而本公司则拥有20%股权。在中国合资企业于2021年4月成立后,我们与中国合资企业签订了免版税开发许可,
9
ONS-5010/LYTENAVA在包括香港、台湾和澳门在内的大中国市场商业化和生产。
吾等将二零二零年五月私募所得款项中约90万用于支付吾等对中国合营公司的初步出资,并承诺向中国合营公司额外出资最多约210美元万,将于许可协议预期的发展计划获批准后四年内或根据该四年期间内可能厘定的其他条款向中国合营公司作出额外出资。
塞莱克斯
2011年10月,Selexis授予我们不可转让的选择权,以根据Selexis技术获得永久、非独家的全球商业许可,以制造或已经制造由使用Selexis技术开发的用于临床测试和商业销售的细胞系生产的重组蛋白。我们在2013年4月行使了这一选择权,并与Selexis就ONS-1045(涵盖ONS-5010/LYTENAVA)以及我们的两种生物相似候选产品ONS-3010和ONS-1050(不再处于积极的临床开发中)签订了三项商业许可协议。我们向Selexis支付了每个商业许可的预付许可费,并同意为每个许可产品支付固定的里程碑付款。此外,我们需要按最终产品和国家/地区的最终产品和国家/地区支付个位数的特许权使用费,这是根据我们或我们的任何附属公司或分被许可人在特许权使用费期限内此类最终产品的全球净销售额计算的。在期限内的任何时候,我们有权通过向Selexis提供书面通知并向Selexis支付版税终止费来终止我们的版税支付义务。
商业许可协议
2013年4月11日,在行使了我们根据Selexis研究许可进入商业许可的选择权后,我们与Selexis就ONS-1045、ONS-3010和ONS-1050分别签订了商业许可协议。根据每个商业许可协议的条款,我们获得了Selexis Technology项下的非独家全球许可,可以使用根据研究许可开发的细胞系和相关材料,制造和商业化获得许可的产品和最终产品,并拥有有限的再许可权利。
我们被要求为每个商业许可向Selexis支付65,000瑞士法郎(约10美元万)的预付许可费,并同意为每个许可产品支付高达365,000瑞士法郎(约40美元万)的里程碑式付款。此外,我们需要按最终产品和国家/地区的最终产品和国家/地区支付个位数的特许权使用费,这是基于我们或我们的任何附属公司或分被许可人在特许权使用费期限内此类最终产品的全球净销售额。每个国家/地区的每个最终产品的使用费期限是从适用的最终产品在适用的国家/地区首次商业销售开始到指定的专利覆盖期满结束的期间。在期限内的任何时候,我们有权通过向Selexis发出书面通知并向Selexis支付1,750,000瑞士法郎(约合180美元万)的特许权使用费终止费来终止我们的特许权使用费支付义务。我们在2019年财政年度启动了ONS-5010/LYTENAVA的第三阶段临床计划,根据商业许可协议,我们于2019年11月向Selexis支付了65,000瑞士法郎(约合10万美元)的里程碑式付款。截至2024年9月30日,根据商业许可协议,我们已向Selexis支付了总计约40美元的万。
我们与Selexis的每一项商业协议都将在所有适用的Selexis专利权到期后全部失效。许可专利权由两个专利族组成。第一个专利系列与细胞转移方法有关,在美国、澳大利亚、加拿大、欧洲、日本和新加坡提交了申请。这一专利家族于2022年开始在全球范围内到期。第二个专利家族声称,物质的DNA成分有助于提高蛋白质生产活性。这一专利家族在美国、澳大利亚、加拿大、中国、欧洲、香港、以色列、印度、日本、韩国、俄罗斯、新加坡和南非都有申请。这一专利家族将于2025年在全球范围内开始到期。任何一方在另一方重大违约未治愈的情况下,或在另一方面临特定的破产、清盘或类似情况的情况下,均可终止相关协议。
如果Selexis技术侵犯了第三方知识产权,任何一方也可以在指定情况下终止相关协议。此外,我们有权在以下时间终止每项商业协议
10
为了我们的方便,任何时候都可以;但是,对于与ONS-3010和ONS-1045相关的协议,根据我们与Selexis和Liomont于2014年11月11日签订的备用协议签署的相应信函,此权利须征得Liomont实验室、S.A.de C.V.或Liomont(ONS-3010和ONS-1045在墨西哥的许可合作伙伴)的同意。备用协议允许Liomont在涉及我们的破产、资不抵债或类似情况的特定触发事件时,根据适用的墨西哥商业协议承担许可证。
制造业
我们正在与Fujifilm DiSynth BioTechnologies(富士)和Ajinomoto Bio-Pharma Services(AjiBio)合作,在当前良好的制造实践(CGMP)制造设施中提供产品制造。我们还签署了一项同类最佳预充式眼科注射器的供应协议,我们相信这将为临床医生提供易用性,并增加ONS-5010/LYTENAVA的安全性,因为目前未经批准的治疗已导致注射器故障和污染相关的问题。我们将根据需要筛选其他合同制造商,以满足我们的临床、商业和监管供应要求。有关我们货源和供应品供应的相关风险的讨论,请参阅“风险因素”。此前,我们在我们的内部设施中为我们的候选产品生产用于临床前和临床供应的原料药。如果我们目前的合同制造商无法在必要的数量或质量水平上生产我们的候选产品,我们的业务可能会受到损害,我们目前聘请单一来源供应商提供临床试验服务,并聘请多个来源供应商提供未来的药物物质制造、填充剂制造和ONS-5010/LYTENAVA的产品测试。失去这些供应商中的任何一个,或任何未来的单一来源供应商,都可能损害我们的业务。
竞争
药品研发领域的竞争是广泛的,在很大程度上取决于多种科学和技术因素。这些因素包括技术和产品获得专利和其他保护的能力,将技术发展商业化的能力,以及获得监管机构批准进行测试、制造和营销的能力。我们的竞争对手包括大型制药和专业生物技术公司,其中许多公司的财务、技术和营销资源远远超过我们,以及重新包装贝伐单抗以治疗视网膜疾病的复方药房。此外,许多生物技术公司已经与大型老牌公司建立了合作关系,以支持可能与我们竞争的产品的研究、开发和商业化,我们还可能在为ONS-5010/LYTENAVA寻找潜在战略合作伙伴的努力中与其他生物技术公司竞争。学术机构、政府机构和其他公共和私人研究组织也在开展研究活动,寻求专利保护,并可能自行或通过合资企业将产品商业化。我们知道竞争对手生产或正在开发的某些其他产品用于治疗我们为产品开发设定的目标健康状况。我们不能保证其他人的发展不会使我们的技术过时、缺乏竞争力或损害我们的发展战略,我们不能保证我们的技术能够跟上新的技术发展步伐,我们的技术能够取代我们目标治疗领域的现有产品和方法,或者我们能够为ONS-5010/LYTENAVA达成战略合作伙伴关系安排。上述因素可能会对我们的业务、前景、财务状况和经营结果产生重大不利影响。这些公司以及学术机构、政府机构和私人研究组织也在招聘和留住高素质的科学人员和顾问方面与我们竞争。
我们将遇到来自现有公司的竞争,这些公司在眼科疾病方面提供有竞争力的解决方案。这些有竞争力的公司可以开发出比我们正在开发的候选产品更好或更具市场接受度的产品。我们将不得不以更大的市场认知度和更多的财务、营销和其他资源与其他生物技术和制药公司竞争。
湿性AMD市场
AMD是一种通常影响老年人的医学状况,通常会导致视力丧失。AMD以“干”(非渗出性)和“湿”(渗出性)形式发生。湿性AMD是黄斑变性的高级形式,它涉及在视网膜后面的眼后形成异常和渗漏的血管,通过一个被称为
11
脉络膜新生血管。根据国家眼科研究所的数据,虽然湿性黄斑变性约占所有AMD病例的15%,但它导致了与AMD相关的严重视力丧失的90%。国家眼科研究所还估计,在美国40岁或40岁以上的成年人中,湿性老年性黄斑变性的流行率约为175名万患者。此外,北美每年新增确诊病例超过20万例。同样,据估计,湿性老年性黄斑变性在欧洲的流行率约为170名万患者。在全球范围内,由于人口老龄化,湿性AMD的发病率和流行率预计将在未来显著增加。
竞争格局
在美国,大约66.3%的新患者是标签外重新包装的贝伐单抗(ASRS 2022成员调查在ASRS NY 2022上公布)。在欧洲,非标签重新包装的贝伐单抗也通常用于治疗湿性AMD。目前FDA批准的治疗湿性AMD的市场领先者是血管内皮生长因子抑制剂,包括EYLEA、EYLEA HD、BEOVU、Lucentis、SUSVIMO和VABYSMO。最近,BYOOVIZ和CIMERLI获得批准并推出,这两种生物仿制药都是ranibizumab生物仿制药,以及一种afLibercept生物仿制药PAVBLU。2020年,抗血管内皮生长因子疗法在全球的年收入估计为131亿美元亿(全球数据、市场范围和投资者预测三角统计(2020年))。我们预计对ONS-5010/LYTENAVA进行战略性定价,使其成为生物仿制药和优质品牌产品的低成本替代品,同时高于标签外的化合物。最近批准的Lucentis和EYLEA的最初生物相似版本也很昂贵,尽管它们比参考药物有折扣。贝伐单抗、BYOOVIZ、CIMERLI、PAVBLU、EYLEA、EYLEA HD、BEOVU、Lucentis和VABYSMO都是通过玻璃体内直接注射到眼睛的。SUSVIMO是一种可植入的可再填充的端口输送系统,可在4-6个月内输送抗血管内皮生长因子,然后重新填充该设备。除了湿性AMD患者使用的其他治疗方法外,还有各种其他公司的产品候选产品处于1期、2期和3期临床试验或FDA审查中,用于治疗湿性AMD。目前处于第二阶段或第三阶段临床试验或FDA审查的计划包括但不限于:
| ● | 上海亨利厄斯生物科技有限公司和埃塞克斯生物科技有限公司正在开发的贝伐单抗(HLX04-O); |
| ● | 由Stada Arzneimittel AG和Xbrane Biophma AB开发的ranibizumab生物类似物; |
| ● | 由Bioeq/Formycon(FB-203)、Mylan(m-710)和Samsung/Biogen(SB-15)等公司开发的afLibercept生物仿制药; |
| ● | 小分子受体酪氨酸激酶抑制剂苹果酸苏尼替尼(GrayBug,GB-102);以及 |
| ● | 携带afLibercept编码序列的腺相关病毒(Adverum,ADVm-022)。 |
我们认为,由于医生熟悉使用非标签阿瓦斯丁,ONS-5010/LYTENAVA具有潜在的竞争优势。我们还相信,一种负担得起的、FDA和欧盟委员会批准的眼用贝伐单抗,安全、有效,并在适当的指导下生产,将获得强大的市场份额和患者获得治疗的机会。此外,我们通过利用我们之前的工作,开发了一种用于治疗癌症的阿瓦斯丁的生物里程碑药物候选产品,从而降低了我们临床计划中的风险。然而,来自其他临床项目的临床试验数据可能会对我们获得未来融资或业务合作、组合或与其他制药和生物技术公司进行交易的能力产生负面影响。
知识产权
我们的商业成功在一定程度上取决于我们避免侵犯第三方专有权的能力,我们获得和维护适用于我们的技术的专有保护的能力,以及防止其他人侵犯我们的专有权利的能力。我们寻求保护我们的专有技术,方法包括评估相关专利,建立防御立场,监控欧盟的反对意见和悬而未决的知识产权,根据美国法律框架准备诉讼战略,并就对我们业务重要的技术、发明和改进提交美国和国际专利申请。截至2024年9月30日,我们拥有三项美国专利、18项外国专利和两项从六项专利合作条约(PCT)申请中国有化的待定国际申请,这些申请涉及为我们传统的生物相似计划ONS-3010和ONS-5010/ONS-1045开发的配方、抗体纯化方法、抗体分离异构体的方法、使用方法、减少高分子量物种的方法、调节果糖物种以及有效确定抗体的氨基酸序列。我们的第一个PCT申请于2016年4月在澳大利亚、加拿大、中国、欧洲、香港、印度、日本、墨西哥和美国被国有化。如果获得批准,专利发放
12
这9项申请预计将于2034年到期,不作任何调整或延长。我们的第二个PCT申请于2017年7月在欧洲和美国被国有化。如果获得批准,这两项申请颁发的专利预计将于2036年到期,不会有任何调整或延期。我们的第三个PCT申请于2018年6月在澳大利亚、加拿大、中国、欧洲、印度、日本、墨西哥和美国被国有化。如果获得批准,这八项申请颁发的专利预计将在2036年到期,不会有任何调整或延期。我们的第四个PCT申请于2018年7月在澳大利亚、加拿大、中国、欧洲、印度、日本、墨西哥和美国被国有化。如果获得批准,这八项申请颁发的专利预计将在2037年到期,不会有任何调整或延期。我们的第五个百分比申请于2018年8月在澳大利亚、加拿大、中国、欧洲、印度、日本、墨西哥和美国被国有化。如果获得批准,这八项申请颁发的专利预计将在2037年到期,不会有任何调整或延期。我们的第六个PCT申请于2018年8月在澳大利亚、加拿大、中国、欧洲、印度、日本、墨西哥和美国被国有化。如果获得批准,这八项申请颁发的专利预计将在2037年到期,不会有任何调整或延期。我们还依靠商业秘密、技术诀窍和持续的技术创新来发展和保持我们的专有地位。
个别专利的期限取决于获得专利的国家的法律期限。在包括美国在内的大多数国家,专利期一般为自在适用国家提交非临时专利申请的最早日期起20年。在美国,在某些情况下,专利期限可以通过专利期限调整来延长,这是对专利权人因美国专利商标局在审查和授予专利方面的行政拖延而进行的补偿,或者如果一项专利因共同拥有的专利或命名为共同发明人的专利而被最终放弃并具有较早的到期日,则专利期限可以缩短。
监管
政府管制与产品审批
FDA和联邦、州和地方各级以及国外的其他监管机构对我们正在开发的生物制品的研究、开发、测试、制造、质量控制、进出口、安全、有效性、标签、包装、储存、分销、记录保存、批准、广告、促销、营销、批准后监控和批准后报告等方面进行了广泛的监管。我们与第三方承包商一起,将被要求满足我们希望进行研究或寻求批准或许可我们候选产品的国家/地区监管机构的各种临床前、临床和商业批准要求。
FDA在生物产品候选产品可以在美国上市之前所需的程序通常包括以下几个方面:
| ● | 根据FDA现行的良好实验室操作规范(GLP)完成临床前实验室测试和动物研究; |
| ● | 向FDA提交IND,它必须在临床试验开始之前生效,并且必须每年更新或在发生重大变化时更新; |
| ● | 在试验开始前,每个临床地点的独立机构审查委员会或伦理委员会的批准; |
| ● | 进行充分和良好控制的人体临床试验,以确定拟议的候选生物产品的安全性、纯度和效力,以达到其预期目的; |
| ● | 在所有关键临床试验完成后,准备并向FDA提交BLA; |
| ● | FDA在收到BLA后60天内决定提交复审申请; |
| ● | 令人满意地完成FDA咨询委员会的审查(如果适用); |
13
| ● | 令人满意地完成FDA对生产建议产品的一个或多个制造设施的批准前检查,以评估对cGMP的遵从性,并确保设施、方法和控制足以保持生物制品的持续安全性、纯度和效力,以及选定的临床研究地点,以评估对良好临床实践或GCP的遵从性;以及 |
| ● | FDA审查和批准BLA,以允许在美国使用的特定适应症的产品的商业营销。 |
临床前和临床发展
在美国开始第一个候选产品的临床试验之前,我们必须向FDA提交IND。IND是FDA授权对人类进行研究的新药产品的请求。IND提交的中心焦点是临床研究的总体研究计划和方案(S)。IND还包括评估该产品的毒理学、药代动力学、药理学和药效学特征的动物和体外研究结果;化学、制造和控制信息;以及任何可用人类数据或文献来支持研究产品的使用。IND必须在人体临床试验开始前生效。IND在FDA收到后30天自动生效,除非FDA在30天内对拟议的临床试验提出安全担忧或问题。在这种情况下,IND可能会被临床搁置,IND赞助商和FDA必须在临床试验开始之前解决任何悬而未决的问题或问题。因此,提交IND可能会导致FDA授权开始临床试验,也可能不会。
临床试验涉及根据GCP在合格研究人员的监督下向人类受试者服用研究产品,其中包括要求所有研究受试者就其参与任何临床研究提供知情同意。临床试验是在详细说明研究目标、用于监测安全性的参数和将要评估的有效性标准的方案下进行的。在产品开发期间进行的每个后续临床试验和后续的任何方案修改都必须单独提交给现有的IND。此外,建议进行临床试验的每个地点的独立IRB必须在该地点开始临床试验之前审查和批准任何临床试验的计划及其知情同意书,并必须监督研究直到完成。监管当局、IRB或赞助商可随时以各种理由暂停临床试验,包括发现受试者面临不可接受的健康风险,或试验不太可能达到其所述的目标。一些研究还包括由临床研究赞助商组织的一个独立的合格专家小组的监督,该小组被称为数据安全监测委员会,该委员会根据对研究的某些数据的访问,授权研究是否可以在指定的检查点进行,如果确定对受试者存在不可接受的安全风险或其他理由,如没有显示疗效,可能会停止临床试验。还有关于向公共注册机构报告正在进行的临床研究和临床研究结果的要求。
出于BLA批准的目的,人体临床试验通常分三个可能重叠的连续阶段进行。
| ● | 阶段1-研究产品最初引入健康的人体受试者或患有目标疾病或状况的患者。这些研究旨在测试研究产品在人体内的安全性、剂量耐受性、吸收、新陈代谢和分布,以及与增加剂量相关的副作用,并在可能的情况下获得有效性的早期证据。 |
| ● | 第二阶段-研究产品用于特定疾病或状况的有限患者群体,以评估初步疗效、最佳剂量和剂量计划,并确定可能的不良副作用和安全风险。在开始更大规模和更昂贵的3期临床试验之前,可以进行多个2期临床试验以获得信息。 |
| ● | 第三阶段-研究产品用于扩大的患者群体,以进一步评估剂量,提供临床疗效的统计上有意义的证据,并进一步测试安全性,通常在多个地理分散的临床试验地点进行。这些临床试验旨在确定研究产品的总体风险/收益比率,并为产品批准提供充分的基础。 |
14
在某些情况下,FDA可能会要求,或者公司可能会自愿在产品获得批准后进行额外的临床试验,以获得有关该产品的更多信息。这些所谓的第四阶段研究可能是批准《法案》的一个条件。在临床试验的同时,公司可以完成额外的动物研究,开发关于候选产品生物学特征的额外信息,并必须根据cGMP要求最终确定商业批量生产产品的过程。制造过程必须能够持续地生产高质量的候选产品批次,尤其是必须开发方法来测试最终产品的特性、强度、质量和纯度,或者对于生物制品,必须开发安全、纯度和效力的测试方法。此外,必须选择和测试适当的包装,并进行稳定性研究,以证明候选产品在保质期内不会发生不可接受的变质。
BLA提交和审查
假设根据所有适用的法规要求成功完成所有要求的测试,则产品开发、非临床研究和临床试验的结果将作为BLA的一部分提交给FDA,请求批准将该产品用于一个或多个适应症的市场。BLA必须包括从相关的临床前和临床研究中获得的所有相关数据,包括否定或模糊的结果以及积极的发现,以及与产品的化学、制造、控制和建议的标签等相关的详细信息。提交BLA需要向FDA支付一笔可观的申请使用费,除非适用于豁免或豁免。
一旦提交了BLA,FDA的目标是在接受提交申请后10个月内审查标准申请,或者如果申请符合优先审查资格,则在FDA接受提交申请后6个月内审查标准申请。在标准审查和优先审查中,FDA要求提供更多信息或澄清的要求往往大大延长了审查过程。FDA审查BLA以确定产品是否安全、纯净和有效,以及其制造、加工、包装或持有的设施是否符合旨在确保产品持续安全、纯度和效力的标准。FDA可能会召集一个咨询委员会,就申请审查问题提供临床见解。在批准BLA之前,FDA通常会检查生产产品的一个或多个设施。FDA将不会批准申请,除非它确定制造工艺和设施符合cGMP要求,并足以确保产品在所要求的规格下一致生产。此外,在批准BLA之前,FDA通常会检查一个或多个临床地点,以确保符合GCP。如果FDA确定申请、制造工艺或制造设施不可接受,它将在提交的文件中列出不足之处,并经常要求进行额外的测试或提供信息。尽管提交了任何要求的补充信息,FDA最终可能会决定该申请不符合批准的监管标准。
在FDA评估了BLA并对将生产研究产品和/或其药物的制造设施进行检查后,FDA可能会签发批准信或CRL。批准函授权该产品的商业营销,并提供特定适应症的具体处方信息。CRL将描述FDA在BLA中发现的所有缺陷,但FDA确定支持申请的数据不足以支持批准的情况下,FDA可以在不首先进行必要的检查、测试提交的产品批次和/或审查拟议标签的情况下发布CRL。在发布CRL时,FDA可以建议申请人可能采取的行动,以使BLA处于批准的条件下,包括要求提供更多信息或澄清。如果不符合适用的监管标准,FDA可以推迟或拒绝批准BLA,要求额外的测试或信息和/或要求上市后测试和监督以监测产品的安全性或有效性。
如果一种产品获得监管部门的批准,这种批准将被授予特定的适应症,并可能导致对该产品可能上市的指定用途的限制。例如,FDA可能会批准BLA和风险评估和缓解战略,或REMS,以确保产品的好处大于其风险。REMS是一种安全策略,用于管理与产品相关的已知或潜在严重风险,并通过管理此类药物的安全使用使患者能够继续获得这些药物,可能包括药物指南、医生沟通计划或确保安全使用的要素,如受限分配方法、患者登记和其他风险最小化工具。FDA还可能以改变拟议的标签或制定适当的控制和规范等为条件进行批准。一旦获得批准,如果没有保持对上市前和上市后要求的遵从性,或者如果产品达到
15
市场。FDA可能要求一个或多个第4阶段上市后试验和监测,以进一步评估和监测产品在商业化后的安全性和有效性,并可能根据这些上市后研究的结果限制产品的进一步销售。
审批后要求
我们根据FDA批准制造或分销的任何产品都受到FDA普遍和持续的监管,其中包括与记录保存、不良事件报告、定期报告、产品抽样和分销以及产品广告和促销相关的要求。在批准后,对批准的产品的大多数更改,如增加新的适应症或其他标签声明,都要经过FDA的事先审查和批准。还有持续的用户费用要求,根据这一要求,FDA评估批准的BLA中确定的每种产品的年度计划费用。生物制造商及其分包商必须向FDA和某些州机构注册他们的机构,并接受FDA和某些州机构的定期突击检查,以了解cGMP的合规性,这对我们和我们的第三方制造商施加了某些程序和文件要求。对制造工艺的更改受到严格的监管,根据更改的重要性,可能需要FDA事先批准才能实施。FDA的规定还要求调查和纠正任何偏离cGMP的情况,并对我们和我们可能决定使用的任何第三方制造商提出报告要求。因此,制造商必须继续在生产和质量控制领域花费时间、金钱和精力,以保持遵守cGMP和其他方面的法规遵从性。
如果没有遵守监管要求和标准,或者如果产品上市后出现问题,FDA可能会撤回批准。除其他外,其他潜在后果包括:
| ● | 限制产品的销售或制造、从市场上完全撤出该产品或召回该产品; |
| ● | 对批准后的临床研究处以罚款、警告信或搁置; |
| ● | FDA拒绝批准待批准的申请或对已批准申请的补充,或暂停或撤销现有的产品批准; |
| ● | 产品被扣押或扣留,或FDA拒绝允许产品进出口;或 |
| ● | 禁制令或施加民事或刑事处罚。 |
FDA严格监管生物制品的营销、标签、广告和促销。一家公司只能根据FDA批准的标签的规定,提出与安全性和有效性、纯度和效力有关的声明。FDA和其他机构积极执行禁止推广非标签用途的法律法规。不遵守这些要求可能会导致负面宣传、警告信、改正广告以及潜在的民事和刑事处罚。医生可能会为合法获得的产品开具处方,用于产品标签中未描述的用途,以及与我们测试和FDA批准的用途不同的用途。这种标签外的使用在医学专科中很常见。医生可能会认为,在不同的情况下,这种非标签使用是许多患者的最佳治疗方法。FDA不规范医生在选择治疗时的行为。然而,FDA确实限制了制造商在产品标签外使用问题上的沟通。
16
生物仿制药与参考产品排他性
2010年签署成为法律的《患者保护和平价医疗法案》,或统称为《平价医疗法案》的《平价医疗法案》,包括一个副标题《2009年生物制品价格竞争和创新法案》,或BPCIA,它为与FDA批准的参考生物制品生物相似或可互换的生物制品创建了一个简短的审批途径。到目前为止,一些生物仿制药已根据BPCIA获得许可,许多生物仿制药已在欧洲获得批准。FDA已经发布了几份指导文件,概述了审查和批准生物仿制药的方法。
生物相似性是指生物制品和参比制品在安全性、纯度和效力方面没有临床上有意义的差异,这可以通过分析研究、动物研究和临床研究来证明。互换性要求产品与参考产品生物相似,并且该产品必须证明在任何给定的患者中,它可以预期产生与参考产品相同的临床结果,对于多次给药的产品,在先前给药后,生物和参考生物可以交替或交换,而不会增加安全风险或相对于独家使用参考生物而降低疗效的风险。与生物制品更大且往往更复杂的结构相关的复杂性,以及制造此类产品的工艺,对FDA仍在制定的简化审批途径的实施构成了重大障碍。
根据BPCIA,生物相似产品的申请必须在参考产品首次获得FDA许可的四年后才能提交给FDA。此外,FDA对生物相似产品的批准可能要到参考产品首次获得许可之日起12年后才能生效。在这12年的独占期内,如果FDA批准竞争产品的完整BLA,包含申请人自己的临床前数据和来自充分和良好控制的临床试验的数据,以证明其产品的安全性、纯度和有效性,另一家公司仍可能销售该参考产品的竞争版本。BPCIA还为被批准为可互换产品的生物仿制药设立了某些排他性期限。
其他美国医保法和合规性要求
尽管我们目前在市场上没有任何产品,但我们目前和未来与医疗保健专业人员、主要调查人员、顾问、客户和第三方付款人的安排使我们面临联邦政府以及我们开展业务的州和外国政府广泛适用的医疗法规和执法。这些法律包括但不限于州和联邦反回扣、欺诈和滥用、虚假声明、隐私和安全以及医生阳光法律法规。
除其他事项外,联邦反回扣法规禁止任何个人或实体在知情的情况下故意以现金或实物直接或间接提供、索取、接受或提供报酬,以诱导或奖励个人推荐某一物品或服务,或购买、推荐或订购商品或服务,为此可根据联邦医疗保险和医疗补助计划等联邦医疗保健计划支付。联邦反回扣法规可能会有不同的解释。过去,政府曾执行联邦反回扣法规,以与医疗保健公司达成大规模和解,在某些情况下,是基于与医生的虚假咨询和其他财务安排。此外,经《卫生保健和教育和解法》修订的《患者保护和平价医疗法》,或统称为《平价医疗法案》,除其他外,修改了联邦《反回扣条例》和规范医疗欺诈的刑事法规的意图要求。个人或实体不再需要实际了解这些法规或违反这些法规的具体意图即可实施违规。此外,《平价医疗法案》规定,根据《民事虚假申报法》或联邦民事罚金法规的规定,政府可以断言,包括因违反联邦《反回扣条例》而产生的物品或服务的索赔构成虚假或欺诈性索赔。
此外,联邦虚假索赔和民事罚款法律,包括民事虚假索赔法案,除其他事项外,禁止故意或导致向美国政府提交虚假、虚构或欺诈性的付款索赔,或通过虚假陈述来避免、减少或隐瞒向联邦政府付款的义务。根据《民事虚假申报法》提起的诉讼可由总检察长提起,也可由个人以政府名义提起拟诉讼。联邦政府使用了民事虚假申报法,
17
在对全国各地的制药和生物技术公司进行调查和起诉时,例如,在宣传产品用于未经批准的用途和其他非法销售和营销做法方面,它还面临着重大责任的威胁。
1996年的联邦健康保险携带和责任法案,或HIPAA,制定了额外的联邦刑法,禁止明知和故意执行或试图执行诈骗任何医疗福利计划的计划,包括私人第三方付款人,明知和故意挪用或窃取医疗福利计划,故意阻碍对医疗保健违法行为的刑事调查,以及明知和故意伪造、隐瞒或掩盖重大事实,或作出任何与提供或支付医疗福利、项目或服务有关的重大虚假、虚构或欺诈性陈述。
HIPAA经《经济和临床健康信息技术法案》(HITECH)及其实施条例修订后,对承保实体或某些医疗服务提供者、健康计划和医疗信息交换所、向涉及个人可识别健康信息的服务的业务伙伴及其使用、披露或以其他方式处理个人可识别健康信息的分包商施加了有关个人可识别健康信息的隐私和安全要求,包括强制性合同条款。HITECH还增加了可能对覆盖的实体和商业伙伴施加的民事和刑事处罚,并赋予州总检察长新的权力,可以向联邦法院提起民事诉讼,要求损害赔偿或执行HIPAA的禁令。
此外,最近出现了一种趋势,即联邦和州政府加强了对支付给医生和其他医疗保健提供者的费用的监管。除其他事项外,《负担得起的医疗费用法案》通过《医生支付阳光法案》对某些药品、设备、生物制品和医疗用品制造商提出了年度报告要求,这些药品、设备、生物制品和医疗用品可以根据联邦医疗保险、医疗补助或儿童健康保险计划付款,但具体的例外情况是,这些制造商向医生(定义包括医生、牙医、视光师、足科医生和脊椎按摩师)、某些其他医疗保健提供者(如医生助理和护士从业者)和教学医院付款,以及医生及其直系亲属持有的所有权和投资权益。
某些州还对药品制造商的营销行为施加限制,并/或要求跟踪和报告向医生支付的礼物、补偿和其他报酬。某些州和地方政府要求药品销售代表注册。此外,类似的州和外国法律法规,如州反回扣和虚假索赔法,可能适用于涉及由非政府第三方付款人(包括私人保险公司)报销的医疗项目或服务的销售或营销安排和索赔。州法律也可能适用,要求制药公司遵守制药行业的自愿合规指南和联邦政府颁布的相关合规指南,或以其他方式限制可能向医疗保健提供者或其他潜在转介来源支付的款项。此外,某些州要求药品制造商报告与向医生和其他医疗保健提供者支付和其他价值转移或营销支出或药品定价有关的信息。此外,州和地方法律可能要求药品销售代表注册。在某些情况下,我们还可能受到管理健康信息隐私和安全的州和外国法律的约束,其中许多法律在很大程度上彼此不同,而且往往不会被HIPAA抢占,从而使合规工作复杂化。
不断变化的商业合规环境,以及需要建立和维护强大的系统来遵守多个司法管辖区的不同合规和/或报告要求,增加了医疗保健公司违反其中一项或多项要求的可能性。如果我们的业务被发现违反了适用于我们的任何此类法律或任何其他政府法规,我们可能会受到重大处罚,包括但不限于民事、刑事和行政处罚、损害赔偿、罚款、交还、额外的报告要求和监督,如果我们受到公司诚信协议或类似协议的约束,以解决有关违反这些法律的指控、削减或重组我们的业务、被排除在联邦和州医疗保健计划之外以及个人监禁,任何这些都可能对我们的业务运营能力和我们的财务业绩产生不利影响。
18
医疗改革
在美国和一些外国司法管辖区,我们预计将继续进行几项立法和监管改革,并提议对医疗体系进行改革,以控制成本、提高质量和扩大医疗服务的可及性。例如,2010年3月,总裁·奥巴马签署了《平价医疗法案》,其中包括扩大未参保者的覆盖范围,同时控制总体医疗成本,扩大和增加医疗补助计划覆盖的药品的行业回扣,并对联邦医疗保险处方药福利下的覆盖要求进行了修改。
《平价医疗法案》的某些方面受到了司法、国会和行政部门的挑战,我们预计未来还会对《平价医疗法案》提出更多挑战和修正案。例如,2021年6月17日,美国最高法院驳回了一项基于程序理由的挑战,该挑战辩称,《平价医疗法案》整体违宪,因为“个人授权”已被国会废除。此外,拜登政府的一些医疗改革举措也对《平价医疗法案》产生了影响。例如,2022年8月16日,总裁·拜登签署了2022年通胀削减法案,将个人在平价医疗法案市场购买医疗保险的增强补贴延长至2025年计划年。从2025年开始,爱尔兰共和军还通过新建立的制造商折扣计划,显著降低受益人的最大自付成本,从而消除了联邦医疗保险D部分计划下的“甜甜圈漏洞”。《平价医疗法案》有可能在未来受到司法或国会的挑战。因此,我们继续评估《平价医疗法案》对我们业务的影响。
自《平价医疗法案》颁布以来,美国还提出并通过了其他立法修改。例如,2011年的《预算控制法案》导致每个财政年度向医疗保险提供者支付的医疗保险金额自动减少高达2%。这些削减于2013年4月生效,由于随后的立法修正案,除非国会采取额外行动,否则这些削减将一直有效到2032年。2013年1月,总裁·奥巴马签署了2012年美国纳税人救济法,其中包括进一步减少对几家医疗服务提供者的医疗保险支付。此外,2021年3月11日,总裁·拜登签署了2021年美国救援计划法案,从2024年1月1日起,取消了针对单一来源和创新多来源药物的法定医疗补助药品退税上限,该上限以前设定为药品平均制造商价格的100%。
此外,政府最近对药品制造商为其上市产品定价的方式进行了更严格的审查,导致国会进行了几次调查,并提出并颁布了联邦和州立法,旨在提高产品定价的透明度,审查定价与制造商患者计划之间的关系,以及改革政府对药品的计划报销方法。2021年7月,拜登政府发布了一项行政命令,名为“促进美国经济中的竞争”,其中有多项针对处方药的条款。为了回应拜登的行政命令,2021年9月9日,卫生与公众服务部(HHS)发布了一份应对高药价的综合计划,其中概述了药品定价改革的原则,并列出了国会可以采取的各种潜在立法政策,以及HHS可以采取的潜在行政行动来推进这些原则。此外,爱尔兰共和军除其他事项外,(I)指示HHS就联邦医疗保险覆盖的某些高支出、单一来源的药物和生物制品的价格进行谈判,并通过提供不等于或低于根据法律谈判的“最高公平价格”的价格,对药品制造商处以民事罚款和潜在的消费税,以及(Ii)根据联邦医疗保险b部分和联邦医疗保险D部分实施回扣,以惩罚超过通胀的价格上涨。爱尔兰共和军允许卫生和公众服务部在最初几年通过指导而不是监管来实施其中许多规定。这些规定于2023财年开始逐步生效。2024年8月15日,HHS宣布了接受价格谈判的前十种药物的商定补偿价格,尽管联邦医疗保险药物价格谈判计划目前受到法律挑战。卫生和公众服务部将在2025年选择最多15种D部分涵盖的额外药物进行谈判。此外,为了回应拜登政府2022年10月的行政命令,HHS于2023年2月14日发布了一份报告,概述了由医疗保险和医疗补助服务创新中心测试的三种新模型,这些模型将根据它们降低药品成本、促进可获得性和提高医疗质量的能力进行评估。目前还不清楚这些模型是否会在未来的任何医疗改革措施中使用。此外,2023年12月7日,拜登政府宣布了一项倡议,通过使用《贝赫-多尔法案》下的进入权来控制处方药的价格。2023年12月8日,美国国家标准与技术研究院公布了一份考虑3月-
19
在权利中,它第一次将产品的价格作为一个因素,机构可以在决定行使进行权时使用。虽然以前没有行使过游行权利,但在新的框架下,这种权利是否会继续下去还不确定。在接下来的几年里,可能会对政府的健康计划进行更多的立法和监管改革,这可能会对制药公司和我们候选产品的成功产生重大影响。在州一级,立法机构越来越多地通过立法和实施旨在控制药品和生物制品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入的限制、营销成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家进口和批量购买。我们无法预测未来可能会采取什么医疗改革举措,特别是在美国总统和国会选举的情况下。根据《平价医疗法案》、爱尔兰共和军,以及其他联邦、州和外国医疗改革措施,这些措施已经采取,未来也可能采取,可能会损害我们未来的收入。
国际规则
除了美国的法规外,外国的法规还管理着他们管辖范围内的临床试验、商业销售和候选产品的分销。监管批准程序因国家而异,批准的时间可能比FDA批准所需的时间长或短。
欧盟的临床试验
与美国类似,欧盟的非临床和临床研究的各个阶段都受到重要的监管控制。在欧盟,临床试验受2022年1月31日生效的临床试验条例(EU)第536/2014号(CTR)管辖,该条例废除并取代了以前的临床试验指令2001/20(CTD)。
CTR旨在协调和简化临床试验授权,简化不良事件报告程序,改善对临床试验的监督,并增加透明度。具体地说,该条例直接适用于所有欧盟成员国,通过单一入口点、“欧盟门户网站”、临床试验信息系统或CTIS引入了简化的申请程序;为申请准备和提交的单一文件集;以及为临床试验赞助商简化的报告程序。已经采用了评估临床试验申请的统一程序,该程序分为两个部分。第一部分评估由试验赞助商选择的参考成员国的主管当局领导,涉及被认为在欧盟成员国之间科学协调的临床试验方面。然后,该评估报告将提交给所有有关成员国的主管当局,供其审查。第二部分由每个有关欧盟成员国的主管当局和道德委员会分别进行评估。个别欧盟成员国保留授权在其领土上进行临床试验的权力。
正在进行的临床试验将在多大程度上受到CTR的管理,这将取决于个别临床试验的持续时间。对于在2023年1月31日之前根据CTD提出批准申请的临床试验,CTD将继续以过渡性方式申请,直至2025年1月31日。到那时,所有正在进行的审判都将受制于《禁止酷刑公约》的规定。如果相关的临床试验申请是在CTR的基础上提出的,或者如果临床试验在2025年1月31日之前已经过渡到CTR框架,则CTR将适用于较早日期的临床试验。
在……里面 所有 案件, 临床 审判 必须 BE 已进行 在……里面 根据 使用 GCP 和 的 适用 监管部门 要求和 的 伦理 原则 那 有 他们的 起源 在……里面 的 申报 的 赫尔辛基 药品 使用 在……里面 临床 试验,包括 ATMP,必须制造 根据 的准则 使用GMP和GMP许可的设施, 可以是主题 到GMP检查。
欧盟审查和批准流程
在欧盟,药品只有在获得相关上市授权(MA)后才能商业化。要在欧盟获得产品的MA,申请人必须根据欧洲药品管理局(EMA)或以下一项管理的集中程序提交上市授权申请(MAA)
20
欧盟成员国主管当局管理的程序(分散程序、国家程序或相互承认程序)。MA只能授予在欧盟成立的申请者。
中央程序规定由欧洲委员会批准一项在整个欧洲经济区(由27个欧盟成员国加上冰岛、列支敦士登和挪威组成)有效的单一管理协议。根据(EC)第726/2004号条例,对于特定产品,包括(I)生物技术产品,(Ii)被指定为孤儿药物的产品,(Iii)高级治疗药物产品,或ATMP,以及(Iv)含有用于治疗艾滋病毒/艾滋病、癌症、神经退行性疾病、糖尿病、自身免疫和其他免疫功能障碍以及病毒疾病的新活性物质的产品,必须实行集中管理程序。对于含有用于治疗其他疾病的新活性物质的产品,以及具有高度创新性或集中过程有利于患者利益的产品,在相关批准时,通过集中程序的授权是可选的。
在集中程序下,EMA的人用药品委员会(CHMP)对产品进行初步评估。CHMP还负责几项授权后和维护活动,例如对现有MA的修改或扩展进行评估。在中央程序下,对重大影响评估进行评估的最长时限为210天,不包括申请人在答复《气候变化框架公约》问题时提供补充信息或书面或口头解释的时间。
在特殊情况下,如果从公共卫生的角度,特别是从治疗创新的角度,预计一种针对未得到满足的医疗需求的医药产品具有重大利益,则CHMP可以批准加速评估。如果CHMP接受加速评估的请求,210天的时限将减少到150天(不包括时钟停顿)。然而,如果CHMP认为不再适合进行加速评估,它可以恢复到集中程序的标准时限。
与集中授权程序不同,分散的MA程序需要单独向产品销售所在的每个欧盟成员国的主管当局提出申请,并由其单独批准。这一申请与将通过中央程序提交给环境管理机构进行授权的申请相同。欧盟参考成员国在收到有效申请后120天内编写评估草案和相关材料草稿。由此产生的评估报告将提交给有关欧盟成员国,这些成员国必须在收到评估报告和相关材料后90天内决定是否批准该报告和相关材料。如果有关欧盟成员国出于对公共卫生潜在严重风险的担忧而不能批准评估报告和相关材料,争议内容可能会提交给药品机构负责人相互认可和下放程序协调小组-人类,或CMDH-进行审查。欧盟委员会随后的决定对所有欧盟成员国都具有约束力。
互认程序允许已经在一个欧盟成员国拥有授权的医药产品的公司申请这一授权,以获得其他欧盟成员国的主管当局的承认。与权力下放程序一样,相互承认程序的基础是欧盟成员国的主管当局接受其他欧盟成员国的主管当局对医药产品的认可。国家MA的持有人可以向欧盟成员国的主管当局提出申请,要求该主管当局承认由另一个欧盟成员国的主管当局交付的MA。
原则上,MA的初始有效期为5年。五年后,可根据欧洲金融管理局或原授予该协议的欧盟成员国的主管当局对风险-收益平衡的重新评估,续签该协议。为支持申请,MA持有者必须在MA失效前至少9个月向EMA或主管当局提供通用技术文件的合并版本,该文件提供有关产品质量、安全和功效的最新数据,包括自授予MA以来引入的所有变化。欧盟委员会或欧盟成员国主管当局可根据与药物警戒有关的正当理由,决定将MA的续展期再延长5年。一经其后最终续期,金融管理专员的有效期为无限期。任何授权之后,如果没有在授权失效后三年内将医药产品实际投放到欧盟市场(进行集中的MA)或授权的欧盟成员国的市场上(所谓的日落条款)。
21
针对未得到满足的医疗需求并有望对公众健康有重大影响的创新产品可能有资格获得一些快速开发和审查计划,如优先药品计划,该计划提供类似于美国突破性治疗指定的激励措施。PRIME是一项自愿计划,旨在加强EMA对针对未得到满足的医疗需求的医疗产品开发的支持。符合条件的产品必须针对存在未得到满足的医疗需求的情况(欧盟没有令人满意的诊断、预防或治疗方法,或者,如果有,新的医疗产品将带来重大的治疗优势),并且它们必须展示通过引入新的治疗方法或改进现有方法来满足未得到满足的医疗需求的潜力。具有Prime称号的候选产品的赞助商将获得好处,包括但不限于,及早与EMA进行积极主动的监管对话,频繁讨论临床试验设计和其他开发计划要素,以及在提交档案后可能加快MAA评估。
在欧盟,在尚未获得所有所需的安全性和有效性数据的情况下,可能会授予“有条件的”MA。如果证明符合以下所有标准,欧盟委员会可批准医药产品的有条件并购:(I)医药产品的效益-风险平衡为正;(Ii)申请人很可能能够在授权后提供全面的数据;(Iii)医药产品满足未得到满足的医疗需求;以及(Iv)患者可立即获得医药产品的好处大于仍需要额外数据的固有风险。有条件的MA必须满足生成丢失数据或确保增加安全措施的条件。它的有效期为一年,必须每年续签,直到所有相关条件都满足为止。一旦提供了任何悬而未决的研究,条件MA就可以转换为传统MA。然而,如果这些条件没有在EMA设定的时间框架内得到满足并得到欧盟委员会的批准,MA将停止续签。
在“特殊情况下”,如果申请人能够证明,即使在产品获得授权和实施特定程序后,它也无法提供有关正常使用条件下的疗效和安全性的全面数据,也可以授予MA。这些情况尤其可能发生在预期的适应症非常罕见,而且在当时的科学知识状况下,不可能提供全面的信息,或者当生成数据可能违反普遍接受的伦理原则时。与有条件的MA一样,在特殊情况下授予的MA是指拟被授权用于治疗罕见疾病或未得到满足的医疗需求的医药产品,而申请人并不持有授予标准MA所需的完整数据集。不过,与有条件收购不同的是,在特殊情况下申请认可的申请人其后无须提供遗失的数据。虽然“在特殊情况下”的MA是最终批准的,但医药产品的风险-收益平衡每年都会得到审查,如果风险-收益比不再有利,MA将被撤回。
儿科 欧盟的发展
在……里面 的 欧盟, 监管 (EC)第1901/2006号 提供 那 所有 MAAS FOR 新医药 产品 有 到 包括 结果 的 审判 已进行 在……里面 的 儿科 人口, 在……里面 合规 使用 a 儿科 调查 计划, 或PIP,同意EMA的儿科 委员会, 或PDCO。 PIP规定了时间 和措施 提出 生成 数据 到 支持 a 儿科 指示 的 的 药用 产品 为 哪一个 马 是 被 寻求。 PDCO 可以 格兰特 a 推迟 的 的 义务 到 实施 一些 或 所有 的 的 措施 提供 在……里面 的 PIP 直到 是 足够 数据 到 证明 的 疗效 和 安全 的 的 产品 在……里面 成年人了 此外, 的 义务 提供 儿科 临床 审判 数据 可以 BE 放弃 通过 的 PDCO 当 这些 数据 是 不 需要 或 适当 因为 的 产品 是 可能 到 BE 无效 或 不安全 在……里面 孩子们, 的 疾病 或 条件 为 哪一个 的 产品 预期 发生 仅限 在……里面 成人 人口, 或 当 的 产品 并 不 代表 a 显著 治疗益处 完毕 现有 治疗 为 儿科 患者 一旦 的 马 是 获得 在……里面 所有 欧盟 构件 国 和研究 结果 是 包括 在……里面 的 产品 信息, 甚至 当 消极的, 的 产品 是 资格 为 a 延长六个月 到 的 补充 保护 证书, 或 SPC, 如果 任何 是 在……里面 效果 在… 的 时间 的 授权 或者在 的 情况 的 孤儿 药用 产品, a 两年制 延伸 的 孤儿 市场 排他性。
22
欧盟的制造业监管
除了MA之外,各种其他要求也适用于制造和投放到欧盟市场的医药产品。在欧盟制造医药产品需要制造授权,向欧盟进口医药产品需要允许进口的制造授权。制造授权持有人必须遵守适用的欧盟法律、法规和指南中规定的各种要求,包括欧盟cGMP标准。同样,医药产品在欧盟境内的分销必须遵守适用的欧盟法律、法规和准则,包括要求持有欧盟成员国主管当局授予的适当的分销授权。如果不遵守欧盟或欧盟成员国适用于医药产品制造的要求,营销授权持有人和/或制造和进口授权,或MA持有人和/或分销授权持有人可能受到民事、刑事或行政制裁,包括暂停制造授权。
数据和市场 排他性
的 欧盟 提供 机遇 为 数据 和 市场 排他性 相关 到 玛斯。 一旦接收 一个 硕士,创新 药用 产品 是 一般 题为 到 接收 八 年份 的 数据 排他性 和 10 年份 市场 排他性。 数据排他性, 如果 当然, 防止 监管部门 当局 在 欧盟 从 引用 创新者的 数据 到 评估 a 通用 应用 或 生物类似 应用 为 八 年份 从 的 日期 授权 的创新 产品,之后 哪是通用的 或生物相似 可以提交MAA, 和创新者的 数据 可能 被参考。 市场 排他性 期间 防止 一个成功 通用 或生物仿制药申请人 从 商业化 其 产品 在……里面 的 欧盟 直到 10年 有 经过 从 的 首字母 马 参考 产品 在……里面 的 EU. 的 整体 十年 期间 可能, 偶尔, BE 扩展 为 a 进一步 年 到 最大 的 11 年份 如果, 期间 的 第一 八 年份 的 那些 十 多年来, 的 MA持有人 获得 一个 授权 一 或 更 新的 治疗 适应症 其中, 期间 的 科学 评价 之前 到 他们的 授权,是 保持 到 带来 a 显著 临床 受益 在……里面 比较 使用 现有 疗法。 然而, 那里 是 不能保证 产品将被考虑 由欧盟监管机构 当局 成为新的化学/生物实体,并且产品可能没有资格获得数据独占权。
[In欧盟对生物仿制药或与参考药品相似但不符合仿制药定义的生物药品有一个特殊制度。对于此类产品,必须提供适当的临床前或临床试验的结果来支持MA申请。EMA的指南详细说明了为不同类型生物产品提供的补充数据数量类型。]
许可后 欧盟的要求
哪里 一个 马 是 授予 在……里面 关系 到 a 药用 产品 在……里面 的 欧盟, 的 保持者 的 的 马 是 需 到 遵守 a 范围 的 监管部门 要求 适用 到 的 制造业, 营销, 促进 和 销售 药用 产品。 类似 到 的 联合 各州, 两 马 持有者 和 厂商 的 药用 产品 须 到 全面 监管部门 监督 通过 的 EMA, 的 欧洲人 选委会 和/或 的 主管监管 当局 的 个人 欧盟 构件 States. 持有人 硕士必须 建立 和维护 药物警戒 系统 并任命个人 合格 药物警戒专员 谁负责 监督 的 那 系统。 关键 义务 包括 加急 报告 的 涉嫌 严重 不良 反应和提交 定期 安全 更新 报道称, 或OPS。
所有 新的MAA必须 包括 a 风险 管理 计划, 或 MRP,描述 的 风险 管理 系统 那 公司 将要 放 在……里面 地方 和 记录 措施 到 防止 或 尽量减少 的 风险 关联 使用 该产品. 监管 当局 可能 也 征收 具体 义务 作为条件 的 MA.这种风险-最小化 措施 或授权后 义务 可能 包括 额外 安全 监控, 更 频繁提交 的 PSURs, 或 的 进行 的 额外 临床 审判 或 许可后 安全 问题研究
在……里面 的 欧盟, 的 广告 和 促进 的 药用 产品 是 主题 到 两 欧盟 和 欧盟 构件 国 规律 促进 的 药用 产品, 相互作用 使用 医生 和 其他 医疗保健 专业人士, 误导 和 比较 广告 和 不公平 商业 实践 欧盟法律规定了药品广告和促销的一般要求,例如处方药直接面向消费者的广告。
23
然而,细节受个别欧盟成员国的法规管辖,并且各国之间可能有所不同。例如,适用法律要求与药品相关的宣传材料和广告必须符合产品的产品特性概要(UPC),该概要可能需要获得与MA相关的国家主管部门的批准。PPC是向医生提供有关产品安全有效使用的信息的文件。不符合UPC的促销活动被视为标签外使用,在欧盟被禁止。
联合王国
英国退出 从 欧盟于2020年1月31日通常 提述 随着英国脱欧, 改变了 监管 关系 之间 的 英国 和 的 EU. 的 药品和保健 产品 监管 机构,或MHRA, 是 现在 英国的独立 药品和医疗器械监管机构。 伟大 英国 (英格兰, 苏格兰 和 威尔士) 是 现在 a 欧盟的第三个国家。 北部 爱尔兰 会, 使用 方面 到 欧盟 法规, 继续 到 遵循 的 欧盟 监管部门 规则,直到温莎框架实施为止。
英国与临床试验相关的监管框架由 2004年人用药物(临床试验)法规,经修订,该法规是 源自CPD,并通过二级立法实施到英国国家法律中。 在……上面2022年1月17日,MHRA 推出 一个 八周 协商 对 重构 的 英国 立法 为 临床 试验, 和 其旨在简化临床试验审批、实现创新、提高临床试验透明度、实现 更大 风险 相称性, 和 促进 患者 和 公共 参与 在……里面 临床 审判 的 英国政府于2023年3月21日发布了对磋商的回应,确认将对立法提出修改。这些由此产生的立法修正案将决定英国法规与TLR的一致程度。2023年10月,MHRA宣布了一项新的临床试验通知计划,该计划能够对4期和低风险3期临床试验申请的初始临床试验申请采取更简化和风险成比例的方法。
英国的营销授权受 经修订的人用药品法规(SI 2012/1916)。 自2021年1月1日起,申请人 对于欧盟来说 程序 市场营销 授权 不能再 建立 在 英国. 结果,s因斯 这 日期, 成立的公司 在……里面 的 英国 不能 使用 的欧盟集中 程序 和 相反 必须 遵循 一 的 的 英国 国家授权 程序 或英国脱欧后剩余的国际合作程序之一 到 获得 a 上市许可 到 市场 产品 在……里面 的 英国. A集中授权产品的所有现有欧盟营销授权均已自动转换 或 祖父 成 英国 营销授权,有效 在……里面 大不列颠 只是, 免费 的 装药 对 1月1日, 2021, 除非 营销授权持有者选择了退出这种可能性。北爱尔兰将保持在欧盟授权范围内,涉及中央授权的医药产品,直到温莎框架的实施。因此,从什么时候开始温莎框架在北爱尔兰实施(目前预计为2025年1月1日),属于欧盟集中程序范围的产品只能通过英国在英国的国家授权程序进行授权。要在英国使用、销售或供应医药产品,必须获得在英国有效的营销授权。申请受《人类药品条例》(SI 2012/1916)管辖,并通过MHRA提交门户网站以电子方式提交。英国退欧后,MHRA还对国家营销授权程序进行了改革。有两种国家途径可供核准,即150天评估程序(以计时器为限)和滚动审查程序。滚动审查程序允许单独或联合向MHRA提交质量、非临床和临床数据,这些数据可以在滚动审查的基础上进行审查。在根据滚动审查程序提出的申请获得批准后,应在100天内收到决定(受制于时钟停顿)。
此外,自2024年1月1日起,MHRA在审查某些类型的营销授权申请时可能会依赖国际认可程序或IRP。根据IRP,MHRA将考虑值得信赖的监管伙伴(例如澳大利亚、加拿大、瑞士、新加坡、日本、美国和欧盟的监管机构)的专业知识和决策。MHRA将对IRP申请进行有针对性的评估,但如果提供的证据被认为不够有力,则保留拒绝申请的权力。*IRP允许由符合某些标准的此类值得信赖的监管合作伙伴批准的医药产品经过MHRA快速审查,以获得和/或更新英国或英国的MA。如果在60天内没有发现无法解决的重大异议,则应在最长60天内决定申请,并获得MHRA的批准
24
选定的值得信赖的监管合作伙伴在过去2年内获得批准,或在110天内发现有此类重大异议或在过去2年内未获得批准。申请者可以向IRP提交初始MAA,但该程序也可以在产品的整个生命周期中用于授权后程序,包括产品线扩展、更改和续订。
在英国,MA的初始期限为五年,续签后将无限期有效,除非MHRA基于与药物警戒相关的正当理由决定仅再续签一次五年。任何授权之后如果没有在三(3)年内将药物实际投放到英国(或英国,如果MA仅在英国有效)市场,则应易于生效。
英国有一项名为创新许可和接入路径的倡议,或ILAP,其目标与欧盟Prime计划相似,但存在显著差异。ILAP可以更早加入,特别是在非临床开发期间。MHRA和特别是国家健康与护理卓越研究所(负责评估哪些药物应由英格兰和威尔士的NHS资助的机构)将协助制定ILAP接受的药物的目标发展概况。
药品承保范围、定价和报销
在美国和其他国家,我们获得监管部门批准进行商业销售的任何产品的销售,在一定程度上将取决于承保范围的可用性和第三方付款人的报销是否充分,这些付款人包括政府卫生行政部门、管理医疗机构、私人健康保险公司和其他组织。除了安全性和有效性外,第三方付款人越来越多地审查药品和服务的医疗必要性和成本效益,因此,新药产品的报销状况存在重大不确定性。付款人决定为药品提供保险并不意味着将批准适当的报销率。此外,在美国,保险和报销没有统一的政策。第三方付款人在设置自己的报销费率时通常依赖于联邦医疗保险覆盖政策和支付限制,但除了联邦医疗保险确定之外,也有自己的方法和审批流程。因此,一个付款人决定为一种药品提供保险并不能保证其他付款人也会为该药品提供保险。可能无法获得足够的第三方报销,使我们无法实现产品开发投资的适当回报。一旦获得批准,我们的候选产品可能很难获得并保持足够的报销。我们可能需要进行昂贵的药物经济学研究,以证明与现有批准的生物制品和其他疗法相比,保险和报销或报销水平是合理的。在美国,新批准的药物在获得保险和报销方面可能会有很大延误,而且保险范围可能比该产品在美国境外获得FDA或类似监管机构批准的适应症更有限。此外,美国政府、州立法机构和外国政府继续实施成本控制计划,包括价格控制、对覆盖范围和补偿的限制以及对仿制药替代的要求。采取价格控制和成本控制措施,以及在现有控制和措施的司法管辖区采取更严格的政策,可能会进一步限制我们的净收入和业绩。我们候选产品的第三方报销减少或第三方付款人决定不覆盖我们的候选产品可能会减少医生对我们产品的使用,并对我们的销售、运营结果和财务状况产生实质性的不利影响。
在欧洲,不同国家的定价和报销方案差别很大。例如,一些国家规定,只有在就补偿价格达成协议后,才能销售产品。在收到产品的上市批准后,与政府当局进行这种定价谈判可能需要相当长的时间。政治、经济和监管方面的事态发展可能会使定价谈判进一步复杂化,在获得补偿后,定价谈判可能会继续进行。此外,欧盟为其成员国提供了各种选择,以限制其国家健康保险制度提供报销的产品范围,并控制供人使用的医疗产品的价格。欧盟成员国可以批准产品的具体价格,可以对将产品投放市场的公司的盈利能力采取直接或间接控制制度。其他欧盟成员国允许公司固定自己的产品价格,但监测和控制处方量,并向医生发布指导以限制处方。此外,一些欧盟成员国可能要求完成额外的研究,将特定候选医药产品的成本效益与目前可用的疗法进行比较。这一卫生技术评估或HTA过程是根据该程序对公共健康影响进行评估,
25
对个别国家的国家保健系统中使用特定医疗产品的治疗影响以及经济和社会影响进行了研究。关于特定医药产品的HTA的结果往往会影响欧盟个别成员国主管当局给予这些医药产品的定价和补偿地位。
隐私法
在我们的正常业务过程中,我们可能会处理个人或敏感数据,包括与我们的临床试验相关的数据。因此,我们正在或可能受到众多数据隐私和安全义务的约束,包括与数据隐私、安全和保护相关的联邦、州、地方和外国法律、法规、指导方针和行业标准。此类义务可以包括但不限于2018年《加州消费者隐私法》或修订后的CCPA、欧盟2016/679一般数据保护条例或欧盟GDPR、欧盟GDPR,因为它凭借2018年欧盟(退出)法案第3条构成英国法律的一部分,或英国GDPR,统称为GDPR。
CCPA和GDPR是与个人数据处理相关的日益严格和不断演变的监管框架的例子,这可能会增加我们的合规义务和任何不合规的风险敞口。
这些法律对受这些法律约束的实体规定了重大而复杂的遵约义务。例如,欧盟GDPR适用于在欧洲经济区内成立的任何公司,以及在欧洲经济区外设立的处理与向欧洲经济区内的数据主体提供商品或服务或监测欧洲经济区内数据主体的行为有关的个人数据的公司。这些义务可包括将个人数据处理仅限于特定、明确和合法目的所必需的;要求个人数据处理有法律依据;要求在某些情况下任命一名数据保护官员;增加对数据当事人的透明度义务;要求在某些情况下进行数据保护影响评估;限制收集和保留个人数据;增加数据当事人的权利;正式确定数据当事人同意的更高和更高的编纂标准;要求实施和维持对个人数据的技术和组织保障;要求向相关监督当局和受影响的个人通知某些违反个人数据的行为;以及在某些情况下授权任命驻英国和/或欧盟的代表。
附加法规
除上述规定外,与环境保护和有害物质有关的州和联邦法律,包括《职业安全与健康法》、《资源节约与回收法》和《有毒物质控制法》,都会影响我们的业务。这些法律和其他法律规范了我们对各种生物、化学和放射性物质的使用、处理和处置,这些物质用于我们的行动,以及由我们的行动产生的废物。如果我们的运营导致环境污染或使个人暴露在危险物质中,我们可能会承担损害赔偿和政府罚款的责任。我们相信,我们在实质上遵守了适用的环境法律,继续遵守这些法律不会对我们的业务产生实质性的不利影响。然而,我们无法预测这些法律的变化可能会如何影响我们未来的运营。
我们还受到许多联邦、州和地方法律的约束,这些法律涉及安全工作条件、制造实践、环境保护、火灾危险控制和危险或潜在危险物质的处置。我们现在或将来遵守这些法律和法规可能会产生巨大的成本。
员工和人力资本资源
截至2024年9月30日,我们拥有23名全职员工,其中7人主要从事研发活动,5人拥有博士学位。我们的员工没有工会代表,也没有集体谈判协议的覆盖范围。
我们的人力资本目标包括识别、招聘、留住、激励和整合我们现有的和新的员工、顾问和顾问。我们的股权和现金激励计划的主要目的是通过授予基于股票和现金的薪酬奖励来吸引、留住和奖励员工,以通过激励这些员工尽其所能并实现我们的目标来增加股东价值和公司的成功。
26
企业信息
我们最初于2010年1月在新泽西州注册为Oncobiologics,Inc.,2015年10月,我们通过与特拉华州的一家公司合并并成为特拉华州的一家公司,在特拉华州重新注册。2018年11月,我们更名为Outlook治疗公司。我们的总部位于新泽西州伊塞林S·伍德大道111S.Wood Avenue,#100,08830,电话号码是(609)619-3990。我们的网站地址是www.outlookTreateutics.com。本公司网站所载或可透过本网站查阅的资料并非本年度报告10-k表格的一部分,亦不会以引用方式并入本年报。
项目1A.危险因素
您应仔细考虑以下描述的风险和不确定因素,以及本10-k表格年度报告中的所有其他信息。如果发生以下任何风险,我们的业务、财务状况、经营业绩和前景都可能受到不利影响。下面描述的风险并不是我们公司面临的唯一风险。我们目前不知道或我们目前认为不重要的风险和不确定性也可能对我们的业务、财务状况、运营结果和/或前景产生不利影响。
与我们的财务状况和资本要求有关的风险
自我们成立以来,我们的运营已经发生了重大亏损和负现金流,预计至少在未来12个月内将继续出现重大亏损和运营现金流负增长。
自2010年1月5日成立以来,我们每年都发生净亏损,其中截至2024年9月30日和2023年9月30日的年度分别净亏损7,540美元万和5,900美元万。我们没有从任何产品的销售中获得实质性收入。作为一家公司,我们的成功在很大程度上取决于我们从ONS-5010/LYTENAVA的销售中创造收入的能力,该药已在欧盟和英国被批准用于治疗湿性AMD。
我们投入了几乎所有的财务资源来确定、开发和制造我们的候选产品,其中包括进行分析表征、工艺开发和制造、配方和临床试验、监管申报和沟通活动,并为这些业务提供一般和行政支持。到目前为止,我们只有一款候选产品ONS-5010/LYTENAVA,已获准在欧盟和英国销售,我们的运营资金主要来自出售股权证券和债务融资,以及在有限程度上根据我们的共同开发和许可协议支付。我们未来的净亏损数额将部分取决于我们从产品销售中创造收入的能力、我们未来支出的比率以及我们通过股权或债务融资获得资金的能力,或者我们进入并获得战略许可或共同开发合作下的资金的能力。
我们预计,至少在未来12个月内,我们将继续产生巨额费用和运营亏损。我们预计,如果以下情况发生,我们的费用可能大幅增加:
| ● | 准备在欧盟和英国推出并销售ONS-5010/LYTENAVA,如果该产品在这些地区获得批准,还将在其他国家/地区推出和销售; |
| ● | 继续ONS-5010/LYTENAVA的临床开发; |
| ● | 推进ONS-5010/LYTENAVA进入额外的临床试验; |
| ● | 变更或增加合同制造提供商、临床研究服务提供商、检测实验室、设备供应商、合法服务提供商或其他供应商或供应商; |
| ● | 如果我们成功完成临床试验,将在美国和其他市场寻求ONS-5010/LyTENAVA的监管和营销批准; |
27
| ● | 建立销售、营销和分销基础设施,将我们可能获得市场批准并保留这种权利的任何产品商业化; |
| ● | 寻求确定、评估、获取或开发可能与ONS-5010/LYTENAVA互补的其他候选产品; |
| ● | 根据任何许可协议预付、里程碑、特许权使用费或其他款项; |
| ● | 努力创造、维护、保护和扩大我们的知识产权组合; |
| ● | 从事诉讼,包括未决的证券集体诉讼,以及任何其他可能的诉讼; |
| ● | 努力吸引和留住技术人才; |
| ● | 创建额外的基础设施,以支持我们作为上市公司的运营和任何未来的商业化努力;以及 |
| ● | 以上任何一项的任何延迟或遇到问题,包括但不限于临床试验失败、结果冲突、安全问题或监管挑战,可能需要对现有研究、额外的主要研究或额外的支持性研究进行更长时间的后续研究才能获得上市批准。 |
如果我们不能实现并保持盈利,将降低我们的价值,并可能削弱我们筹集资金、保持研发努力、扩大业务或继续运营的能力。我们价值的下降也可能导致您的全部或部分投资损失。
我们从未从产品销售中获得任何收入,也可能永远不会盈利。
我们有一种产品,ONS-5010/LYTENAVA,在欧盟和英国被批准商业化,从未从产品销售中获得任何收入。我们创造收入和实现盈利的能力取决于我们单独或与战略协作合作伙伴成功完成ONS-5010/LYTENAVA的开发并获得商业化所需的监管和营销批准的能力 用于治疗湿性AMD和我们的其他目标适应症,并视情况适用于我们的任何其他候选产品。我们目前估计,我们最早可能在2025年上半年开始从欧洲的产品销售中获得收入,但这在很大程度上取决于我们在许多领域的成功,包括但不限于:
| ● | 确保资本充足,为我们的商业化努力提供资金; |
| ● | ONS-5010/LYTENAVA的发射和商业化 以及我们或我们的合作伙伴获得监管和营销批准的任何其他候选产品; |
| ● | 维护和获得ONS-5010/LYTENAVA的监管和营销批准 以及我们或我们的合作伙伴完成临床试验的任何其他候选产品; |
| ● | 为ONS-5010/LYTENAVA保留我们的制造合作伙伴 以及任何批准的候选产品,以支持临床开发、法规要求和市场对任何该等批准的候选产品的需求; |
| ● | 获得ONS-5010/LYTENAVA的第三方保险和足够的补偿以及任何其他候选产品(如果获得批准); |
| ● | 获得市场对ONS-5010/LYTENAVA的接受 以及我们获得监管和市场批准作为可行治疗方案的任何其他候选产品; |
28
| ● | 在医学界建立或示范ONS-5010/LYTENAVA的安全性和有效性与现有用于治疗湿性AMD的产品相比,其潜在的优势和副作用; |
| ● | 在我们可能加入的任何合作、许可或其他安排中谈判有利条件; |
| ● | 维护、保护和扩大我们的知识产权组合,包括专利、商业秘密和专有技术; |
| ● | 吸引、聘用和留住合格人才;以及 |
| ● | 完成ONS-5010/LYTENAVA的临床开发 用于治疗湿性AMD的美国和其他有针对性的适应症,以及我们未来可能开发的任何其他候选产品。 |
我们预计,将ONS-5010/LYTENAVA和我们未来可能被批准商业化的任何其他候选产品商业化会产生巨大的成本。如果FDA或其他监管机构(超国家、国内或国外)或任何针对我们的知识产权诉讼的不利结果要求我们改变我们的制造工艺或分析,或在我们目前预期的基础上进行临床、临床前或其他类型的研究,我们的费用可能会超出我们的预期。
我们通过销售ONS-5010/LYTENAVA获得收入的能力在欧盟、英国或该产品获得批准的任何其他国家/地区,或与可能获得批准的任何其他候选产品有关,将在一定程度上取决于:
| ● | 我们执行ONS-5010/LYTENAVA销售和营销战略的能力在欧盟和英国; |
| ● | 我们有能力维护和管理成功商业化ONS-5010/LyTENAVA所需的必要销售、营销和其他能力和基础设施 在欧盟和英国; |
| ● | 我们获得监管批准的地区的市场规模; |
| ● | 此类市场中竞争对手的数量; |
| ● | ONS-5010/LyTENAVA的市场接受度 以及可能获得批准的任何其他候选产品; |
| ● | 产品的可接受价格; |
| ● | 能够获得ONS-5010/LyTENAVA的保险和足够的报销 以及可能获得批准的任何其他候选产品; |
| ● | ONS-5010/LyTENAVA的质量和性能 以及可能获得批准的任何其他候选产品,包括相对安全性和有效性;以及 |
| ● | 无论我们拥有该地区的商业权还是合作伙伴。 |
如果ONS-5010/LyTENAVA的市场 或我们未来可能开发的任何其他候选产品,或者我们在该市场的份额,没有我们预期的那么大,监管机构批准的适应症数量比我们预期的要少,或者治疗的目标人群因竞争、医生选择或治疗指南而缩小,我们可能不会从销售此类产品中产生显着的收入来盈利。如果我们无法成功完成ONS-5010/LyTENAVA的开发并获得监管机构批准 欧盟和英国以外,我们的生意就会受到损害。
29
人们对我们作为一家持续经营的企业继续下去的能力有很大的怀疑。我们将需要筹集大量额外资金来完成ONS-5010/LYTENAVA的开发欧盟和英国以外的地区并支持我们的运营,直到我们能够通过销售ONS-5010/LYTENAVA产生足够的收入在欧盟和英国。这笔额外的资金可能无法以可接受的条款获得,或者根本不能获得。如果不能在需要时获得这笔必要的资金,我们可能会被迫推迟、限制或终止我们的产品开发努力或其他业务。
开发候选产品是一个昂贵、有风险和漫长的过程。我们已获得欧盟委员会和MHRA对ONS-5010/LYTENAVA的营销授权分别在欧盟和英国用于治疗湿性AMD。我们目前正在推进ONS-5010/LYTENAVA 通过额外的临床开发和美国的监管批准程序。我们的费用可能会因我们正在进行的活动而增加,特别是当我们继续研发、继续和启动ONS-5010/LYTENAVA的临床试验并寻求上市批准时 欧盟和英国以外.
截至2024年9月30日,我们的现金和现金等价物余额为1,490美元万。我们认为,我们截至2024年9月30日的现有现金和现金等价物,加上自2024年9月30日以来根据市场销售计划出售普通股的170万美元万净收益,不足以为我们的运营提供从Form 10-k申请日起一年的资金。2022年12月22日,我们签订了证券购买协议,并向斯特里特维尔资本有限责任公司或贷款人发行了面值为3,180万的无担保可转换本票,或2022年12月票据。2024年3月,贷款人同意将2022年12月票据的到期日从2024年4月1日延长至2025年7月1日,以便我们有时间就进一步延长2022年12月票据到期日的条款进行谈判。看见筹集更多资本,包括修改我们现有的可转换证券,可能会对我们的证券持有人造成稀释,限制我们的运营,或者要求我们放弃对我们的技术和候选产品的权利有关2022年12月票据条款下违约事件影响的更多信息。
由于我们的现金和现金等价物将不足以为我们目前计划的业务提供资金,至少从本年度报告中的综合财务报表以Form 10-k发布之日起的未来12个月内,我们作为一家持续经营的企业继续经营的能力存在很大疑问。我们将需要大量额外资金,才能继续作为一家持续经营的企业运营。尽管我们继续寻求与ONS-5010/LYTENAVA在美国以外的其他潜在战略合作伙伴进行讨论,但不能保证我们将成功达成任何此类协议,也不能保证此类协议如果成功,将覆盖ONS-5010/LYTENAVA的预期商业化成本。我们的运营计划也可能因许多我们目前未知的因素而发生变化,我们可能需要比计划更早地寻求额外资金,通过公共或私人股本或债务融资、第三方资金、营销和分销安排,以及通过其他合作、战略联盟和许可安排,或这些方法的组合。即使我们认为我们目前或未来的运营计划有足够的资金,如果市场状况有利或如果我们有特定的战略考虑,我们可能会寻求额外的资本。2024年12月10日,我们的董事会批准了一项裁员计划,以降低运营费用并保留资本。2024年12月13日,我们裁减了5名员工,约占现有员工总数的23%。至少,受裁员影响的所有员工都有资格在解雇后的特定时间段内获得遣散费和支付的眼镜蛇保费,条件是执行针对我们的全面索赔。我们估计,与裁员相关的重组费用约为30美元万,其中包括与员工遣散费和通知期付款、福利和相关成本相关的现金支出。虽然我们预计与裁员相关的大部分现金支付将在2025年第三个日历季度末基本完成,但由于可能发生的意外事件,包括与实施裁员相关的事件,我们可能会产生目前未考虑的其他费用或现金支出。此外,我们可能无法在预期的时间表上实现这些成本削减措施和其他成本削减计划的预期好处,或者根本无法实现,否则可能会加速我们的流动性需求,并可能迫使我们进一步缩减或暂停运营。
任何额外的筹款努力可能会转移我们的管理层对他们日常活动的注意力,这可能会对我们开发和商业化我们的候选产品的能力产生不利影响。此外,我们不能保证未来的融资将以足够的金额或我们可以接受的条款(如果有的话)提供。由于我们无法控制的外部因素,例如新兴生物科技公司的股票市场波动,以及美国和海外的总体经济和市场状况,我们在进入资本市场时可能会遇到困难。例如,
30
我们筹集额外资本的能力可能会受到全球经济状况以及美国和世界各地信贷和金融市场的中断和波动的不利影响,例如最近经历的情况,部分原因是通胀、持续的海外冲突以及由于银行倒闭而中断获得银行存款和贷款承诺的影响。我们不能确定我们是否能够以我们可以接受的条款获得融资,或者根本不能。如果我们不能及时获得足够的资金,将对我们的业务以及我们开发候选技术和产品的能力产生不利影响。此外,任何融资条款可能会对我们股东的持股或权利产生负面影响,我们发行额外的证券(无论是股权或债务)或此类发行的可能性可能会导致我们证券的市场价格下跌。债务的产生可能会导致固定支付义务的增加,我们可能需要同意某些限制性公约,例如对我们产生额外债务的能力的限制,对我们获取、销售或许可知识产权的能力的限制,以及可能对我们开展业务的能力产生不利影响的其他运营限制。为了获得必要的资金,我们可能被要求放弃对我们的一些技术或产品候选产品的权利,或以其他方式同意对我们不利的条款,其中任何一项都可能损害我们的业务、经营业绩和前景。即使我们认为我们有足够的资金用于目前或未来的运营计划,如果市场状况有利或出于特定的战略考虑,我们可能会寻求额外的资本。如果我们无法及时获得资金,我们可能被要求大幅削减、推迟或停止我们的一个或多个开发计划或ONS-5010/LYTENAVA或任何候选产品的商业化(如果获得批准)。我们也可能无法如愿扩大我们的业务或以其他方式利用我们的商机,这可能会损害我们的业务、财务状况和运营结果。
筹集更多资本,包括对我们现有可转换证券的修改,可能会对我们的证券持有人造成稀释,限制我们的运营,或者要求我们放弃对我们的技术或候选产品的权利。
在此之前,如果我们能够产生足够的产品收入,我们预计将通过股权和债务融资的组合,以及有选择地继续进行合作、战略联盟和许可安排来满足我们的现金需求。我们目前没有任何承诺的外部资金来源。在我们通过出售股权或可转换债务证券筹集额外资本的情况下,您的所有权权益将被稀释,这些证券的条款可能包括清算或其他优惠,对您作为证券持有人的权利产生不利影响。
2022年12月,我们向贷款人发行了2022年12月票据。根据2022年12月票据,一旦发生其中所述的某些事件,包括本公司未能支付根据2022年12月票据到期和应付的款项、破产或破产事件、未能遵守证券购买协议和2022年12月票据中所载的契诺、违反证券购买协议中的陈述和担保、以及未经贷款人同意而发生某些交易(每个此类事件均为触发事件),除某些例外情况外,贷款人有权:将2022年12月票据余额增加10%,用于主要触发事件(定义见2022年12月票据),增加5%用于次要触发事件(定义见2022年12月票据)。如果触发事件在贷款人发出书面通知后十(10)个交易日内未得到纠正,将导致违约事件(此类事件,即“违约事件”)。在发生违约事件后,贷款人可以加快2022年12月票据的发行速度,使其下的所有金额立即到期并应支付,并应以每年22%的利率累加利息,直至支付为止。在2022年4月1日之前,根据2022年12月的报告,“转换价格”是指在重大触发事件之前每股40.00美元(受股票拆分和股票组合调整的影响),在重大触发事件发生后,(I)每股40.00美元(受股票拆分和股票组合调整的影响),和(Ii)90%乘以公司普通股在转换通知交付日期前三个交易日的最低收盘价。如果转换价格低于每股3.51美元,我们将被要求以现金满足贷款人的转换通知。除某些例外情况外,虽然2022年12月的票据未偿还,但贷款人将对任何未来的浮动利率交易或任何债务拥有同意权,并在任何未来的债务或股权融资中拥有10%的参与权。
2024年1月22日,我们与贷款人签署了2022年12月票据的修正案,在满足某些条件后于2024年4月1日生效,包括各种所需的股东批准和2024年3月18日结束私募。 2022年12月发行的票据的到期日延长至2025年7月1日。
如果可以获得额外的债务融资,可能会涉及到包括限制或限制我们能力的契约的协议
31
采取具体行动,如招致额外债务、进行资本支出或宣布股息,并可能以我们的全部或部分资产作为担保。如果我们通过与第三方达成合作、战略联盟或许可安排来确保ONS-5010/LYTENAVA或任何未来候选产品的开发资金,我们可能不得不放弃对我们的技术、未来收入来源、研究计划或候选产品的额外宝贵权利,或者以可能对我们不利的条款授予许可。如果我们无法在需要时筹集更多资金,我们可能需要推迟、限制、减少或终止我们的产品开发或商业化努力,包括ONS-5010/LYTENAVA, 或授予开发和销售ONS-5010/LYTENAVA的权利或其他我们本来更愿意自己开发和营销的候选产品,终止产品开发或未来的商业化努力,包括ONS-5010/LYTENAVA,或者完全停止运营。
与我们的候选产品的发现和开发相关的风险
我们高度依赖ONS-5010/LYTENAVA的成功,这是我们唯一在欧盟和英国获得批准的产品。如果ONS-5010/LYTENAVA没有获得欧盟和英国以外的监管机构批准,或者没有成功商业化,我们的业务可能会受到损害。
我们目前有一款产品,ONS-5010/LYTENAVA, 该产品已获准在欧盟和英国进行商业销售。我们可能永远无法获得监管部门对ONS-5010/LYTENAVA的批准在欧盟或英国以外,商业化ONS-5010/LYTENAVA在欧盟或英国,或开发其他适销对路的产品。我们预计,在可预见的未来,我们的大部分努力和支出将用于推动ONS-5010/LYTENAVA的发展,这是我们唯一获得批准的产品,也是目前正在积极开发的唯一候选产品。我们还预计,我们将需要为ONS-5010/LYTENAVA的商业化做出重大努力在欧盟、英国和其他市场在监管部门批准后,如果收到的话。我们不能向您保证我们将能够成功地获得ONS-5010/LYTENAVA的监管批准欧盟和英国以外的地区并为ONS-5010/LYTENAVA开发足够的商业能力 如果有必要的话。因此,我们的业务目前在很大程度上依赖于ONS-5010/LYTENAVA的成功监管批准在欧盟和英国以外,和ONS-5010/LYTENAVA的商业化。
我们不能确定ONS-5010/LYTENAVA 将获得欧盟或英国以外的监管批准,或者甚至在欧盟或英国或我们获得监管批准的任何其他目标市场成功商业化。产品的研究、测试、制造、标签、批准、销售、营销和分销现在和将来都受到FDA和美国和其他国家的其他监管机构的广泛监管,这些监管机构各自有不同的监管规定。我们不被允许销售ONS-5010/LYTENAVA 在美国,直到我们获得FDA的批准,或在任何外国,直到我们从这些国家的适当当局那里获得上市授权所需的批准。
获得FDA的批准或类似的监管批准是一个广泛、漫长、昂贵和内在不确定的过程,FDA或其他外国监管机构可能会推迟、限制或拒绝批准ONS-5010/LYTENAVA 原因有很多,包括:
| ● | 我们可能无法证明ONS-5010/LYTENAVA对于我们目前的任何目标适应症的治疗效果令FDA或其他相关监管机构满意; |
| ● | 相关监管机构可能需要额外的审批前研究或临床试验,这将增加我们的成本并延长我们的开发时间表; |
| ● | 我们的临床试验结果可能不符合FDA或其他相关监管机构对上市批准所要求的统计或临床意义水平; |
| ● | FDA或其他相关监管机构可能不同意我们临床试验的数量、设计、规模、进行或实施; |
| ● | FDA或其他相关监管机构可能不会发现来自非临床研究或临床试验的数据足以证明这些产品的临床和其他好处超过了它们的安全风险; |
32
| ● | FDA或其他相关监管机构可能不同意我们对ONS-5010/LYTENAVA和任何未来候选产品的非临床研究和临床试验结果的数据或意义的解释,或者可能要求我们进行额外的试验; |
| ● | FDA或其他相关监管机构可要求制定风险评估和缓解战略,或与之类似的战略,作为批准的条件; |
| ● | FDA或其他相关监管机构可能要求额外的上市后研究,这将是昂贵的; |
| ● | FDA或其他相关监管机构可能会发现我们的第三方制造商的制造工艺或设施中存在缺陷;或 |
| ● | FDA或其他相关监管机构可能会改变其批准政策或采用新的法规。 |
不能保证我们用于湿性AMD的ONS-5010/LYTENAVA的BLA或MAAS,或计划中的未来其他视网膜适应症的临床试验,最终将满足足以让我们获得欧盟和英国以外的监管批准的要求。例如,在2022年5月,我们自愿撤回了我们的BLA,以提供FDA要求的更多信息。我们于2022年8月30日向FDA重新提交了ONS-5010/LYTENAVA的BLA。2023年8月29日,我们收到了一份CRL,其中FDA得出结论,由于几个CMC问题、批准前制造检查的公开观察以及缺乏实质性证据,FDA在本审查周期内不能批准BLA。在随后与FDA的A类会议上,我们了解到FDA要求成功完成评估ONS-5010/LYTENAVA的额外的充分和良好控制的临床试验,以及CRL中指示的额外要求的CMC数据,以批准ONS-5010/LYTENAVA用于湿性AMD。根据SPA,我们收到了FDA关于挪威八项试验方案的协议,并于2024年9月完成了试验。*2024年11月,我们报告称,ONS-5010/LYTENAVA在与FDA的特别协议评估(SPA)中规定的第8周未达到预先指定的非劣势终点。然而,试验的初步数据显示,视力和生物活性的存在有所改善,以及ONS-5010持续良好的安全性。对数据的分析正在进行中,因为正在收集北欧八国的第三个月数据,预计将于2025年1月提供。在收到北欧8号的3个月全部疗效和安全性结果后,我们计划在2025年第一季度重新提交ONS-5010/LYTENAVA的BLA申请。不能保证我们将解决CRL中确定的缺陷,使FDA满意。
由于我们有限的资源和获得资金的途径,我们已经并将继续需要优先开发某些候选产品;这些决定可能被证明是错误的,可能会损害我们的业务。
因为我们只有有限的资源和资本来资助我们的运营,我们必须决定追求哪些候选产品以及分配给每个产品的资源量。我们目前只专注于一个积极的开发计划,ONS-5010/LYTENAVA,而不再积极开发ONS-3010、ONS-1045或我们正在开发的其他生物相似产品候选产品。我们目前不打算积极开发这种生物相似的候选产品。我们关于将研究、协作、管理和财政资源分配给特定候选产品或治疗领域的决定可能不会导致可行的商业产品的开发,并可能从更好的机会中转移资源。同样,我们在某些产品开发计划上推迟、终止或与第三方合作的潜在决定也可能被证明不是最优的,并可能导致我们错过预期的宝贵机会。如果我们对候选产品的市场潜力做出了错误的判断,或者误读了制药行业的趋势,我们的业务、财务状况和运营结果可能会受到损害。
33
临床药物开发是一个漫长而昂贵的过程,我们可能会在临床试验中遇到重大延误,或者可能无法证明安全性和有效性,使适用的监管机构满意。
ONS-5010/LYTENAVA是我们唯一在欧盟和英国批准用于治疗湿性AMD的产品,也是我们唯一正在积极开发的候选产品,在我们准备提交其他适应症的监管批准申请之前,需要进行额外的充分且受控的临床试验,评估ONS-5010/LYTENAVA,以及CRL中显示的额外要求的CMC数据。在获得监管部门批准销售我们的候选产品之前,我们和任何合作伙伴必须进行临床试验,以证明候选产品在人体上的安全性和有效性。.
我们不能保证未来的任何临床试验将按计划进行或如期完成,如果有的话。例如,北欧一和北欧二学习的入学人数从我们最初的预期推迟了。一旦启动,我们可能会在其余的北欧试验(4、5、6和7)中遇到类似的登记延迟。一个或多个临床试验的失败可能发生在测试的任何阶段,我们未来的临床试验可能不会成功。可能妨碍成功或及时完成临床开发的事件包括但不限于:
| ● | 无法产生足够的临床前、毒理学或其他体内或体外数据来支持人类临床试验的启动; |
| ● | 延迟与监管当局就研究设计达成共识; |
| ● | 延迟与预期的合同研究组织或CRO和临床试验地点就可接受的条款达成协议,其条款可以进行广泛的谈判,并且在不同的CRO和临床试验地点之间可能存在显著差异; |
| ● | 延迟获得每个临床试验地点所需的IRB批准,或道德委员会的积极意见; |
| ● | 在审查IND、申请或修订或同等文件,或检查我们的临床试验操作或试验地点后,或由于临床试验期间报告的不良事件,由监管机构实施临床搁置; |
| ● | 在招募合适的患者参与我们的临床试验方面进一步拖延; |
| ● | 难以与患者团体和调查人员合作; |
| ● | 我们的CRO、其他第三方或我们未能遵守临床试验要求; |
| ● | 未能按照FDA的良好临床实践、GCP、要求或其他国家适用的监管指南执行; |
| ● | 受试者延迟完成研究或返回接受治疗后随访,或受试者退出研究; |
| ● | 与候选产品相关的不良事件的发生被认为超过其潜在益处; |
| ● | 监管要求和指南的变化需要修改或提交新的临床方案; |
| ● | 我们候选产品的临床试验成本高于我们的预期; |
34
| ● | 我们候选产品的临床试验产生否定或不确定的结果,这可能导致我们决定或监管机构要求我们进行额外的临床试验或放弃产品开发计划;以及 |
| ● | 延迟生产、测试、发布、验证或进口/出口和/或分销足够稳定数量的我们用于临床试验的候选产品,或无法执行上述任何操作。 |
任何无法成功完成临床前研究和临床开发的情况都可能导致我们的额外成本或削弱我们创造收入的能力。此外,如果我们对我们的候选产品进行制造或配方更改,我们可能需要进行额外的临床试验,以将我们的修改后的候选产品与更早的版本连接起来。
以前的临床试验结果可能无法预测未来的结果,我们目前和计划进行的临床试验的结果可能不符合FDA、EMA和欧盟委员会或其他类似的外国监管机构的要求。
临床失败可能发生在临床发展的任何阶段。临床试验可能会产生阴性或不确定的结果,我们或我们当前和未来的任何合作者可能会决定,或者监管机构可能会要求我们进行额外的临床或临床前测试。我们将被要求通过良好控制的临床试验以大量证据证明我们的候选产品在特定患者群体中使用同样安全和有效,然后我们才能寻求监管机构批准其商业销售。早期临床试验的成功并不意味着未来更大规模的注册临床试验也将成功,因为后期临床试验中的候选产品可能无法证明同等的安全性和有效性,使FDA、EMA和欧盟委员会以及其他类似的外国监管机构满意,尽管已经通过了初步临床试验。在早期临床试验中显示出有希望的结果的候选产品仍可能在随后的验证性临床试验中失败。同样,临床前试验和早期临床试验的结果可能不能预测后来的临床试验的成功,临床试验的中期结果也不一定能预测最终结果。制药行业的一些公司,包括那些拥有比我们更多的资源和经验的公司,在高级临床试验中遭遇了重大挫折,即使在早期的临床试验中取得了令人振奋的结果。
此外,临床试验的设计可以确定其结果是否支持产品的批准,而临床试验设计中的缺陷可能在临床试验进展良好之前不会变得明显。我们可能无法设计和执行临床试验来支持监管部门的批准。在一些情况下,由于许多因素,同一候选产品的不同试验之间的安全性或有效性结果可能存在显著差异,这些因素包括但不限于试验方案的变化、患者群体的大小和类型的差异、对给药方案的坚持以及临床试验参与者的辍学率。
此外,我们的候选产品可能不会获得批准,即使它们在第三阶段临床试验或注册试验中达到了主要终点。FDA、EMA或欧盟委员会以及其他类似的外国监管机构可能不同意我们的试验设计以及我们对临床前研究和临床试验数据的解释。此外,这些监管机构中的任何一个都可以更改对候选产品的批准要求,即使在审查并提供了关于可能导致FDA或其他机构批准的3期临床试验方案的意见或建议之后。例如,在2022年5月,我们自愿撤回了我们的BLA,以提供FDA要求的更多信息。我们于2022年8月30日向FDA重新提交了ONS-5010/LYTENAVA的BLA。2023年8月29日,我们收到了一份CRL,其中FDA得出结论,由于几个CMC问题、批准前制造检查的公开观察以及缺乏实质性证据,FDA在本审查周期内不能批准BLA。在随后与FDA的A类会议上,我们了解到FDA要求成功完成评估ONS-5010/LYTENAVA的额外的充分和良好控制的临床试验,以及CRL中指示的额外要求的CMC数据,以批准ONS-5010/LYTENAVA用于湿性AMD。虽然我们在2024年1月与FDA就SPA达成了协议,但这一协议仅表明同意关键的试验设计概念;这并不意味着FDA已经审查或同意了不影响批准的方案细节。此外,SPA协议的存在并不保证营销申请将被提交或批准,即使审判是根据议定书进行的。2024年11月,我们报告说,ONS-5010/LYTENAVA在第8周没有达到FDA特别协议评估(SPA)中规定的预先指定的非劣势终点。
35
我们已获得ONS-5010/LYTENAVA的营销授权在欧盟和英国用于治疗湿性AMD。我们还打算寻求批准ONS-5010/LYTENAVA 用于在欧盟和英国以外的地区治疗湿性AMD。任何监管机构都可以批准比我们要求的适应症更少的候选产品,也可以根据昂贵的上市后临床试验的表现来批准。
ONS-5010/LYTENAVA和任何未来的候选产品可能会导致不良副作用或具有其他特性,如果获得批准,可能会推迟或阻止其监管批准,限制已批准标签的商业形象,或在上市批准后导致重大负面后果。
与大多数药品一样,使用ONS-5010/LYTENAVA 任何未来的候选产品都可能与副作用或不良事件有关,这些副作用和不良事件的严重程度和频率可能会有所不同。与使用ONS-5010/LYTENAVA相关的副作用或不良事件 任何未来的候选产品都可能在任何时候被观察到,包括在临床试验中或当产品商业化时。ONS-5010/LYTENAVA引起的不良反应 任何未来的候选产品都可能导致我们或监管机构中断、推迟或停止临床试验,并可能导致更严格的标签,或者推迟或拒绝FDA或其他外国当局的监管批准。我们的试验结果可能显示副作用、毒性或其他安全问题的严重程度和流行率高且不可接受,并可能要求我们进行额外的研究或停止开发或销售ONS-5010/LYTENAVA 或任何未来的候选产品,或使我们面临产品责任诉讼,这将损害我们的业务。在这种情况下,监管机构可能会要求我们就ONS-5010/LYTENAVA或任何我们没有计划或预期的未来候选产品的安全性和有效性进行额外的动物或人体研究,或者我们的研究可能被暂停或终止,FDA或类似的外国监管机构可以命令我们停止进一步开发ONS-5010/LYTENAVA,或者拒绝或撤回对ONS-5010/LYTENAVA的批准 或任何或所有目标适应症的任何未来候选产品。不能保证我们将及时解决任何可能损害我们的业务、前景和财务状况的与任何产品相关的不良事件相关的问题,使FDA或任何其他监管机构满意。
此外,产品质量特征已被证明对工艺条件、制造技术、设备或场地以及其他相关考虑因素的变化非常敏感,因此,我们在监管批准之前或之后实施的任何制造工艺更改都可能影响产品安全。
此外,如果我们的一个或多个候选产品获得市场批准,如ONS-5010/LYTENAVA,而我们或其他人后来发现此类产品造成的不良副作用,可能会导致许多潜在的重大负面后果,包括但不限于:
| ● | 监管部门可以撤回、变更或暂停批准此类产品; |
| ● | 监管部门可能要求在标签上附加警告; |
| ● | 我们可能需要创建REMS计划,其中可能包括概述此类副作用风险的药物指南,以分发给患者,为医疗保健提供者和/或确保安全使用的其他要素制定沟通计划,或外国同等战略; |
| ● | 我们可能会被起诉,并对给患者造成的伤害承担责任;以及 |
| ● | 我们的声誉可能会受损。 |
任何这些事件都可能阻止我们实现或保持市场对ONS-5010/LYTENAVA的接受或任何其他未来的候选产品可能会被批准,并可能对我们的业务、运营结果和前景造成重大损害。
FDA、MHRA、EEA当局和其他类似的外国监管机构要求我们报告有关不良医疗事件的某些信息,如果这些产品可能导致或促成了这些不良事件。我们报告义务的时间将由我们意识到不良事件以及事件的性质的日期触发。我们可能无法在规定的时间范围内报告我们意识到的不良事件。我们可以
36
我们也没有意识到我们已经意识到了可报告的不良事件,特别是如果它没有作为不良事件报告给我们,或者如果它是意外的不良事件或在使用我们的产品时被及时删除。如果我们未能履行我们的报告义务,FDA、MHRA、EEA国家的国家主管当局或其他外国监管机构可能会采取行动,包括但不限于刑事起诉、施加民事罚款、扣押我们的产品、撤回、更改或暂停我们的批准或推迟对未来产品候选产品的批准或审批。
如果对我们提起产品责任诉讼,我们可能会招致重大责任,并可能被要求限制我们当前或未来候选产品的商业化,而我们现有的保险覆盖范围可能不足以满足可能出现的任何责任。
与药物相关的副作用可能会影响临床试验患者的招募、登记患者完成我们研究的能力或导致潜在的产品责任索赔。我们目前为每个候选产品投保1,000万的产品责任保险,并且根据我们的某些许可协议,我们必须维护产品责任保险。我们可能不能以合理的费用或足够的金额维持保险范围,以保护我们免受因责任造成的损失。一项成功的产品责任索赔或一系列针对我们的索赔可能会对我们的运营和业务结果产生负面影响。此外,无论价值或最终结果如何,产品责任索赔可能会导致我们的商业声誉受损、临床试验参与者退出、相关诉讼造成的成本、管理层对我们主要业务的注意力分散、监管机构发起调查、患者或其他索赔人获得巨额金钱赔偿、无法将ONS-5010/LYTENAVA商业化或任何其他候选产品和对ONS-5010/LYTENAVA的需求减少或任何其他候选产品,如果被批准用于商业销售。此外,我们也可能无法利用适用于仿制药产品的产品责任诉讼限制,这可能会增加我们对被视为危险或缺陷的产品的责任敞口。
如果不能在任何有针对性的司法管辖区获得监管批准,我们将无法向更多的患者群体推销我们的产品,并减少我们的商业机会。
为了在欧洲、美国和其他司法管辖区销售我们的产品,我们和任何合作伙伴必须获得单独的监管批准,并遵守众多不同的监管要求。我们已获得欧盟委员会和MHRA对ONS-5010/LYTENAVA的营销授权分别在欧盟和英国用于治疗湿性AMD。欧盟的营销授权是在所有欧盟国家以及冰岛、列支敦士登和挪威有效。在其他国家获得批准所需的时间可能与获得FDA批准所需的时间不同。外国监管机构的审批过程可能包括与获得FDA批准相关的所有风险,我们可能无法及时获得外国监管机构的批准,如果有的话。欧盟委员会、MHRA或FDA的批准不能确保其他国家的监管机构批准,一个外国监管机构的批准不能确保其他国家的监管机构或FDA的批准。我们或任何协作合作伙伴可能无法申请监管批准,也可能无法获得在其他欧洲国家/地区、美国或其他司法管辖区将我们的产品商业化所需的批准。如果未能获得这些批准,将损害我们的业务、财务状况和运营结果。
即使我们的候选产品获得了监管部门的批准,我们的产品仍将受到监管部门的审查。
ONS-5010/LYTENAVA或我们可能追求的任何其他已获批准的候选产品,将受到制造、标签、包装、储存、广告、促销、抽样、记录保存、上市后研究和提交安全、疗效和其他上市后信息的持续监管要求,包括欧盟、其他欧洲经济区国家和英国的要求,以及美国的联邦和州要求以及其他类似外国监管机构的要求。
制造商和制造设施必须遵守广泛的FDA和类似的外国监管机构的要求,包括确保质量控制和制造程序符合cGMP法规。因此,我们目前和未来的制造合作伙伴将接受持续的审查和检查,以评估对cGMP的遵守情况以及对任何保密协议、营销授权、BLA或营销授权申请中做出的承诺的遵守情况。因此,我们和我们的合作者和供应商必须
37
继续在监管合规的所有领域投入时间、金钱和精力,包括制造、生产和质量控制。
我们或任何协作合作伙伴就我们的候选产品获得的任何监管批准可能会受到产品上市所批准的指定用途的限制或批准条件的限制,或者可能包含可能代价高昂的额外临床试验和监测要求,以监控候选产品的安全性和有效性。我们将被要求向FDA和类似的外国监管机构报告某些不良反应和生产问题。任何解决药品安全问题的新立法都可能导致产品开发或商业化的延迟,或者增加确保遵从性的成本。我们必须遵守有关我们产品的广告和促销的要求。与处方药有关的促销信息受到各种法律和法规的限制,必须与产品经批准的标签上的信息一致。因此,我们不允许为未经批准的适应症或用途推广我们的产品。我们必须提交新的或补充申请,并获得批准对已授予ONS-5010/LYTENAVA的营销授权进行某些更改在欧盟和英国,或任何其他经批准的产品、产品标签或制造工艺。我们还可以被要求进行上市后临床试验,以验证我们产品在一般或特定患者亚组中的安全性和有效性。不成功的上市后研究或未能完成此类研究可能会导致撤回、暂停或更改上市批准。
如果监管机构发现一种批准的产品存在以前未知的问题,例如意想不到的严重程度或频率的不良事件,或我们的制造设施存在问题,或不同意产品的促销、营销或标签,该监管机构可能会对该产品或我们施加限制,包括要求该产品退出市场。如果我们未能遵守适用的监管要求,监管当局或执法当局可能会采取其他措施:
| ● | 发出无标题和警告信; |
| ● | 施加民事或者刑事处罚的; |
| ● | 暂停、变更或者撤销监管审批; |
| ● | 暂停我们正在进行的任何临床试验; |
| ● | 拒绝批准我们提交的待决申请或已批准申请的补充申请; |
| ● | 完全或部分暂停生产、分销或制造的; |
| ● | 对我们的运营施加限制,包括关闭我们的制造设施; |
| ● | 吊销执照;或 |
| ● | 扣押或扣留产品或要求召回产品。 |
任何政府对涉嫌违法行为的调查都可能需要我们花费大量时间和资源来应对,并可能会产生负面宣传。任何不遵守持续监管要求的行为都可能会对我们的产品商业化和产生收入的能力产生重大不利影响。如果实施监管制裁或撤回、暂停或变更监管批准,我们公司的价值和经营业绩将受到负面影响。
38
药品的开发和商业化受到广泛的监管,我们可能不会在欧盟或英国以外的地区或在我们计划及时或根本不为其开发产品或任何未来候选产品的任何其他适应症上获得ONS-5010/LYTENAVA的监管批准。
临床开发、制造、标签、包装、储存、记录保存、广告、促销、出口、进口、营销、分销、不良事件报告,包括提交安全和其他上市后信息和报告,以及其他可能与ONS-5010/LYTENAVA有关的活动,以及我们未来可能开发的任何其他候选产品,都受到广泛的监管。生物制品在美国的上市批准需要向FDA提交BLA,在我们获得FDA对该产品的BLA批准之前,我们不被允许在美国销售任何候选产品。BLA必须由大量的临床和临床前数据以及有关药理学、化学、制造和控制的大量信息支持。
FDA对BLA的批准并不是有保证的,审查和批准过程是一个昂贵和不确定的过程,可能需要几年时间。FDA在审批过程中也有很大的自由裁量权。BLA批准所需的临床前研究和临床试验的数量和类型因候选产品、疾病或候选产品设计用于治疗的条件以及适用于任何特定候选产品的法规而异。尽管与临床前研究和临床试验相关的时间和费用都很高,但失败在任何阶段都可能发生。ONS-5010/LYTENAVA或任何未来候选产品的临床前和早期临床试验结果可能不能预测我们后期临床试验的结果。
临床试验失败可能是多种因素造成的,包括试验设计、剂量选择、安慰剂效应、患者登记标准以及未能证明良好的安全性或有效性特征,临床试验失败可能发生在任何阶段。生物制药行业的公司经常由于缺乏疗效或不良安全性而在临床试验的进展中受挫,尽管在早期的试验中取得了良好的结果。根据阴性或不确定的结果,我们可能决定,或监管机构可能要求我们进行额外的临床试验或临床前研究。此外,从临床试验中获得的数据容易受到不同解释的影响,监管机构可能不会像我们那样对我们的数据进行有利的解释,这可能会进一步推迟、限制或阻止上市批准。
FDA可以出于多种原因推迟、限制或拒绝对候选产品的批准,或者要求提供更多信息,包括:
| ● | 可能不认为我们的候选产品足够安全和有效; |
| ● | 可能不同意从临床试验收集的数据是可接受的或足以支持提交BLA或其他提交或获得监管批准,并可能对额外的临床前研究或临床试验提出要求; |
| ● | 可确定在我们的临床试验中参与者所经历的不良事件代表不可接受的风险水平; |
| ● | 可能确定在临床试验中研究的人群可能不够广泛或具有足够的代表性,以确保我们寻求批准的全部人群的安全性; |
| ● | 可能不接受在临床机构或在医疗标准可能与美国不同的国家进行的试验的临床数据; |
| ● | 可能对配方、标签和/或规格有不同意见; |
| ● | 不得批准与我们的候选产品相关的制造工艺或设施; |
| ● | 可能改变审批政策或采用新法规;或 |
39
| ● | 可能由于提交的内容或格式等原因而不接受提交。 |
例如,在2022年5月,我们自愿撤回了我们的BLA,以提供FDA要求的更多信息。我们于2022年8月30日向FDA重新提交了ONS-5010/LYTENAVA的BLA。2023年8月29日,我们收到了一份CRL,其中FDA得出结论,由于几个CMC问题、批准前制造检查的公开观察以及缺乏实质性证据,FDA在本审查周期内不能批准BLA。在随后与FDA的A型会议上,我们了解到FDA要求成功完成评估ONS-5010/LYTENAVA的另外一项充分和良好控制的临床试验,以及CRL中指示的额外要求的CMC数据,以批准ONS-5010/LYTENAVA用于湿性AMD。为了响应FDA的CRL,我们正在进行挪威八项临床试验,并于2024年9月完成登记。2024年11月,我们报告说,在与FDA的特别协议评估(SPA)中规定的第8周,ONS-5010/LYTENAVA不符合预先指定的非劣势终点。然而,试验的初步数据显示,ONS-5010/LYTENAVA的视力和生物活性有所改善,并继续保持良好的安全性。对数据的分析正在进行中,因为正在收集北欧八国的第三个月数据,预计将于2025年1月提供。一般来说,公众对药品安全性的担忧可能会推迟或限制我们获得监管部门批准的能力,导致我们的标签中包含不利信息,或者要求我们进行其他可能产生额外成本的活动。我们还没有获得FDA对任何产品的批准。这种经验的缺乏可能会阻碍我们及时获得FDA对ONS-5010/LYTENAVA的批准(如果有的话)。我们可能得不到FDA对《BLA》的审查结束后,我们打算在北欧8号完成后重新提交的批准,在这种情况下,我们的业务、财务状况和运营结果将受到进一步损害。
如果我们在获得批准方面遇到更多延误,或者如果我们未能获得ONS-5010/LYTENAVA的批准 欧盟和英国以外,我们的商业前景将受到损害,我们的创收能力将受到重大损害,这将对我们的业务、前景、财务状况和运营业绩产生不利影响。
我们计划或未来的临床试验的开始或完成,或终止或暂停的任何延迟,都可能导致我们的成本增加,推迟或限制我们创造收入的能力,并对我们的商业前景产生不利影响。
我们计划或未来的临床试验的开始或完成,或终止或暂停的任何延迟,都可能导致我们的成本增加,推迟或限制我们创造收入的能力,并对我们的商业前景产生不利影响。在我们能够以任何明显的适应症在美国启动临床试验之前,我们必须向FDA提交临床前和/或其他研究的结果以及其他信息,包括有关化学、制造和控制的信息以及我们建议的临床试验方案,作为IND或类似监管文件的一部分。
在获得FDA批准销售任何适应症的候选产品之前,我们必须进行广泛的临床研究,以证明其安全性和有效性。临床测试费用昂贵,耗时长,结果不确定。此外,我们预计将部分依赖CRO和其他第三方生成的临床前、临床和质量数据,以提交ONS-5010/LYTENAVA的监管文件。虽然我们已经或将会就这些第三方的服务达成协议,但我们对他们的实际表现的影响力有限。如果这些第三方不向我们提供数据,或在适用的情况下,根据我们与他们的协议及时提交监管报告,我们的开发计划可能会显著延迟,我们可能需要独立进行额外的研究或收集额外的数据。无论是哪种情况,我们的开发成本都会增加。
FDA可能会要求我们对候选产品进行额外的研究,然后才允许我们在任何IND下启动临床试验,这可能会导致额外的延迟并增加我们开发计划的成本。我们计划的或未来的临床试验的开始或完成出现任何此类延误,都可能严重影响我们的产品开发成本。我们不知道计划中的审判是否会按时开始,或者是否会如期完成。临床试验的开始和完成可能会因多种原因而推迟,包括与以下方面有关的延迟:
| ● | FDA不同意我们的临床研究的设计或实施; |
| ● | 获得FDA授权开始试验或与FDA就试验设计达成共识; |
40
| ● | 未能或延迟与CROs和临床试验中心达成协议,协议条款可能需要进行广泛谈判,并且不同CROs和试验中心之间可能存在很大差异; |
| ● | 获得一个或多个IRS的批准; |
| ● | IRC拒绝批准、暂停或终止研究中心的试验,阻止招募更多受试者,或撤回对试验的批准; |
| ● | 临床试验方案变更; |
| ● | 临床研究中心偏离试验方案或退出试验; |
| ● | 生产足够数量的候选产品或获得足够数量的联合疗法以用于临床试验; |
| ● | 受试者未能按照我们预期的速度入组或继续参加我们的试验,或未能返回接受治疗后随访; |
| ● | 受试者选择替代治疗,或参与竞争性临床试验; |
| ● | 缺乏足够的资金来继续临床试验; |
| ● | 出现严重或意外药物相关不良反应的受试者; |
| ● | 在其他公司进行的同类药物试验中发生严重不良事件的; |
| ● | 选择需要较长时间的临床观察或结果数据分析的临床终点; |
| ● | 因违反cGMP、法规或其他适用要求,或在生产过程中对候选产品进行感染或交叉污染,FDA要求生产我们的候选产品或其任何组件的工厂暂时或永久关闭; |
| ● | 可能需要或希望对我们的制造工艺进行的任何更改; |
| ● | 第三方临床研究人员失去进行临床试验所需的执照或许可,未按预期时间表或符合临床试验规程、GCP或其他法规要求进行临床试验; |
| ● | 第三方承包商未及时或准确地进行数据收集或分析;或 |
| ● | 第三方承包商因违反监管要求而被FDA或其他政府或监管机构禁止或暂停或以其他方式处罚,在这种情况下,我们可能需要寻找替代承包商,并且我们可能无法使用此类承包商提供的部分或全部数据来支持我们的营销应用。 |
如果临床试验被我们、正在进行此类试验的机构的IRBs或道德委员会、用于此类试验的数据安全监测委员会或FDA或超国家或类似的外国监管机构暂停或终止,我们也可能遇到延迟。
这些主管部门可能会因为一些因素而暂停或终止临床试验,这些因素包括未能按照法规要求或我们的临床方案进行临床试验、对临床试验操作的检查
41
由FDA或类似的外国监管机构在试验地点或地点进行试验,导致实施临床暂停、不可预见的安全问题或不良副作用、未能证明使用药物的益处、政府法规或行政措施的变化,或者缺乏足够的资金来继续临床试验。此外,监管要求和政策可能会发生变化,我们可能需要修改临床试验方案以适应这些变化。修正案可能要求我们向IRBs或道德委员会重新提交我们的临床试验方案进行重新审查,这可能会影响临床试验的成本、时间或成功完成。
完成临床试验的任何延误都将增加我们的成本,减缓我们的开发和审批过程,并危及我们开始产品销售和创造收入的能力,这可能会严重损害我们的业务、财务状况和前景。
如果我们在计划的临床试验中招募患者时遇到延误或困难,我们收到欧盟和英国以外的ONS-5010/LYTENAVA必要的监管批准可能会被推迟或阻止。
如果我们不能根据FDA的要求确定和招募足够数量的合格患者参加这些试验,我们可能无法启动或继续我们计划的临床试验。我们的一些竞争对手可能正在进行候选产品的临床试验,这些候选产品将治疗与ONS-5010/LYTENAVA或我们可能开发的任何未来候选产品相同的适应症,本来有资格参加我们临床试验的患者可以转而注册我们竞争对手的候选产品的临床试验。患者入选还受到其他因素的影响,包括:
| ● | 正在调查的疾病的严重程度; |
| ● | 我们有能力招聘具有适当能力和经验的临床试验研究人员; |
| ● | 在临床试验期间获取候选产品性能的证据所需的侵入性程序; |
| ● | 被调查疾病的批准药物的可获得性和有效性; |
| ● | 有关试验的议定书中规定的资格标准; |
| ● | 分析试验的主要终点所需的患者群体大小; |
| ● | 感知的风险和收益; |
| ● | 努力促进及时登记参加临床试验; |
| ● | 医生不愿鼓励患者参与临床试验; |
| ● | 在治疗期间和治疗后充分监测患者的能力; |
| ● | 我们获得和维持患者同意的能力;以及 |
| ● | 临床试验地点的接近性和可用性适合潜在患者。 |
这些因素可能会因其他情况而加剧。如果我们无法招募足够数量的患者参加我们的临床试验,将导致重大延误,或者可能需要我们完全放弃一项或多项临床试验。我们临床试验的招募延迟可能会导致开发成本增加,这将导致我们公司的价值下降并限制我们获得额外融资的能力。
42
与ONS-5010/LYTENAVA或任何未来候选产品相关的不良副作用或其他安全风险可能会推迟或阻止批准,导致我们暂停或停止临床试验,放弃进一步开发,限制经批准的标签的商业形象,或导致上市批准后的重大负面后果(如果有)。
就像药品的一般情况一样,在计划的临床试验中,可能会有与候选产品相关的副作用和不良事件。我们的临床试验结果可能会显示副作用或意想不到的特征的严重程度和流行程度。候选产品引起的不良副作用可能会导致我们或FDA或超国家或类似的外国监管机构出于多种原因而推迟、暂停或终止临床试验,或者可能导致FDA或类似的外国监管机构的批准延迟,类似于我们在2022年5月撤回我们的BLA,以提供FDA要求的更多信息。如果我们选择或被要求推迟、暂停或终止任何临床试验,ONS-5010/LYTENAVA或任何未来候选产品的商业前景将受到损害,我们从该候选产品产生产品收入的能力将被推迟或取消。临床试验中观察到的严重不良事件可能会阻碍或阻止市场接受ONS-5010/LYTENAVA或任何未来的候选产品。任何这些情况都可能对我们的业务、前景、财务状况和经营结果造成重大损害。
此外,如果ONS-5010/LYTENAVA或任何未来的候选产品在临床试验中与不良副作用或具有意想不到的特征有关,我们可能会选择放弃或将其开发限制在更狭窄的用途或人群中,从风险-效益的角度来看,不良副作用或其他特征不那么普遍、不那么严重或更容易接受,这可能会限制商业预期,如果获得批准。我们还可能被要求根据临床试验的结果修改我们的研究计划。许多最初在早期测试中表现出希望的生物制品后来被发现会产生副作用,阻碍进一步的开发。此外,监管机构可能会得出不同的结论,或者要求进行额外的测试来确认这些决定。
当我们在更大、更长和更广泛的临床试验中测试候选产品时,包括用于其他适应症,或者随着ONS-5010/LYTENAVA或任何未来候选产品的使用在监管部门批准后变得更广泛,患者可能会报告在早期试验中观察到的疾病、伤害、不适和其他不良事件,以及在以前试验中未发生或未检测到的情况。如果这些副作用在开发后期或在获得批准后才为人所知,这些发现可能会对我们的业务、财务状况和前景造成重大损害。
此外,如果在欧盟和英国获得ONS-5010/LYTENAVA的营销授权后,或者如果ONS-5010/LYTENAVA获得FDA批准,或者如果任何未来的候选产品获得营销批准,而我们或其他人后来发现不良副作用,可能会导致一些潜在的重大负面后果,包括:
| ● | 监管部门可以撤销、暂停或更改对该产品的批准; |
| ● | 我们可能会被要求召回一种产品或改变给患者服用该产品的方式; |
| ● | 监管机构可能要求在标签上附加警告,如“黑匣子”警告或禁忌,或发布安全警报、亲爱的医疗保健提供者信函、新闻稿或其他包含警告或有关产品的其他安全信息的通信; |
| ● | 我们可能被要求实施REMS,或创建一份药物指南,概述此类副作用的风险,以便分发给患者,或类似的外国策略; |
| ● | 可对特定产品的营销或促销或该产品或其任何组成部分的制造工艺施加额外限制; |
| ● | 我们可能会被起诉,并对给患者造成的伤害承担责任; |
43
| ● | 这种产品可能会变得不那么有竞争力; |
| ● | 我们的声誉可能会受损。 |
任何这些事件都可能阻止我们实现或保持市场对ONS-5010/LYTENAVA或任何可能获得批准的未来候选产品的接受,并可能严重损害我们的业务、运营结果和前景。
我们不时宣布或公布的临床试验的临时、“顶线”和初步结果可能会随着更多数据的获得而发生变化,并受到审计和验证程序的约束,这可能会导致最终数据发生重大变化。
我们可能会不时地公布临床试验的中期、顶线或初步结果。我们可能完成的临床试验的中期结果可能会受到这样的风险,即随着患者登记的继续和更多患者数据的获得,一个或多个临床结果可能会发生实质性变化。初步或最重要的结果也仍然受到审计和核查程序的制约,这可能会导致最终数据与我们以前公布的初步数据有很大不同。因此,在获得最终数据之前,应谨慎看待中期和初步数据。初步、营收或中期数据与最终数据之间的差异可能会严重损害我们的业务前景,并可能导致我们普通股的交易价格大幅波动。我们还作出假设、估计、计算和结论,作为我们数据分析的一部分,我们可能没有收到或没有机会全面和仔细地评估所有数据。因此,我们报告的主要结果可能与相同研究的未来结果不同,或者一旦收到更多数据并进行充分评估,不同的结论或考虑因素可能会使这些结果合格。
此外,包括监管机构在内的其他人可能不接受或同意我们的假设、估计、计算、结论或分析,或者可能以不同的方式解释或权衡数据的重要性,这可能会影响特定开发计划的价值、特定候选产品或产品的批准或商业化,以及我们公司的总体情况。此外,我们选择公开披露的有关特定研究或临床试验的信息通常是基于广泛的信息,您或其他人可能不同意我们确定的重要信息或其他适当的信息包含在我们的披露中。我们决定不披露的任何信息最终可能会被您或其他人视为对未来关于特定候选产品或我们的业务的决策、结论、观点、活动或其他方面有意义。如果我们报告的中期、主要或初步数据与实际结果不同,或者如果包括监管机构在内的其他人不同意得出的结论,我们获得候选产品批准并将其商业化的能力可能会受到损害,这可能会严重损害我们的业务前景。
与我们候选产品商业化相关的风险
我们面临着激烈的竞争和快速的技术变革,我们的竞争对手可能会开发出与我们类似、更先进或更有效的疗法。其他产品可能会在我们之前获得批准并成功商业化,这可能会对我们的财务状况和我们成功将我们的候选产品商业化的能力产生不利影响。
我们希望进入竞争激烈的药品市场。制药市场上的成功竞争对手已经证明了有效地发现、获得专利、开发、测试和获得产品监管批准的能力,以及有效地将批准的产品商业化、营销和推广的能力。许多公司、大学和其他研究机构都在从事与我们正在开发的产品竞争的产品的开发、专利、制造和营销。这些潜在竞争对手中有许多是经验丰富的大型制药公司,它们享有显著的竞争优势,例如更多的财务、研发、制造、人员和营销资源。这些公司在对候选产品进行临床前测试和临床试验以及获得FDA和其他监管机构对产品的批准方面也拥有更高的品牌认知度和更多经验。
44
我们在美国和国际上都有竞争对手,包括大型跨国制药公司、专业制药公司和生物技术公司。例如,我们预计将与之竞争的一些制药和生物技术公司包括目前营销Lucentis和BEOVU的诺华公司、及其产品EYLEA的Regeneron公司、VABYSMO的营销商Genentech公司、Biogen和Coherus公司及其生物相似制剂Lucentis和Amgen及其生物相似配方EYLEA,所有这些公司都已被批准用于湿性AMD患者。此外,由罗氏公司销售的抗癌药物阿瓦斯丁被用于湿性AMD患者的标签外,尽管它尚未被批准用于这些患者。ONS-5010/LYTENAVA是欧盟和英国批准的非标签阿瓦斯丁以及更昂贵的批准疗法的替代品,并正在其他市场为相同目的开发。此外,这些公司和其他规模较小的生物技术和制药公司也在开发湿性AMD的新疗法,并处于临床前和临床开发的不同阶段。
我们的许多竞争对手拥有更多的财务、技术和其他资源,例如更多的研发人员和经验丰富的营销和制造组织。制药行业的更多合并和收购可能会导致更多的资源集中在我们的竞争对手身上。因此,这些公司可能会在我们尚未获得ONS-5010/LYTENAVA批准的国家/地区获得监管批准,速度比我们更快,在销售和营销他们的产品方面可能更有效。规模较小或处于早期阶段的公司也可能是重要的竞争对手,特别是通过与大型老牌公司的合作安排,我们还与这些公司竞争从这样的大型老牌公司那里获得资源,并与这些公司达成合作安排。我们的竞争对手可能成功地开发、收购或独家授权比我们可能开发的任何候选产品更有效或成本更低的产品;他们还可能获得可能阻止我们产品的专利保护;他们可能会在我们尚未获得ONS-5010/LYTENAVA批准、产品商业化和市场渗透早于我们的国家获得监管批准。我们的竞争对手开发的候选产品可能会使ONS-5010/LYTENAVA和我们的任何其他潜在候选产品变得不经济、不太可取或过时,我们可能无法成功地向竞争对手营销我们的候选产品。
我们预计将有更多的公司寻求批准,生产和销售用于眼科适应症的抗血管内皮生长因子疗法。如果其他抗血管内皮生长因子疗法在我们尚未获得ONS-5010/LYTENAVA批准并在ONS-5010/LYTENAVA之前成功商业化的国家获得批准,我们可能永远无法获得该产品的显著市场份额,我们的收入将会减少,因此,我们的业务、前景和财务状况可能会受到损害。
任何当前或未来候选产品的商业成功将取决于医生、患者、第三方付款人和医学界其他人对市场的接受程度。
即使有FDA、欧盟委员会、MHRA和类似的外国监管机构的必要批准,ONS-5010/LYTENAVA的商业成功 或我们可能追求的任何其他候选产品将在一定程度上取决于医学界、患者和接受ONS-5010/LYTENAVA的第三方付款人或我们的产品具有医疗用途、成本效益和安全性。尽管我们预计ONS-5010/LYTENAVA将以合理的价格定价,但不能保证ONS-5010/LYTENAVA或我们直接或通过战略合作伙伴推向市场的任何其他产品将获得医生、患者、第三方付款人和医学界其他人的市场接受。ONS-5010/LYTENAVA的市场接受度或我们的任何候选产品,如果被批准用于商业销售,将取决于许多因素,包括但不限于:
| ● | 该产品在临床试验中的安全性和有效性,以及与竞争疗法相比的潜在优势; |
| ● | 第三方发布有关我们产品的不良安全性或有效性数据; |
| ● | 任何副作用的流行和严重程度,包括产品批准的标签中包含的任何限制或警告; |
| ● | 批准的临床适应症; |
45
| ● | 认可和接受我们的候选产品而不是竞争对手的产品; |
| ● | 产品获批治疗的疾病或病症的患病率; |
| ● | 治疗成本,特别是与竞争治疗相关的费用; |
| ● | 目标患者人群尝试我们的疗法的意愿以及医生开出这些疗法的意愿; |
| ● | 营销和分销支持的力度以及竞争产品的市场引入时机; |
| ● | 该产品获准纳入医院和管理式护理组织处方集的程度; |
| ● | 有关我们的产品或竞争产品和治疗的宣传; |
| ● | 第三方付款人为ONS-5010/LyTENAVA或我们可能寻求并可能获得批准的任何其他候选产品提供保险和充分报销的程度; |
| ● | 我们保持遵守监管要求的能力;以及 |
| ● | FDA或其他监管机构强制实施的标签或命名。 |
即使ONS-5010/LYTENAVA或我们未来可能开发的任何其他候选产品在临床前和临床试验中显示出同等或更有利的疗效和安全性,市场对ONS-5010/LYTENAVA的接受度或任何其他候选产品在发布后才能完全知晓,可能会受到潜在的不良安全体验和其他候选产品的跟踪记录的负面影响。我们或任何战略许可合作伙伴的努力,让医疗界和第三方付款人了解ONS-5010/LYTENAVA的好处或我们未来的其他候选产品可能需要大量资源,与资金充足的大型制药实体相比可能资源不足,可能永远不会成功。如果ONS-5010/LYTENAVA或我们未来可能开发的任何其他已获批准的候选产品无法获得医生、患者、第三方付款人和医学界其他人的足够接受,我们将无法产生足够的收入来实现或保持盈利。
尽管ONS-5010/LYTENAVA在欧盟和英国获得批准,但阿瓦斯丁在复方药店的标签外重新包装可能会继续,这可能会对我们的业务和财务状况产生实质性的不利影响。
在美国,大约66.3%的新患者开始使用标签外重新包装的贝伐单抗(ASRS 2022会员调查在ASRS NY 2022上公布),尽管这种使用是标签外的,需要在复方药房重新包装。虽然ONS-5010/LYTENAVA在欧盟和英国被批准用于治疗湿性AMD,但ONS-5010/LYTENAVA尚未在美国获得批准。即使ONS-5010/LYTENAVA已获批准对于在欧盟和英国用于治疗湿性AMD的药物,或者即使它在美国或其他国家获得批准用于相同用途,也不能保证我们将有效地减少欧盟、英国、美国或其他主要市场的阿瓦斯丁和其他药物的非标签使用,我们计划在这些市场寻求监管批准并将ONS-5010/LYTENAVA商业化,如果获得批准,直接或通过战略合作伙伴。如果我们不能成功地通过ONS-5010/LYTENAVA减少阿瓦斯丁或其他药物的非标签使用,我们的业务和财务状况可能会受到不利影响。
我们目前没有营销和销售组织。如果我们无法在我们选择保留商业化权利的司法管辖区建立和维持销售和营销能力,我们可能无法产生任何收入。
我们目前没有内部营销或销售组织。我们有一种产品,ONS-5010/LYTENAVA,我们在欧盟和英国获得了营销授权。作为一家公司,我们没有销售和营销经验
46
任何药品。为了成功地将ONS-5010/LYTENAVA或我们获得批准的任何其他产品商业化,我们需要开发这些能力,无论是我们自己还是与其他人合作。如果我们找不到战略许可合作伙伴将ONS-5010/LYTENAVA或我们获得批准的任何其他产品商业化,我们可能需要建立自己的销售和营销组织,拥有技术专长和支持分销能力,将ONS-5010/LYTENAVA或我们可能选择保留商业化权利的主要市场批准的任何其他候选产品商业化。这样做将是昂贵、困难和耗时的。我们已经与Cencora签订了一项战略合作协议,以支持ONS-5010/LYTENAVA在全球的商业推出,目前的重点是欧盟、英国以及美国以外的其他地区(如果获得批准),根据这些协议,Cencora将在欧洲经济区和英国以及美国以外的其他地区提供第三方物流服务和分销,以及医疗信息和药物警戒服务。我们内部销售、营销和分销能力发展的任何失败或延误都将对我们产品的商业化产生不利影响。此外,鉴于我们之前缺乏营销和销售产品的经验,我们对所需销售队伍规模的初步估计可能实质上高于或低于有效地将我们的候选产品商业化所需的销售队伍规模。因此,我们可能需要雇用更多的销售代表和医疗支持联系人,以充分支持ONS-5010/LYTENAVA的商业化,否则我们可能会因雇用超过必要的销售代表而产生额外成本。对于某些地理市场,我们可能会与其他实体合作,以利用他们在当地的营销和分销能力,但我们可能无法以优惠的条款达成此类协议,如果有的话。如果我们未来的协作合作伙伴没有投入足够的资源将我们未来的产品商业化(如果有的话),并且我们无法自行开发必要的营销能力,我们将无法产生足够的产品收入来维持我们的业务。如果我们无法为任何批准的产品建立销售和营销能力,无论是我们自己还是通过合作,包括通过与Cencora的战略合作协议,我们的运营结果都将受到负面影响。
我们可能需要与其他能够为候选产品的开发和商业化提供能力和资金的公司结成联盟。如果我们不能以有利的条件建立或维持这些联盟,我们的业务可能会受到损害。
由于我们是一家商业化前的生物制药公司,我们发现有必要与其他公司结盟。例如,我们就ONS-5010/LYTENAVA的咨询服务签订了一项战略伙伴关系协议,根据该协议,我们在终止此类协议之前每月支付一笔费用。我们还签署了临床试验的服务协议,以及我们的生物相似候选产品的共同开发和许可协议,并可能为ONS-5010/LYTENAVA寻找战略合作伙伴。未来,我们可能还会发现有必要与主要制药公司结成其他联盟或合资企业,共同开发和/或商业化我们正在开发的非活性生物相似产品以及我们可能开发的任何其他产品。在这样的联盟中,我们希望我们的合作伙伴在监管事务以及销售和营销方面提供实质性的能力。我们可能无法成功达成任何此类联盟,包括与ONS-5010/LYTENAVA的潜在合作伙伴达成协议。即使我们确实成功地获得了这样的联盟,我们也可能无法维持这种联盟,例如,如果候选产品的开发或批准被推迟,或者批准的产品的销售令人失望。我们也可能不时与我们的合作伙伴就我们在此类安排下的权利和义务发生分歧。如果我们不能成功解决与合同合作伙伴的分歧,可能会对我们的业务或声誉造成负面影响。此外,如果我们无法确保或维持这样的联盟,我们可能没有必要的能力来继续或完成我们候选产品的开发并将其推向市场,这可能会对我们的业务产生不利影响。
除了商业化能力外,我们还可以依靠与其他公司的联盟,为我们的候选产品的开发和潜在的商业化提供大量的额外资金。我们可能无法以优惠的条件从这些联盟获得资金,即使这样,我们也可能低估了我们的开发成本,这些资金可能不足以在内部开发特定的候选产品或将其推向市场。如果不能将ONS-5010/LYTENAVA或我们未来可能开发的任何其他候选产品推向市场,将阻止我们产生销售收入,这将严重损害我们的业务。此外,加入这些联盟的任何延迟都可能推迟我们候选产品的开发和商业化,并降低它们的竞争力,即使它们进入市场。因此,我们的业务和经营业绩可能会受到损害。
47
新批准的产品的第三方覆盖和报销状态不确定。如果不能为新产品或现有产品获得或保持足够的保险和报销,可能会限制我们营销这些产品的能力,并降低我们创造收入的能力。
ONS-5010/LYTENAVA的定价、覆盖范围和报销,或我们未来可能开发的任何其他可能获得批准的产品,可能不足以支持我们的商业基础设施。我们的每位患者的价格可能不足以收回我们的开发成本,并有可能实现盈利。如果获得批准,政府和私人付款人提供的保险范围和足够的报销对于大多数患者能够负担得起像我们这样的昂贵治疗是至关重要的。因此,ONS-5010/LYTENAVA或我们可能获得批准的任何其他候选产品的销售将在很大程度上取决于ONS-5010/LYTENAVA和我们可能获得批准的任何其他候选产品的成本将在多大程度上由第三方付款人支付,如健康维护、管理式医疗机构、药房福利和类似的医疗保健管理组织、私人健康保险公司和其他第三方付款人。如果不提供保险和报销,或仅在不充分的水平上提供,我们可能无法成功地将ONS-5010/LYTENAVA或我们可能获得批准的任何其他候选产品商业化。覆盖范围的决定可能取决于临床和经济标准,当更成熟或更低成本的治疗替代品已经可用或随后可用时,这些标准不利于新药产品。即使提供了保险,批准的报销金额也可能不足以让我们实现投资回报。
与第三方付款人覆盖范围和新批准产品的报销有关的不确定性很大。在美国,第三方付款人在决定新药和生物制品的承保和报销范围方面发挥着重要作用。联邦医疗保险计划涵盖某些65岁或65岁以上的人,或者那些残疾或患有终末期肾脏疾病的人。医疗补助计划因州而异,涵盖某些经济能力有限和/或某些残疾的个人和家庭。联邦医疗保险和医疗补助计划越来越多地被用作第三方付款人如何制定药品和生物制品的保险和报销政策的典范。目前很难预测,如果获得批准,第三方付款人将就我们的生物相似产品候选产品的承保范围和报销做出什么决定。此外,在美国,第三方付款人之间没有统一的生物制品承保和报销政策。因此,生物制品的承保范围和报销范围因付款人而异。因此,寻求有利的承保范围确定的过程通常既耗时又昂贵,可能需要我们为每个付款人单独提供使用我们的产品的科学和临床支持,而不能保证获得承保和足够的补偿。我们无法迅速从第三方付款人那里获得我们开发的任何经批准的产品的承保范围和有利可图的报销率,这可能会对我们的经营业绩、我们筹集产品商业化所需资金的能力以及我们的整体财务状况产生不利影响。
在美国以外,制药企业通常受到广泛的政府价格管制和其他市场监管。报销和医疗保健支付制度因国家而异,许多国家对特定产品和疗法设定了价格上限。欧盟为欧盟成员国提供了各种选择,以限制其国家健康保险制度提供补偿的医疗产品的范围,并控制供人使用的医疗产品的价格。欧盟成员国可以批准医药产品的特定价格,可以拒绝按制造商设定的价格偿还产品,或者转而对将医药产品投放市场的公司的盈利能力采取直接或间接控制的制度。许多欧盟成员国还定期审查其医药产品的报销程序,这可能会对报销状况产生不利影响。
此外,为了在一些欧洲国家(包括一些欧盟成员国)获得我们产品的报销,我们可能需要汇编额外的数据,将我们产品的成本效益与其他现有疗法进行比较。在一些欧盟成员国,包括代表较大市场的国家,这种医疗产品的健康技术评估或HTA正在成为定价和补偿程序中越来越常见的部分。HTA过程是评估特定医疗产品在单个国家的国家医疗保健系统中的治疗、经济和社会影响的程序。HTA的结果往往会影响欧盟个别成员国主管当局给予这些医药产品的定价和补偿地位。目前,欧盟成员国之间的定价和补偿决定受到特定医药产品的HTA影响的程度各不相同。
48
我们相信,欧盟、加拿大和其他国家对成本控制举措的日益重视已经并将继续给我们的候选产品的定价和使用带来压力。额外的外国价格管制或定价法规的其他变化可能会限制我们能够向我们的候选产品收取的费用。因此,在美国以外的市场,与美国相比,我们产品的报销可能会减少,可能不足以产生商业上合理的收入和利润。
此外,美国和海外的政府和第三方付款人加大努力控制医疗成本,可能会导致此类组织限制已批准新产品的承保范围和报销水平,因此,它们可能无法为ONS-5010/LYTENAVA或我们未来可能开发的任何其他可能获得批准的候选产品支付或提供足够的付款。我们预计在销售ONS-5010/LYTENAVA或我们未来可能开发的任何其他候选产品(如果获得批准)方面将面临定价压力,原因是管理型医疗保健的趋势、健康维护组织的影响力越来越大以及额外的立法变化。
在标签外使用或误用我们的产品可能会损害我们在市场上的声誉,导致导致代价高昂的产品责任诉讼的伤害,和/或如果我们未能遵守法规要求或遇到任何产品的意外问题,我们将受到惩罚。
我们只能推广或推销ONS-5010/LYTENAVA在欧洲经济区和英国,或我们的任何其他可能被批准的候选产品,用于其特别批准的适应症。我们将培训我们的营销和销售队伍,防止宣传ONS-5010/LYTENAVA或我们的任何其他候选产品在批准的使用适应症之外的用途,即所谓的“非标签用途”。然而,我们不能阻止医生在标签外使用我们的产品,如果医生认为他或她独立的专业医学判断是合适的。此外,在FDA或类似的外国监管机构批准的适应症之外使用我们的产品可能无法有效治疗此类疾病。ONS-5010/LYTENAVA或我们未来的候选产品的任何此类标签外使用都可能损害我们在医生和患者中的市场声誉。如果医生试图将我们的产品用于这些未经批准的用途,也可能会增加患者受伤的风险,这可能会导致产品责任诉讼,这可能需要大量的财务和管理资源,并可能损害我们的声誉。
在美国获得批准的任何候选产品的广告和促销活动都将受到FDA、美国联邦贸易委员会、司法部或司法部、美国卫生与公众服务部监察长办公室(HHS)、州总检察长、美国国会议员和公众的严格审查。此外,任何在美国境外获得批准的候选产品的广告和推广都将受到可比的外国实体和利益相关者的严格审查。在……里面 的 欧洲经济区, 的 广告 和 促进 的 药用 产品 是 主题 到 两 欧盟 和 欧洲经济区国家 规律 促进 的 药用 产品, 相互作用 使用 医生 和 其他 医疗保健 专业人士, 误导 和 比较 广告 和 不公平 商业 实践 欧盟法律确立了医药产品广告和促销的一般要求,如处方药产品的直接面向消费者的广告。然而,细节由个人的规定来管理欧洲经济区国家而且不同的国家可能会有所不同。例如,适用的法律要求与医药产品有关的促销材料和广告符合产品的产品特性摘要,或SmPC,这可能需要与MA相关的国家主管当局的批准。SmPC是向医生提供有关安全和有效使用产品的信息的文件。不符合SmPC的促销活动被认为是标签外的,在欧盟是被禁止的。违规行为,包括实际或据称宣传我们的产品用于未经批准或标签外的用途,将受到FDA、美国司法部或类似外国当局的执行函、调查和调查以及民事和刑事制裁。任何实际或据称不遵守标签和宣传要求的行为都可能导致罚款、警告信、强制向医疗从业者提供更正信息、禁令或民事或刑事处罚。
ONS-5010/LYTENAVA或我们任何其他未来候选产品的受影响人群可能比我们或第三方目前预测的要少,这可能会影响我们候选产品的潜在市场。
我们对患有我们正在寻求治疗的疾病的人数的预测,以及有可能从我们的候选产品治疗中受益的这些疾病患者的子集,是基于我们的
49
对这些疾病的知识和理解。这些估计可能被证明是不正确的,新的研究可能会进一步降低这种疾病的估计发病率或流行率。美国、欧洲经济区、英国和其他地区的患者数量可能会低于预期,可能无法接受我们的候选产品治疗,或者患者可能变得越来越难以识别和接触,所有这些都将对我们的业务、财务状况、运营结果和前景产生不利影响。此外,即使我们的候选产品获得批准,FDA或其他监管机构也可能会将其批准的适应症限制在我们针对候选产品开发的人群中更狭窄的用途或亚群。
我们候选产品的全部潜在市场机会最终将取决于一系列因素,包括最终标签中包含的诊断和治疗标准(如果被批准用于特定适应症的销售)、医学界的接受度、患者准入以及产品定价和报销。发病率和流行率估计往往基于不准确和可能不适当的信息和假设,方法具有前瞻性和投机性。我们在为我们的目标适应症制定估计发病率和流行范围时所使用的过程涉及从多个来源整理有限的数据。因此,应谨慎看待本Form 10-k年度报告或我们提交给美国证券交易委员会(SEC)或美国证券交易委员会的其他文件中包括的发病率和患病率估计。此外,本年度报告中使用的数据和统计信息或我们提交给美国证券交易委员会的其他文件中使用的数据和统计信息,包括从这些数据和统计信息中得出的估计,可能与我们的竞争对手所做的信息和估计有所不同,也可能与独立来源进行的当前或未来的研究不同。
如果ONS-5010/LYTENAVA或我们未来的任何其他候选产品的发布进一步推迟或不成功,或者如果我们市场产品的销售没有达到目前预期的水平,我们可能面临与我们制造设施以及第三方或我们的合作伙伴的设施的库存过剩或未使用的产能相关的成本。
如果我们的候选产品停产或其临床开发被进一步推迟,如果我们的上市产品或新产品候选产品的新适应症的推出被推迟或没有发生,或者如果此类产品被推出但发布不成功,或者产品随后被召回或营销批准被撤销,我们可能不得不承担100%的相关间接成本和效率低下,以及为我们提供服务的第三方合同制造商的类似成本。例如,在2022年5月,我们自愿撤回了我们的BLA,以提供FDA要求的更多信息。我们于2022年8月30日向FDA重新提交了ONS-5010/LYTENAVA的BLA。2023年8月29日,我们收到了一份CRL,其中FDA得出结论,由于几个CMC问题、批准前制造检查的公开观察以及缺乏实质性证据,FDA在本审查周期内不能批准BLA。在随后与FDA的A类会议上,我们了解到FDA要求成功完成评估ONS-5010/LYTENAVA的额外的充分和良好控制的临床试验,以及CRL中指示的额外要求的CMC数据,以批准ONS-5010/LYTENAVA用于湿性AMD。为了回应这一点,我们进行了另一项临床试验,挪威八号。2024年11月,我们报告说,ONS-5010/LYTENAVA在第8周没有达到FDA特别协议评估(SPA)中规定的预先指定的非劣势终点。然而,试验的初步数据显示,ONS-5010/LYTENAVA的视力和生物活性有所改善,并继续保持良好的安全性。对数据的分析正在进行中,因为正在收集北欧八国的第三个月数据,预计将于2025年1月提供。在收到北欧8号的3个月全部疗效和安全性结果后,我们计划在2025年第一季度重新提交ONS-5010/LYTENAVA的BLA申请。此外,如果我们或我们未来的合作伙伴遇到库存过剩的情况,可能需要冲销或注销该等过剩库存,或产生与制造该产品的工厂相关的减值费用,这可能会对我们的经营业绩产生不利影响。
50
与我们对第三方的依赖有关的风险
我们依赖第三方进行临床前和临床试验,并为我们执行其他任务。如果这些第三方不能成功履行合同职责、在预期期限内完成或遵守监管要求,我们可能无法在欧盟和英国以外获得ONS-5010/LYTENAVA或我们的任何其他候选产品的监管批准,或将ONS-5010/LYTENAVA或我们的任何其他候选产品商业化,我们的业务可能会受到损害。
我们一直依赖并计划继续依赖CRO来监控和管理我们正在进行的临床开发计划的数据。我们依赖这些方来执行我们的临床前和临床试验,我们只能控制他们活动的某些方面。然而,我们有责任确保我们的每一项研究都是按照适用的协议、法律、法规和科学要求和标准进行的,我们对CRO的依赖不会免除我们的监管责任。我们和我们的CRO和其他供应商必须遵守cGMP、GCP和GLP,这些法规和指南由FDA、EEA国家的主管当局和类似的外国监管机构执行,适用于我们临床开发中的所有候选产品。监管当局通过定期检查研究赞助商、主要调查人员、研究地点和其他承包商来执行这些规定。如果我们、我们的任何CRO、服务提供商或调查人员未能遵守适用的法规或GCP,在我们的临床前和临床试验中产生的数据可能被认为是不可靠的,FDA、MHRA、EMA、欧盟委员会或类似的外国监管机构可能会要求我们在批准我们的营销申请之前进行额外的临床前和临床试验。我们不能向您保证,在特定监管机构进行检查后,该监管机构将确定我们的任何临床试验是否符合GCP要求。此外,我们的临床试验必须使用根据cGMP法规生产的产品进行。任何参与方或我们自己如果不遵守这些规定,可能需要我们重复临床试验,这将推迟监管批准过程。此外,如果我们的CRO或任何其他参与方违反了超国家、国家、联邦或州的欺诈和滥用或虚假索赔法律法规或医疗保健隐私和安全法律,我们的业务可能会受到影响。
如果我们与任何这些第三方CRO的关系终止,我们可能无法与替代CRO达成安排,或以商业合理的条款这样做。此外,我们的CRO不是我们的员工,除了根据我们与此类CRO达成的协议向我们提供的补救措施外,我们无法控制他们是否为我们正在进行的临床前和临床项目投入了足够的时间和资源。如果CRO未能成功履行其合同职责或义务或未能在预期期限内完成,如果CRO需要更换CRO,或者如果他们获得的数据的质量或准确性因未能遵守我们的方案、监管要求或其他原因而受到影响,我们的临床试验可能会被延长、推迟或终止,我们可能无法获得监管部门对我们的候选产品的批准或成功将其商业化。CRO还可能产生比预期更高的成本。因此,我们的运营结果和我们候选产品的商业前景将受到损害,我们的成本可能会增加,我们创造收入的能力可能会被推迟。
更换或增加额外的CRO涉及额外的成本,并且需要管理时间和重点。此外,当新的CRO开始工作时,有一个自然的过渡期。因此,可能会出现延迟,这可能会对我们满足期望的临床开发时间表的能力产生负面影响。我们未来可能会遇到挑战或延误,这些延误或挑战可能会对我们的业务、财务状况和前景产生不利影响。
由于我们可能依赖第三方,其中一些是或可能是生产和供应我们的候选药物的临床前和临床开发材料和商业供应的唯一来源供应商,我们的供应可能会变得有限或中断,或者可能不是令人满意的数量或质量。如果我们目前的合同制造商不能在必要的数量或质量水平上生产我们的候选产品,以满足临床前、临床和商业供应,我们的业务可能会受到损害。
我们目前依赖第三方合同制造商提供我们当前和未来的临床试验产品材料和用品,内部没有生产ONS-5010/LYTENAVA或任何其他候选产品用于临床开发的基础设施或能力,我们缺乏生产ONS-5010/LYTENAVA或任何临床或商业规模候选产品的资源和能力。如果我们不能生产或已经生产了足够的ONS-5010/LYTENAVA或任何其他候选产品,我们的开发
51
努力将被推迟,这将对我们的业务和前景产生不利影响。我们选择了Fujifilm DiSynth BioTechnologies或Fujifilm来制造和供应我们未来临床开发的候选产品,并建立ONS-5010/LYTENAVA和我们候选产品的商业供应。如果在整个行业产能短缺期间,我们对合同制造服务的需求增加,我们可能无法及时或在商业上可行的条件下生产ONS-5010/LYTENAVA或我们的候选产品。如果需要,建立更多或替代供应商,包括富士胶片,可能不会很快完成。与我们对第三方制造和供应合作伙伴的依赖相关的制造或供应中断导致的任何延误都可能阻碍、延迟、限制或阻止我们的药物开发和商业化努力。由于需要更换第三方制造商而导致正在进行的临床试验的候选产品供应的任何重大延迟或中断,都可能会大大推迟我们的临床试验、产品测试以及潜在的监管部门对我们候选产品的批准,这可能会损害我们的业务和运营结果。
依赖第三方制造商会带来额外的风险,包括依赖第三方的法规遵从性和质量保证、第三方可能违反制造协议以及第三方可能在成本高昂或对我们造成不便的时候终止或不续订协议。此外,第三方制造商可能无法遵守美国以外的cGMP或类似的监管要求。我们的第三方制造商未能或未能遵守适用的法规可能会导致对我们的制裁,包括罚款、禁令、民事处罚、延迟、暂停、更改或撤回批准、吊销许可证、扣押或召回产品、运营限制和刑事起诉,其中任何一项都可能对ONS-5010/LYTENAVA或我们可能开发的任何其他候选产品的供应造成不利影响。任何未能或拒绝为我们可能开发的候选产品提供组件的情况都可能推迟、阻止或损害我们的临床开发或商业化努力。如果我们的合同制造商违反或终止与我们的制造协议,受影响的产品或候选产品的开发或商业化可能会推迟,这可能会对我们的业务产生不利影响。我们制造商的任何改变都可能代价高昂,因为任何新安排的商业条款都可能不那么有利,而且与必要技术和工艺转让有关的费用可能会很高。
我们可能需要与其他第三方签订合同制造ONS-5010/LYTENAVA或任何其他可能获得批准的候选产品的协议,以生产满足预期市场需求所需的数量。如果我们无法生产和储存ONS-5010/LYTENAVA或我们可能获得批准的任何其他候选产品,数量足以满足推出ONS-5010/LYTENAVA或这些候选产品的要求,或满足未来的需求,我们的收入和毛利率可能会受到不利影响。尽管我们相信我们不会有任何材料供应问题,但我们不能确定我们是否能够获得ONS-5010/LYTENAVA或我们的候选产品的长期供应安排,或者以可接受的条件生产这些产品所用的材料。如果我们无法安排第三方制造,或无法以商业上合理的条款这样做,我们可能无法完成ONS-5010/LYTENAVA或任何其他我们可能获得批准的候选产品的开发或销售。
任何影响ONS-5010/LYTENAVA生产的不利发展都可能大幅增加我们的成本,并限制此类候选产品的供应。
我们的ONS-5010/LYTENAVA和我们的其他候选单抗产品的制造过程是复杂的、严格监管的,并受到几个风险的影响,包括但不限于:
| ● | 未能与CMO和适用的设备供应商签订合同; |
| ● | 因污染、设备故障或设备安装或操作不当、供应商或操作员失误造成的产品损失; |
| ● | 侵犯第三方与制造和质量检测有关的知识产权; |
| ● | 未能达到或保持符合MHRA、EEA当局或FDA关于接受适用的制造设施的要求;以及 |
52
| ● | 劳动力短缺、自然灾害和停电。 |
即使ONS-5010/LYTENAVA或我们的任何候选产品的正常制造工艺稍有偏差,也可能导致产量下降、产品缺陷和其他供应中断。此外,如果我们需要更换CMO,这将增加更换制造地点的时间以及财力和人力资源。如果在ONS-5010/LYTENAVA或我们的候选产品中或在我们的制造设施中发现微生物、病毒或其他污染,我们的设施可能需要关闭很长一段时间以调查和补救污染。
任何影响ONS-5010/LYTENAVA或我们候选产品制造运营的不利发展都可能导致发货延迟、库存短缺、批次故障、撤回或召回或其他供应中断。我们还可能不得不进行库存注销,并为ONS-5010/LYTENAVA或不符合规格的候选产品产生其他费用和支出,进行昂贵的补救努力或寻求更昂贵的制造替代方案。
ONS-5010/LYTENAVA在欧盟和英国的商业化依赖于第三方,如果获得批准,我们可能依赖第三方在美国进行ONS-5010/LYTENAVA的商业化。未能在相关市场实现商业化可能会损害我们的业务和经营业绩。
我们继续就ONS-5010/LYTENAVA在美国以外的许可和/或共同开发权进行谈判。我们可能无法成功地与这些各方达成协议,其条款对我们公司有利,正如我们预期的那样。我们没有任何ONS-5010/LYTENAVA商业化的许可协议,仅将ONS-5010/LYTENAVA许可给我们的中国合资企业,用于在大中国进行商业化。我们目前的安排是针对我们非活跃的生物相似候选产品,除了一项针对ONS-3010的美国安排外,都是针对规模较小的美国以外市场,否则我们不会打算将我们的生物相似候选产品商业化,如中国和印度等。如果与我们签订商业化安排的任何实体未能在其各自的许可司法管辖区内做出商业上合理的努力来营销和销售我们批准的产品,或者以其他方式无效地这样做,我们的业务将受到损害,我们可能无法通过谈判、诉讼、仲裁或终止许可协议来充分补救损害。
我们还与Cencora建立了战略合作关系,为预期的ONS-5010/LYTENAVA在欧洲、英国和美国的商业推出做准备,如果获得FDA的批准,根据这一关系,Cencora将在欧洲和英国以及美国以外的其他地区提供全面的推出支持,包括药物警戒、法规事务、质量管理、市场准入支持、进口、现场解决方案、第三方物流服务和分销、以及医疗信息。如果Cencora无法根据战略关系提供服务,或以其他方式违反我们与他们达成的协议条款,我们在欧洲经济区和英国的商业化努力可能会推迟或受到不利影响,我们的业务、财务状况和前景可能会受到不利影响。
此外,与我们所依赖的第三方就其商业化努力是否充分而发生的任何纠纷,都将极大地转移我们高级管理层对其他商业活动的注意力,并将需要我们产生巨额法律费用,以资助诉讼或仲裁程序。
如果我们的任何许可协议或我们与Cencora的战略关系终止,我们可能需要在这些市场找到另一个合作伙伴来商业化,并在某些情况下制造任何候选产品。此外,在任何此类终止后,我们的合同对手方仍有权将这些候选产品在这些市场上商业化,这可能会影响我们在相同市场上商业化的能力。
我们对第三方的依赖要求我们分享我们的商业秘密,这增加了竞争对手发现这些秘密或我们的商业秘密被挪用或披露的可能性。
因为我们依赖并将继续依赖第三方生产我们当前和未来的候选产品,我们希望继续与第三方合作开发我们当前和任何未来的产品
53
对于候选产品,我们有时必须与他们分享商业秘密。我们寻求通过在开始研究或披露专有信息之前与我们的顾问、员工、CRO、第三方承包商和顾问签订保密协议、材料转让协议、咨询协议或其他类似协议来部分保护我们的专有技术。这些协议通常限制第三方使用或披露我们的机密信息的权利,包括我们的商业秘密。尽管在与第三方合作时采用了合同条款,但共享商业秘密和其他机密信息的需要增加了此类商业秘密被我们的竞争对手知晓、被无意中纳入其他人的技术中、或在违反这些协议的情况下被披露或使用的风险。我们的员工、与我们共享我们设施的第三方员工或我们聘请进行研究、临床试验或制造活动的第三方顾问和供应商的任何有意或无意的披露,或第三方对我们的商业秘密或专有信息的挪用(例如通过网络安全漏洞),都可能使竞争对手复制或超过我们的技术成就,从而侵蚀我们在市场上的竞争地位。此外,在未经授权使用或披露的情况下,可能不存在适当的补救措施。鉴于我们的专有地位在一定程度上基于我们的专有技术和商业秘密,竞争对手发现我们的商业秘密或其他未经授权的使用或披露将损害我们的竞争地位,并可能对我们的业务和运营结果产生不利影响。
此外,这些协议通常限制我们的顾问、员工、第三方承包商和顾问发布可能与我们的商业秘密相关的数据的能力,尽管我们的协议可能包含某些有限的发布权。对未经授权使用我们或我们许可人的知识产权的行为进行监管是困难、昂贵和耗时的,我们可能无法确定任何未经授权使用的程度。此外,执行一方非法披露或挪用商业秘密的主张是困难、昂贵和耗时的,结果是不可预测的。此外,美国国内外的一些法院不太愿意或不愿意保护商业秘密。尽管我们努力保护我们的商业秘密,但我们的竞争对手可能会通过违反我们与第三方的协议、独立开发或由我们的任何第三方合作者发布信息来发现我们的商业秘密。竞争对手发现我们的商业秘密将损害我们的竞争地位,并对我们的业务产生不利影响。
我们目前为临床试验服务聘请单一来源供应商,并为未来ONS-5010/LYTENAVA的药物物质制造、填充剂制造和产品测试聘请多来源供应商。失去这些供应商中的任何一个,或任何未来的单一来源供应商,都可能损害我们的业务。
ONS-5010/LYTENAVA由Ajinomoto Bio-Pharma Services,Inc.或Ajinomoto填充完成。因此,我们严重依赖味之素为我们提供充足的ONS-5010/LYTENAVA。此外,我们选择了Fujifilm DiSynth BioTechnologies进行所有未来ONS-5010/LYTENAVA原料药的生产。尽管我们认为这些服务还有其他来源,但我们不能向您保证,确定和建立新的关系不会导致ONS-5010/LYTENAVA的开发明显延迟。此外,我们可能无法以商业上合理的条款与其他供应商达成安排,或者根本不能。推迟ONS-5010/LYTENAVA的开发,或不得不与不同的第三方以比我们与现有供应商更优惠的条款签订新协议,可能会对我们的业务产生负面影响。
有关知识产权的风险
如果我们侵犯或被指控侵犯第三方的知识产权,我们的业务可能会受到损害。第三方对知识产权侵权的索赔可能会阻碍或推迟我们的开发和商业化努力。
我们的商业成功在很大程度上取决于避免侵犯第三方的专利和专有权利。制药业涉及专利和其他知识产权的诉讼和其他程序很多,包括向美国专利商标局(USPTO)和相应的外国专利局提起的专利侵权诉讼、干预、异议和复审程序。在我们开发候选产品的领域中,存在着大量由第三方拥有的美国和外国颁发的专利和未决的专利申请。随着制药行业的扩张和专利的颁发,我们的候选产品可能会受到侵犯第三方专利权的索赔的风险增加。
54
我们的研究、开发和商业化活动可能侵犯或以其他方式违反或被声称侵犯或以其他方式违反由其他方拥有或控制的专利。
第三方可能会声称我们在未经授权的情况下使用他们的专有技术。可能存在与使用或制造我们的候选产品相关的第三方专利或专利申请,这些专利或专利申请要求与我们的候选产品的成分、配方、制造方法或治疗方法有关。我们已经对我们的主要候选产品的第三方专利进行了专利搜索,并不知道有第三方专利家族声称如果有效和可执行,可以被解释为涵盖这些候选产品或它们各自的制造或使用方法。我们不能保证我们的任何分析都是完整和彻底的,也不能确保我们已经确定了美国和国外与我们的候选产品商业化相关或必要的每一项专利和待定申请。此外,由于专利申请可能需要多年的时间才能发布,因此可能存在当前正在处理的专利申请,这些申请可能会在以后导致已颁发的专利涵盖我们的候选产品。如果专利的有效期超过我们期望的产品发布日期,则任何有效且可强制执行的权利要求涵盖我们的一个或多个候选产品的专利的存在都可能导致我们将候选产品引入美国市场的能力大幅延迟。
也可能有已经提交但尚未发表的专利申请,如果这些申请作为专利发布,它们可能会被指控不利于我们。例如,在大多数情况下,今天提交的专利至少在18个月内不会为行业参与者所知,因为大多数司法管辖区适用的专利规则不要求在提交后18个月之前公布专利申请。此外,我们可能会面临非执业第三方实体的索赔,这些实体没有相关的产品收入,我们自己的专利组合可能对他们没有威慑作用。此外,专利权利要求的范围由法院解释,解释并不总是统一的。如果我们因专利侵权而被起诉,我们需要证明我们的候选产品、产品或方法没有侵犯所声称的专利主张,或者这些主张是无效的和/或不可执行的,我们可能不会成功。
很难证明一项专利是无效的或不可强制执行的。例如,在美国,证明无效性需要出示明确和令人信服的证据,以推翻对已颁发专利享有的有效性的推定。在欧盟法院的诉讼中,证明专利无效的责任通常也落在声称专利无效的一方身上。即使我们在诉讼中胜诉,我们也可能会招致巨额成本,我们的管理层和科学人员的时间和注意力可能会被转移,这可能会损害我们的业务。此外,我们可能没有足够的资源来圆满完成这些行动。
第三方可能对我们提出索赔,这将导致我们产生大量费用,如果胜诉,可能导致我们支付大量金钱损害赔偿。知识产权诉讼的结果受到不确定因素的影响,这些不确定因素事先无法充分量化。如果对我们提起专利侵权诉讼,我们可能被迫停止或推迟作为诉讼标的的产品或候选产品的研究、开发、制造或销售。最终,如果由于实际或威胁的专利侵权索赔,我们无法以商业上可接受的条款或根本不能获得许可,我们可能会被阻止将产品商业化,或被迫停止某些方面的业务运营。如果由于专利侵权索赔或为了避免潜在索赔,我们选择或被要求向第三方寻求许可,则这些许可可能无法以可接受的条款获得或根本无法获得。即使我们能够获得许可,许可也可能迫使我们支付大量许可费或版税,或者两者兼而有之,授予我们的权利可能是非排他性的,这可能会导致我们的竞争对手获得相同的知识产权。
对我们提出索赔的各方可能会获得禁令或其他公平救济,这可能会有效地阻止我们进一步开发和商业化我们的一个或多个候选产品。对这些索赔的辩护,无论其是非曲直,都可能涉及巨额诉讼费用,并可能从我们的业务中大量转移员工资源。如果针对我们的侵权索赔成功,我们除了被禁止进入市场外,还可能不得不支付巨额金钱损害赔偿,包括故意侵权的三倍损害赔偿和律师费、支付特许权使用费、重新设计我们的侵权产品或从第三方获得一个或多个许可,这可能是不可能的,或者需要大量的时间和金钱支出。
除了针对我们的侵权索赔外,我们还可能成为其他专利诉讼和其他诉讼的一方,包括美国专利商标局宣布或批准的干扰、派生或授权后诉讼以及在
55
外国,关于我们当前或未来产品的知识产权。任何此类诉讼的不利结果可能要求我们停止使用相关技术,或试图从胜利方那里获得相关技术的许可权,或者可能导致我们失去宝贵的知识产权。如果胜利方不以商业上合理的条款向我们提供许可,如果提供任何许可,我们的业务可能会受到损害。诉讼或其他程序可能会失败,即使成功,也可能导致巨额成本,并分散我们的管理层和其他员工的注意力。我们还可能卷入与其他人关于知识产权所有权的纠纷。
第三方可在美国或其他司法管辖区提交专利期限延长申请,并在欧盟国家(包括瑞士)提交补充保护证书,以寻求延长某些专利保护,如果批准,可能会干扰或推迟我们一个或多个候选产品的发布。
对我们来说,任何专利诉讼或其他程序的成本,即使解决对我们有利,也可能是巨大的。专利诉讼和其他诉讼可能会失败,即使成功,也可能导致巨额成本,并分散我们的管理层和其他员工的注意力。专利诉讼或其他诉讼的发起和继续带来的不确定性可能会削弱我们在市场上的竞争能力。
所谓的“潜艇”专利可能会授予我们的竞争对手,这可能会显著改变我们对发射时间的预期,缩小我们预计的市场规模,导致我们修改我们的产品或工艺,或者完全阻止我们进入市场。
术语“潜艇”专利在制药行业和其他行业中被用来表示从美国申请颁发的专利,该专利的有效申请日期在1995年6月8日之前,但在授予之前没有公布、公开或可用。潜艇专利给我们的业务增加了巨大的风险和不确定性。我们的竞争对手可能被授予潜艇专利,涵盖我们的候选产品,从而导致重大的市场进入延迟,削弱我们营销候选产品的能力,或导致我们放弃候选产品的开发和/或商业化。
一项或多项潜艇专利的颁发可能会损害我们的业务,因为它会导致我们将候选专利引入美国市场的能力大幅延迟。
我们可能无法识别相关专利,或可能错误地解释专利的相关性、范围或到期时间,这可能会对我们开发和营销产品的能力产生不利影响。
我们不能保证我们的任何专利搜索或分析,包括但不限于相关专利的识别、专利权利要求的范围或相关专利的到期,都是完整和彻底的,我们也不能确保我们已经识别了与我们的候选产品在任何司法管辖区的商业化相关或必要的、在美国和国外的每一项专利和待决申请。
专利权利要求的范围取决于对法律的解释、专利中的书面披露和专利的起诉历史。我们对专利或待决申请的相关性或范围的解释可能是不正确的,这可能会对我们营销我们的产品或候选产品的能力产生负面影响。我们可能会错误地确定我们的产品不受第三方专利的保护。此外,我们可能会得出结论,知情的法院或其他法庭将根据现有技术、启用、书面描述或其他理由裁定相关第三方专利的权利要求无效,并且该结论可能是不正确的,这可能会对我们的产品或管道分子的营销能力产生负面影响。
许多专利可能涵盖上市产品,包括但不限于产品的组成、使用方法、配方、细胞系结构、载体、生长介质、生产工艺和纯化工艺。与参考产品的生产和销售有关的所有专利及其到期日的确定极其复杂,需要有关司法管辖区的复杂法律知识。可能不可能确定与某一上市产品相关的所有司法管辖区的所有专利。我们可能无法识别所有相关专利,或错误地确定其到期日期,这可能会对我们开发和营销产品的能力产生负面影响。
56
我们未能识别和正确解释相关专利,可能会对我们的产品开发、营销和商业化能力产生负面影响。
我们可能会卷入保护或强制执行任何未来专利的诉讼,这可能是昂贵、耗时和不成功的。
我们已经颁发了专利,如果我们真的获得了额外的专利,我们可能会发现竞争对手正在侵犯这些专利。执行我们的专利可能需要昂贵而耗时的诉讼。如果我们或我们的合作伙伴之一对第三方提起法律诉讼,以强制执行涵盖我们的候选产品之一的专利,被告可以反诉覆盖我们候选产品的专利无效和/或不可强制执行。在美国的专利诉讼中,被告声称无效和/或不可执行的反诉很常见。质疑有效性的理由可能是据称未能满足几项法定要求中的任何一项,包括但不限于缺乏新颖性、明显或无法实施。不可执行性主张的理由可能包括声称,参与专利诉讼的某人向美国专利商标局隐瞒了与发明可专利性有关的相关或重要信息,或在起诉期间做出了误导性的陈述。法律断言无效和不可强制执行后的结果是不可预测的,法院可能会裁定我们的专利全部或部分无效或不可强制执行,我们无权阻止另一方使用争议中的发明。还有一种风险是,即使这些专利的有效性得到支持,法院也会狭隘地解释该专利的权利要求,并以我们的专利权利要求不包括该发明为理由,裁定我们无权阻止另一方使用有争议的发明。涉及我们专利的诉讼或诉讼中的不利结果可能会限制我们针对这些方或其他竞争对手主张我们的专利的能力,并可能限制或排除我们排除第三方制造和销售类似或竞争产品的能力。这些情况中的任何一种都可能对我们的竞争业务地位、业务前景和财务状况造成不利影响。即使我们认定侵权行为成立,法院也可能决定不对进一步的侵权活动授予禁制令,而只判给金钱赔偿,这可能是也可能不是足够的补救措施。
同样,如果我们主张商标侵权索赔,法院可能会裁定我们主张的商标无效或不可强制执行,或者我们主张商标侵权的一方拥有对相关商标的优先权利。在这种情况下,我们最终可能会被迫停止使用此类商标。
此外,由于与知识产权诉讼相关的大量发现需要,在我们为执行专利而发起的任何诉讼中,我们的一些机密信息可能会因披露而被泄露。还可以公开宣布听证、动议或其他临时程序或事态发展的结果。如果证券分析师或投资者认为这些结果是负面的,可能会对我们证券的市场价格产生负面影响。此外,不能保证我们将有足够的财政或其他资源来提起和追查这类侵权索赔,这些索赔通常会持续数年才能结案。即使我们最终胜诉,这种诉讼的金钱代价以及我们管理层和科学人员注意力的转移可能会超过我们从诉讼中获得的任何好处。
我们可能会受到以下指控的影响:我们的员工、顾问或独立承包商错误地使用或披露了第三方的机密信息,或者我们的员工错误地使用或披露了其前雇主据称的商业秘密。
我们雇佣个人,并保留以前受雇于大学或其他制药公司的独立承包商、顾问和董事会成员,包括我们的竞争对手或潜在竞争对手。尽管我们努力确保我们的员工、顾问和独立承包商在为我们工作时不使用他人的专有信息或专有技术,并且我们目前没有受到任何关于他们这样做的索赔,但我们未来可能会受到此类索赔的影响。可能有必要提起诉讼来抗辩这些指控。如果我们未能为任何此类索赔辩护,除了支付金钱损害赔偿外,我们还可能失去宝贵的知识产权或人员,这可能会对我们的业务造成不利影响。即使我们成功地对此类索赔进行了辩护,诉讼也可能导致巨额成本,并分散管理层和其他员工的注意力。
此外,虽然我们通常要求可能参与知识产权开发的员工、顾问和承包商签署协议,将此类知识产权转让给我们,但我们可能会
57
未成功地与事实上开发我们视为自己的知识产权的每一方执行此类协议,这可能导致我们主张该知识产权的所有权或对我们提出索赔。如果我们不能起诉或为任何此类索赔辩护,除了支付金钱损害赔偿外,我们还可能失去宝贵的知识产权。即使我们成功地起诉或抗辩这类索赔,诉讼也可能导致巨额费用,并分散我们的高级管理人员和科学人员的注意力。
如果我们无法获得和维护ONS-5010/LYTENAVA或任何未来候选产品的有效专利权,我们可能无法阻止竞争对手使用我们认为对ONS-5010/LYTENAVA或任何未来候选产品的开发和商业化很重要的技术,从而导致失去我们的专利可能为我们提供的任何潜在竞争优势。
虽然我们在与知识产权相关的事务中主要关注的是避免侵犯第三方的有效和可执行的权利,但我们也依赖专利、商业秘密保护和保密协议的组合来保护与我们的候选产品和开发计划相关的我们自己的知识产权。我们能否享有由我们自己的知识产权提供的任何竞争优势,在很大程度上取决于我们在美国和其他国家获得和维护专利和其他知识产权保护的能力,涉及我们候选产品的各种专利要素,例如我们的产品配方和制造产品的工艺,以及我们维护和控制对我们业务至关重要的商业秘密和机密信息的能力。
我们试图通过在美国和海外提交与我们的产品相关的专利申请来保护我们的专有地位,这些产品对我们的业务非常重要。这一过程既昂贵又耗时,我们可能无法以合理的成本或及时提交和起诉所有必要或可取的专利申请。我们也有可能在获得专利保护为时已晚之前,无法确定我们的研发成果中可申请专利的方面。我们不能保证我们提交的任何专利申请都会导致已颁发的专利要求保护我们的产品;因此,我们可能无法有效地阻止其他人将竞争产品商业化。此外,虽然不同司法管辖区对可专利性的基本要求是相似的,但每个司法管辖区对可专利性都有自己的具体要求。我们不能保证在我们提交专利申请的所有司法管辖区内,我们的产品将获得相同或类似的专利保护。
生物制药公司的专利地位通常高度不确定,涉及复杂的法律和事实问题,其法律原则仍未解决。因此,由于多种原因,我们拥有或许可的专利申请可能无法导致颁发的专利涵盖我们在美国或其他外国的候选产品。不能保证在专利诉讼期间发现、考虑或引用了与我们的专利和专利申请有关的所有潜在相关的先前技术,这些技术可被用来使专利无效或阻止专利从未决的专利申请中颁发。即使专利确实成功颁发,即使这些专利涵盖我们的候选产品,第三方也可能会对其有效性、可执行性或范围提出质疑,这可能会导致此类专利主张被缩小、被发现不可执行或无效。此外,即使它们没有受到挑战,我们的专利和专利申请也可能无法充分保护我们的知识产权,为我们的候选产品提供排他性,或阻止其他人围绕我们的主张进行设计。这些结果中的任何一个都可能削弱我们阻止竞争对手使用授予我们的任何专利中声称的技术的能力,这可能会对我们的业务产生不利影响。
欧洲专利局授予的专利可以在授权公布后九个月内遭到任何人的反对,此外,还可以随时向国家法院提出质疑。
此外,即使它们没有受到挑战,我们的专利和专利申请也可能无法充分保护我们的知识产权或阻止其他人围绕我们的主张进行设计。如果我们对候选产品持有、许可或追求的专利和专利申请所提供的保护的广度或强度受到威胁,可能会威胁到我们阻止第三方使用我们在候选产品中使用的相同技术的能力。此外,美国专利法最近的变化为第三方提供了额外的程序,以质疑基于2013年3月15日之后提交的专利申请而颁发的专利的有效性。如果我们持有或追求的专利和专利申请对我们当前或未来的候选产品提供的保护的广度或强度受到挑战,那么它可能会威胁到我们阻止竞争产品使用我们专有技术的能力。此外,由于美国和大多数其他国家的专利申请在一段时间内是保密的,
58
通常,在申请后的18个月内,我们不能确定我们是第一个(I)提交与我们的候选产品相关的任何专利申请或(Ii)发明我们的专利或专利申请中要求的任何发明的公司。此外,对于在2013年3月16日之前提交的申请或从此类申请颁发的专利,可以由第三方发起干扰诉讼或由美国专利商标局提起诉讼,以确定谁最先发明了我们的申请和专利的专利权利要求所涵盖的任何标的。如果第三方在2013年3月15日之后提交了此类申请,则此类第三方可以在美国启动派生程序,以确定我们的发明是否源自他们的发明。
除了我们已颁发的专利外,我们在美国和其他司法管辖区还有针对我们候选产品的各个方面的专利申请,这些申请目前正在审理中。我们不能保证将颁发哪些专利(如果有的话),任何此类专利的广度,或任何已颁发的专利是否会被发现无效和不可执行,或是否会受到第三方的威胁或侵权。第三方挑战任何可能向我们颁发的专利的有效性或可执行性的任何成功行动,都可能剥夺我们阻止其他人使用此类已颁发专利中所声称的技术的能力。
此外,如果我们在监管审批方面遇到拖延,我们可以在专利保护下销售候选产品的时间段可能会缩短。我们目前遇到了FDA批准ONS-5010/LYTENAVA的预期时间表的延迟,因为FDA要求成功完成另一项充分且受控良好的ONS-5010/LYTENAVA试验,这可能会导致如果最终获得FDA批准,我们可以在专利保护下销售ONS-5010/LYTENAVA的时间段缩短。
当我们相信获得这样的专利可能会带来竞争优势时,我们已经为我们的候选产品提交了针对我们自己的专有配方和工艺的专利申请。例如,胡米拉和阿瓦斯丁的创始人® (分别为AbbVie和Genentech)拥有针对这些产品的配方的专利。我们没有等待这些配方专利到期,而是为这些产品开发了我们自己的专利配方,我们认为这些产品没有被第三方专利的有效主张所涵盖,包括AbbVie或Genentech的配方专利;我们已经提交了针对我们配方的专利申请。我们不能保证我们的专有配方将避免侵犯第三方专利。此外,由于竞争对手可能能够开发自己的专有产品配方,因此不确定我们的任何未决专利申请是否针对阿达利单抗(Humira)和贝伐单抗(阿瓦斯丁)的配方®)将涵盖任何竞争对手的配方。例如,我们知道Sandoz正在开发生物相似版本的adalimumab(Humira),并已提交了针对adalimumab(Humira)制剂的专利申请。我们还知道,Boehringer正在开发一种生物相似版本的adalimumab(Humira),并已提交了一项针对adalimumab(Humira)制剂的专利申请。我们拥有各种生物仿制药的下游制造工艺方面的专利和专利申请,包括ONS-3010。与我们针对ONS-3010配方的专利申请不同,我们在与工艺相关的专利申请中包含的专利技术,虽然针对我们认为可能为我们提供竞争优势的发明,但并不是我们为避免第三方专利而开发的。就像我们的配方专利申请一样,我们高度不确定,也无法预测我们在工艺改进方面的专利申请是否会为我们提供相对于第三方的竞争优势。
获得和维护我们的专利保护有赖于遵守政府专利机构施加的各种程序要求、文件提交、费用支付和其他要求。如果不遵守这些要求,我们的专利保护可能会减少或取消。
美国专利商标局和各种外国政府专利机构要求在专利过程中遵守一些程序、文件、费用支付和其他规定。在许多情况下,疏忽可以通过支付滞纳金或根据适用规则的其他方式予以补救。然而,在某些情况下,不遵守规定可能会导致专利或专利申请的放弃或失效,从而导致相关司法管辖区的专利权部分或全部丧失。在这种情况下,竞争对手可能会比其他情况下更早进入市场。
59
我们可能无法在世界各地保护我们的知识产权。
在世界上所有国家对候选产品申请、起诉、辩护和执行专利的费用都高得令人望而却步,而且我们在美国以外的一些国家的知识产权可能没有美国那么广泛。此外,一些外国的法律对知识产权的保护程度不如美国的联邦和州法律。此外,许可合作伙伴可以选择不在我们可能获得商业权利的某些司法管辖区提交专利申请,从而排除了以后在这些国家获得专利保护的可能性。因此,我们可能无法阻止第三方在美国以外的所有国家实施我们的发明,或将使用我们的发明制造的产品进口到美国或其他司法管辖区。竞争对手可以在我们没有获得专利保护的司法管辖区使用我们的技术来开发自己的产品,也可以向我们拥有专利保护的地区出口侵权产品,但执行我们专利的能力没有美国那么强。这些产品可能会与我们的产品竞争,而我们的专利或其他知识产权可能不能有效或不足以阻止他们竞争。
许多公司在外国司法管辖区保护和捍卫知识产权方面遇到了重大问题。某些国家的法律制度,特别是某些发展中国家的法律制度,不支持专利、商业秘密和其他知识产权保护的执行,这可能会使我们很难阻止侵犯我们的专利或以侵犯我们的专有权的方式销售竞争产品。在外国司法管辖区强制执行我们的专利权的诉讼,无论是否成功,都可能导致巨额成本,转移我们对业务其他方面的努力和注意力,可能会使我们的专利面临被无效或狭义解释的风险,我们的专利申请可能不会获得批准,并可能引发第三方对我们提出索赔。我们可能不会在我们发起的任何诉讼中获胜,所判给的损害赔偿或其他补救措施(如果有的话)可能没有商业意义。一些外国政府可能会强迫我们以商业上不合理或我们不能接受的条款将我们的专利授权给第三方。因此,我们在世界各地执行我们的知识产权的努力可能不足以从我们开发或许可的知识产权中获得显著的商业优势。
美国专利法的变化可能会降低专利的整体价值,从而削弱我们保护候选产品的能力。
与其他生物制药公司一样,我们的成功在很大程度上依赖于知识产权,特别是专利。在生物制药行业获得和实施专利既涉及技术上的复杂性,也涉及法律上的复杂性。因此,获得和执行生物制药专利既昂贵又耗时,而且具有内在的不确定性。此外,美国最近颁布并正在实施范围广泛的专利改革立法,包括2011年9月16日签署成为法律的《莱希-史密斯美国发明法》或《美国发明法》。
自2013年3月16日起,美国转变为在不同当事人提交两项或两项以上要求同一发明的专利申请时,决定哪一方应被授予专利的先行申请制度。因此,在我们之前向美国专利商标局提交专利申请的第三方可以被授予涵盖我们的发明的专利,即使我们在第三方做出发明之前就已经做出了发明。《美国发明法》对美国专利法的改变之一,就是将美国专利法从先发明改为先发明。在专利法的其他一些重大变化中,有一些变化限制了专利权人可以提起专利侵权诉讼的范围,并为第三方提供了通过授予后和双方审查等程序在USPTO挑战任何已发布专利的机会。美国专利商标局的这些对抗性诉讼在没有推定美国专利在美国联邦法院诉讼中的有效性的情况下审查专利主张,并使用比在美国联邦法院诉讼中使用的更低的举证责任。因此,通常认为,竞争对手或第三方在专利局授权后复审或各方之间复审程序中使专利无效比在美国联邦法院的诉讼中无效更容易。如果我们的任何专利在这样的USPTO诉讼中受到第三方的挑战,不能保证我们或我们的许可人或合作者会成功地捍卫该专利,这将导致被质疑的专利权的丧失。目前还不清楚美国发明法将对我们的业务运营产生什么影响(如果有的话)。然而,美国发明法及其实施可能增加围绕起诉的不确定性和成本
60
我们的专利申请以及任何已颁发专利的执行或保护,所有这些都可能损害我们的业务和财务状况。
此外,最近法院对分子病理学协会诉Myriad Genetics,Inc.(Myriad I)、基于BRCA1和BRCA2的遗传性癌症测试专利列表(Myriad II)以及Promega Corp.诉Life Technologies Corp.等案件的裁决缩小了某些情况下可用的专利保护范围,并在某些情况下削弱了专利所有者的权利。
除了关于我们未来获得专利的能力的不确定性增加之外,这种事件的结合也造成了关于一旦获得专利的价值的不确定性。根据美国国会、联邦法院和美国专利商标局未来的行动,管理专利的法律和法规可能会以不可预测的方式发生变化,从而削弱我们获得新专利或强制执行现有专利和我们未来可能获得的专利的能力。
如果我们无法维护ONS-5010/LYTENAVA或我们的候选产品或任何未来候选产品的有效所有权,我们可能无法在我们的市场上有效竞争。
虽然我们已经提交了专利申请,以保护我们自己的专利配方和工艺开发的某些方面,但我们也依靠商业秘密保护和保密协议来保护不可或可能不可申请专利或我们选择不申请专利的专有科学、商业和技术信息和诀窍。然而,机密信息和商业秘密可能很难保护。此外,我们的商业秘密和机密信息中包含的信息可以由第三方独立和合法地开发或发现,而不会不当使用或引用信息或商业秘密。我们寻求保护支持我们运营的科学、技术和商业信息,以及与我们需要向其披露机密信息的各方签订保密协议,特别是与我们的候选产品相关的机密信息,这些各方包括我们的员工、顾问、董事会成员、承包商、潜在合作者和金融投资者。然而,我们不能肯定已经与所有有关各方达成了此类协议。我们还试图通过维护我们场所的物理安全以及我们的信息技术系统的物理和电子安全来保护我们的数据和商业秘密的完整性和保密性,但这些安全措施可能会被破坏。虽然我们对这些个人、组织和系统有信心,但协议或安全措施可能会被违反,我们可能没有足够的补救措施来应对任何违规行为。因此,我们的机密信息和商业秘密可能会被我们的竞争对手以我们无法证明或补救的方式知晓。
虽然我们希望我们的所有员工和顾问将他们的发明转让给我们,我们的所有员工、顾问、顾问和任何能够访问我们专有技术、信息或技术的第三方都能签订保密协议,但我们不能保证所有这些协议都得到了适当的执行。我们不能保证我们的商业秘密和其他机密专有信息不会被泄露,也不能保证竞争对手不会以其他方式获取我们的商业秘密或独立开发实质上相同的信息和技术。例如,任何一方都可能违反协议,泄露我们的专有信息,包括我们的商业秘密,而我们可能无法就此类违规行为获得足够的补救措施。
挪用或未经授权披露我们的商业秘密可能会损害我们的竞争地位,并可能损害我们的业务。此外,如果为保护我们的商业秘密而采取的措施被认为是不充分的,我们可能没有足够的追索权来对抗第三方挪用任何商业秘密。我们不能保证我们的员工、前员工或顾问不会提交专利申请,声称我们的发明。由于美国的“第一次申请”法律,这种未经授权的专利申请可能会挫败我们为自己的发明获得专利的努力。
我们可能会受到质疑我们的专利申请和其他知识产权的发明权的索赔。
我们未来可能会受到前雇员、合作者或其他第三方作为发明人或共同发明人在我们的专利申请或我们可能被授予的专利或其他知识产权中拥有权益的索赔。例如,我们可能会因为参与开发我们候选产品的顾问或其他人的义务冲突而产生库存或所有权纠纷。诉讼可能是必要的,以对抗这些和其他挑战库存或所有权的索赔。如果我们不能为任何此类索赔辩护,除了支付金钱损害赔偿外,
61
我们可能会失去有价值的知识产权,例如对有价值的知识产权的独家所有权或使用权。这样的结果可能会损害我们的业务。即使我们成功地对此类索赔进行了辩护,诉讼也可能导致巨额成本,并分散管理层和其他员工的注意力。
如果我们未能履行我们在协议中的义务,我们根据这些协议从第三方许可知识产权和其他权利,或者我们与许可人的业务关系受到干扰,我们可能会失去对我们的业务非常重要的许可权。
我们与Selexis签署了一项关于临床测试和销售其细胞系表达技术的非独家全球商业许可协议,我们未来可能会签订其他许可协议。我们与Selexis的商业许可协议规定,我们预计未来的许可协议将对我们施加各种里程碑式的付款、特许权使用费支付和其他义务。如果我们未能履行我们在这些协议下的义务,或者如果我们面临破产,我们可能被要求向我们许可证的许可方支付某些款项,或者许可方可能有权终止许可证,在这种情况下,我们将无法开发或销售许可证涵盖的产品。此外,与这些许可证相关的里程碑和其他付款将降低我们开发候选产品的利润。
如果我们违反了我们在这些协议下的任何义务,我们可能会对我们的许可合作伙伴承担重大责任。根据许可协议,可能会发生关于知识产权的纠纷,包括但不限于:
| ● | 根据许可协议授予的权利范围和其他与解释有关的问题; |
| ● | 我们的技术和流程侵犯了许可方不受许可协议约束的知识产权的程度; |
| ● | 专利和其他权利的再许可; |
| ● | 我们在许可协议下的尽职义务,以及哪些活动满足这些尽职义务; |
| ● | 我们的许可人和我们以及我们的合作者共同创造或使用知识产权所产生的发明和专有技术的所有权;以及 |
| ● | 专利技术发明的优先顺序。 |
如果围绕我们许可的知识产权和其他权利的纠纷阻碍或削弱我们以可接受的条款维持目前的许可安排的能力,我们可能无法成功开发受影响的候选产品并将其商业化,这可能会损害我们的业务。
我们可能无法通过收购和许可获得或保持对ONS-5010/LYTENAVA或我们的候选产品的必要权利。
我们目前通过包括Selexis在内的第三方的许可证拥有某些知识产权的权利,以开发ONS-5010/LYTENAVA/ONS-1045和ONS-3010。因为我们可能会发现我们的程序需要使用由第三方持有的专有权,所以我们业务的增长可能在一定程度上取决于我们获取、授权或使用这些专有权的能力。我们可能无法从第三方获得我们认为对我们的候选产品必需的成分、使用方法、工艺或其他第三方知识产权,或无法在许可范围内获得这些知识产权。第三方知识产权的许可和收购是一个竞争领域,一些更成熟的公司也在寻求我们可能认为有吸引力的第三方知识产权许可或收购战略。这些老牌公司由于其规模、财务资源以及更强的临床开发和商业化能力,可能比我们具有竞争优势。此外,将我们视为竞争对手的公司可能不愿将权利转让或许可给我们。我们也可能无法以使我们的投资获得适当回报的条款许可或获得第三方知识产权。
62
如果我们不能成功地获得所需的第三方知识产权或保持我们现有的知识产权,我们可能不得不放弃该计划的发展,我们的业务和财务状况可能会受到影响。
与我们的业务运营相关的风险
我们的业务在未来可能会受到疾病暴发、流行病和流行病的影响,受到实质性的不利影响。
在我们的临床试验地点和其他业务运营集中的地区,疾病爆发、流行病和大流行可能会对我们的业务产生不利影响,包括导致我们的运营和/或我们所依赖的制造商和CRO的运营严重中断。疾病爆发、流行病和流行病可能会对我们启动新的临床试验地点、招募新患者和维持参与临床试验的现有患者的能力产生负面影响,这可能会导致临床试验成本增加、时间延长,以及我们获得监管部门对我们候选产品的批准的能力(如果有的话)的延迟。例如,由于当地临床试验地点旨在保护工作人员和患者免受新冠肺炎感染的协议,挪威二号患者的招募和招募被推迟。此外,在疾病爆发、流行病或大流行期间,一般供应链问题可能会加剧,还可能影响我们的临床试验地点及时获得我们试验中使用的基本医疗用品的能力(如果有的话)。此外,疾病爆发、流行病和流行病可能对我们的业务、运营结果和财务状况造成多大程度的影响,将取决于未来的事态发展,这些事态发展具有很大的不确定性,无法有信心地预测。可能会出现新的卫生流行病或大流行,导致我们的业务受到类似或更严重的干扰。如果未来的任何疾病爆发、流行或大流行对我们的业务、财务状况、运营结果和增长前景产生不利影响,它还可能导致本“风险因素”一节中描述的许多其他风险和不确定性加剧。
不利的全球经济和政治环境可能会对我们的业务、财务状况或经营结果产生不利影响。
我们的经营业绩可能会受到全球经济、全球金融市场和全球政治状况的不利影响。美国和全球经济正面临不断增长的通胀、更高的利率和潜在的经济衰退。我们未来的部分临床试验可能会在美国以外的地方进行,而不利的经济条件导致美元走弱,将使这些临床试验的操作成本更高。此外,严重或长期的经济衰退,包括流行病、流行病或持续的海外冲突导致的衰退或萧条,可能会给我们的业务带来各种风险,包括对ONS-5010/LYTENAVA或任何其他 我们的候选产品或任何未来的候选产品,如果获得批准,以及我们在需要时以可接受的条件筹集额外资本的能力(如果有的话)。疲软或衰退的经济或政治动荡,包括任何国际贸易争端,也可能给我们的制造商或供应商带来压力,可能导致供应中断,或导致我们的客户推迟支付我们潜在的产品。上述任何一项都可能严重损害我们的业务,我们无法预见政治或经济气候和金融市场状况可能严重损害我们业务的所有方式。
我们在确定、开发或商业化其他候选产品的努力可能不会成功。
尽管我们目前的大量工作集中在欧盟和英国以外的ONS-5010/LYTENAVA的潜在批准以及ONS-5010/LYTENAVA的商业化上,但我们业务的长期成功也取决于我们识别、开发和商业化其他候选产品的能力。确定新产品候选产品的研究项目需要大量的技术、财力和人力资源。我们可能会将我们的努力和资源集中在最终被证明不成功的潜在计划或产品候选上。我们的开发努力可能无法产生更多适合临床开发和商业化的候选产品,原因包括但不限于以下几个原因:
| ● | 我们可能无法成功识别出通过我们严格筛选标准的潜在候选产品; |
63
| ● | 我们可能无法克服开发的技术障碍,或者候选产品可能无法以可接受的成本生产商业批量,或者根本无法生产; |
| ● | 我们可能无法收集足够的资源来获取或发现更多的候选产品; |
| ● | 我们的候选产品可能在临床前或临床测试中不会成功; |
| ● | 竞争对手可能会开发替代产品,从而使我们的候选产品过时或吸引力降低,或者候选产品的市场可能会发生变化,以至于候选产品可能无法证明进一步开发的合理性。 |
如果发生上述任何事件,我们可能会被迫放弃为一个或多个计划所做的开发工作,或者我们可能无法识别、开发或商业化其他候选产品,这将损害我们的业务,并可能导致我们停止运营。
我们高度依赖我们主要高管和人员的服务,如果我们不能留住这些管理层成员或招聘更多的管理、临床和科学人员,我们的业务将受到影响。
我们高度依赖我们的管理层和科技人员的主要成员。我们的任何管理人员或关键科学技术人员的服务损失可能会损害我们的业务以及我们在继续开发和商业化ONS-5010/LYTENAVA以及我们可能开发的任何未来产品方面的前景。此外,我们依赖于我们继续吸引、留住和激励高素质的额外管理、临床和科学人员的能力。如果我们不能保留我们的管理层并以可接受的条件吸引更多合格的人员来继续发展我们的业务,我们可能无法维持我们的运营或将我们的产品供应扩大到超过ONS-5010/LYTENAVA。
2024年12月10日,我们的董事会批准了一项裁员计划,以降低运营费用并保留资本。2024年12月13日,我们裁减了5名员工,约占现有员工总数的23%。我们将重点放在开发ONS-5010/LYTENAVA和其他潜在的未来候选药物上,这将需要足够的工作人员。我们可能需要雇佣和留住新员工来执行我们未来的临床开发和制造计划。我们不能保证我们将能够雇用或保留足够的人员水平,以开发我们目前和潜在的未来候选药物,或运营我们的业务,或实现我们的所有目标。我们可能会遇到由受裁员影响的员工履行某些职责的延迟或其他困难,这可能会导致我们的业务严重中断,并延误我们的发展努力和时间表。此外,我们的裁员可能会产生意想不到的后果,如声誉风险、诉讼风险和费用、超出计划裁员的自然减员、日常运营中的困难增加以及机构知识和专业知识的丧失。裁员还可能损害我们吸引和留住对我们的运营至关重要的合格人员的能力。此外,我们未来可能需要进行更多的裁员或重组活动。
由于生物技术、制药等行业对人才的激烈竞争,我们未来可能无法吸引或留住人才。近年来,我们行业的管理人员流失率很高。如果我们不能吸引、留住和激励必要的人员来实现我们的业务目标,我们可能会遇到限制,这些限制将严重阻碍我们发展目标的实现、我们筹集额外资本的能力以及我们实施业务战略的能力。
我们未来的业绩还将在一定程度上取决于我们能否成功地将新的高管人员纳入我们的管理团队,以及我们能否在高级管理层之间建立有效的工作关系。我们未能整合这些人员并在他们和其他管理层成员之间建立有效的工作关系,可能会导致ONS-5010/LYTENAVA或我们的任何其他候选产品的开发和商业化效率低下,损害未来的监管批准、ONS-5010/LYTENAVA或我们可能获得批准的任何其他候选产品的销售,以及我们的运营结果。此外,我们目前不为我们的高管或任何员工的生命维持“关键人物”人寿保险。
64
在一起悬而未决的证券集体诉讼中,我们和我们的某些官员被列为被告。我们的一些高管和董事也被列为一起悬而未决的股东衍生诉讼的被告。 这些诉讼,以及潜在的类似或相关诉讼,可能会导致重大损害赔偿,转移管理层的时间和注意力,并对我们的运营结果产生实质性的不利影响。这些诉讼,以及我们所受的任何其他诉讼,辩护或起诉的代价都将是高昂的,其结果也是不确定的。
与证券相关的集体诉讼和/或衍生品诉讼经常针对证券市场价格波动的公司,包括生物技术和生物制药公司。这一风险对我们来说尤其重要,因为我们经常在产品开发活动中经历重大的股价波动。
2023年11月3日,美国新泽西州地区法院对我们和我们的某些官员提起了证券集体诉讼。集体诉讼指控我们在2022年12月29日至2023年8月29日期间,违反了经修订的1934年证券交易法或交易法,涉及我们在2022年12月29日至2023年8月29日期间做出的与我们的BLA有关的涉嫌虚假和误导性陈述。起诉书中指控,除其他事项外,我们违反了交易法第10(B)和20(A)条和美国证券交易委员会规则100亿.5,未能披露据称缺乏支持ONS-5010/LYTENAVA作为湿性AMD治疗方法的证据,以及我们和/或我们的制造合作伙伴对ONS-5010/LYTENAVA的CMC控制不足,在我们的BLA重新提交给FDA时仍未解决,因此,FDA不太可能批准我们的BLA,并且当此类信息披露时,我们的股价下跌。集体诉讼中的原告要求损害赔偿和利息,以及包括律师费在内的合理费用的裁决。被告的驳回动议目前正在法庭待决。
2024年10月10日,在特拉华州地区法院提起的股东派生诉讼中,该公司的某些高管和董事被列为被告。*衍生品起诉书声称,被告违反了他们的受托责任,导致和/或允许该公司违反联邦证券法,其依据与证券集体诉讼相同的被指控的失实陈述。衍生品起诉书还指控被告违反了交易法第14(A)条,以及对出资、不当得利和浪费公司资产的索赔。*衍生品诉讼寻求未指明的损害赔偿、公司治理改革、恢复原状、分担、律师费和其他费用。
可能会就这些相同或其他事项提起更多诉讼,或收到股东的指控,并将我们和/或我们的高级管理人员和董事列为被告。这类诉讼和任何其他相关诉讼都受到固有不确定性的影响,实际的辩护和处置成本将取决于许多未知因素。这类诉讼的结果必然是不确定的。我们可能会被迫花费大量资源来为未决的诉讼和任何额外的诉讼辩护,而我们可能不会获胜。此外,我们可能会产生与此类诉讼相关的大量法律费用和费用。我们目前无法估计这件事给我们带来的可能成本,因为未决的诉讼目前处于早期阶段,我们不能确定可能需要多长时间来解决未决的诉讼,或者我们可能需要支付的任何损害赔偿的可能金额。对我们的管理层来说,监控、发起和防范法律行动非常耗时,成本可能很高,可能会削弱我们将内部资源充分集中在业务活动上的能力。我们可能被迫花费大量资源来解决或辩护悬而未决的诉讼和任何潜在的未来诉讼,而我们可能无法在此类诉讼中获胜。此外,在我们的保险覆盖范围内,我们可能不会成功地驳回或解决任何此类诉讼。
我们没有为与未决诉讼或任何潜在的未来诉讼相关的任何潜在责任建立任何准备金。我们有可能在将来作出判决或就金钱损害索赔达成和解。在未决的诉讼或类似或相关的诉讼中做出有损我们利益的决定,可能会导致支付巨额损害赔偿或罚款,并可能对我们的业务、我们的股票价格、现金流、运营结果和财务状况产生实质性的不利影响。
65
医疗保健立法改革措施和其他监管改革可能会损害我们的业务和运营结果。
在美国,已经并将继续有一些立法倡议,以改善获得医疗保健的机会和质量,并控制医疗保健成本。例如,2010年3月通过了《平价医疗法案》,该法案极大地改变了政府和私营保险公司为医疗保健提供资金的方式,并对美国制药业产生了重大影响。除其他事项外,《平价医疗法案》规定了一种新的方法,即对吸入、输注、滴注、植入或注射的药品计算制造商在联邦医疗补助药品退税计划下的退税,提高了制造商在医疗补助药品退税计划下的最低医疗补助退税,将退税计划扩大到参加联邦医疗补助管理的医疗机构的个人,增加了一项条款,增加了产品线延长或重新配方药物的医疗补助退税,建立了对某些品牌处方药和生物制剂的制造商和进口商的年费,并推广了新的联邦医疗保险D部分覆盖缺口折扣计划。《平价医疗法案》还扩大了医疗补助计划的资格,并引入了一个新的以患者为中心的结果研究所,以监督、确定优先事项,并进行临床有效性比较研究,以及为此类研究提供资金。
《平价医疗法案》的某些方面受到了司法、国会和行政部门的挑战,我们预计未来还会对《平价医疗法案》提出更多挑战和修正案。例如,2021年6月17日,美国最高法院驳回了一项基于程序理由的挑战,该挑战辩称,《平价医疗法案》整体违宪,因为“个人授权”已被国会废除。此外,拜登政府的一些医疗改革举措也对《平价医疗法案》产生了影响。例如,2022年8月16日,总裁·拜登签署了爱尔兰共和军,使之成为法律,其中包括将对在《平价医疗法案》市场购买医疗保险的个人的增强补贴延长至2025年计划年。从2025年开始,爱尔兰共和军还通过新建立的制造商折扣计划,显著降低受益人的最大自付成本,从而消除了联邦医疗保险D部分计划下的“甜甜圈漏洞”。《平价医疗法案》有可能在未来受到司法或国会的挑战。目前尚不清楚这些挑战以及拜登政府的任何额外医疗改革措施将如何影响《平价医疗法案》和我们的业务。因此,我们继续评估《平价医疗法案》及其可能被废除或取代对我们业务的潜在影响。
此外,自《平价医疗法案》颁布以来,美国还提出并通过了其他立法修改。例如,2011年8月2日,2011年预算控制法案签署成为法律,其中包括导致向医疗保险提供者支付的医疗保险支出每财年总计减少2%。这些削减于2013年4月1日生效,由于随后的立法修正案,除非国会采取额外行动,否则这些削减将一直有效到2032年。此外,2013年1月2日,总裁·奥巴马签署了2012年美国纳税人救济法,其中包括进一步减少对某些提供者的医疗保险支付,包括医生、医院和癌症治疗中心。此外,2021年3月11日,总裁·拜登签署了2021年美国救援计划法案,从2024年1月1日起,取消了针对单一来源和创新多来源药物的法定医疗补助药品退税上限,该上限以前设定为药品平均制造商价格的100%。
此外,政府最近对药品制造商为其上市产品定价的方式进行了更严格的审查,导致国会进行了几次调查,并提出并颁布了联邦和州立法,旨在提高产品定价的透明度,审查定价与制造商患者计划之间的关系,以及改革政府对药品的计划报销方法。例如,2021年7月,拜登政府发布了一项行政命令,名为《促进美国经济中的竞争》,其中有多项针对处方药的条款。作为对拜登行政命令的回应,2021年9月9日,HHS发布了一份应对高药价的综合计划,其中概述了药品定价改革的原则,并列出了国会可以采取的各种潜在立法政策,以及HHS可以采取的潜在行政行动来推进这些原则。此外,爱尔兰共和军除其他事项外,(I)指示HHS就联邦医疗保险覆盖的某些高支出、单一来源的药物和生物制品的价格进行谈判,并通过提供不等于或低于根据法律谈判的“最高公平价格”的价格,对药品制造商处以民事罚款和潜在的消费税,以及(Ii)根据联邦医疗保险b部分和联邦医疗保险D部分实施回扣,以惩罚超过通胀的价格上涨。爱尔兰共和军允许卫生和公众服务部在最初几年通过指导而不是监管来实施其中许多规定。这些规定将从#年起逐步生效。
66
2023财年。2024年8月15日,HHS宣布了接受价格谈判的前十种药物的商定补偿价格,尽管联邦医疗保险药物价格谈判计划目前受到法律挑战。卫生和公众服务部将在2025年选择最多15种D部分涵盖的额外药物进行谈判。随着这些计划的实施,HHS已经并将继续发布和更新指导意见。此外,拜登政府于2022年10月14日发布了一项额外的行政命令,指示HHS在90天内提交一份报告,说明如何进一步利用联邦医疗保险和医疗补助创新中心来测试降低联邦医疗保险和医疗补助受益人的药品成本的新模式。2023年12月7日,拜登政府还宣布了一项倡议,通过使用贝赫-多尔法案下的进场权利来控制处方药的价格。2023年12月8日,美国国家标准与技术研究所发布了一份考虑行使进行权的机构间指导框架草案,征求意见,其中首次将产品价格作为机构决定行使进行权时可以使用的一个因素。虽然以前没有行使过游行权利,但在新的框架下,这种权利是否会继续下去还不确定。在州一级,立法机构越来越多地通过立法和实施旨在控制药品和生物制品定价的法规,包括价格或患者报销限制、折扣、对某些产品准入的限制、营销成本披露和透明度措施,在某些情况下,旨在鼓励从其他国家进口和批量购买。
我们预计,平价医疗法案、爱尔兰共和军以及未来可能采取的其他医疗改革措施,可能会导致更严格的保险标准和更低的报销,并对我们获得批准的任何产品的价格构成额外的下行压力,特别是在美国总统和国会选举的情况下。联邦医疗保险或其他政府资助计划的任何报销减少都可能导致私人支付者支付的类似减少。实施成本控制措施或其他医疗改革可能会导致对我们候选产品的需求减少或额外的定价压力,并可能阻止我们创造收入、实现盈利或将我们的药物商业化。
2021年12月,欧盟通过了关于卫生技术评估的第2021/2282号条例。该条例于2022年1月生效,自2025年1月起适用。它旨在促进欧盟成员国在评估包括新医药产品在内的卫生技术方面的合作,并为在这些领域进行联合临床评估的欧盟层面的合作提供基础。该条例将允许欧盟成员国使用欧盟范围内通用的HTA工具、方法和程序,以及早确定有前景的技术,并在其他领域继续自愿合作。欧盟各成员国将继续负责评估卫生技术的非临床(例如,经济、社会、伦理)方面,并就定价和报销作出决定。如果我们无法在欧盟成员国对我们可能成功开发并获得监管批准的候选产品保持有利的定价和报销地位,那么这些产品在欧盟的任何预期收入和增长前景都可能受到负面影响。
此外,2023年4月26日,欧盟委员会通过了一项关于修订现行药品立法的新指令和条例的提案,2024年4月10日,议会通过了相关立场。IF按照建议的形式通过,欧盟委员会最近提出的修订现行欧盟药品授权法律的建议可能会导致我们的候选产品在欧盟的数据和市场独家机会减少,并使它们比目前更早地接受仿制药或生物相似的竞争,相关的报销状态也会降低。
我们直接或间接地受到外国、联邦和州医疗保健法律和法规的约束,包括欺诈和滥用、虚假索赔、医生支付透明度以及医疗信息隐私和安全法律。如果我们不能遵守或没有完全遵守这些法律,我们可能面临重大处罚。
我们的业务直接或间接地通过我们目前和未来与医疗保健专业人员、主要调查人员、顾问、客户和第三方付款人的安排,受到各种外国、联邦和州欺诈和滥用法律的约束,包括但不限于联邦反回扣法规、民事虚假索赔法案和医生阳光法律法规。这些法律可能会影响我们的临床研究、拟议的销售、营销、慈善捐赠和赠款、教育计划和患者援助等。此外,我们可能会受到
67
联邦政府和我们开展业务的州对患者数据隐私和安全的监管。可能影响我们运营能力的医保法律包括但不限于:
| ● | 联邦反回扣法规,除其他事项外,禁止个人和实体在知情和故意的情况下,直接或间接地以现金或实物形式索取、接受、提供或支付报酬,以诱导、奖励或回报个人转介,或购买、推荐、订购或提供根据联邦医疗保健计划,如联邦医疗保险和医疗补助计划,全部或部分可报销的物品或服务; |
| ● | 联邦民事和刑事虚假报销法和民事金钱惩罚法,包括民事虚假报销法,可由个人通过民事举报人或准诉讼强制执行,其中禁止个人或实体在知情的情况下提出或导致提交虚假或欺诈性的医疗保险、医疗补助或其他政府健康计划的付款索赔; |
| ● | HIPAA,它制定了额外的联邦刑法,禁止除其他外,执行骗取任何医疗福利计划的计划,并做出与医疗保健事项有关的虚假陈述; |
| ● | HIPAA,经《经济和临床健康信息技术法》及其实施条例修订,其中规定了某些要求,包括强制性合同条款,涉及隐私、安全和传输个人可识别健康信息的健康计划、某些医疗保健提供者和医疗保健信息交换所,称为覆盖实体,及其商业伙伴,向覆盖实体提供服务,涉及个人可识别健康信息及其使用、披露或以其他方式处理个人可识别健康信息的分包商; |
| ● | 联邦立法通常被称为《平价医疗法案》下的《医生支付阳光法案》,该法案要求某些药品、器械、生物制品和医疗用品的制造商每年向医疗保险和医疗补助服务中心报告与这些制造商向医生(定义为包括医生、牙医、验光师、足科医生和脊医)、某些其他医疗保健提供者(如医生助理和护士从业者)、教学医院以及医生及其直系亲属持有的所有权和投资权益有关的付款和其他价值转移的信息; |
| ● | 类似的国家和外国法律法规,例如可能适用于任何第三方付款人(包括商业保险公司)报销的项目或服务的反回扣和虚假索赔法律;要求制药公司遵守制药行业自愿合规指南和政府颁布的相关合规指南或以其他方式限制向医疗保健提供者和其他潜在转介来源付款的州和外国法律;要求药品制造商报告与向医生和其他医疗保健提供者支付和以其他方式转移价值有关的信息或营销支出或药品定价的州和外国法律;要求药品销售代表注册的州、外国和地方法律;以及在某些情况下管理健康信息隐私和安全的国家和外国法律,其中许多法律在很大程度上彼此不同,可能不会产生相同的效果,从而使遵守工作复杂化。 |
由于这些法律的广泛性,以及现有的法定例外情况和监管安全港的狭窄程度,我们的一些商业活动可能会受到一项或多项此类法律的挑战。此外,最近的医疗改革立法加强了这些法律。例如,《平价医疗法案》等修改了联邦反回扣和医疗欺诈刑事法规的意图要求。个人或实体不再需要实际了解这些法规或违反这些法规的具体意图即可实施违规。此外,《平价医疗法》规定,政府可以主张,根据《民事虚假索赔法》,包括因违反联邦《反回扣条例》而产生的物品或服务的索赔构成虚假或欺诈性索赔。
68
如果我们的业务被发现违反了上述任何法律或适用于我们的任何其他政府法规,我们可能会受到重大处罚,包括民事、刑事和行政处罚、损害赔偿、罚款、被排除在政府医疗保健计划之外,如Medicare和Medicaid或类似的外国计划、个人监禁、交还、合同损害、名誉损害、利润减少和未来收益减少、额外的报告要求和监督(如果我们受到公司诚信协议或类似协议的约束,以解决有关违反这些法律的指控,以及削减或重组我们的业务),其中任何一项都可能对我们的业务运营能力和运营结果产生不利影响。防御任何此类行动都可能是昂贵、耗时的,可能需要大量的财政和人力资源。
因此,即使我们成功地抵御了任何可能对我们提起的此类诉讼,我们的业务也可能受到损害。
我们业务的国际方面使我们面临与在美国以外开展业务相关的商业、监管、政治、运营、金融和经济风险。
我们目前自己的国际业务有限,并有几个国际合作。在国际上开展业务涉及许多风险,包括但不限于:
| ● | 多重、相互冲突和不断变化的法律法规,如隐私法规、税法、进出口限制、就业法、监管要求和其他政府批准、许可和许可证; |
| ● | 我们或我们的合作伙伴未能获得并保持在不同国家/地区使用我们产品的监管批准; |
| ● | 其他可能相关的第三方专利权; |
| ● | 在获得保护和执行我们的知识产权方面的复杂性和困难; |
| ● | 我们或我们的合作伙伴在海外业务的人员配备和管理方面的困难; |
| ● | 与我们的协作合作伙伴管理多个付款人报销制度、政府付款人或患者自付系统相关的复杂性; |
| ● | 我们或我们的合作伙伴打入国际市场的能力有限; |
| ● | 金融风险,例如较长的付款周期、难以收回应收账款、本地和地区性金融危机对我们产品的需求和付款的影响以及受外币汇率波动的影响; |
| ● | 自然灾害、政治和经济不稳定,包括战争、恐怖主义和政治动乱、疾病爆发、抵制、削减贸易和其他商业限制; |
| ● | 某些费用,除其他外,包括旅费、翻译和保险费;以及 |
| ● | 与保持准确信息和对销售和活动的控制有关的监管和合规风险,这些销售和活动可能属于美国《反海外腐败法》、其账簿和记录条款或其反贿赂条款或类似的外国要求的权限。 |
如果我们不遵守环境、健康和安全法律法规,我们可能会受到罚款或处罚,或者产生可能损害我们业务的成本。
我们的第三方供应商的活动涉及对危险材料的受控储存、使用和处置,包括我们候选产品的组件和其他危险化合物。我们和我们的供应商受法律和
69
管理这些危险材料的使用、制造、储存、搬运和处置的规定。在某些情况下,这些危险材料和使用它们产生的各种废物储存在我们的设施中,等待使用和处置。我们无法消除污染风险,这可能导致我们的商业化努力、研发和制造努力以及业务运营中断,以及环境破坏,从而导致成本高昂的清理工作,并根据管理这些材料和指定废物的使用、储存、处理和处置的适用法律和法规承担责任。虽然我们相信我们的供应商在处理和处置这些材料时所采用的安全程序大体上符合这些法律法规规定的标准,但我们不能保证情况确实如此,也不能消除这些材料意外污染或伤害的风险。在这种情况下,我们可能要对由此产生的任何损害承担责任,并且这种责任可能超出我们的资源范围,州、联邦或其他适用机构可能会限制我们对某些材料的使用和/或中断我们的业务运营。此外,环境法律法规复杂,变化频繁,并有变得更加严格的趋势。我们无法预测此类变化的影响,也无法确定我们未来的合规情况。我们目前不承保生物或危险废物保险。
收购或合资企业可能会扰乱我们的业务,导致我们的股东股权稀释,并以其他方式损害我们的业务。
我们在持续的基础上积极评估各种战略交易。我们可以收购其他业务、产品或技术,并寻求战略联盟、合资企业或投资于互补业务。这些交易中的任何一项都可能对我们的财务状况和经营业绩产生重大影响,并使我们面临许多风险,包括:
| ● | 此类交易导致我们与现有战略合作伙伴或供应商的关系中断; |
| ● | 与被收购公司或合资企业有关的意外负债; |
| ● | 难以将收购的人员、技术和运营整合到我们现有的业务中; |
| ● | 留住关键员工; |
| ● | 将管理时间和重点从经营我们的业务转移到管理战略联盟或合资企业或收购整合挑战; |
| ● | 增加我们的费用,减少我们可用于运营和其他用途的现金;以及 |
| ● | 可能与被收购业务相关的注销或减值费用。 |
此外,我们在寻找合适的战略合作伙伴方面面临着激烈的竞争,谈判过程既耗时又复杂。此外,我们为我们的候选产品建立战略联盟或其他替代安排的努力可能不会成功,因为它们可能被认为处于协作努力的开发阶段太早,第三方可能不认为我们的候选产品具有展示安全性和有效性的必要潜力。与我们的候选产品相关的新战略交易的任何延迟都可能推迟我们的候选产品在某些地区的开发和商业化,这将损害我们的业务前景、财务状况和运营结果。
除上述风险外,外国收购还涉及独特的风险,包括与跨不同文化和语言的业务整合相关的风险、货币风险、海外业务的潜在不利税收后果以及与特定国家相关的特定经济、政治和监管风险。
任何战略联盟、合资企业或收购的预期利益可能无法实现,或者此类战略联盟、合资企业或收购可能会被禁止。此外,未来的收购或处置可能会导致我们股票证券的潜在稀释性发行、债务、或有负债或摊销费用的产生或善意的核销,其中任何一种都可能损害我们的财务状况。我们无法预测未来合资企业或收购的数量、时间或规模,也无法预测任何此类交易可能对我们的经营业绩产生的影响。
70
我们可能会将我们的候选产品与其他经批准的疗法结合起来进行开发。如果FDA或类似的外国监管机构撤销对任何此类治疗药物的批准,或者如果我们未来与我们的候选产品之一联合使用的任何治疗药物出现安全性、有效性、制造或供应问题,我们可能无法进一步开发和/或营销我们的候选产品,或者我们可能会遇到严重的监管延迟或供应短缺,我们的业务可能会受到实质性损害。
我们可能会将我们的候选产品与其他批准的疗法结合起来进行开发,并可能在未来开始我们的候选产品与其他批准的疗法结合的临床试验。在这种情况下,我们将不会开发或获得监管部门对这些批准的治疗药物的批准,也不会制造或销售这些批准的治疗药物。此外,这些联合疗法很可能以前从未经过过测试,可能无法显示出协同活性,未能达到相对于使用单一药物或其他联合疗法的最佳结果,可能会加剧与我们的候选产品之一相关的不良事件,但可能无法在临床试验中证明足够的安全性或有效性,从而使我们无法完成那些临床试验或获得联合疗法的上市批准。
如果FDA或类似的外国监管机构撤销了对任何联合疗法的批准,我们将无法继续与该被撤销的疗法相结合的任何候选产品的临床开发或营销。如果我们寻求结合的疗法出现安全性或有效性问题,我们可能会遇到重大的监管延迟,FDA或类似的外国监管机构可能会要求我们重新设计或终止适用的临床试验。此外,出于供应、数据参考或其他目的,我们可能需要与销售这些批准的疗法的公司合作或以其他方式接触。如果我们不能及时、按可接受的条款或根本不这样做,我们可能不得不减少候选产品或适应症的开发,减少或推迟其开发计划,推迟其潜在的商业化,或缩小任何销售或营销活动的范围。
我们的员工、独立承包商、顾问、合作者、首席调查员、CRO、供应商和供应商可能从事不当行为或其他不当活动,包括不遵守监管标准和要求。
我们面临员工、独立承包商、顾问、合作者、主要调查人员、CRO、供应商和供应商可能从事欺诈行为或其他非法活动的风险。这些当事人的不当行为可能包括故意、鲁莽和/或疏忽的行为,违反了FDA的规定,包括那些要求向FDA报告真实、完整和准确信息的法律、制造标准、联邦和州医疗保健法律法规,以及要求真实、完整和准确报告财务信息或数据的法律,以及类似的外国法规。特别是,医疗保健行业的销售、营销和商业安排受到旨在防止欺诈、回扣、自我交易和其他滥用行为的广泛法律法规的约束。这些法律法规可能会限制或禁止广泛的定价、折扣、营销和促销、销售佣金、客户激励计划和其他商业安排。这些各方的不当行为还可能涉及不当使用个人身份信息,包括但不限于在临床试验过程中获得的信息,这可能导致监管制裁和对我们的声誉造成严重损害。识别和阻止不当行为并不总是可能的,我们为发现和防止此类活动而采取的预防措施可能无法有效控制未知或未管理的风险或损失,或保护我们免受因未能遵守此类法律或法规而引起的政府调查或其他行动或诉讼。如果对我们提起任何此类诉讼,而我们未能成功地为自己辩护或维护我们的权利,这些行动可能会对我们的业务产生重大影响,包括施加重大的民事、刑事和行政处罚,包括但不限于损害赔偿、罚款、交还、监禁、被排除在参与政府医疗保健计划之外,如Medicare和Medicaid或类似的外国计划,如果我们受到公司诚信协议或类似协议的约束,以解决有关违反这些法律的指控,以及削减或重组我们的业务。
71
我们的商业活动将受到《反海外腐败法》以及类似的反贿赂和反腐败法律的约束。
当我们在美国以外扩展我们的业务活动,包括我们的临床试验工作时,我们将受到《反海外腐败法》以及我们所在国家/地区的类似反贿赂或反腐败法律、法规或规则的约束。《反海外腐败法》一般禁止向非美国政府官员提供、承诺、给予或授权他人直接或间接给予任何有价值的东西,以影响官方行动,或以其他方式获得或保留业务。《反海外腐败法》还要求上市公司制作和保存准确和公平地反映公司交易的账簿和记录,并制定和维持适当的内部会计控制制度。我们的业务受到严格监管,因此涉及与包括非美国政府官员在内的公职人员的重大互动。此外,在许多其他国家,开药的医疗保健提供者受雇于其政府,而药品的购买者是政府实体;因此,我们与这些处方者和购买者的交易将受到《反海外腐败法》的监管。最近,美国证券交易委员会和司法部增加了针对生物技术和制药公司的《反海外腐败法》执法活动。我们不能确定我们的所有员工、代理商、供应商、制造商、承包商或合作者或我们附属公司的员工是否都会遵守所有适用的法律和法规,特别是考虑到这些法律的高度复杂性。违反这些法律和法规可能会导致对我们、我们的官员或我们的员工进行罚款、刑事制裁、关闭设施,包括我们的供应商和制造商的设施、要求获得出口许可证、停止在受制裁国家的业务活动、实施合规计划以及禁止我们开展业务。任何此类违规行为可能包括禁止我们在一个或多个国家或地区提供我们的产品,以及制造或继续开发我们的产品的困难,并可能严重损害我们的声誉、我们的品牌、我们的国际扩张努力、我们吸引和留住员工的能力,以及我们的业务、前景、经营业绩和财务状况。
我们和与我们合作的第三方受严格且不断变化的美国和外国法律、法规和规则、合同义务、行业标准、政策和其他与数据隐私和安全相关的义务的约束。*我们实际或被认为未能履行此类义务可能导致监管调查或行动;诉讼(包括集体索赔)和大规模仲裁要求;罚款和处罚;我们业务运营的中断;声誉损害;收入或利润损失;以及其他不利的业务后果。
在正常业务过程中,我们收集、接收、存储、处理、生成、使用、传输、披露、可访问、保护、保护、处理、传输和共享(统称为处理)个人数据和其他敏感信息,包括专有和机密的商业数据、商业秘密、我们收集的与临床试验相关的试验参与者数据、知识产权、敏感第三方数据、商业计划、交易和财务信息(统称为敏感数据)。
我们的数据处理活动要求我们承担许多数据隐私和安全义务,例如各种法律、法规、指南、行业标准、外部和内部隐私和安全政策、合同要求以及与数据隐私和安全相关的其他义务。在美国,联邦、州和地方政府颁布了许多数据隐私和安全法律,包括数据泄露通知法、个人数据隐私法、消费者保护法(例如,联邦贸易委员会法案第5条)和其他类似法律(例如,窃听法)。例如,经《经济和临床健康信息技术法》(HITECH)修订的1996年联邦《健康保险可携带性和责任法案》(HIPAA)对可单独识别的受保护健康信息的隐私、安全和传输提出了具体要求。
在过去的几年里,美国许多州-包括加利福尼亚州、弗吉尼亚州、科罗拉多州、康涅狄格州和犹他州-都颁布了全面的隐私法,对覆盖的企业施加了某些义务,包括在隐私通知中提供具体的披露,并向居民提供有关其个人数据的某些权利。如果适用,此类权利可能包括访问、更正或删除某些个人数据的权利,以及选择退出某些数据处理活动的权利,例如定向广告、分析和自动决策。这些权利的行使可能会影响我们的业务以及提供产品和服务的能力。某些州还对处理某些个人数据,包括敏感信息,提出了更严格的要求,例如进行数据隐私影响评估。这些州的法律允许对不遵守规定的行为处以法定罚款。例如,经2020年加州隐私权法案(CPRA)或CPRA(统称为CCPA)修订的2018年加州消费者隐私法案适用于属于加州居民的消费者、商业代表和员工的个人数据,并要求企业在隐私通知中提供具体披露,并尊重此类个人行使某些隐私权利的请求。《全面和平协议》
72
规定对每一次故意违规行为处以最高7500美元的罚款,并允许受某些数据泄露影响的私人诉讼当事人追回重大法定损害赔偿。CCPA和其他全面的美国州隐私法豁免了在临床试验背景下处理的一些数据,但这些发展可能会使合规工作进一步复杂化,并增加我们和我们合作的第三方的法律风险和合规成本。其他几个州以及联邦和地方各级也在考虑类似的法律,我们预计未来会有更多的州通过类似的法律。
在美国以外,管理数据隐私和安全的法律、法规和行业标准越来越多。例如,欧盟的一般数据保护条例,或欧盟的GDPR,英国的GDPR,或英国的GDPR,统称为GDPR,巴西的一般数据保护法(Lei Geral de Proteção de Dados Pessoais,或LGPD)(第13,709/2018号法律),以及中国的个人信息保护法,对处理个人数据提出了严格的要求。
例如,根据《消费者权益保护法》,在发生任何不遵守规定的情况下,受法律约束的公司可能面临数据处理和其他纠正行动的临时或最终禁令;根据欧盟《消费者权益保护法》,公司可能面临最高2 000万欧元的罚款;根据英国《消费者权益保护法》,公司可能面临最高1750万英镑的罚款,或者在每种情况下,都将面临全球年收入的4%(以金额较大者为准);或与处理由经法律授权代表其利益的各类数据主体或消费者保护组织提起的个人数据有关的私人诉讼。瑞士联邦数据保护法也适用于瑞士境内的公司收集和处理个人数据,包括与健康有关的信息,或者在某些情况下,瑞士境外的公司收集和处理个人数据。
我们的员工和人员使用生成性人工智能(AI)技术来执行他们的工作,在生成性AI技术中披露和使用个人数据受各种隐私法和其他隐私义务的约束。各国政府已经通过了,并可能会通过更多的法律来监管生成性人工智能。我们使用这项技术可能会导致额外的合规成本、监管调查和行动以及诉讼。如果我们不能使用生成性人工智能,它可能会降低我们的业务效率,并导致竞争劣势。
此外,由于数据本地化要求或跨境数据流动的限制,我们可能无法将个人数据从欧洲和其他司法管辖区转移到美国或其他国家。欧洲和其他司法管辖区已经制定了法律,要求数据本地化或限制向其他国家转移个人数据。特别是,欧洲经济区(European Economic Area,简称EEA)和英国(UK,简称英国)对向美国和其他它普遍认为隐私法不足的国家转移个人数据做出了重大限制。其他司法管辖区可能会对其数据本地化和跨境数据转移法采取类似严格的解释。尽管目前有各种机制可用于依法将个人数据从欧洲经济区和英国转移到美国,例如欧洲经济区的标准合同条款、英国的国际数据转移协议/附录以及欧盟-美国数据隐私框架及其英国扩展(允许转移到自我认证合规并参与该框架的相关美国组织),但这些机制受到法律挑战,不能保证我们可以满足或依赖这些措施合法地向美国转移个人数据。如果我们没有合法的方式将个人数据从欧洲经济区、英国或其他司法管辖区转移到美国,或者如果合法转移的要求过于繁琐,我们可能面临重大不利后果,包括我们的业务中断或降级、需要以巨额费用将我们的部分或全部业务或数据处理活动转移到其他司法管辖区(如欧洲)、面临更多的监管行动、巨额罚款和处罚、无法转移数据和与合作伙伴、供应商和其他第三方合作,以及禁止我们处理或转移运营我们业务所需的个人数据。 此外,将个人数据从欧洲经济区和英国转移到其他司法管辖区,特别是转移到美国的公司,将受到监管机构、个人诉讼人和活动团体的更严格审查。*一些欧洲监管机构已下令某些公司暂停或永久停止将某些个人数据转移出欧洲,理由是它们涉嫌违反了GDPR的跨境数据转移限制。--
除了数据隐私和安全法律外,我们在合同上还受到行业组织采用的某些行业标准的约束,并可能在未来受到此类义务的约束。我们还受到与数据隐私和安全相关的其他合同义务的约束。我们履行此类合同义务的努力可能不会成功,这可能会导致对我们的索赔。--
我们发布隐私政策、营销材料和其他有关数据隐私和安全的声明。如果这些政策、材料或声明被发现对我们的做法有缺陷、缺乏透明度、欺骗性、不公平或不实,我们可能会受到调查、监管机构的执法行动或其他不利后果。
73
与数据隐私和安全(以及消费者的数据隐私期望)相关的义务正在迅速变化,变得越来越严格,并带来不确定性。此外,这些义务可能会受到不同的适用和解释,这在法域之间可能是不一致的或冲突的。*准备和遵守这些义务需要我们投入大量资源,并可能需要对我们的服务、信息技术、系统和做法以及代表我们处理个人数据的任何第三方的服务、信息技术、系统和做法进行更改。
我们有时可能会在遵守我们的数据隐私和安全义务的努力中失败(或被认为失败)。此外,尽管我们做出了努力,但我们的人员或与我们合作的第三方可能无法履行此类义务,这可能会对我们的业务运营产生负面影响。如果我们或我们所依赖的第三方未能或被视为未能处理或遵守适用的数据隐私和安全义务,我们可能面临重大后果,包括但不限于:政府执法行动(例如,调查、罚款、处罚、审计、检查等);诉讼(包括集体诉讼索赔)和大规模仲裁要求;额外的报告要求和/或监督;禁止处理个人数据;以及命令销毁或不使用个人数据。特别是,原告越来越积极地对公司提起与隐私相关的索赔,包括集体索赔和大规模仲裁要求。*其中一些索赔允许在每次违规的基础上追回法定损害赔偿,如果可行,还可能产生巨大的法定损害赔偿,具体取决于数据量和违规数量。*任何这些事件都可能对我们的声誉、业务或财务状况产生重大不利影响,包括但不限于:客户流失;我们的业务运营(包括我们的临床试验)中断或停顿;无法处理个人数据或在某些司法管辖区运营;为任何索赔或调查辩护的时间和资源有限;不利宣传;或我们的业务模式或运营(包括临床试验)的重大变化。--
如果我们的信息技术系统或与我们合作的第三方的信息技术系统或我们的数据被或被泄露,我们可能会经历这种损害所产生的不利后果,包括但不限于监管调查或行动;诉讼;罚款和处罚;我们的业务运营中断;声誉损害;收入或利润损失;以及其他不利后果。
在我们的正常业务过程中,我们和与我们合作的第三方处理敏感数据,因此,我们和我们依赖的第三方面临各种不断变化的威胁,这些威胁可能会导致安全事件。网络攻击、基于互联网的恶意活动、线上和线下欺诈以及其他类似活动威胁到我们的敏感数据和信息技术系统以及我们所依赖的第三方系统的机密性、完整性和可用性。但此类威胁很普遍,而且还在继续上升,越来越难以检测,来源多种多样,包括传统的计算机“黑客”、威胁行为者、“黑客活动家”、有组织的犯罪威胁行为者、人员(例如通过盗窃或滥用)、复杂的民族国家和民族国家支持的行为者。--
一些行为者现在从事并预计将继续从事网络攻击,包括但不限于出于地缘政治原因并结合军事冲突和防御活动的民族国家行为者。在战争和其他重大冲突期间,我们和与我们合作的第三方可能容易受到这些攻击的高风险,包括报复性网络攻击,这可能会实质性地扰乱我们的系统和运营、供应链以及生产、销售和分销我们服务的能力。
我们和与我们合作的第三方受到各种不断变化的威胁,包括但不限于社会工程攻击(包括通过深度伪装,这可能越来越难以识别为假货)、恶意代码(如病毒和蠕虫)、恶意软件(包括高级持续威胁入侵的结果)、拒绝服务攻击、凭据填充、凭据获取、人员不当行为或错误、勒索软件攻击、供应链攻击、软件漏洞、服务器故障、软件或硬件故障、数据或其他信息技术资产的丢失、广告软件、人工智能增强或促进的攻击、电信故障、地震、火灾、洪水和其他类似的威胁。
特别是,严重的勒索软件攻击正变得越来越普遍,可能导致我们的运营严重中断,提供我们的产品或服务的能力,敏感数据和收入的损失,声誉损害,以及资金转移。勒索付款可能会减轻勒索软件攻击的负面影响,但我们可能不愿意或无法支付此类付款,例如,由于适用的法律或法规禁止此类付款。
随着越来越多的员工在我们的办公场所或网络之外使用网络连接、计算机和设备,包括在家里、途中和公共场所工作,远程工作已变得越来越普遍,并增加了我们的信息技术系统和数据的风险。此外,未来或过去的业务交易(如收购或整合)可能会使我们面临额外的网络安全风险和漏洞,因为我们的系统可能是负面的
74
受收购或整合实体的系统和技术中存在的漏洞的影响。此外,我们可能会发现在对这些被收购或整合的实体进行尽职调查时没有发现的安全问题,并且可能很难将公司整合到我们的信息技术环境和安全计划中。
此外,我们对第三方服务提供商的依赖可能会给我们的业务运营带来新的网络安全风险和漏洞,包括供应链攻击和其他威胁。 我们依赖第三方服务提供商和技术来运行关键业务系统,以在各种环境中处理敏感数据(包括与我们的临床试验相关的数据),包括但不限于合同研究组织、员工电子邮件、向客户提供内容以及其他功能。*我们监控这些第三方信息安全做法的能力有限,这些第三方可能没有足够的信息安全措施到位。如果与我们合作的第三方遇到安全事件或其他中断,我们可能会遇到不利后果。虽然如果这些第三方未能履行其对我们的隐私或安全相关义务,我们可能有权获得损害赔偿,但任何赔偿都可能不足以弥补我们的损害,或者我们可能无法追回此类赔偿。 此外,供应链攻击的频率和严重性都有所增加,我们不能保证我们供应链中第三方的基础设施或我们第三方合作伙伴的供应链没有受到损害。
虽然我们已经实施了旨在防范安全事件的安全措施,但不能保证这些措施将是有效的。我们采取旨在检测、缓解和补救我们信息系统(例如我们的硬件和/或软件,包括与我们合作的第三方的硬件和/或软件)中的漏洞的步骤。然而,我们可能不会及时检测和补救所有此类漏洞。此外,我们可能会在部署旨在解决已识别的漏洞的补救措施或补丁方面遇到延误。这些漏洞可能被利用并导致安全事件。
任何先前识别的或类似的威胁都可能导致安全事件或其他中断,从而可能导致未经授权、非法或意外地获取、修改、销毁、丢失、更改、加密、披露或访问我们的敏感数据或我们的信息技术系统或与我们合作的第三方的敏感数据或系统。*安全事件或其他中断可能会扰乱我们(以及与我们合作的第三方)运营我们业务的能力,包括进行我们的临床试验。
我们可能会花费大量资源或修改我们的业务活动(包括我们的临床试验活动),以试图防范安全事故。此外,某些数据隐私和安全义务可能要求我们实施和维护特定的安全措施或行业标准或合理的安全措施,以保护我们的信息技术系统和敏感数据。
适用的数据隐私和安全义务可能要求我们,或我们可能自愿选择,将安全事件通知相关利益相关者,包括受影响的个人、客户、监管机构和投资者,或采取其他行动,如提供信用监控和身份窃取保护服务。*此类披露和相关行动可能代价高昂,披露或不遵守此类适用要求可能导致不良后果。
重大安全事件(无论是实际的还是感知的,无论是我们或与我们合作的第三方经历的)都可能造成实质性的不利后果,如政府执法行动(例如,调查、罚款、处罚、审计和检查);额外的报告要求和/或监督;对处理敏感数据的限制(包括个人数据或与我们临床试验相关的数据);诉讼(包括类别索赔);赔偿义务;负面宣传;声誉损害;货币资金转移;转移管理层注意力;我们业务中断(包括数据可用性);财务损失;以及其他类似损害。*安全事件和随之而来的后果可能会对我们增长和运营业务的能力产生负面影响。
我们的合同可能不包含责任限制,即使有,也不能保证我们的合同中的责任限制足以保护我们免受与我们的数据隐私和安全义务相关的责任、损害或索赔。我们不能确定我们的保险范围(如果有)是否足以保护我们免受或减轻因我们的隐私和安全做法而产生的责任,此类保险将继续以商业合理的条款或根本不存在,或此类保险将支付未来的索赔。
除了经历安全事件外,第三方还可能从公共来源、数据经纪人或其他方式收集、收集或推断有关我们的敏感数据,这些信息会泄露有关我们组织的竞争敏感细节,并可能被用来破坏我们的竞争优势或市场地位。此外,公司的敏感数据可能会被泄露,
75
由于我们的员工、人员或供应商使用生成性人工智能技术而披露或披露的。
与我们证券所有权相关的风险
我们证券的交易价格可能会波动,购买我们证券的人可能会遭受重大损失。
我们证券的市场价格一直是波动的,而且可能会继续波动。总的来说,股票市场和我们经营的市场都经历了极端的波动,这种波动往往与特定公司的经营业绩无关。由于这种波动,投资者可能无法出售他们的证券获利。我们证券的市场价格可能会因各种因素而大幅波动,这些因素包括但不限于:
| ● | 有竞争力的服务、产品或技术的成功; |
| ● | 临床前或临床试验的不良结果或延迟; |
| ● | 任何无法获得额外资金的情况; |
| ● | 对ONS-5010/LYTENAVA或我们的任何候选产品按计划提交IND、BLA或其他监管提交的任何延迟,以及与适用监管机构对该IND、BLA或其他监管提交的审查有关的任何不利发展或被认为不利的发展; |
| ● | ONS-5010/LYTENAVA或我们的任何其他候选产品的有限市场规模或定价的看法; |
| ● | 未能成功开发和商业化ONS-5010/LYTENAVA或我们的任何其他候选产品; |
| ● | 与我们的候选产品相关的上市后安全问题; |
| ● | 未能维持现有的战略合作或进入新的合作; |
| ● | 我们或我们的许可方和战略合作伙伴未能起诉、维护或执行我们的知识产权; |
| ● | 适用于我们产品的法律或法规的变更; |
| ● | 无法为我们的候选产品获得足够的产品供应或无法以可接受的价格这样做; |
| ● | 不利的监管决定; |
| ● | 我们的竞争对手引入新产品、服务或技术; |
| ● | 未能达到或超过我们可能向公众提供的财务预测; |
| ● | 未能达到或超过投资界的财务预测; |
| ● | 公众、立法机构、监管机构和投资界对制药行业的看法; |
76
| ● | 我们、我们的战略合作伙伴或我们的竞争对手宣布重大收购、战略合作伙伴关系、合资企业或资本承诺; |
| ● | 与专有权相关的纠纷或其他发展,包括专利、诉讼事项以及我们为我们的技术获得专利保护的能力; |
| ● | 关键科学或管理人员的增加或离开; |
| ● | 重大诉讼,包括股东诉讼和我们提起或针对我们提起的有关专利侵权或其他侵犯知识产权的诉讼; |
| ● | 寻求限制或限制ONS-5010/LyTENAVA在欧盟或英国的批准或我们任何可能获得批准的候选产品提出的任何公民请愿书的结果; |
| ● | 如果证券或行业分析师没有发布有关我们业务的研究或报告,或者他们对我们的股票发表不利或误导性意见; |
| ● | 同类公司的市场估值变化; |
| ● | 一般经济、行业或市场状况; |
| ● | 我们或我们的股东未来出售我们的证券; |
| ● | 本公司证券成交量; |
| ● | 向第三方发放专利,这可能会阻碍我们将候选产品商业化; |
| ● | 失去一名或多名组成我们领导团队的员工; |
| ● | 监管要求的变化可能会使我们更难开发我们的候选产品;以及 |
| ● | 此“风险因素”部分描述的其他因素。 |
如上文题为我们和我们的一些官员已被列为一起悬而未决的证券集体诉讼的被告。我们的一些高管和董事也被列为一起悬而未决的股东衍生诉讼的被告。 这些诉讼和潜在的类似或相关诉讼可能会导致重大损害赔偿,转移管理层的时间和注意力,并对我们的运营结果产生实质性的不利影响。这些诉讼,以及我们所受的任何其他诉讼,辩护或起诉的代价都很高,而且其结果是不确定的“,我们和我们的两名高管在美国新泽西州地区法院提起的集体诉讼中被列为被告,我们的某些高管和董事在特拉华州地区法院提起的股东派生诉讼中被列为被告。此类诉讼经常针对包括我们在内的公司提起,这些公司的证券经历了一段时间的市场价格波动。悬而未决的诉讼和未来对我们提起的任何诉讼都可能导致巨额成本,这将损害我们的财务状况和运营结果,并分散管理层的注意力和资源,这可能会阻碍或推迟商业化努力。
此外,生物制药公司尤其经历了极端的价格和数量波动,这些波动往往与这些公司的经营业绩无关或不成比例。无论我们的实际经营业绩如何,广泛的市场和行业因素都可能对我们证券的市场价格产生负面影响。
77
GMS Ventures实益拥有我们相当大比例的普通股,有权指定我们的董事会成员,并能够对有待股东批准的事项施加重大控制,这可能会阻止新投资者影响重大的公司决策。
截至2024年9月30日,GMS Ventures拥有5,808,074股普通股和额外3,458,571股普通股的认股权证。因此,截至该日,GMS Ventures实益拥有我们约33.9%的普通股。根据与GMS Ventures的修订和重述的投资者权利协议,GMS Ventures目前还有权按照GMS Ventures(包括其任何附属公司)的总持有量指定我们的董事会成员,我们的十名董事会成员中有两名是由GMS Ventures指定的。GMS Ventures的利益可能与其他证券持有人的利益不一致。GMS Ventures有能力通过其所有权地位和在我们董事会中的代表来影响我们的公司,这两者可能会阻止或阻止您可能认为符合您作为我们证券持有人之一的最佳利益的对我们股本的主动收购建议或要约。
我们的季度经营业绩可能大幅波动,或者可能低于投资者或证券分析师的预期,每一种情况都可能导致我们的股价波动或下跌。
我们的季度经营业绩可能会有很大波动,这使得我们很难预测未来的经营业绩。这些波动可能是由各种因素造成的,其中许多因素是我们无法控制的,可能很难预测,包括但不限于:
| ● | 我们有能力成功地开发、营销和销售ONS-5010/LYTENAVA和任何其他候选产品; |
| ● | ONS-5010/LYTENAVA和任何其他候选产品的临床开发成本; |
| ● | 有竞争力的产品或技术的成功; |
| ● | 我们的候选产品或我们的竞争对手的临床试验结果; |
| ● | 与专利申请、已颁发的专利或者其他专有权利有关的发展或者纠纷; |
| ● | 关键人员的招聘或离职; |
| ● | 与我们的任何候选产品或临床开发计划相关的费用水平; |
| ● | 我们努力发现、开发、制造、收购或许可其他候选产品的结果; |
| ● | 对财务业绩、开发时间表或证券分析师建议的估计的实际或预期变化; |
| ● | 我们或被认为与我们相似的公司的财务业绩存在差异; |
| ● | 制药和生物技术领域的市场状况; |
| ● | 总体经济、行业和市场状况;以及 |
| ● | 此“风险因素”部分描述的其他因素。 |
如果我们的季度经营业绩低于投资者或证券分析师的预期,我们证券的市场价格可能会大幅下跌。此外,我们经营业绩的任何季度波动反过来可能会导致我们的证券价格大幅波动。我们认为,财务业绩的季度比较不一定有意义,也不应依赖于作为我们未来业绩的指标。
78
如果证券或行业分析师不发表关于我们业务的研究报告,或发表不利的研究报告,我们证券的市场价格和交易量可能会下降。
我们证券的交易市场在一定程度上取决于证券或行业分析师发布的关于我们或我们的业务、我们的市场和我们的竞争对手的研究和报告。我们对这些分析师没有任何控制权。如果任何跟踪我们的分析师下调我们的证券评级或改变他们对我们证券的看法,我们证券的市场价格可能会下跌。如果其中一位或多位分析师停止对我们公司的报道,或未能定期发布有关我们的报告,我们可能会失去在金融市场的可见度,这可能会导致我们证券的市场价格或交易量下降。
我们是一家“规模较小的报告公司”,由于我们选择使用降低的报告要求,某些投资者可能会发现投资我们的证券的吸引力降低。
根据美国证券交易委员会的披露规则,我们是一家“规模较小的报告公司”,这意味着我们拥有:(I)公开上市的万不到25000美元;或(Ii)最近结束的财年的年收入不到10000美元万;并且没有公开上市;或者公开上市的万不到70000美元。
作为一家规模较小的报告公司,与其他发行人相比,我们被允许在提交给美国证券交易委员会的文件中履行缩减的披露义务,包括在我们的定期报告和委托书中关于高管薪酬的披露义务。我们已选择采用对较小的报告公司可用的便利。在我们不再是一家规模较小的报告公司之前,我们提交给美国证券交易委员会的文件中的缩减披露将导致有关我们公司的信息比其他上市公司更少。如果投资者认为我们的普通股不那么有吸引力,因为我们选择使用允许较小报告公司进行缩减披露的做法,我们的普通股交易市场可能会不那么活跃,我们的股价可能会更加波动。
根据《交易法》,我们也是非加速申请者,我们不需要遵守2002年《萨班斯-奥克斯利法案》第404(B)节的审计师认证要求。因此,我们对财务报告的内部控制将不会得到与发行人年度报告中的核数师认证相关的程序所提供的审查水平,这些程序受到核数师认证要求的约束。此外,我们无法预测投资者是否会发现我们的普通股吸引力下降,因为我们不需要遵守审计师的认证要求。我们无法预测投资者是否会因为我们依赖这些可用的豁免而发现我们的证券吸引力下降。如果一些投资者因此认为我们的证券吸引力下降,我们的证券交易市场可能会变得不那么活跃,我们证券的市场价格可能会更加波动。
我们已经并将继续因遵守影响美国上市公司的法律和法规而对管理层产生重大成本和要求,这可能会损害我们的经营业绩。
作为一家在美国上市的上市公司,我们已经并将继续产生大量额外的法律、会计和其他费用。萨班斯-奥克斯利法案,以及美国证券交易委员会随后实施的规则,以及纳斯达克股票市场有限责任公司,对上市公司提出了各种要求。此外,与公司治理和公开披露相关的法律、法规和标准的变化,包括美国证券交易委员会和纳斯达克实施的法规,或者由于股东维权运动的结果,可能会增加法律和财务合规成本,并使一些活动更加耗时。这些法律、条例和标准有不同的解释,因此,随着监管机构和理事机构提供新的指导,它们在实践中的适用可能会随着时间的推移而演变。《萨班斯-奥克斯利法案》(Sarbanes-Oxley Act)要求我们对财务报告和披露控制和程序保持有效的内部控制。特别是,我们被要求对我们的财务报告内部控制进行系统和流程评估和测试,以使管理层能够根据萨班斯-奥克斯利法案第404条或第404条报告我们对财务报告的内部控制的有效性。我们的测试可能会揭示我们在财务报告方面的内部控制缺陷,这些缺陷被认为是实质性的弱点。我们遵守第404条要求我们产生大量的会计费用并花费大量的管理努力。我们目前没有内部审计小组,依靠独立承包人进行控制、监测以及编制和审查我们的合并财务报表。如果我们不能及时遵守第404条的要求,或者如果我们发现或我们的独立注册会计师事务所发现我们在财务报告的内部控制中存在被认为是重大弱点的缺陷,我们的股票的市场价格
79
我们可能会拒绝,我们可能会受到纳斯达克、美国证券交易委员会或其他监管机构的制裁或调查,这将需要额外的财务和管理资源。我们打算投入资源来遵守不断变化的法律、法规和标准,这一投资可能会导致一般和行政费用的增加,并将管理层的时间和注意力从创收活动转移到合规活动上。尽管我们努力遵守新的法律、法规和标准,但如果我们不遵守,监管部门可能会对我们提起法律诉讼,我们的业务可能会受到损害。
此外,不遵守这些法律、法规和标准也可能使我们更难获得某些类型的保险,包括董事和高级人员责任保险,我们可能会被迫接受降低的保单限额和承保范围,或者为获得相同或类似的保险而产生更高的费用。这些事件的影响也可能使我们更难吸引和留住合格的人在我们的董事会、董事会委员会或高级管理层成员中任职。
未来出售和发行我们的普通股或购买证券的权利,包括根据我们的股权激励计划或行使认股权证,可能会导致我们股东的所有权百分比进一步稀释,并可能导致我们证券的市场价格下跌。
我们未来将需要额外的资金来继续我们计划中的业务。在一定程度上,我们通过发行股权证券筹集额外资本,我们的股东可能会经历严重的稀释。我们可以在一次或多次交易中以我们不时确定的价格和方式出售普通股、可转换证券或其他股权证券。如果我们在不止一笔交易中出售普通股、可转换证券或其他股权证券,投资者可能会因随后的出售而被严重稀释。这些出售还可能导致我们现有股东的实质性稀释,新的投资者可能获得优于我们现有股东的权利。
根据2024年股权激励计划或2024年计划,我们的管理层有权向员工、董事和顾问授予股票期权和其他基于股权的奖励。根据2024年计划,截至2024年9月30日,我们为未来发行保留的普通股数量为4,680,755股。此外,我们已根据2016年员工股票购买计划(ESPP)预留股票供发行,该计划类似地规定了每年“常青树”的增长,除非我们的董事会另有决定。如果我们的董事会不选择减少根据2024年计划或ESPP未来可供授予的股票数量的年度增长,我们的股东可能会经历额外的稀释,这可能会导致我们证券的市场价格下跌。我们目前还发行和发行了一些认股权证,以购买我们普通股的总计14,207,622股,价格从每股7.7美元到240.00美元不等。此外,在2022年12月,我们向贷款人发行了2022年12月票据。2022年12月发行的票据可根据贷款人或本公司的选择权在某些条件下转换为普通股,具体情况在“第7项.管理层对财务状况和经营结果的讨论和分析--流动资金和资本资源--负债说明”中有更详细的描述。
我们使用净营业亏损结转和某些其他税收属性的能力可能受到限制。
我们在历史上遭受了巨大的亏损,并不指望在不久的将来实现盈利,而且我们可能永远也不会实现盈利。2018年1月1日之前开始的应税年度未使用的联邦净营业亏损,或NOL,可以结转以抵消未来的应税收入,如果有的话,直到这些未使用的NOL到期。根据现行法律,在2017年12月31日之后的应税年度发生的联邦NOL可以无限期结转,但此类联邦NOL的扣除额限制在应税收入的80%。目前还不确定各州是否以及在多大程度上会遵守联邦税法。
此外,根据修订后的1986年《国税法》第382和383条或该法典,如果一家公司经历了一次“所有权变更”,通常定义为某些股东在三年期间其股权所有权的变化超过50个百分点(按价值计算),该公司使用变更前的NOL和其他变更前的税收属性(如研究税收抵免)来抵销变更后的收入或税收的能力可能会受到限制。我们可能在过去经历过所有权的变化,未来可能会因为我们股票所有权的后续变化而经历所有权变化(其中一些变化不是我们所能控制的)。因此,如果我们获得净应纳税所得额,我们使用变动前的NOL来抵消此类应税收入的能力将受到限制。州税法的类似规定也可能适用于限制我们使用累积的州税收属性。另外,在州一级,
80
可能会有一段时间暂停或以其他方式限制NOL的使用,这可能会加速或永久增加州政府应缴税款。因此,即使我们实现盈利,我们也可能无法使用我们的NOL和其他税收属性的一大部分,这可能会对我们未来的现金流或运营结果产生不利影响。
建议或将来制定的税务法例,可能会对我们的财政状况和经营业绩造成负面影响。
我们受制于或在其下运作的税收制度不稳定,可能会发生重大变化。发布与现有或未来税法有关的额外指导,或由现任或未来的美国总统政府、国会或其他司法管辖区的税务当局提议或实施的税法或法规变更,可能会对我们的纳税义务产生重大影响。例如,从2022年开始,2017年的减税和就业法案取消了在发生的年份扣除研发支出的选项,而是要求纳税人将此类支出资本化,然后在5年内摊销在美国境内开展的研究活动,并在15年内在美国境外开展研究活动。此外,美国联邦、州和地方税法极其复杂,受到不同解释的影响。虽然我们相信我们的税务估计和立场是合理的,但不能保证我们的税务立场不会受到相关税务机关的质疑。如果有关税务机关向我们评估额外税款,这可能会导致调整或影响应纳税所得额、扣减或其他税收分配的时间或金额,从而可能对我们的经营业绩和财务状况产生不利影响。
我们的国际业务可能会使我们承担比预期更大的税务负担。
我们在不同司法管辖区可能缴纳的税额取决于包括美国在内的不同司法管辖区的税法在我们的国际业务活动中的适用情况、税率的变化、新的或修订的税法或对现有税收法律和政策的解释,以及我们以与我们的公司结构和公司间安排一致的方式运营业务的能力。我们经营业务的司法管辖区的税务机关可能会质疑我们根据任何未来公司间安排为公司间交易定价的方法,或不同意我们对特定司法管辖区的收入和支出的确定。如果出现这样的挑战或分歧,而我们的地位无法维持,我们可能需要支付额外的税款、利息和罚款,这可能会导致一次性税费、更高的有效税率、现金流减少,以及我们业务的整体盈利能力下降。我们的财务报表可能无法反映出足够的准备金来应对这种意外情况。同样,税务当局可以断言,我们在一个我们认为没有建立应税联系的司法管辖区纳税,根据国际税务条约,这种联系通常被称为“常设机构”,如果成功,这种断言可能会增加我们在一个或多个司法管辖区的预期纳税义务。
我们不打算为我们的股本支付股息,因此,任何回报都将限于我们证券的价值。
我们从未宣布或支付过我们股本的任何现金股息。我们目前预计,我们将为业务的发展、运营和扩张保留未来的收益,在可预见的未来不会宣布或支付任何现金股息。因此,对证券持有人的任何回报都将仅限于其证券的增值。
我们修订和重述的公司注册证书以及修订和重述的章程中的条款,以及特拉华州法律中的条款,可能会使第三方更难收购我们或增加收购我们的成本,即使这样做会使我们的证券持有人受益或罢免我们目前的管理层。
我们经修订、修订和重述的公司注册证书,经修订、修订和重述的章程和特拉华州法律包含的条款可能会延迟或阻止我们控制权的变更或我们管理层的变更。我们的章程文件还包含其他可能具有反收购效力的条款,例如:
| ● | 建立一个分类的董事会,不是所有的董事会成员都是一次选举产生的; |
81
| ● | 允许董事会确定董事人数,填补任何空缺和新设立的董事职位; |
| ● | 规定董事只有在有理由的情况下才能被免职; |
| ● | 禁止董事的累积投票权; |
| ● | 要求以绝对多数表决修改我们修订和重述的公司注册证书和修订和重述的章程中的一些条款; |
| ● | 授权发行“空白支票”优先股,董事会可以用来实施股东权益计划; |
| ● | 取消股东召开股东特别会议的能力;以及 |
| ● | 禁止股东在书面同意下采取行动,这要求所有股东的行动必须在我们的股东会议上进行。 |
这些条款单独或共同作用,可以推迟、阻止或阻止敌意收购、控制权变更或管理层变动。
此外,由于我们是在特拉华州注册成立的,我们受特拉华州公司法第203条的规定管辖,该条款限制持有我们已发行有表决权股票超过15%的股东与我们合并或合并的能力。
我们修订和重述的公司注册证书或修订和重述的章程或特拉华州法律中任何具有延迟或威慑控制权变更的条款都可能限制我们的证券持有人为其证券获得溢价的机会,也可能影响一些投资者愿意为我们的证券支付的价格。
我们修订和重述的公司注册证书以及我们修订和重述的章程规定,特拉华州衡平法院将成为我们与我们股东之间几乎所有纠纷的独家法庭,这可能限制我们的股东在与我们或我们的董事、高级管理人员或员工的纠纷中获得有利的司法论坛的能力。
我们经修订和重述的公司注册证书以及我们经修订和重述的公司章程规定,特拉华州衡平法院是根据特拉华州成文法或普通法提起的下列类型的诉讼或诉讼的独家法院:代表我们提起的任何派生诉讼或诉讼;任何声称违反受托责任的诉讼;根据特拉华州公司法、我们的修订和重述公司注册证书或经修订和重述的附例对我们提出索赔的任何诉讼;或者根据内部事务原则对我们提出索赔的任何诉讼。这一规定不适用于为执行《交易法》规定的义务或责任而提起的诉讼,也不适用于美国联邦法院拥有专属管辖权的任何其他索赔。
法院条款的选择可能会限制股东在其认为有利于与我们或我们的董事、高级管理人员或其他员工发生纠纷的司法论坛上提出索赔的能力,这可能会阻止针对我们和我们的董事、高级管理人员和其他员工的此类诉讼。如果法院发现我们修订和重述的公司注册证书或我们修订和重述的章程(经修订)中包含的法院条款选择在诉讼中不适用或不可执行,我们可能会承担与解决其他司法管辖区此类诉讼相关的额外费用,这可能会损害我们的业务和财务状况。
82
在公开市场上出售大量我们已发行的普通股可能会导致我们的普通股价格下跌。
由于大量出售普通股或认为这些出售可能发生,我们的普通股价格可能会下降。这些出售,或者这些出售可能发生的可能性,也可能使我们在未来以我们认为合适的时间和价格出售股权证券变得更加困难。
此外,在未来,我们可能会发行普通股,或其他可转换为普通股的股权或债务证券,与融资、收购、员工安排或其他相关。任何此类发行,包括根据任何市场协议,都可能导致我们现有股东的大量稀释,并可能导致我们普通股的价格下跌。
项目10亿。未解决的员工评论
不适用。
项目1C。网络安全泰伊
风险管理和战略
我们依赖于我们的信息系统的运作、可用性和安全性,包括金融、数据处理、通信和操作系统。一些信息系统,如软件应用程序和云平台,是由第三方提供的。我们的网络安全风险框架旨在使我们能够识别、评估和管理我们面临的与我们的系统和我们处理的信息有关的网络安全风险。
作为我们框架的一部分,我们维护为评估、识别和管理风险而定义的某些流程。例如,我们有一个事件管理和响应流程,根据该流程,我们将某些威胁和事件的详细信息适当地传达给管理层和董事会;使用旨在监控相关信息系统的漏洞、威胁和事件的手动和自动化流程;管理和采取某些旨在应对可能发生的事件的行动;以及采取旨在补救相关环境中发现的某些漏洞的行动。我们在我们的基础设施中采用了一系列数据安全技术、流程和方法,旨在保护我们的系统和敏感信息免受未经授权的访问。我们与全球信息技术顾问合作,他们在监控不断发展的行业实践方面提供建议和专业知识。我们对网络安全威胁的重大风险的评估和管理已整合到公司的整体风险管理流程中。例如,某些管理人员,包括我们的执行副总裁和首席财务官,根据我们的整体业务目标评估来自网络安全威胁的重大风险,并适当地向董事会审计委员会报告此类评估,该委员会随后评估我们的整体企业风险。
除了上述第三方,我们还使用其他第三方服务提供商在整个业务中执行各种功能,如企业和员工管理平台、实验室、合同研究机构、合同制造机构和供应链资源。根据所提供服务的性质、所涉信息系统和数据的敏感性以及提供商的身份,我们会采取旨在应对此类服务提供商可能向我们提供的网络安全风险的步骤,例如对此类服务提供商的网络安全做法和风险概况进行调查。
.
有关可能对公司产生重大影响的网络安全威胁的风险描述以及如何实现这些风险,请参阅第一部分第1A项下的风险因素。本10-k表格年度报告中的风险因素,包括如果我们的信息技术系统或与我们合作的第三方的信息技术系统或我们的数据被或被泄露,我们可能会经历这种妥协所产生的不利后果,包括但不限于监管调查或行动;诉讼;罚款和处罚;我们的业务运营中断;声誉损害;收入或利润损失;以及其他不利后果。.
83
治理
我们的网络安全风险评估和管理流程由某些管理层实施和维护,包括我们的信息技术董事,他拥有20多年的信息技术和信息技术领导经验。我们的信息技术董事在我们的执行副总裁兼首席财务官的监督下,管理和监控我们的网络安全风险(包括我们的信息技术服务提供商提出的风险)。董事负责向执行副总裁兼首席财务官通报相关的网络安全风险,包括相关的网络安全事件的预防、检测、缓解和补救。我们的执行副总裁兼首席财务官拥有20多年的管理经验,包括对信息技术和网络安全事务的监督。
我们的董事会在审计委员会的协助下,对我们面临的网络安全风险以及我们旨在识别、优先排序、评估、管理和缓解这些风险的流程进行监督。作为监督职责的一部分,审计委员会定期收到执行副总裁兼首席财务官关于网络安全和信息技术事项以及相关风险暴露(包括某些网络安全事件引起的风险暴露)的最新情况。
项目2.性能
我们的总部位于新泽西州的伊塞林,根据2029年4月30日到期的租约,我们在那里占用了大约3726平方英尺的办公空间。2021年3月,我们与位于新泽西州伊塞林的前公司总部签订了一份为期三年的公司办公室租约,租约于2024年4月30日结束。
项目3.法律诉讼
2023年11月3日,美国新泽西州地区法院对我们和我们的某些官员提起了证券集体诉讼。集体诉讼指控我们在2021年8月3日至2023年8月29日期间就我们的BLA所作的虚假和误导性陈述违反了《交易法》。起诉书中指控,除其他事项外,我们违反了交易法第10(B)和20(A)条和美国证券交易委员会规则100亿.5,未能披露据称缺乏支持ONS-5010/LYTENAVA作为湿性AMD治疗方法的证据,以及我们和/或我们的制造合作伙伴对ONS-5010/LYTENAVA的CMC控制不足,在我们的BLA重新提交给FDA时仍未解决,因此,FDA不太可能批准我们的BLA,并且当此类信息披露时,我们的股价下跌。集体诉讼中的原告要求损害赔偿和利息,以及包括律师费在内的合理费用的裁决。被告的驳回动议目前正在法庭待决。
2024年10月10日,在特拉华州地区法院提起的股东派生诉讼中,该公司的某些高管和董事被列为被告。*衍生品起诉书声称,被告违反了他们的受托责任,导致和/或允许该公司违反联邦证券法,其依据与证券集体诉讼相同的被指控的失实陈述。衍生品起诉书还指控被告违反了交易法第14(A)条,以及对出资、不当得利和浪费公司资产的索赔。*衍生品诉讼寻求未指明的损害赔偿、公司治理改革、恢复原状、分担、律师费和其他费用。
悬而未决的诉讼和任何其他相关诉讼都存在固有的不确定性,实际的辩护和处置成本将取决于许多未知因素。悬而未决的诉讼和任何其他相关诉讼的结果必然是不确定的。我们可能会被迫花费大量资源来为未决的诉讼和任何额外的诉讼辩护,而我们可能不会获胜。此外,我们可能会产生与此类诉讼相关的大量法律费用和费用。我们目前无法估计这些事项可能给我们带来的成本,因为未决的诉讼目前处于早期阶段,我们不能确定解决未决的诉讼可能需要多长时间,或者我们可能需要支付的任何损害赔偿的可能金额。如果我们不在未决诉讼和任何其他相关诉讼的辩护中获胜,或者即使
84
85
第二部分
项目5.注册人普通股市场、相关股东事项和发行人购买股权证券
市场信息
我们的普通股在纳斯达克资本市场交易,代码为OTLK。
普通股股东
截至2024年12月14日,我们的普通股大约有78名登记在册的股东。股东的实际数量超过了记录持有人的数量,包括作为受益者的股东,但其股票是由经纪人和其他被提名人以街头名义持有的。这一数量的登记持有人也不包括其股份可能由其他实体以信托形式持有的股东。
股利政策
我们从未宣布或支付过我们的股本的任何现金股息,也不预期在可预见的未来支付任何现金股息。未来支付现金股息(如果有的话)将由我们的董事会酌情决定,并将取决于当时的条件,包括我们的财务状况、经营业绩、合同限制、资本要求、业务前景和我们的董事会可能认为相关的其他因素。
根据股权补偿计划获授权发行的证券
本项目所要求的有关股权补偿计划的信息通过参考本年度报告表格10-k第12项中的信息并入。
最近出售的未注册股票证券
没有。
发行人购买股票证券
在截至2024年9月30日的财年中,我们没有回购任何股权证券。
第6项保留。
86
项目7.管理层对财务状况和经营成果的讨论和分析
以下讨论应与本年度报告表格10-k中其他部分所载的合并财务报表及其附注一并阅读。这份Form 10-k年度报告包括以下各节,包含前瞻性陈述。这些陈述会受到风险和不确定因素的影响,这些风险和不确定因素可能会导致实际结果和事件与这些前瞻性陈述中明示或暗示的内容大相径庭。关于这些风险和不确定因素的详细讨论,请参阅本年度报告表格10-k中的第1A项“风险因素”。另请参阅“关于前瞻性陈述和行业数据的警示说明”。我们告诫读者不要过度依赖这些前瞻性陈述,这些陈述仅反映了截至本10-k表格日期管理层的分析。我们不承担更新前瞻性陈述的义务,这些前瞻性陈述反映了在本10-K表格日期之后发生的事件或情况.
概述
我们是一家生物制药公司,致力于推出首个贝伐单抗眼科制剂,该制剂已获得欧盟委员会(European Commission)、英国药品和保健产品监管机构(MHRA)和美国食品和药物管理局(FDA)的批准,用于视网膜适应症。我们最初的目标是直接或与欧盟和英国的合作伙伴一起推出,如果获得批准,将作为第一个也是唯一批准的眼用贝伐单抗在美国直接推出,用于治疗视网膜疾病,包括湿性老年性黄斑变性或湿性AMD。我们的计划还包括寻求批准,并在日本和其他市场推出该产品。2024年5月27日,我们获得了欧盟委员会对治疗湿性AMD的ONS-5010/LYTENAVA的营销授权。该授权在整个欧洲经济区(EEA)内有效,并提供8年的数据独占性和10年的市场独占性。2024年7月8日,我们还获得了ONS-5010/LYTENAVA在英国治疗湿性AMD的营销授权,随后英国国家健康与护理卓越研究所(NICE)于2024年12月4日推荐LYTENAVA™(贝伐单抗伽玛)作为治疗湿性AMD的一种选择。在美国以外,我们目前正在评估直接商业化或通过战略合作伙伴商业化的选择。
贝伐单抗是一种全长、人源化的抗血管内皮生长因子重组单抗,可抑制血管内皮生长因子及其相关的血管生成活性。2022年10月,我们向欧洲药品管理局(EMA)提交了ONS-5010/LYTENAVA的营销授权申请(MAA)。MAA是根据2001/83/EC指令第8.3条作为“全混合营销授权申请”提交的。2024年3月22日,EMA的人用药品委员会(CHMP)对ONS-5010/LYTENAVA(贝伐单抗伽马)的授权发表了积极的意见,贝伐单抗是欧盟治疗湿性老年性黄斑变性(WAM)的贝伐单抗的一种眼科研究配方。2024年5月,欧盟委员会批准了ONS-5010/LYTENAVA在欧盟治疗湿性AMD的营销授权。该决定自动适用于所有27个欧盟成员国,并在30天内适用于冰岛、挪威和列支敦士登。此外,在2024年4月,我们向英国MHRA提交了一份MAA,寻求批准ONS-5010/LYTENAVA(贝伐单抗伽玛)用于治疗湿性AMD。提交的申请是根据新的国际认可程序(IRP)完成的,该程序允许MHRA在考虑英国市场营销授权申请时,依赖于从MHRA指定的参考监管机构(RR)之一获得的同一产品的授权。这些RRS包括EMA的CHMP对同一产品在欧盟的营销授权申请的积极意见。2024年7月,MHRA批准ONS-5010/LYTENAVA在英国用于治疗湿性AMD。ONS-5010/LYTENAVA是欧盟和英国第一个也是唯一一个被授权用于治疗湿性AMD的贝伐单抗眼科制剂。
另外,在2022年3月,我们向FDA提交了ONS-5010/LYTENAVA的BLA,这是一种贝伐单抗的眼科研究配方,我们已经开发出作为玻璃体内注射的药物,用于治疗湿性AMD和其他视网膜疾病。2022年5月,我们自愿撤回了我们的BLA,以提供FDA要求的更多信息。我们于2022年8月30日向FDA重新提交了ONS-5010/LYTENAVA的BLA,并于2022年10月收到FDA的确认,即我们的BLA已被接受,目标日期为2023年8月29日,供FDA审查决定。2023年8月29日,我们收到了一封完整的回复信(CRL),FDA在信中得出结论,由于几个化学、制造和控制(CMC)问题、批准前制造检查的公开观察以及缺乏
87
确凿的证据。在随后与FDA的A型会议上,我们了解到FDA要求完成另一项充分和良好控制的临床试验,评估ONS-5010/LYTENAVA,以及CRL中显示的额外要求的CMC数据,以批准ONS-5010/LYTENAVA用于湿性AMD。
在与FDA讨论支持我们的ONS-5010/LYTENAVA的BLA后,我们同意进行另一项充分和良好控制的临床试验。2023年12月,我们向FDA提交了这项研究的特别方案评估(SPA)(挪威八国),寻求确认如果成功,它将满足FDA对第二次充分和良好控制的临床试验的要求,以支持我们计划重新提交ONS-5010/LYTENAVA BLA。2024年1月,我们得到确认,FDA已经根据SPA审查并同意了挪威八国试验方案。如果挪威的八项试验成功,它将满足FDA的要求,即第二次充分和良好控制的临床试验,以完全解决CRL中确定的临床缺陷。此外,通过A类会议和与FDA的其他互动,我们已经确定了解决CRL中CMC意见所需的方法。我们正在努力解决尚未解决的CMC项目,并已与FDA结束了一系列C型和D型会议,以帮助解决这些意见,然后在2024年第四季度报告北欧八国的主要业绩。我们于2024年9月完成了北欧八国试验的招生工作。2024年11月,我们报告说,ONS-5010/LYTENAVA在第8周没有达到FDA特别协议评估(SPA)中规定的预先指定的非劣势终点。然而,试验的初步数据显示,视力和生物活性的存在有所改善,以及ONS-5010持续良好的安全性。对数据的分析正在进行中,因为正在收集北欧八国的第三个月数据,预计将于2025年1月提供。在收到北欧8号的3个月全部疗效和安全性结果后,我们计划在2025年第一季度重新提交ONS-5010/LYTENAVA的BLA申请。
我们为湿性AMD患者提交的ONS-5010/LYTENAVA的BLA和MAA涉及三项临床试验,我们称之为北欧一号、北欧二号和北欧三号。我们评估ONS-5010/LYTENAVA作为贝伐单抗眼用配方的临床计划的研究设计在2018年4月与FDA的第二阶段会议结束时进行了审查,我们于2019年第一季度向FDA提交了我们的研究新药申请或IND。2020年8月,我们报告了临床经验研究Norse One的概念验证结果达到了预期的安全性和有效性。Norse 2是我们关键的3期临床试验,比较了ONS-5010/LYTENAVA和雷尼比珠单抗(Lucentis)。2021年8月来自Norse Two的TOPLINE结果显示,ONS-5010/LYTENAVA达到了疗效的主要和关键次要终点,并观察到了治疗患者的临床影响变化。2021年3月,我们报告说,北欧三号的结果显示ONS-5010/LYTENAVA的安全性状况是积极的。
根据与FDA在SPA中达成的协议,Norse Eight是一项随机、对照、平行分组、掩蔽、非劣势研究,约400名新诊断的湿性AMD受试者按1:1的比例随机接受1.25毫克ONS-5010/LYTENAVA或0.5毫克雷尼比珠单抗玻璃体内注射。受试者在第0天(随机化)、第4周和第8周接受注射。主要终点是从基线到第8周的BCVA的平均变化。2024年11月,我们报告说,ONS-5010/LYTENAVA在第8周没有达到SPA中规定的预先指定的非劣势终点。然而,试验的初步数据显示,ONS-5010/LYTENAVA的视力和生物活性有所改善,并继续保持良好的安全性。对数据的分析正在进行中,因为正在收集北欧八国的第三个月数据,预计将于2025年1月提供。在收到北欧8号的3个月全部疗效和安全性结果后,我们计划在2025年第一季度重新提交ONS-5010/LYTENAVA的BLA申请。如果获得批准,我们预计将在美国获得12年的监管排他性。
此外,在2021年11月,我们开始招募患者参加我们的挪威七号临床试验。这项研究比较了眼用贝伐单抗瓶装和预填充注射器的安全性,这些受试者被诊断为视网膜疾病,将受益于玻璃体内注射贝伐单抗的治疗,包括渗出性老年性黄斑变性,DME,或BRVO。受试者将接受为期三个月的治疗,接受ONS-5010/LYTENAVA瓶装研究的受试者的登记工作已经完成。
我们还从FDA获得了三个SPA的协议,为我们正在进行的ONS-5010/LYTENAVA第三阶段计划进行三个额外的注册临床试验。与FDA就这些水疗中心达成的协议涵盖
88
Norse 4的注册临床试验,评估ONS-5010/LYTENAVA治疗BRVO的注册临床试验;以及Norse 5和Norse 6的注册临床试验,评估ONS-5010/LYTENAVA治疗DME。启动这些研究的时间尚未确定,等待FDA对湿性AMD的初步批准。
由于美国和其他主要市场没有批准的贝伐单抗产品用于治疗视网膜疾病,我们提交了标准的BLA,并且没有使用生物相似的药物开发途径,如果阿瓦斯丁是靶向疾病的批准药物,则需要使用生物相似的药物开发途径。如果在美国获得批准,我们相信ONS-5010/LYTENAVA有潜力降低未经批准的贝伐单抗在标签外使用的风险。在美国,66.3%的视网膜医生表示,非标签重新包装的贝伐单抗是他们最常用的一线抗血管内皮生长因子药物(ASRS 2022成员调查在ASRS NY 2022上公布)。
2024年12月10日,我们的董事会批准了一项裁员计划,以降低运营费用并保留资本。2024年12月13日,我们裁减了5名员工,约占现有员工总数的23%。至少,受裁员影响的所有员工都有资格在解雇后的特定时间段内获得遣散费和支付的眼镜蛇保费,条件是执行针对我们的全面索赔。我们估计,与裁员相关的重组费用约为30美元万,其中包括与员工遣散费和通知期付款、福利和相关成本相关的现金支出。虽然我们预计与裁员相关的大部分现金支付将在2025年第三个日历季度末基本完成,但由于可能发生的意外事件,包括与实施裁员相关的事件,我们可能会产生目前未考虑的其他费用或现金支出。此外,我们可能无法在预期的时间表上实现这些成本削减措施和其他成本削减计划的预期好处,或者根本无法实现,否则可能会加速我们的流动性需求,并可能迫使我们进一步缩减或暂停运营。
持续经营考虑
截至2024年9月30日,我们通过出售和发行我们的股权和债务证券所得的53090美元 万为我们的几乎所有业务提供了资金。到目前为止,根据我们的合作和许可协议,我们还收到了2,900美元的万。我们截至2024年9月30日的年度净亏损为7,540美元万。在截至2023年9月30日的一年中,我们还净亏损5,900美元万。我们没有从产品销售中获得任何收入。我们预计在ONS-5010/LYTENAVA或我们可能开发的任何其他候选产品产生可观的销售之前,我们将招致额外的损失。
于2023年5月16日,吾等与BTIG,LLC(“BTIG”)订立市场销售协议(“BTIG ATM协议”或“BTIG ATM发售”),根据该协议,吾等可不时透过BTIG发行及出售普通股股份,总发行价最高可达10000美元万。我们产生了40美元的万融资成本,这些成本已资本化,当我们根据BTIG ATM产品出售普通股时,这些成本将按比例重新分类为额外的实收资本。
根据BTIG自动取款机协议,公司向BTIG支付相当于根据BTIG自动取款机协议出售普通股的总毛收入3.0%的佣金。根据BTIG自动柜员机协议发售普通股将于(I)出售受BTIG自动柜员机协议约束的所有普通股或(Ii)根据协议条款终止BTIG自动柜员机协议时终止。
在2024年11月和2024年12月,我们根据BTIG ATM协议出售了1,000,000股普通股,在向BTIG支付费用和其他发行成本10美元万后,净收益为170美元万。
我们评估了是否有一些条件或事件,从总体上考虑,对我们作为一家持续经营的企业继续存在的能力提出了很大的怀疑。我们认为,截至2024年9月30日,我们目前的现金资源为1,490 美元万,加上自2024年9月30日以来根据BTIGATM发售出售普通股所得的170万美元万净收益,不足以为我们的运营提供资金,从Form 10-k申请日起计一年。这些因素使人对我们作为一家持续经营的公司继续经营的能力产生很大怀疑。我们将需要筹集大量额外资金,为我们计划中的未来运营提供资金,获得ONS-5010/LYTENAVA的批准并将其商业化,开始和继续临床试验,或开发其他候选产品。我们计划通过以下方式为未来的运营提供资金
89
与制药公司的潜在许可和/或营销安排、发行股权证券和发行额外债务、潜在合作和未来潜在产品销售收入(如果有的话)的组合。不能保证我们将成功地获得足够的资金,用于ONS-5010/LYTENAVA或任何其他当前或未来候选产品的开发和商业化。如果我们无法获得足够的额外资金,我们的业务、经营业绩、财务状况和现金流可能会受到实质性的不利影响。我们的合并财务报表不包括任何必要的调整,如果我们无法继续经营下去的话。
协作和许可协议
我们不时就我们的产品和/或候选产品的研发、制造和/或商业化签订合作和许可协议。这些协议通常规定不可退还的预付许可费、开发和商业业绩里程碑付款、成本分摊、特许权使用费支付和/或利润分享。我们还在其他市场获得了我们的传统生物相似产品候选产品(ONS-3010、ONS-1045和ONS-1050)的许可权。
合通-私募与中国合资企业
2020年5月,我们与新通签订了一项股票购买协议,根据协议,我们于2020年6月以私募方式出售并发行了800,000股普通股,收购价为每股20美元,总收益为1,600美元万。关于订立购股协议,吾等与Syntone‘s People’s Republic of China(或中国联营公司)订立合资协议,据此,吾等同意成立一家中国合资企业,由Syntone的中国联营公司拥有80%股权,并由吾等拥有20%股权。于二零二一年四月成立中国合营公司后,吾等与中国合营公司订立免收特许权使用费许可协议,在包括香港、台湾及澳门在内的中国市场进行ONS-5010/LYTENAVA的开发、商业化及制造。
Selexis SA
2011年10月,我们与Selexis签订了一项研究许可协议,根据该协议,我们获得了在内部或与第三方合作进行研究的非独家许可,以利用Selexis表达技术或Selexis技术从哺乳动物细胞中创造的细胞系中开发重组蛋白质。有关更多详情,请参阅本年度报告中综合财务报表附注8的表格10-k。
我们运营业绩的组成部分
反向股票拆分
自2024年3月14日起,我们修改了修订和重述的公司证书,以实施普通股20股1股的反向股票拆分。我们经营业绩的披露反映了所有期间的反向股票拆分。
研发费用
研发费用包括与我们的候选产品的发现和开发相关的费用。我们按所发生的费用来支付研究和开发费用。这些费用包括:
| ● | 根据与合同研究组织或CRO以及进行临床前研究和临床试验的研究地点和顾问的协议而发生的费用; |
| ● | 由我们直接以及根据与合同制造组织或CMO的协议产生的费用,用于制造扩大成本,以及获取和制造临床前和临床试验材料和商业材料的成本,包括制造验证批次; |
| ● | 外包专业科学发展服务; |
90
| ● | 与员工有关的费用,包括工资、福利和股票薪酬; |
| ● | 根据第三方转让协议支付的款项,根据该协议我们获得了知识产权; |
| ● | 与监管活动有关的费用,包括向监管机构支付的申请费; |
| ● | 用于支持我们研究活动的实验室材料和用品;以及 |
| ● | 分摊的费用、水电费和其他与设施有关的成本。 |
我们的候选产品能否成功开发具有很大的不确定性。目前,我们无法合理估计或知道完成剩余开发所需努力的性质、时机和成本,或者我们的任何其他候选产品何时可能开始大量现金净流入。这种不确定性是由于与临床试验的持续时间和成本相关的许多风险和不确定因素,由于许多因素,这些风险和不确定因素在项目的整个生命周期内有很大的不同,包括:
| ● | 纳入试验的临床地点的数目; |
| ● | 招收合适病人所需的时间长短; |
| ● | 最终参与试验的患者数量; |
| ● | 患者接受的剂量数量; |
| ● | 患者随访时间长短; |
| ● | 我们的临床试验结果; |
| ● | 建立商业制造能力; |
| ● | 收到上市批准;以及 |
| ● | 候选产品的商业化。 |
我们的支出受到其他不确定性的影响,包括监管批准的条款和时间。我们可能永远不会成功地获得监管部门对我们的任何生物相似候选产品的批准。我们的临床试验可能会得到意想不到的结果。我们可能会选择停止、推迟或修改一些候选产品的临床试验,或者专注于其他产品。对于候选产品的开发,这些变量中的任何一个的结果的变化可能意味着与该候选产品的开发相关的成本和时间的重大变化。例如,如果FDA或其他监管机构要求我们进行超出我们目前预期的临床试验,或者如果我们在任何临床试验的登记方面遇到重大延误,我们可能需要花费大量额外的财政资源和时间来完成临床开发。产品的完全商业化将需要几年时间和数百万美元的额外成本。
研发活动是我们商业模式的核心。处于临床开发后期阶段的候选产品通常比处于临床开发早期阶段的候选产品具有更高的开发成本,这主要是由于后期临床试验的规模、复杂性和持续时间的增加。
一般和行政费用
一般和行政费用主要包括行政、行政、财务和法律职能人员的薪金和相关费用,包括股票报酬、差旅费和招聘费用。其他一般和行政费用包括与设施有关的费用、专利申请和起诉费用以及业务发展的专业费用、法律、审计和税务服务以及保险费用。
我们预计,如果我们认为监管部门有可能批准候选产品,我们的一般和行政费用将会增加,我们预计工资和费用将因我们为商业运营做准备而增加,特别是与我们产品的销售和营销相关的费用。
91
Loss on equity method investment
Loss on equity method investment represents our proportionate share for the period of the net loss of our investee to which the equity method of accounting is applied. We account for equity investments where we own a non-controlling interest, but have the ability to exercise significant influence, under the equity method of accounting.
Interest income
Interest income is earned from short term investments primarily money market investments.
Interest Expense
Interest expense consists of cash paid and non-cash interest expense related to our December 2022 Note. The interest expense was associated with the fees incurred for extending the debt and original issue discount and debt issuance costs that were written off upon election to fair value and accounted for as interest.
Loss on Extinguishment of Debt
We recognized a $0.6 million loss on extinguishment related to the prepayment and cancellation our November 2021 Note (as defined below) during the year ended September 30, 2023 that was accounted for as an extinguishment.
Change in Fair Value of Promissory Notes
The change in fair value relates to convertible promissory notes that we elected to account for at fair value. As permitted under ASC 825, we elected the fair value option to account for our convertible promissory notes. We recorded the convertible promissory note at fair value with changes in fair value recorded in the consolidated statements of operations.
Warrant Related Expenses
The warrant related expense relates to the excess of the fair value of the warrants upon issuance over the proceeds of the private placements that closed on March 18, 2024 and April 15, 2024.
Change in Fair Value of Warrant Liability
We issued warrants to purchase our common stock in conjunction with convertible senior secured notes issued pursuant to a certain Note and Warrant Purchase Agreement dated December 22, 2017, which are classified as liabilities and recorded at fair value. The warrants are subject to re-measurement at each balance sheet date and we recognize any change in fair value in our statements of operations as other (income) expense.
Income Taxes
Since inception, we have not recorded any U.S. federal or state income tax benefits (excluding the sale of New Jersey state NOLs and research and development, or R&D, tax credits) for the net losses we have incurred in each year or on our earned R&D tax credits, due to our uncertainty of realizing a benefit from those items. As of September 30, 2024, we had federal and state NOL carryforwards of $406.7 million and $242.5 million, respectively, that will begin to expire in 2030 and 2039, respectively. As of September 30, 2024, we had federal foreign tax credit carryforwards of $0.3 million available to reduce future tax liabilities, which begin to expire starting in 2023. As of September 30, 2024, we also had federal and state R&D tax credit carryforwards of $13.0 million and $0.8 million, respectively, that will begin to expire in 2032 and 2033, respectively.
In general, under Section 382 of the Internal Revenue Code of 1986, as amended, or the Code, a corporation that undergoes an “ownership change” is subject to limitations on its ability to utilize its NOLs to offset future taxable income. We have not completed a study to assess whether an ownership change has occurred in the past. Our existing NOLs may be subject to limitations arising from previous ownership changes, and if we undergo an ownership change in connection with or
92
after our Initial Public Offering, or IPO, our ability to utilize NOLs could be further limited by Section 382 of the Code. Future changes in our stock ownership, some of which are outside of our control, could result in an ownership change under Section 382 of the Code. Our NOLs are also subject to international regulations, which could restrict our ability to utilize our NOLs. Furthermore, our ability to utilize NOLs of companies that we may acquire in the future may be subject to limitations. There is also a risk that due to regulatory changes, such as suspensions on the use of NOLs, or other unforeseen reasons, our existing NOLs could expire or otherwise be unavailable to offset future income tax liabilities.
Furthermore, our ability to utilize NOLs of companies that we may acquire in the future may be subject to limitations. There is also a risk that due to regulatory changes, such as suspensions on the use of NOLs, or other unforeseen reasons, our existing NOLs could expire or otherwise be unavailable to offset future income tax liabilities.
Results of Operations
Comparison of Years Ended September 30, 2024 and 2023
Year ended September 30, | |||||||||
| 2024 |
| 2023 |
| Change | ||||
Operating expenses: | |||||||||
Research and development | $ | 41,763,047 | $ | 26,452,942 | $ | 15,310,105 | |||
General and administrative | 29,940,188 | 26,673,440 | 3,266,748 | ||||||
Loss from operations | (71,703,235) | (53,126,382) | (18,576,853) | ||||||
Loss on equity method investment | 100,742 | 10,998 | 89,744 | ||||||
Interest income | (906,150) | (971,480) | 65,330 | ||||||
Interest expense | 3,156,964 | 2,531,228 | 625,736 | ||||||
Loss on extinguishment of debt | — | 577,659 | (577,659) | ||||||
Change in fair value of promissory notes | 2,457,153 | 3,756,000 | (1,298,847) | ||||||
Warrant related expenses | 37,490,012 | — | 37,490,012 | ||||||
Change in fair value of warrant liability | (38,638,042) | (50,919) | (38,587,123) | ||||||
Loss before income taxes | (75,363,914) | (58,979,868) | (16,384,046) | ||||||
Income tax expense | 2,800 | 2,800 | — | ||||||
Net loss | $ | (75,366,714) | $ | (58,982,668) | $ | (16,384,046) | |||
Research and Development Expenses
The following table summarizes our research and development expenses by functional area for the years ended September 30, 2024 and 2023:
Year ended September 30, | ||||||
| 2024 |
| 2023 | |||
ONS-5010/LYTENAVA development | $ | 37,355,884 | $ | 28,718,140 | ||
Compensation and related benefits | 2,507,635 | 2,126,772 | ||||
Stock-based compensation | 800,956 | 986,598 | ||||
Other research and development | 1,098,572 | (5,378,568) | ||||
Total research and development expenses | $ | 41,763,047 | $ | 26,452,942 | ||
Research and development expenses for the year ended September 30, 2024 increased by $15.3 million compared to the year ended September 30, 2023. The increase was primarily due to an $8.6 million rise in development costs associated with ONS-5010/LYTENAVA related to the commencement and subsequent completion of enrollment in the NORSE EIGHT clinical trial, combined with the effects of a $6.2 million refund for BLA submission fees from the FDA received in the prior period.
93
General and Administrative Expenses
The following table summarizes our general and administrative expenses by type for the years ended September 30, 2024 and 2023:
Year ended September 30, | ||||||
| 2024 |
| 2023 | |||
Professional fees | $ | 9,866,128 | $ | 14,522,528 | ||
Compensation and related benefits | 6,301,200 | 4,366,447 | ||||
Stock-based compensation | 4,584,168 | 4,560,421 | ||||
Europe prelaunch expenses | 5,010,687 | — | ||||
Facilities, fees and other related costs | 4,178,005 | 3,224,044 | ||||
Total general and administrative expenses | $ | 29,940,188 | $ | 26,673,440 | ||
General and administrative expenses for the year ended September 30, 2024 increased by $3.3 million compared to the year ended September 30, 2023. During the year ending September 30, 2024, we incurred pre-launch expenses in Europe amounting to $5.0 million, along with a $1.9 million increase in compensation and benefits primarily attributed to severance-related costs and adjustments in headcount. These increases were offset by a $4.7 million decrease in professional fees, which resulted from the discontinuation of U.S. commercial launch activities following the receipt of the CRL in August 2023.
Loss on Equity Method Investment
Loss on equity method investment represents our share of the loss from Beijing Syntone Biopharma Ltd, or Syntone JV.
Interest Income
Interest income for the year ended September 30, 2024 and 2023 was earned from short term investments, primarily consisting of money market investments.
Interest Expense
Interest expense for the year ended September 30, 2024 increased by $0.6 million compared to prior year. This increase was primarily attributable to convertible promissory note maturity extension fees of $3.2 million associated with the December 2022 Note incurred during the year, in contrast to $2.5 million incurred in the prior year primarily related to the recognition of the original issue discount as interest expense on the December 2022 Note, as result of our adoption the fair value option for accounting purposes.
Loss on Extinguishment of Debt
We recognized a $0.6 million loss on extinguishment related to the prepayment and cancellation of our November 2021 Note (as defined below) during the year ended September 30, 2023 that was accounted for as an extinguishment.
Change in Fair Value of Promissory Notes
The change in fair value relates to the convertible promissory notes that we elected to account for at fair value. As permitted under ASC 825, we elected the fair value option to account for our convertible promissory notes. We record the convertible promissory notes at fair value with changes in fair value recorded in the consolidated statements of operations.
Warrant Related Expenses
During the year ended September 30, 2024, we recognized charges associated with warrants issued during the period, which were categorized as liabilities. The warrant related charges amounted to the difference between the fair value of the warrants and the net proceeds received from private placements that closed on March 18, 2024 and April 15, 2024.
94
Change in Fair Value of Warrant Liability
We recognized income related to the decrease in the fair value of our common stock warrant liability in both fiscal years 2024 and 2023. This income was attributed to a decline in the price of our common stock during those periods. In fiscal year 2024, we recorded income of $38.6 million, compared to $0.1 million in fiscal year 2023. We issued warrants to purchase our common stock in conjunction with convertible senior secured notes issued pursuant to a certain Note and Warrant Purchase Agreement dated December 22, 2017. Additionally, we issued warrants in connection with private placements that closed on March 18, 2024 and April 15, 2024. These warrants are categorized as liabilities and recorded at fair value. The warrants are subject to re-measurement at each balance sheet date, and we recognize any change in fair value in our statements of operations. The gain recorded during the period was primarily due to the reduction in our stock price per share of common stock during the year.
Liquidity and Capital Resources
We have not generated any revenue from product sales. Since inception, we have incurred net losses and negative cash flows from our operations. Through September 30, 2024, we have funded substantially all of our operations with $530.9 million in net proceeds from the sale and issuance of our equity securities, debt securities and borrowings under debt facilities.
We anticipate incurring additional losses until such time, if ever, that we can generate significant sales of ONS-5010/LYTENAVA or any other product candidate we may develop. We will need substantial additional financing to fund our operations and to commercially launch ONS-5010/LYTENAVA or any other product candidate we may develop. Management is currently evaluating various strategic opportunities to obtain the required funding for future operations. These strategies may include but are not limited to payments from potential strategic research and development, licensing and/or marketing arrangements with pharmaceutical companies, private placements and/or public offerings of equity and/or debt securities. Alternatively, we will be required to, among other things, make reductions in our workforce, scale back our plans and place certain activities on hold, discontinue our development programs, liquidate all or a portion of our assets, and/or seek protection under the provisions of the U.S. Bankruptcy Code.
On November 16, 2021, we received $10.0 million in net proceeds from the issuance of an unsecured promissory note (the “November 2021 Note”), with a face amount of $10.2 million. The November 2021 Note bore interest at a rate of 9.5% per annum, was due to mature January 1, 2023 and included an original issue discount of $0.2 million. We could prepay all or a portion of the note at any time by paying 105% of the outstanding balance elected for prepayment. On December 28, 2022, we prepaid the November 2021 Note in full by paying 105% of the outstanding balance. The total payment was $11.9 million, which included interest of $1.2 million and a prepayment fee of $0.6 million.
During the year ended September 30, 2023, we sold 44,769 shares of common stock under our prior at-the-market offering program for $1.1 million in net proceeds, and the fees paid to the sales agent were immaterial.
On May 16, 2023, we entered into the BTIG ATM Agreement, under which we may issue and sell shares of common stock having an aggregate offering price of up to $100.0 million from time to time through BTIG. Under the BTIG ATM Agreement, we pay BTIG a commission equal to 3.0% of the aggregate gross proceeds of any sales of common stock under the BTIG ATM Agreement. The offering of common stock pursuant to the BTIG ATM Agreement will terminate upon the earlier of (i) the sale of all common stock subject to the BTIG ATM Agreement or (ii) termination of the BTIG ATM Agreement in accordance with its terms. No shares of common stock were sold under the BTIG ATM Offering during the year ended September 30, 2024. During the year ended September 30, 2023, we sold 178,911 shares of common stock pursuant to the BTIG ATM Offering, generating $6.1 million in net proceeds after we paid fees to BTIG of $0.2 million.
In December 2022, in a registered direct equity offering to certain institutional and accredited investors, including GMS Ventures, our largest stockholder, we issued 1,423,041 shares of common stock at a purchase price per share of $17.568 for $23.2 million in net proceeds after payment of placement agent fees and other offering costs. GMS Ventures purchased an aggregate of 711,520 shares of common stock in the registered direct equity offering. In connection with the registered direct equity offering, we issued to M.S. Howells & Co., as placement agent for certain accredited investors in the offering,
95
warrants to purchase up to an aggregate of 25,787 shares of common stock, which will be exercisable commencing on the one-year anniversary of the closing of the offering at an exercise price of $21.00 per share, which warrants have a three-year term.
On December 22, 2022, we entered into a Securities Purchase Agreement and issued an unsecured convertible promissory note with a face amount of $31.8 million, or the December 2022 Note, to Streeterville Capital, LLC, or the Lender, the holder of our November 2021 Note. The December 2022 Note has an original issue discount of $1.8 million. A portion of the proceeds from the December 2022 Note were used to repay in full the remaining outstanding principal and accrued interest on the November 2021 Note, which was cancelled upon repayment. We received net proceeds of $18.1 million upon the closing on December 28, 2022, after deducting the Lender’s transaction costs in connection with the issuance and November 2021 Note repayment. In December 2023, the Company extended the maturity of the December 2022 Note from January 1, 2024 to April 1, 2024. The Company incurred a $475,000 extension fee. The December 2022 Note bore interest at 9.5% per annum through April 1, 2024. On January 22, 2024, the Company entered into an amendment to the December 2022 Note (the “January 2024 Note Amendment”) with the Lender, which became effective on April 1, 2024 after satisfaction of certain closing conditions, including various required stockholder approvals and the closing of the private placement that closed on March 18, 2024. The maturity of the December 2022 Note was extended to July 1, 2025. An extension fee of $2.7 million (calculated as 7.5% of the outstanding balance of the December 2022 Note) was added to the outstanding balance on March 18, 2024. Under the January 2024 Note Amendment, the initial conversion price with respect to $15.0 million in aggregate principal amount of the December 2022 Note was changed to $7.00, the price per share in the private placement that closed on March 18, 2024 and the remaining aggregate principal amount has a conversion price of $40.00 per share. Effective April 1 2024, the December 2022 Note bears interest at the prime rate (as published in the Wall Street Journal) plus 3% (subject to a floor of 9.5%) and the Company has an obligation to repay at least $3.0 million of the outstanding balance of the December 2022 Note for each calendar quarter beginning with the second calendar quarter of 2024 (subject to adjustment for conversions by the Lender and to payment of an exit fee as set forth in the December 2022 Note) and continuing until the December 2022 Note is repaid in full. The December 2022 Note contains customary covenants, including a restriction on our ability to pledge certain ofour assets, subject to certain exceptions, without the Lender’s consent. The principal amount and conversion price of the December 2022 Note are subject to adjustment upon certain triggering events. See “Description of Indebtedness” and Note 7 in the Notes to Consolidated Financial Statements in this Annual Report on Form 10-K for additional detail.
During the year ended September 30, 2024, an aggregate of principal and accrued interest totaling $11.3 million of the December 2022 Note was converted into 1,607,093 shares of our common stock.
In March 2024, in a private placement pursuant to a securities purchase agreement entered into in January 2024 with certain institutional and accredited investors, including GMS Ventures, our largest stockholder, we issued an aggregate of 8,571,423 shares of common stock and warrants to purchase an aggregate of 12,857,133 shares of common stock at a purchase price per share of $7.00 per share and accompanying warrant to purchase one and one-half shares of common stock for $55.5 million in net proceeds after payment of placement agent fees and other offering costs. GMS Ventures purchased an aggregate of 2,305,714 shares of common stock and warrants to purchase an aggregate of 3,458,571 shares of common stock in the private placement. The warrants have an exercise price of $7.70 per share of common stock and will expire on March 18, 2029.
On April 15, 2024, in a private placement with Syntone Ventures, LLC pursuant to a securities purchase agreement entered into in January 2024, we issued 714,286 shares of common stock and accompanying warrants to purchase 1,071,429 shares of common stock for $4.8 million in gross proceeds on substantially the same terms as those in the private placement closed in March 2024. The warrants have an exercise price of $7.70 per share of common stock and will expire on April 15, 2029.
In November 2024 and December 2024, we sold 1,000,000 shares of common stock under the BTIG ATM Agreement generated $1.7 million in net proceeds after paying fees to BTIG and other issuance costs of $0.1 million.
We evaluated whether there are conditions or events, considered in the aggregate, that raise substantial doubt about our ability to continue as a going concern. As of September 30, 2024, we had an accumulated deficit of $543.3 million and $31.4 million of principal, accrued interest and exit fees due on the December 2022 Note. We do not believe our current
96
cash resources of $14.9 million, together with $1.7 million in net proceeds from the sale of shares of common stock under the BTIG ATM Offering since September 30, 2024, are sufficient to fund our operations through one year from the Form 10-K filing date as a result of the costs associated with the NORSE EIGHT clinical trial and the July 1, 2025 maturity date of the December 2022 Note, as amended in January 2024. These factors raise substantial doubt about our ability to continue as a going concern. Our consolidated financial statements do not include any adjustments related to the recoverability and classification of recorded asset amounts or the amounts and classification of liabilities that might result from the outcome of this uncertainty. We anticipate incurring additional losses until such time, if ever, that we can generate significant sales of ONS-5010/LYTENAVA or any other product candidate we may develop. We will need substantial additional financing to fund our operations and to commercially develop ONS-5010/LYTENAVA or any other product candidate we may develop. Management is currently evaluating various strategic opportunities to obtain the required funding for future operations. These strategies may include but are not limited to payments from potential strategic research and development, licensing and/or marketing arrangements with pharmaceutical companies, private placements and/or public offerings of equity and/or debt securities. There can be no assurance that these future funding efforts will be successful. Alternatively, we will be required to, among other things, make reductions in our workforce, scale back our plans and place certain activities on hold, discontinue our development programs, liquidate all or a portion of our assets, and/or seek protection under the provisions of the U.S. Bankruptcy Code.
Our future operations are highly dependent on a combination of factors, including (i) the timely and successful completion of additional financing discussed above, (ii) our ability to complete revenue-generating partnerships with pharmaceutical companies, (iii) the success of our research and development, (iv) the development of competitive therapies by other biotechnology and pharmaceutical companies, and, ultimately, (v) regulatory approval and market acceptance of our proposed future products.
While we expect that the majority of the cash payments related to the workforce reduction will be substantially complete by the third calendar quarter of 2025, we may incur other charges or cash expenditures not currently contemplated due to unanticipated events that may occur, including in connection with the implementation of the workforce reduction. Additionally, we may not achieve the expected benefits of these cost reduction measures and other cost reduction plans on the anticipated timeline, or at all, which could otherwise accelerate our liquidity needs and could force us to further curtail or suspend our operations.
Cash Flows
The following table summarizes our cash flows for each of the years presented:
Year ended September 30, | ||||||
| 2024 |
| 2023 | |||
Net cash used in operating activities | $ | (68,793,858) | $ | (42,973,398) | ||
Net cash provided by financing activities | 60,329,414 | 48,968,568 | ||||
Net (decrease) increase in cash and cash equivalents | $ | (8,464,444) | $ | 5,995,170 | ||
Operating Activities
During the year ended September 30, 2024, we used $68.8 million of cash in operating activities resulting primarily from our net loss of $75.4 million. This use of cash was partially offset by $9.6 million of non-cash items such as stock-based compensation, non-cash interest expense, change in fair value of promissory notes, warrant related expense, change in fair value of warrant liability, loss on equity method investment and depreciation and amortization expense. The net cash outflow of $3.0 million from changes in our operating assets and liabilities was primarily due to an increase in prepaid expenses of $4.9 million for timing of payments associated with ONS-5010/LYTENAVA development costs relating to clinical trial and drug development costs partially offset by an increase in accounts payable and accrued expenses of $1.9 million due to professional fees associated with our EU launch activities.
During the year ended September 30, 2023, we used $43.0 million of cash in operating activities resulting primarily from our net loss of $59.0 million. This use of cash was partially offset by $12.4 million of non-cash items such as stock-based compensation, non-cash interest expense, change in fair value of promissory notes, change in fair value of warrant liability,
97
loss on extinguishment of debt, loss on equity method investment and depreciation and amortization expense. We also paid interest on debt of $1.2 million during the period. The net cash inflow of $4.8 million from changes in our operating assets and liabilities was primarily due to a net increase in accounts payable and accrued expenses of $2.4 million and a decrease in prepaid expenses of $2.6 million related to timing of payments associated with ONS-5010/LYTENAVA development costs, partially offset by an increase in other assets of $0.2 million.
Financing Activities
During the year ended September 30, 2024, net cash provided by financing activities was $60.3 million, primarily attributable to $60.3 million in net proceeds from private placements in March 2024 and April 2024 of an aggregate of 9,285,709 shares of our common stock and warrants to purchase an aggregate of 13,928,562 shares of our common stock.
During the year ended September 30, 2023, net cash provided by financing activities was $49.0 million, primarily attributable to $23.2 million in net proceeds from a registered direct equity offering in December 2022 of an aggregate of 1,423,041 shares of our common stock, $7.2 million in net proceeds from the sale of common stock under our prior at-the-market offering program and BTIG ATM Offering and $30.0 million in net proceeds from the issuance of the December 2022 Note with a face amount of $31.8 million in December 2022. We also made $10.2 million in debt and finance lease obligation payments and a $0.8 million payment of financing costs.
Description of Indebtedness
The December 2022 Note contains customary covenants, including a restriction on the Company’s ability to pledge certain of the Company’s assets, subject to certain exceptions, without the Lender’s consent. Since April 1, 2023, the Lender has the right to convert the December 2022 Note at the Conversion Price (as defined below). The principal amount and Conversion Price of the December 2022 Note were subject to adjustment upon certain triggering events. In addition, the Company has the right to convert all or any portion of the outstanding balance under the December 2022 Note into shares of common stock at the Conversion Price if certain conditions have been met at the time of conversion, including if at any time after the six-month anniversary of the closing date, the daily volume-weighted average price of the common stock on Nasdaq equals or exceeds $50.00 per share (subject to adjustments for stock splits and stock combinations) for a period of 30 consecutive trading days. Payments may be made by the Company (i) in cash, (ii) in shares of common stock, with the number of shares being equal to the portion of the applicable payment amount divided by the Conversion Price (as defined below), or (iii) a combination of cash and shares of common stock. Any payments made by the Company in cash, including prepayments or repayment at maturity, will be subject to an additional fee of 7.5%. Upon the occurrence of certain events described in the December 2022 Note, including, among others, the Company’s failure to pay amounts due and payable under the December 2022 Note, events of insolvency or bankruptcy, failure to observe covenants contained in the Securities Purchase Agreement and the December 2022 Note, breaches of representations and warranties in the Securities Purchase Agreement, and the occurrence of certain transactions without the Lender’s consent (each such event, a “Trigger Event”), the Lender shall have the right, subject to certain exceptions, to increase the balance of the December 2022 Note by 10% for a Major Trigger Event (as defined in the December 2022 Note) and 5% for a Minor Trigger Event (as defined in the December 2022 Note). If a Trigger Event is not cured within ten (10) trading days of written notice thereof from the Lender, it will result in an event of default (such event, an “Event of Default”). Following an Event of Default, the Lender may accelerate the December 2022 Note such that all amounts thereunder become immediately due and payable, and interest shall accrue at a rate of 22% annually until paid. Prior to April 1, 2024, under the December 2022 Note, “Conversion Price” meant, prior to a Major Trigger Event, $40.00 per share (subject to adjustment for stock splits and stock combinations), and following a Major Trigger Event, the lesser of (i) $40.00 per share (subject to adjustment for stock splits and stock combinations), and (ii) 90% multiplied by the lowest closing bid price of the Company’s common stock in the three trading days prior to the date on which the conversion notice is delivered. The maturity date of the December 2022 Note was extended from January 1, 2024 to April 1, 2024 in December 2023.
On January 22, 2024, the Company entered into the January 2024 Note Amendment with the Lender, which became effective on April 1, 2024 after satisfaction of certain closing conditions, including various required stockholder approvals and the closing of the private placement that closed on March 18, 2024. The maturity of the December 2022 Note was extended to July 1, 2025. An extension fee of $2.7 million (calculated as 7.5% of the outstanding balance of the December 2022 Note) was added to the outstanding balance on March 18, 2024. Under the January 2024 Note Amendment, the initial
98
conversion price with respect to $15.0 million in aggregate principal amount of the December 2022 Note was changed to $7.00, the price per share in the private placement that closed on March 18, 2024 and the remaining aggregate principal amount is converted at a price ofhas a conversion price of $40.00 per share. Effective April 1 2024, the December 2022 Note bears interest at the prime rate (as published in the Wall Street Journal) plus 3% (subject to a floor of 9.5%) and the Company has an obligation to repay at least $3.0 million of the outstanding balance of the December 2022 Note for each calendar quarter beginning with the second calendar quarter of 2024 (subject to adjustment for conversions by the Lender and to payment of an exit fee as set forth in the December 2022 Note) and continuing until the December 2022 Note is repaid in full. If the Conversion Price is below $3.51 per share, the Company will be required to satisfy a conversion notice from the Lender in cash. Subject to certain exceptions, while the December 2022 Note is outstanding, the Lender will have a consent right on any future variable rate transactions or any debt and a 10% participation right in any future debt or equity financings.
Funding Requirements
We plan to focus in the near term on supporting the review of our BLA submission for ONS-5010/LYTENAVA with the FDA and to prepare for the potential launch of ONS-5010/LYTENAVA to support the generation of commercial revenues. We anticipate we will incur net losses and negative cash flow from operations for the foreseeable future. We may not be able to initiate commercialization of ONS-5010/LYTENAVA if, among other things, the FDA does not approve our BLA when we expect, or at all, or if we are not able to secure sufficient funding of our expected post-launch commercial costs.
Our primary uses of capital are, and we expect will continue to be, compensation and related expenses, manufacturing and facility costs, external research and development services, laboratory and related supplies, legal and other regulatory expenses, and administrative and overhead costs. Our future funding requirements will be heavily determined by the resources needed to support the marketing and development of our lead product candidate and any other product candidates we may choose to pursue.
We do not believe our existing cash and cash equivalents of $14.9 million as of September 30, 2024, together with $1.7 million in net proceeds from the sale of shares of common stock under the BTIG ATM Offering since September 30, 2024, are sufficient to fund our operations through one year from the Form 10-K filing date. We have based this estimate on assumptions that may prove to be wrong, and we could utilize our available capital resources sooner than we expect. We will need to raise substantial additional capital in order to complete our planned ONS-5010/LYTENAVA development program. We plan to finance our future operations with a combination of proceeds from potential strategic collaborations, sale of the development and commercial rights to our drug product candidates, the issuance of equity securities, the issuance of additional debt, and revenues from potential future product sales, if any. If we raise additional capital through the sale of equity or convertible debt securities, your ownership will be diluted, and the terms of these securities may include liquidation or other preferences that adversely affect your rights as a holder of our common stock. Further, due to current market volatility, we may be unable to raise additional funds or enter into such other arrangements when needed on favorable terms or at all. There are no assurances that we will be successful in obtaining an adequate level of financing for the commercialization of ONS-5010/LYTENAVA or the development of any other current or future product candidates. Alternatively, we will be required to, among other things, modify our clinical trial plans for ONS-5010/LYTENAVA in additional indications, make reductions in our workforce, scale back our plans and place certain activities on hold, discontinue our development programs, liquidate all or a portion of our assets, and/or seek protection under the provisions of the U.S. Bankruptcy Code.
Because of the numerous risks and uncertainties associated with research, development and commercialization of pharmaceutical products, we are unable to estimate the exact amount of our working capital requirements. Our future funding requirements will depend on many factors, including:
| ● | the number and characteristics of the product candidates we pursue; |
| ● | the scope, progress, results and costs of researching and developing our product candidates, and conducting preclinical studies and clinical trials; |
| ● | the timing of, and the costs involved in, obtaining regulatory approvals for our product candidates; |
99
| ● | the cost of manufacturing our product candidates and any drugs we successfully commercialize; |
| ● | our ability to establish and maintain strategic collaborations, licensing or other arrangements and the financial terms of such agreements; |
| ● | the costs involved in preparing, filing, prosecuting, maintaining, defending and enforcing patent claims, including litigation costs and the outcome of such litigation; |
| ● | expenses associated with the pending securities class action lawsuit, as well as other potential litigation; and |
| ● | the timing, receipt and amount of sales of, or milestone payments related to or royalties on, our current or future product candidates, if any. |
See Item 1A “Risk Factors” for additional risks associated with our substantial capital requirements.
Critical Accounting Policies and Significant Judgments and Estimates
Our consolidated financial statements are prepared in accordance with U.S. generally accepted accounting principles, or GAAP. The preparation of our consolidated financial statements and related disclosures requires us to make estimates and judgments that affect the reported amounts of assets and liabilities, disclosure of contingent assets and liabilities at the date of the consolidated financial statements, and the reported amounts of revenues and expenses during the reported period. We base our estimates on historical experience, known trends and events and various other factors that we believe to be reasonable under the circumstances, the results of which form the basis for making judgments about the carrying values of assets and liabilities that are not readily apparent from other sources. We evaluate our estimates and assumptions on an ongoing basis. Our actual results may differ from these estimates under different assumptions and conditions.
While our significant accounting policies are described in more detail in the notes to our audited consolidated financial statements appearing elsewhere in this Annual Report on Form 10-K we believe that the following accounting policies are those most critical to the judgments and estimates used in the preparation of our consolidated financial statements.
Research and Development Expenses
As part of the process of preparing our consolidated financial statements, we are required to estimate our prepaid and accrued research and development expenses. This process involves reviewing open contracts and purchase orders, communicating with our applicable personnel to identify services that have been performed on our behalf and estimating the level of service performed and the associated cost incurred for the service when we have not yet been invoiced or otherwise notified of actual costs. The majority of our service providers require advance payments; however, some invoice us in arrears for services performed, on a pre-determined schedule or when contractual milestones are met. We make estimates of our prepaid expenses and accrued expenses as of each balance sheet date in the consolidated financial statements based on facts and circumstances known to us at that time. We periodically confirm the accuracy of the estimates with the service providers and make adjustments if necessary. Examples of estimated prepaid and accrued research and development expenses include fees paid to:
| ● | vendors in connection with preclinical development activities |
| ● | CMOs for the production of preclinical and clinical trial materials; |
| ● | CROs in connection with clinical trials; and |
| ● | clinical trial sites. |
We base our expenses related to preclinical studies and clinical trials on our estimates of the services received and efforts expended pursuant to quotes and contracts with multiple research institutions and CROs that conduct and manage
100
preclinical studies and clinical trials on our behalf. The financial terms of these agreements are subject to negotiation, vary from contract to contract and may result in uneven payment flows. In many instances payments made to our vendors will exceed the level of services provided and result in a prepayment of the expense. Payments under some of these contracts depend on factors such as the successful enrollment of patients and the completion of clinical trial milestones. In recognizing service fees, we estimate the time period over which services will be performed and the level of effort to be expended in each period. If the actual timing of the performance of services or the level of effort varies from the estimate, we adjust the accrual or prepaid accordingly. Although we do not expect our estimates to be materially different from amounts actually incurred, our understanding of the status and timing of services performed relative to the actual status and timing of services performed may vary and may result in reporting amounts that are too high or too low in any particular period. To date, we have not made any material adjustments to our prior estimates of prepaid and accrued research and development expenses.
Recently Issued Accounting Pronouncements
In November 2023, the FASB issued ASU 2023-07, Segment Reporting (Topic 280): Improvements to Reportable Segment Disclosures. ASU 2023-07, which is applicable to entities with a single reportable segment and will primarily require enhanced disclosures about significant segment expenses and enhanced disclosures in interim periods. The guidance in ASU 2023-07 will be applied retrospectively and is effective for annual reporting periods in fiscal years beginning after December 15, 2023 and interim reporting periods in fiscal years beginning after December 31, 2024, with early adoption permitted. We are currently evaluating the impact that the adoption of ASU 2023-07 will have on its consolidated financial statements and disclosures.
In December 2023, the FASB issued ASU 2023-09, Income Taxes (Topic 740): Improvements to Income Tax Disclosures. ASU 2023-09 which is intended to improve income tax disclosure requirements by requiring (1) consistent categories and greater disaggregation of information in the rate reconciliation and (2) the disaggregation of income taxes paid by jurisdiction. The guidance makes several other changes to the income tax disclosure requirements. The guidance in ASU 2023-09 will be effective for annual reporting periods in fiscal years beginning after December 15, 2024. We are currently evaluating the impact that the adoption of ASU 2023-09 will have on its consolidated financial statements and disclosures.
Item 7A. Quantitative and Qualitative Disclosures about Market Risk
As a “Smaller Reporting Company”, this Item and the related disclosure is not required.
101
Item 8. Consolidated Financial Statements and Supplementary Data
OUTLOOK THERAPEUTICS, INC.
ANNUAL REPORT ON FORM 10-K
INDEX TO AUDITED CONSOLIDATED FINANCIAL STATEMENTS
Page | |
Report of Independent Registered Public Accounting Firm (PCAOB ID | 103 |
105 | |
106 | |
107 | |
108 | |
109 |
102
Report of Independent Registered Public Accounting Firm
To the Stockholders and Board of Directors
Outlook Therapeutics, Inc.:
Opinion on the Consolidated Financial Statements
We have audited the accompanying consolidated balance sheets of Outlook Therapeutics, Inc. and subsidiaries (the Company) as of September 30, 2024 and 2023, the related consolidated statements of operations, stockholders’ equity (deficit), and cash flows for the years then ended, and the related notes (collectively, the consolidated financial statements). In our opinion, the consolidated financial statements present fairly, in all material respects, the financial position of the Company as of September 30, 2024 and 2023, and the results of its operations and its cash flows for the years then ended, in conformity with U.S. generally accepted accounting principles.
Going Concern
The accompanying consolidated financial statements have been prepared assuming that the Company will continue as a going concern. As discussed in Note 2 to the consolidated financial statements, the Company has incurred recurring losses from operations and negative cash flows from operations and has an accumulated deficit, that raise substantial doubt about its ability to continue as a going concern. Management’s plans in regard to these matters are also described in Note 2. The consolidated financial statements do not include any adjustments that might result from the outcome of this uncertainty.
Basis for Opinion
These consolidated financial statements are the responsibility of the Company’s management. Our responsibility is to express an opinion on these consolidated financial statements based on our audits. We are a public accounting firm registered with the Public Company Accounting Oversight Board (United States) (PCAOB) and are required to be independent with respect to the Company in accordance with the U.S. federal securities laws and the applicable rules and regulations of the Securities and Exchange Commission and the PCAOB.
We conducted our audits in accordance with the standards of the PCAOB. Those standards require that we plan and perform the audit to obtain reasonable assurance about whether the consolidated financial statements are free of material misstatement, whether due to error or fraud. The Company is not required to have, nor were we engaged to perform, an audit of its internal control over financial reporting. As part of our audits, we are required to obtain an understanding of internal control over financial reporting but not for the purpose of expressing an opinion on the effectiveness of the Company’s internal control over financial reporting. Accordingly, we express no such opinion.
Our audits included performing procedures to assess the risks of material misstatement of the consolidated financial statements, whether due to error or fraud, and performing procedures that respond to those risks. Such procedures included examining, on a test basis, evidence regarding the amounts and disclosures in the consolidated financial statements. Our audits also included evaluating the accounting principles used and significant estimates made by management, as well as evaluating the overall presentation of the consolidated financial statements. We believe that our audits provide a reasonable basis for our opinion.
Critical Audit Matter
The critical audit matter communicated below is a matter arising from the current period audit of the consolidated financial statements that was communicated or required to be communicated to the audit committee and that: (1) relates to accounts or disclosures that are material to the consolidated financial statements and (2) involved our especially challenging, subjective, or complex judgments. The communication of a critical audit matter does not alter in any way our opinion on the consolidated financial statements, taken as a whole, and we are not, by communicating the critical audit matter below, providing a separate opinion on the critical audit matter or on the accounts or disclosures to which it relates.
103
Evaluation of prepaid and accrued research and development expenses
As discussed in Note 3 to the consolidated financial statements, research and development costs are expensed as incurred and consist primarily of funds paid to third parties for the provision of services for product candidate development, clinical and preclinical development and related supply and manufacturing costs, as well as regulatory compliance costs. At the end of each reporting period, the Company compares the payments made to third-party service providers to the estimated progress towards completion of the research or development objectives. Such estimates are subject to change as additional information becomes available. Depending on the timing of payments to the service providers and the progress that the Company estimates has been made as a result of the service provided, the Company may record net prepaid or accrued expense related to these costs.
We identified the evaluation of prepaid and accrued research and development expenses for contract manufacturing organizations (CMOs) used by the Company for supply and manufacturing of pre-clinical and clinical trial materials and commercial materials, including manufacturing validation batches, as a critical audit matter. Specifically, evaluating the sufficiency of audit evidence obtained over associated costs incurred for the services provided by the CMOs required especially subjective auditor judgment due to the nature of evidence available regarding progress towards completion of underlying phases within the statements of work.
The following are the primary procedures we performed to address this critical audit matter. We examined a sample of (1) statements of work, (2) payments, and (3) communications received from the CMOs related to the status of underlying phases within the statements of work, and compared them to the Company's schedules of costs incurred as of year-end. We also confirmed the status of underlying phases within the statements of work directly with the CMOs. We assessed the sufficiency of audit evidence obtained related to prepaid and accrued research and development expenses related to statements of work with the CMOs by evaluating the cumulative results of the audit procedures.
/s/
We have served as the Company’s auditor since 2015.
December 27, 2024
104
Outlook Therapeutics, Inc.
Consolidated Balance Sheets
September 30, | ||||||
2024 |
| 2023 | ||||
Assets | ||||||
Current assets: | ||||||
Cash and cash equivalents | $ | | $ | | ||
Prepaid expenses and other current assets | | | ||||
Total current assets | | | ||||
Operating lease right-of-use assets, net | | | ||||
Equity method investment | | | ||||
Other assets | | | ||||
Total assets | $ | | $ | | ||
Liabilities and stockholders’ deficit | ||||||
Current liabilities: | ||||||
Unsecured convertible promissory note | $ | | $ | | ||
Finance lease liabilities | — | | ||||
Current portion of operating lease liabilities | | — | ||||
Accounts payable | | | ||||
Accrued expenses | | | ||||
Income taxes payable | | | ||||
Total current liabilities | | | ||||
Operating lease liabilities | | — | ||||
Warrant liability | | | ||||
Total liabilities | | | ||||
Commitments and contingencies (Note 8) | ||||||
Stockholders’ deficit: | ||||||
Preferred stock, par value $ | ||||||
Common stock, par value $ | | | ||||
Additional paid-in capital | | | ||||
Accumulated deficit | ( | ( | ||||
Total stockholders' deficit | ( | ( | ||||
Total liabilities and stockholders' deficit | $ | | $ | | ||
See accompanying notes to consolidated financial statements
105
Outlook Therapeutics, Inc.
Consolidated Statements of Operations
Year ended September 30, | ||||||
| 2024 |
| 2023 | |||
Operating expenses: | ||||||
Research and development | $ | | $ | | ||
General and administrative | | | ||||
Loss from operations | ( | ( | ||||
Loss on equity method investment | | | ||||
Interest income | ( | ( | ||||
Interest expense | | | ||||
Loss on extinguishment of debt | — | | ||||
Change in fair value of promissory notes | | | ||||
Warrant related expenses (Note 9) | | — | ||||
Change in fair value of warrant liability | ( | ( | ||||
Loss before income taxes | ( | ( | ||||
Income tax expense | | | ||||
Net loss | $ | ( | $ | ( | ||
Per share information: | ||||||
Net loss per share of common stock, basic and diluted | $ | ( | $ | ( | ||
Weighted average shares outstanding, basic and diluted | | | ||||
See accompanying notes to consolidated financial statements
106
Outlook Therapeutics, Inc.
Consolidated Statements of Stockholders’ Equity (Deficit)
Stockholders’ Equity (Deficit) | ||||||||||||||
Common Stock | Additional | Accumulated | Total Stockholders’ | |||||||||||
| Shares |
| Amount |
| Paid-in Capital |
| Deficit |
| Equity (Deficit) | |||||
Balance at October 1, 2022 |
| | | | ( | | ||||||||
Issuance of common stock in connection with conversion of convertible promissory note |
| | | | — | | ||||||||
Sale of common stock, net of issuance costs (Note 9) |
| | | | — | | ||||||||
Stock-based compensation expense |
| — | — | | — | | ||||||||
Net loss |
| — | — | — | ( | ( | ||||||||
Balance at September 30, 2023 |
| | | | ( | ( | ||||||||
Issuance of common stock in connection with conversion of convertible promissory note |
| | | | — | | ||||||||
Sale of common stock, net of issuance costs (Note 9) |
| | | — | — | | ||||||||
Stock-based compensation expense |
| — | — | | — | | ||||||||
Net loss |
| — | — | — | ( | ( | ||||||||
Balance at September 30, 2024 |
| |
| $ | |
| $ | |
| $ | ( |
| $ | ( |
See accompanying notes to consolidated financial statements.
107
Outlook Therapeutics, Inc.
Consolidated Statements of Cash Flows
Year ended September 30, | ||||||
| 2024 |
| 2023 | |||
OPERATING ACTIVITIES | ||||||
Net loss | $ | ( | $ | ( | ||
Adjustments to reconcile net loss to net cash used in operating activities: | ||||||
Depreciation and amortization | | | ||||
Loss on extinguishment of debt | — | | ||||
Non-cash interest expense | | | ||||
Stock-based compensation | | | ||||
Change in fair value of promissory notes | | | ||||
Warrant related expenses (Note 9) | | — | ||||
Change in fair value of warrant liability | ( | ( | ||||
Loss on equity method investment | | | ||||
Interest paid on debt | — | ( | ||||
Changes in operating assets and liabilities: | ||||||
Prepaid expenses and other current assets | ( | | ||||
Other assets | ( | ( | ||||
Operating lease liabilities | | ( | ||||
Accounts payable | | | ||||
Accrued expenses | | ( | ||||
Net cash used in operating activities | ( | ( | ||||
FINANCING ACTIVITIES | ||||||
Proceeds from the sale of common stock and warrants to purchase common stock, net of issuance costs | | | ||||
Proceeds from debt | — | | ||||
Payments of finance lease obligations | ( | ( | ||||
Repayment of debt | — | ( | ||||
Payment of financing costs | — | ( | ||||
Net cash provided by financing activities | | | ||||
Net (decrease) increase in cash and cash equivalents | ( | | ||||
Cash and cash equivalents at beginning of year | | | ||||
Cash and cash equivalents at end of year | $ | | $ | | ||
Supplemental disclosure of cash flow information: | ||||||
Cash paid for interest | $ | | $ | | ||
Supplemental schedule of non-cash financing activities: | ||||||
Convertible promissory note converted into common stock | $ | | $ | | ||
Recognition of warrant liability | $ | | $ | — | ||
Deferred offering costs amortization | $ | — | $ | | ||
Right-of-use asset and lease liability recognized for new operating lease liabilities | $ | | $ | — | ||
See accompanying notes to consolidated financial statements.
108
1. Organization and Operations
Description of the Business
Outlook Therapeutics, Inc. (“Outlook” or the “Company”) was incorporated in New Jersey on January 5, 2010, started operations in July 2011, reincorporated in Delaware by merging with and into a Delaware corporation in October 2015 and changed its name to “Outlook Therapeutics, Inc.” in November 2018. The Company is a biopharmaceutical company focused on developing and commercializing ONS-5010/LYTENAVA™ (bevacizumab-gamma), an ophthalmic formulation of bevacizumab for use in retinal indications. The Company is based in Iselin, New Jersey.
In May 2024, the Company received Marketing Authorization from the European Commission for ONS-5010/LYTENAVA, an ophthalmic formulation of bevacizumab for the treatment of wet age-related macular degeneration (“AMD”) in the European Union (“EU”). Additionally, in July 2024 the Company also received marketing authorization for ONS-5010/LYTENAVA in the United Kingdom (“UK”) from the UK Medicines and Healthcare products Regulatory Agency (MHRA). ONS-5010/LYTENAVA is the first and only authorized ophthalmic formulation of bevacizumab for use in treating wet AMD in the EU and UK.
In the fourth quarter of calendar 2023, the Company agreed to conduct an additional adequate and well-controlled clinical trial following discussions with the U.S. Food and Drug Administration (“FDA”) in support of the Company’s Biologics License Application (“BLA”) for ONS-5010/LYTENAVA. In December 2023, the Company submitted a Special Protocol Assessment (“SPA”) to the FDA for this study (NORSE EIGHT) seeking confirmation that, if successful, it will address the FDA’s requirement for a second adequate and well-controlled clinical trial to support its planned resubmission of the ONS-5010/LYTENAVA BLA. In January 2024, the Company received confirmation that the FDA had reviewed and agreed upon the NORSE EIGHT trial protocol pursuant to the SPA and that, if the NORSE EIGHT trial is successful, it would satisfy the FDA’s requirement for a second adequate and well-controlled clinical trial to address fully the clinical deficiency identified in the Complete Response Letter (“CRL”). In addition, through a Type A meeting and additional interactions, the Company has identified the approaches needed to resolve the chemistry, manufacturing and controls (“CMC”) comments in the CRL. In November 2024, the Company reported that ONS-5010/LYTENAVA did not meet the pre-specified non-inferiority endpoint at week 8 set forth in the SPA. However, the preliminary data from the trial demonstrated an improvement in vision and the presence of biologic activity, as well as a continued favorable safety profile for ONS-5010. Analysis of the data is ongoing as the month 3 data from NORSE EIGHT is being collected, which is expected to be available in January 2025.
2. Liquidity
The Company has incurred recurring losses and negative cash flows from operations since its inception and has an accumulated deficit of $
In November 2024 and December 2024, the Company sold
Management does not believe that the Company’s existing cash and cash equivalents as of September 30, 2024, together with $
109
needed by the Company to fund its operations in the future and to commercially develop ONS-5010/LYTENAVA and to develop any other product candidates. Management is currently evaluating different strategies to obtain the required funding for future operations, including but not limited to, the exercise of outstanding warrants to purchase shares of the Company’s common stock (subject to meeting the requirements for calling such warrants), proceeds from potential licensing and/or marketing arrangements or collaborations with pharmaceutical or other companies, sale of the development and commercial rights to the Company’s drug product candidates in regions outside of the U.S., the issuance of additional debt, the issuance of equity securities, including accessing capital through at-the-market offering agreements (refer to Note 9 for further details), and revenues from potential future product sales, if any. There can be no assurance that these future funding efforts will be successful. The Company’s consolidated financial statements do not include any adjustments that might be necessary if it is unable to continue as a going concern.
The Company’s future operations are highly dependent on a combination of factors, including (i) the timely and successful completion of additional financing discussed above; (ii) the Company’s ability to successfully begin marketing of its product candidates or complete revenue-generating partnerships with other companies; (iii) the success of its research and development; (iv) the development of competitive therapies by other biotechnology and pharmaceutical companies; and, ultimately, (v) regulatory approval and market acceptance of the Company’s proposed future products.
3. Basis of Presentation and Summary of Significant Accounting Policies
Basis of presentation
The accompanying consolidated financial statements have been prepared in conformity with U.S. generally accepted accounting principles (“GAAP”). Any reference in these notes to applicable guidance is meant to refer to GAAP as found in the Accounting Standards Codification (“ASC”) and Accounting Standards Updates (“ASU”) of the Financial Accounting Standards Board (“FASB”). The accompanying consolidated financial statements include the accounts of the Company and Outlook Therapeutics Pty Ltd, its wholly-owned subsidiary incorporated in Australia (the “Subsidiary”). All intercompany accounts and transactions have been eliminated in consolidation. The Company has determined the functional currency of the Subsidiary to be the U.S. dollar. The Company translates assets and liabilities of its foreign operations at exchange rates in effect at the balance sheet date. The Company records remeasurement gains and losses on monetary assets and liabilities, such as incentive and tax receivables and accounts payables, which are not in the functional currency of the operation. These remeasurement gains and losses are recorded in the consolidated statements of operations as they occur.
Reverse stock split
Effective on March 14, 2024, the Company amended its amended and restated certificate of incorporation to implement a reverse stock split of its common stock. As a result of the reverse stock split, the Company made corresponding adjustments to the share amounts under its employee incentive plans, outstanding options, and common stock warrant agreements with third parties. The disclosure of common shares and per common share data in the accompanying consolidated financial statements and related notes reflect the reverse stock split for all periods presented.
Cash and cash equivalents
Cash and cash equivalents include cash-on-hand and demand deposits with financial institutions and other short-term investments with maturities of less than three months when acquired and convertible to known cash amounts. At September 30, 2024 and 2023, the Company’s cash equivalents consist of a money market account.
Equity method investment
The Company accounts for equity investments where it owns a non-controlling interest, but has the ability to exercise significant influence, under the equity method of accounting. Under the equity method of accounting, the original cost of the investment is adjusted for the Company’s share of equity in the earnings or loss of the equity investee and reduced by dividends and distributions of capital received, unless the fair value option is elected, in which case the investment balance
110
is marked to fair value each reporting period and the impact of changes in fair value of the equity investment are reported in earnings. The Company has not elected the fair value option. The Company assesses its investment for other-than-temporary impairment when events or changes in circumstances indicate that the carrying amount of the investment might not be recoverable and recognize an impairment loss to adjust the investment to its then-current fair value.
Use of estimates
The preparation of the consolidated financial statements in conformity with GAAP requires management to make estimates and assumptions that affect the reported amounts of assets and liabilities and disclosure of contingent assets and liabilities at the date of the financial statements and reported amounts of revenues and expenses during the reporting period. Actual results could differ from those estimates. Due to the uncertainty of factors surrounding the estimates or judgments used in the preparation of the consolidated financial statements, actual results may materially vary from these estimates. Estimates and assumptions are periodically reviewed and the effects of revisions are reflected in the consolidated financial statements in the period they are determined to be necessary.
Fair value of financial instruments
Certain assets and liabilities are carried at fair value under GAAP. Fair value is defined as the exchange price that would be received for an asset or paid to transfer a liability (an exit price) in the principal or most advantageous market for the asset or liability in an orderly transaction between market participants on the measurement date. Valuation techniques used to measure fair value must maximize the use of observable inputs and minimize the use of unobservable inputs. Financial assets and liabilities carried at fair value are to be classified and disclosed in one of the following three levels of the fair value hierarchy, of which the first two are considered observable and the last is considered unobservable:
| ● | Level 1 — Quoted prices in active markets for identical assets or liabilities. |
| ● | Level 2 — Observable inputs (other than Level 1 quoted prices), such as quoted prices in active markets for similar assets or liabilities, quoted prices in markets that are not active for identical or similar assets or liabilities, or other inputs that are observable or can be corroborated by observable market data. |
| ● | Level 3 — Unobservable inputs that are supported by little or no market activity and that are significant to determining the fair value of the assets or liabilities, including pricing models, discounted cash flow methodologies and similar techniques. |
The asset’s or liability’s fair value measurement level within the fair value hierarchy is based on the lowest level of any input that is significant to the fair value measurement. Valuation techniques used need to maximize the use of observable inputs and minimize the use of unobservable inputs.
At September 30, 2024 and 2023, the Company’s financial instruments included cash and cash equivalents, accounts payable, accrued expenses, unsecured convertible promissory note and warrant liabilities. The carrying amount of accounts payable, and accrued expenses approximates fair value due to the short-term maturities of these instruments.
Fair Value Option
The Company elected the fair value option to account for the December 2022 Note. Refer to Note 7 for further details on the December 2022 Note.
Leases
At lease commencement, the Company records a lease liability based on the present value of lease payments over the expected lease term including any options to extend the lease that the Company is reasonably certain to exercise. The Company calculates the present value of lease payments using an incremental borrowing rate as the Company’s leases do not provide an implicit interest rate. The Company’s incremental borrowing rate for a lease is the rate of interest it would have to pay on a collateralized basis to borrow an amount equal to the lease payments under similar terms. At the lease
111
commencement date, the Company records a corresponding right-of-use lease asset based on the lease liability, adjusted for any lease incentives received and any initial direct costs paid to the lessor prior to the lease commencement date. The Company may enter into leases with an initial term of 12 months or less (“Short-Term Leases”). For Short-Term Leases, the Company records the rent expense on a straight-line basis and does not record the leases on the consolidated balance sheet. The Company had no Short-Term Leases as of September 30, 2024.
After lease commencement, the Company measures its leases as follows: (i) the lease liability based on the present value of the remaining lease payments using the discount rate determined at lease commencement and (ii) the right-of-use lease asset based on the re-measured lease liability, adjusted for any unamortized lease incentives received, any unamortized initial direct costs and the cumulative difference between rent expense and amounts paid under the lease agreement. Any lease incentives received, and any initial direct costs incurred are amortized on a straight-line basis over the expected lease term. Rent expense is recorded on a straight-line basis over the expected lease term.
Stock-based compensation
The Company measures equity classified stock-based awards based on the estimated fair value on the date of grant and recognizes compensation expense of those awards on a straight-line basis over the requisite service period, which is generally the vesting period of the respective award. The Company accounts for forfeitures of stock option awards as they occur.
The fair value of each stock option grant is estimated on the date of grant using the Black-Scholes option pricing model, which is described more fully in Note 11. The fair value of each restricted stock award is measured as the fair value per share of the Company’s common stock on the date of grant.
Research and development
Research and development costs are expensed as incurred and consist primarily of funds paid to third parties for the provision of services for product candidate development, clinical and preclinical development and related supply and manufacturing costs, and regulatory compliance costs. At the end of the reporting period, the Company compares payments made to third-party service providers to the estimated progress toward completion of the research or development objectives. Such estimates are subject to change as additional information becomes available. Depending on the timing of payments to the service providers and the progress that the Company estimates has been made as a result of the service provided, the Company may record net prepaid or accrued expense relating to these costs.
Upfront milestone payments made to third parties who perform research and development services on the Company’s behalf are expensed as services are rendered. Costs incurred in obtaining technology licenses are charged to research and development expense as acquired in-process research and development if the technology licensed has not reached technological feasibility and has no alternative future use.
Income taxes
The Company accounts for income taxes using the asset and liability method. Under the asset and liability method, deferred tax assets and liabilities are recognized for the future tax consequences attributable to differences between the financial statement carrying amounts of existing assets and liabilities and their respective tax bases. Deferred tax assets and liabilities are measured using enacted tax rates expected to apply to taxable income in the years in which those temporary differences are expected to be recovered or settled. The effect on deferred tax assets and liabilities of a change in tax rates is recognized in income in the period that includes the enactment date. A valuation allowance is recorded to the extent it is more likely than not that some portion or all of the deferred tax assets will not be realized.
Net loss per share
Basic net loss per common share is determined by dividing net loss attributable to common stockholders by the weighted-average number of shares of common stock outstanding during the period. For purposes of calculating diluted net loss per common share, the denominator includes both the weighted average common shares outstanding and the number of
112
common stock equivalents if the inclusion of such common stock equivalents would be dilutive. Dilutive common stock equivalents potentially include convertible debt, warrants, performance-based stock options and units, and stock options the treasury stock method. For all periods presented, there is no difference in the number of shares used to compute basic and diluted shares due to the Company’s losses.
The following potentially dilutive securities have been excluded from the computation of diluted weighted-average shares outstanding as of September 30, 2024 and 2023, as they would be antidilutive:
As of September 30, | |||||
| 2024 |
| 2023 | ||
Performance-based stock units | — | | |||
Performance-based stock options | | | |||
Stock options | | | |||
Common stock warrants | | | |||
Convertible debt | | (i) | | (ii) | |
| (i) | The calculation for potentially dilutive securities pertaining to convertible debt is as follows: $ |
| (ii) | The potentially dilutive securities related to convertible debt are calculated based on a fixed conversion price of $ |
Recently issued accounting pronouncements
In November 2023, the FASB issued ASU 2023-07, Segment Reporting (Topic 280): Improvements to Reportable Segment Disclosures. ASU 2023-07, which is applicable to entities with a single reportable segment and will primarily require enhanced disclosures about significant segment expenses and enhanced disclosures in interim periods. The guidance in ASU 2023-07 will be applied retrospectively and is effective for annual reporting periods in fiscal years beginning after December 15, 2023 and interim reporting periods in fiscal years beginning after December 31, 2024, with early adoption permitted. The Company is currently evaluating the impact that the adoption of ASU 2023-07 will have on its consolidated financial statements and disclosures.
In December 2023, the FASB issued ASU 2023-09, Income Taxes (Topic 740): Improvements to Income Tax Disclosures. ASU 2023-09 which is intended to improve income tax disclosure requirements by requiring (1) consistent categories and greater disaggregation of information in the rate reconciliation and (2) the disaggregation of income taxes paid by jurisdiction. The guidance makes several other changes to the income tax disclosure requirements. The guidance in ASU 2023-09 will be effective for annual reporting periods in fiscal years beginning after December 15, 2024. The Company is currently evaluating the impact that the adoption of ASU 2023-09 will have on its consolidated financial statements and disclosures.
113
4. Fair Value Measurements
The following table presents the Company’s liabilities that are measured at fair value on a recurring basis:
September 30, 2024 | |||||||||
| (Level 1) |
| (Level 2) |
| (Level 3) | ||||
Liabilities | |||||||||
Unsecured convertible promissory note | $ | — | $ | — | $ | | |||
— | — | | |||||||
Total | $ | — | $ | — | $ | | |||
September 30, 2023 | |||||||||
(Level 1) |
| (Level 2) |
| (Level 3) | |||||
Liabilities | |||||||||
Unsecured convertible promissory note | $ | — | $ | — | $ | | |||
— | — | | |||||||
Total | $ | — | $ | — | $ | | |||
The table presented below is a summary of changes in the fair value of the Company’s Level 3 valuation for the warrant liability and the December 2022 Note for the years ended September 30, 2024 and 2023:
Unsecured Convertible | ||||||
| Promissory Note |
| Warrants | |||
Balance at October 1, 2022 | $ | — | $ | | ||
Fair value at issuance | | — | ||||
Accrued interest converted to common stock | ( | — | ||||
Change in fair value | | ( | ||||
Balance at September 30, 2023 | | | ||||
Issued in connection with sale of common stock | — | | ||||
Promissory note maturity extension fee added to outstanding balance | | — | ||||
Principal and accrued interest converted to common stock | ( | — | ||||
| ( | |||||
Balance at September 30, 2024 | $ | | $ | | ||
As further described in Note 7, the Company elected the fair value option to account for the December 2022 Note. The fair value of the December 2022 Note is estimated using a binomial lattice model, which evaluates the payouts under hold, convert or call decisions. Significant estimates in the binomial lattice model include the Company’s stock price, volatility, risk-free rate of return, and credit-adjusted discount rate.
The fair values of the December 2022 Note as of September 30, 2024 and 2023 were estimated using a binomial lattice model with the following assumptions:
September 30, | ||||||||
2024 | 2023 | |||||||
Term (years) | | | ||||||
Volatility | | % | | % | ||||
Risk-free rate | | % | | % | ||||
Dividend yield | | % | | % | ||||
Credit-adjusted discount rate | | % | | % | ||||
Stock price | $ | | $ | | ||||
114
The warrants related to the Note and Warrant Purchase Agreement dated December 22, 2017 are classified as liabilities as the warrants include cash settlement features at the option of the holders under certain circumstances. The warrants issued in connection with private placements that closed on March 18, 2024 and April 15, 2024 are classified as liabilities as the Company assessed that they are not indexed to the Company’s own stock and must be classified as liabilities. For further details on the evaluation refer to Note 9.
The above warrant liabilities are revalued each reporting period with the change in fair values recorded in the accompanying consolidated statements of operations until the warrants are exercised or expire. The fair values of the warrant liabilities are estimated using the Black-Scholes option pricing model using the following weighted average assumptions:
September 30, | ||||||||
2024 | 2023 | |||||||
Risk-free interest rate | | % | | % | ||||
Remaining contractual term of warrants (years) | | | ||||||
Expected volatility | | % | | % | ||||
Annual dividend yield | | % | | % | ||||
Fair value of common stock (per share) | $ | | $ | | ||||
5. Equity Method Investment
In connection with the execution of a stock purchase agreement with Syntone Ventures LLC (“Syntone Ventures”), the U.S. based affiliate of Syntone Technologies Group Co. Ltd. (“Syntone PRC”) on May 22, 2020, the Company and Syntone PRC entered into a joint venture agreement pursuant to which they agreed to form a People’s Republic of China (“PRC”) joint venture, Beijing Syntone Biopharma Ltd (“Syntone JV”), that is
The Company made the initial investment of $
6. Accrued Expenses
Accrued expenses consists of:
| September 30, | |||||
2024 |
| 2023 | ||||
Compensation | $ | | $ | | ||
Professional fees | | | ||||
Research and development | | | ||||
Other accrued expenses | | | ||||
$ | | $ | | |||
115
7. Debt
Debt consists of:
| September 30, | |||||
2024 |
| 2023 | ||||
Unsecured convertible promissory note (measured at fair value) | $ | | $ | | ||
Less: current portion | ( | ( | ||||
Long-term debt | $ | — | $ | — | ||
December 2022 Note
On December 22, 2022, the Company entered into a Securities Purchase Agreement and issued the December 2022 Note with a face amount of $
In December 2023, the Company extended the maturity of the December 2022 Note from January 1, 2024 to April 1, 2024. The Company incurred a $
The December 2022 Note contains customary covenants, including a restriction on the Company’s ability to pledge certain of the Company’s assets, subject to certain exceptions, without the Lender’s consent. Beginning on April 1, 2023, the Lender had the right to convert the December 2022 Note at the Conversion Price (as defined below). The principal amount and conversion price of the December 2022 Note were subject to adjustment upon certain triggering events. In addition, the Company had the right to convert all or any portion of the outstanding balance under the December 2022 Note into shares of common stock at the Conversion Price if certain conditions have been met at the time of conversion, including if at any time after the six-month anniversary of the closing date, the daily volume-weighted average price of the common stock on Nasdaq equals or exceeds $
116
On January 22, 2024, the Company entered into an amendment to the December 2022 Note (the “January 2024 Note Amendment”) with the Lender, which became effective on April 1, 2024 after satisfaction of certain conditions, including various required stockholder approvals and the closing of the private placement on March 18, 2024. The maturity of the December 2022 Note was extended to July 1, 2025. An extension fee of $
Under the January 2024 Note Amendment, the initial conversion price with respect to $
During the year ended September 30, 2024, an aggregate of principal and accrued interest totaling $
The Company elected to account for the December 2022 Note at fair value (Note 4) and was not required to bifurcate the conversion option as a derivative and as a result the original issue discount of $
November 2021 Note
On November 16, 2021, the Company received $
As discussed above, the November 2021 Note was cancelled using proceeds from the December 2022 Note issued to the same lender. The total repayment was $
During the year ended September 30, 2023, the Company recognized $
8. Commitments and Contingencies
Selexis Commercial License Agreements
In April 2013, the Company entered into commercial license agreements with Selexis for each of the ONS-3010, ONS-1045 and ONS-1050 biosimilar product candidates (which agreements were subsequently amended on May 21, 2014). Under the terms of each commercial license agreement, the Company acquired a non-exclusive worldwide license under the Selexis Technology to use the applicable Selexis expression technology along with the resulting Selexis
117
materials/cell lines, each developed under the research license, to manufacture and commercialize licensed and final products, with a limited right to sublicense.
The Company paid an upfront licensing fee to Selexis for each commercial license and also agreed to pay a fixed milestone payment for each licensed product. In addition, the Company is required to pay a low single-digit royalty on a final product-by-final product and country-by-country basis, based on worldwide net sales of such final products by the Company or any of the Company’s affiliates or sublicensees during the royalty term. The royalty term for each final product in each country is the period commencing from the first commercial sale of the applicable final product in the applicable country and ending on the expiration of the specified patent coverage. At any time during the term, the Company has the right to terminate its royalty payment obligation by providing written notice to Selexis and paying Selexis a royalty termination fee.
Each of the Company’s commercial agreements with Selexis will expire upon the expiration of all applicable Selexis patent rights. Either party may terminate the related agreement in the event of an uncured material breach by the other party or in the event the other party becomes subject to specified bankruptcy, winding up or similar circumstances. Either party may also terminate the related agreement under designated circumstances if the Selexis Technology infringes third-party intellectual property rights. In addition, the Company has the right to terminate each of the commercial agreements at any time at its convenience; however, with respect to the agreements relating to ONS-3010 and ONS-1045, this right is subject to the licensee’s consent pursuant to a corresponding letter the Company executed in conjunction with the standby agreement entered into between Selexis and Laboratories Liomont, S.A. de C.V. (“Liomont”) in November 2014.
The standby agreement permits Liomont to assume the license under the applicable commercial agreement for Mexico upon specified triggering events involving the Company’s bankruptcy, insolvency or similar circumstances.
Technology License
The Company entered into a technology license agreement with Selexis that will require milestone payments of $
Litigation
On November 3, 2023, a securities class action lawsuit was filed against the Company and certain of its officers in the United States District Court for the District of New Jersey. The class action complaint alleges violations of the Securities Exchange Act of 1934, as amended, or the Exchange Act, in connection with allegedly false and misleading statements made by the Company related to the Company’s BLA during the period from August 3, 2021 through August 29, 2023. The complaint alleges, among other things, that the Company violated Sections 10(b) and 20(a) of the Exchange Act and SEC Rule 10b-5 by failing to disclose that there was an alleged lack of evidence supporting ONS-5010/LYTENAVA as a treatment for wet AMD and that the Company and/or their manufacturing partner had deficient CMC controls for ONS-5010/LYTENAVA, which remained unresolved at the time the Company’s BLA was re-submitted to the FDA and, as a result, the FDA was unlikely to approve the Company’s BLA, and that the Company’s stock price dropped when such information was disclosed. The plaintiffs in the class action complaint seek damages and interest, and an award of reasonable costs, including attorneys’ fees. Defendants’ motion to dismiss is currently pending before the court.
On October 10, 2024, certain of the company’s officers and directors were named as defendants in a shareholder derivative action filed in the District Court of the District of Delaware. The derivative complaint alleges that defendants breached their fiduciary duties by causing and/or allowing the Company to violate federal securities laws based on the same alleged misstatements as the securities class action. The derivative complaint also alleges defendants violated Section 14(a) of the Exchange Act, as well as claims for contribution, unjust enrichment, and waste of corporate assets. The derivative complaint seeks unspecified damages, corporate governance reforms, restitution, contribution, attorneys’ fees, and other costs.
118
The pending lawsuits and any other related lawsuits are subject to inherent uncertainties, and the actual defense and disposition costs will depend upon many unknown factors. The outcome of the pending lawsuits and any other related lawsuits is necessarily uncertain. The Company could be forced to expend significant resources in the defense of the pending lawsuits and any additional lawsuits, and the Company may not prevail. In addition, the Company may incur substantial legal fees and costs in connection with such lawsuits. The Company currently is not able to estimate the possible cost to it from these matters, as the pending lawsuits are currently at an early stage, and the Company cannot be certain how long it may take to resolve the pending lawsuits or the possible amount of any damages that the Company may be required to pay. Such amounts could be material to the Company’s financial statements if it does not prevail in the defense of the pending lawsuits and any other related lawsuits, or even if it does prevail. The Company has not established any reserve for any potential liability relating to the pending lawsuits and any other related lawsuits. It is possible that the Company could, in the future, incur judgments or enter into settlements of claims for monetary damages.
Leases
Corporate office
In March 2021, the Company entered into a
In March 2024, the Company entered into a
Equipment leases
As of September 30, 2024, all equipment leases had expired. The Company had equipment leases with terms between
The components of lease cost for the years ended September 30, 2024 and 2023 were as follows:
Year ended September 30, | ||||||
| 2024 |
| 2023 | |||
Lease cost: |
|
|
|
| ||
Interest on lease liabilities | $ | | $ | | ||
Total finance lease cost |
| |
| | ||
Operating lease cost |
| |
| | ||
Total lease cost | $ | | $ | | ||
119
Amounts reported in the consolidated balance sheets for leases where the Company is the lessee were as follows:
| September 30, | |||||
2024 |
| 2023 | ||||
Operating leases: |
|
|
| |||
Right-of-use asset | $ | | $ | | ||
Operating lease liabilities |
| |
| — | ||
Finance leases: |
|
|
|
| ||
Right-of-use asset | $ | — | $ | — | ||
Financing lease liabilities |
| — |
| | ||
Weighted-average remaining lease term (years): |
|
|
|
| ||
Operating leases | ||||||
Finance leases |
| — |
| |||
Weighted-average discount rate: |
|
|
|
| ||
Operating leases | ||||||
Finance leases |
| — |
| |||
Other information related to leases for the years ended September 30, 2024 and 2023 are as follows:
Year ended September 30, | ||||||
| 2024 |
| 2023 | |||
Cash paid for amounts included in the measurement of lease obligations: |
|
|
| |||
Operating cash flows from finance leases | $ | | $ | | ||
Operating cash flows from operating leases |
| |
| | ||
Financing cash flows from finance leases |
| |
| | ||
Right-of-use assets obtained in exchange for lease obligations: |
|
|
|
| ||
Operating leases | $ | | $ | — | ||
Future minimum payments under noncancelable leases at September 30, 2024 are as follows for the years ending September 30:
Operating leases | ||||||
2025 | $ | | ||||
2026 | | |||||
2027 | | |||||
2028 | | |||||
2029 | | |||||
Total undiscounted lease payments | | |||||
Less: Imputed interest |
| | ||||
Total lease obligations | $ | | ||||
Employee Benefit Plan
The Company maintains a defined contribution 401(k) plan (the “Plan”) in which employees may contribute up to
120
9. Stockholders’ Equity
Common stock
On March 7, 2024, following receipt of stockholder approval at the Company’s 2024 annual meeting of stockholders, the number of authorized shares of common stock under the Company’s Certificate of Incorporation was increased from
On March 18, 2024, in a private placement (the “Private Placement”) pursuant to a securities purchase agreement entered in January 2024 with certain institutional and accredited investors, including GMS Ventures and Investments (“GMS Ventures”), the Company’s largest stockholder, the Company issued an aggregate of
On April 15, 2024, in a private placement with Syntone pursuant to a securities purchase agreement entered into in January 2024 (the “Syntone Private Placement”), the Company issued
The Company evaluated the equity classification for the common stock warrants and considered the conditions as prescribed within ASC 815-40, Derivatives and Hedging, Contracts in an Entity’s own Equity (“ASC 815-40”). The Company determined that the warrants did not meet the “fixed for fixed” settlement provision set forth in Step 2 of the indexation guidance and as a result they are not indexed to the Company’s own stock and must be classified as liabilities. The warrants were measured at fair value at issuance and recorded as a liability and will be remeasured to fair value at each subsequent reporting date, with changes in fair value recorded in current earnings. The net proceeds from the Private Placement were allocated first to the warrants at fair value, with the residual amount recorded as common stock at par value. The Company will continue to classify such warrants as liabilities until they are exercised, expire, or are no longer required to be classified as liabilities.
In December 2022, in a registered direct equity offering to certain institutional and accredited investors, including GMS Ventures, the Company issued
Each share of common stock entitles the holder to
H.C. Wainwright & Co. At-the-Market Offering Agreement
On March 26, 2021, the Company entered into an At-the-Market Offering Agreement with H.C. Wainwright & Co., as sales agent (“Wainwright”), (the “Wainwright ATM Agreement” or the “Wainwright ATM Offering”), under which the Company may issue and sell shares of its common stock from time to time through Wainwright as sales agent. The Company filed a prospectus supplement, dated March 26, 2021, with the Securities and Exchange Commission pursuant to which the Company may offer and sell shares of common stock having an aggregate offering price of up to up to $
121
capitalized and were being reclassified to additional paid in capital on a pro rata basis when the Company sold common stock under the Wainwright ATM Offering.
Under the Wainwright ATM Offering, the Company paid Wainwright a commission equal to
BTIG, LLC At-the-Market Offering Agreement
On May 16, 2023, the Company entered into an At-the-Market Sales Agreement with BTIG, LLC (“BTIG”), as sales agent (the “BTIG ATM Agreement” or the “BTIG ATM Offering”), under which the Company may issue and sell shares of its common stock having an aggregate offering price of up to $
Under the BTIG ATM Agreement, the Company pays BTIG a commission equal to
During the year ended September 30, 2024,
Common stock warrants
As of September 30, 2024, the Company had the following warrants outstanding to acquire shares of its common stock:
Shares of | |||||
common stock | |||||
issuable upon | |||||
exercise of | Exercise Price | ||||
Expiration Date |
| warrants |
| Per Share | |
December 22, 2024 | (i) | | $ | | |
February 24, 2025 | | $ | | ||
April 13, 2025 | (i) | | $ | | |
May 31, 2025 | (i) | | $ | | |
June 22, 2025 | | $ | | ||
December 28, 2025 | | $ | | ||
January 28, 2026 | | $ | | ||
February 2, 2026 | | $ | | ||
November 23, 2026 | | $ | | ||
March 18, 2029 | (ii) | | $ | | |
April 15, 2029 | (ii) | | $ | | |
| |||||
| (i) | The warrants were issued in connection with the convertible senior secured notes originally issued pursuant to the certain Note and Warrant Purchase Agreement dated December 22, 2017 and are classified as liabilities on the accompanying consolidated balance sheets, as the warrants include cash settlement features at the option of the holders under certain circumstances. Refer to Note 4 for fair value measurements disclosures. |
122
| (ii) | The warrants were issued in connection with private placements that closed on March 18, 2024 and April 15, 2024 and are exercisable only for cash, except in limited circumstances, at any time after the date of issuance. The Company evaluated the warrants under ASC 815-40 guidance and determined that the warrants did not meet Step 2 of the indexation. As a result they are not indexed to the Company’s own stock and must be classified as liabilities. Refer to the disclosure above under the header “—Common stock” for further details. |
A holder of warrants may not exercise the warrant if the holder, together with its affiliates, would beneficially own more than a specified percentage of the outstanding common stock (
10. Preferred Stock
On May 13, 2024, the Company filed a Certificate of Elimination to its Certificate of Incorporation, as then amended, with the Secretary of State of the State of Delaware to eliminate from the Certificate of Incorporation all matters set forth in the Certificates of Designation filed with the Secretary of State of the State of Delaware on September 8, 2017 (with respect to its Series A Convertible Preferred Stock and the Series B Convertible Preferred Stock) and July 18, 2018, as amended on March 19, 2020 (with respect to its Series A-1 Convertible Preferred Stock) and returning each of the Series A Convertible Preferred Stock, Series B Convertible Preferred Stock and Series A-1 Convertible Preferred Stock to the status of authorized but unissued shares of preferred stock of the Company, without designation as to series. There were
11. Stock-Based Compensation
2011 Equity Incentive Plan
The Company’s 2011 Equity Compensation Plan (the “2011 Plan”) provided for the Company to sell or issue restricted common stock, restricted stock units (“RSUs”), performance-based awards (“PSUs”), cash-based awards or to grant stock options for the purchase of common stock to officers, employees, consultants and directors of the Company. The 2011 Plan was administered by the board of directors or, at the discretion of the board of directors, by a committee of the board. As of September 30, 2024, there were no equity awards outstanding under the 2011 Plan. In light of the December 2015 adoption of the 2015 Equity Incentive Plan, (the “2015 Plan”) no future awards under the 2011 Plan will be granted.
2024 Equity Incentive Plan
In December 2015, the Company adopted the 2015 Plan. The 2015 Plan provided for the grant of stock options, stock appreciation rights, restricted stock awards, RSU awards, performance stock awards and other forms of equity
123
compensation to Company employees, directors and consultants. In August 2024, the Company’s stockholders approved the amendment and restatement of the 2015 Plan and, in connection with amending and restating the 2015 Plan, the name of the 2015 Plan was updated to the Outlook Therapeutics, Inc. 2024 Equity Incentive Plan (the “2024 Plan”). The 2024 Plan provides for the grant of stock options, stock appreciation rights, restricted stock awards, RSU awards, performance stock awards and other forms of equity compensation to Company employees, directors and consultants. The aggregate number of shares of common stock authorized for issuance pursuant to the Company’s 2024 Plan is
Stock options and RSUs granted under the Company's 2024 Plan generally vest over a period of to
The Company recorded stock-based compensation expense in the following expense categories of its consolidated statements of operations for the years ended September 30, 2024 and 2023:
Year ended September 30, | ||||||
| 2024 |
| 2023 | |||
Research and development | $ | | $ | | ||
General and administrative | | | ||||
$ | | $ | | |||
Stock options
The following table summarizes all of the Company’s stock option activity for the years ended September 30, 2024:
Weighted | ||||||||||
Average | ||||||||||
Weighted | Remaining | |||||||||
Number of | Average | Contractual | Aggregate | |||||||
| Shares |
| Exercise Price |
| Term (Years) |
| Intrinsic Value | |||
Balance at October 1, 2023 | | $ | | |||||||
Granted | | | ||||||||
Forfeited | ( | | ||||||||
Expired | ( | | ||||||||
Balance at September 30, 2024 | | $ | | $ | | |||||
Vested and exercisable at September 30, 2024 | | $ | | $ | | |||||
The aggregate intrinsic value represents the total amount by which the fair market value of the common stock subject to options exceeds the exercise price of the related options.
The Company estimated the fair value of each stock option award on the grant date using the Black-Scholes option pricing model, wherein expected volatility is based on a weighted average of the Company’s historical volatility and the volatilities of similar entities within the Company’s industry which are commensurate with the expected term assumption. The expected term calculation is based on the “simplified” method described in Staff Accounting Bulletin (“SAB”) No. 107, Share-Based Payment, and SAB No. 110, Share-Based Payment, since the simplified method provides a reasonable estimate in comparison to actual experience. The risk-free interest rate is based on the U.S. Treasury yield at the date of grant for an instrument with a maturity that is commensurate with the expected term of the stock options. The dividend yield is
124
The weighted average grant date fair value of the options awarded to employees and directors for the years ended September 30, 2024 and 2023 was $
Year ended September 30, | |||||
2024 |
| 2023 | |||
Risk-free interest rate |
| | % | | % |
Expected term (years) | |||||
Expected volatility | | % | | % | |
Expected dividend yield | — | — | |||
As of September 30, 2024, there was $
Performance-based stock options
The Company granted certain officers of the Company option awards where vesting was contingent upon meeting certain company-wide performance goals. The performance stock options were granted “at-the-money” and have a term of
The fair value of each option grant under the performance share option plan was estimated on the date of grant using the same option valuation model used for non-statutory options above. Compensation expense for performance-based stock options is only recognized when management determines it is probable that the awards will vest.
The following table summarizes all of the Company’s performance-based stock option activity for the years ended September 30, 2024.
Weighted | ||||||||||
Average | ||||||||||
Weighted | Remaining | |||||||||
Number of | Average | Contractual | Aggregate | |||||||
| Shares |
| Exercise Price |
| Term (Years) |
| Intrinsic Value | |||
Balance at October 1, 2023 | | $ | | |||||||
Granted | | | ||||||||
Forfeited | ( | | ||||||||
Balance at September 30, 2024 | | $ | | $ | — | |||||
Vested and exercisable at September 30, 2024 | | $ | | $ | — | |||||
The weighted average grant date fair value of the performance stock options awarded for the years ended September 30, 2024 and 2023 was $
Year ended September 30, | |||||
| 2024 |
| 2023 | ||
Risk-free interest rate | | % | | % | |
Expected term (years) | |||||
Expected volatility | | % | | % | |
Expected dividend yield | — | — | |||
125
基于绩效的股票单位
该公司已发行PSU,通常具有
加权 | ||||||||||
平均 | ||||||||||
Number | 行使 | 剩余 | ||||||||
的 | 价格 | 合同 | 集料 | |||||||
| 个psu |
| 每个PSU |
| 任期(年) |
| 内在价值 | |||
2023年10月1日余额 | | $ | | |||||||
过期 | ( | | ||||||||
2024年9月30日余额 | — | $ | — | — | $ | — | ||||
于2024年9月30日授予并可行使 | — | $ | — | — | $ | — | ||||
12. 合作安排
Syntone战略合作伙伴和中国合资企业
关于公司与Syntone于2020年5月签订的股票购买协议,公司与Syntone签订了一份合资企业协议,据此,双方同意成立一家中国合资企业,该企业将由
公司初始投资为美元
13. 所得税
截至2024年9月30日和2023年9月30日止年度的所得税优惠包括以下内容:
截至9月30日的一年, | ||||||
| 2024 |
| 2023 | |||
国家税务 |
| $ | |
| $ | |
按法定联邦所得税率计算的所得税费用(福利)与财务报表中反映的所得税的对账如下:
截至9月30日的一年, |
| ||||
| 2024 |
| 2023 |
| |
美国联邦法定税率 | ( | % | ( | % | |
州税,扣除联邦福利 |
| ( |
| ( | |
推迟调整 | | | |||
永久性差异 |
| |
| ( | |
外国税收抵免 |
| |
| | |
研究与开发信贷 |
| ( |
| ( | |
估值津贴变化 |
| |
| | |
其他 |
| ( |
| ( | |
实际所得税率 |
| | % | | % |
126
导致递延税的暂时差异的税收影响如下:
9月30日, | ||||||
| 2024 |
| 2023 | |||
递延所得税资产: |
|
| ||||
净营业亏损结转 | $ | | $ | | ||
资本化的研发成本 |
| |
| | ||
股票补偿 |
| |
| | ||
租赁负债 | | — | ||||
研发信贷结转 |
| |
| | ||
外国税收抵免 |
| |
| | ||
应计及其他 |
| |
| | ||
递延税资产总额 |
| |
| | ||
减去:估值免税额 |
| ( |
| ( | ||
| |
| | |||
递延税务负债: |
|
|
|
| ||
财产和设备 |
| — |
| — | ||
使用权资产 |
| ( |
| ( | ||
递延税项资产净额 | $ | — | $ | — | ||
截至2024年9月30日,该公司约有
当存在不确定的税收头寸时,公司确认税收头寸的税收优惠,以使其更有可能实现而不是不实现。关于税收优惠是否更有可能实现的决定,是基于税收状况的技术优点以及对现有事实和情况的考虑。该公司在其综合经营报表的所得税拨备中确认任何未确认的税收优惠的应计利息和罚款。
未确认的税收优惠的期初和期末金额的对账如下:
截至9月30日的一年, | ||||||
2024 | 2023 | |||||
年初余额 |
| $ | |
| $ | |
基于与当年相关的税务状况的变化 |
| |
| | ||
年底余额 | $ | | $ | | ||
公司预计未来12个月内未确认的税收优惠不会发生重大变化。这些未确认的税收优惠如果得到确认,将影响年度有效税率。该公司2011年至2023年的所得税申报表仍开放供国税局以及各州和市审查。
由于该准则所有权条款的变化,公司NOL结转的可用性可能会受到未来时期应税收入的年度限制,这可能会极大地限制此类结转的最终利用。公司尚未分析其股权融资的历史或潜在影响
127
因此,尚未确定结转的净营业亏损是否受任何规范第382节的限制。在有限制的范围内,递延税项资产将减少,估值免税额将抵销减少。
14.对后续活动的评论
行政总裁离职
于2024年12月3日,C.Russell Trenary III辞去本公司总裁兼首席执行官及本公司董事会(“董事会”)成员职务,即日起生效(“生效日期”)。特雷纳里辞职后,董事会决定立即将其规模缩减至9名董事。
Trenary先生的离职构成了就Trenary先生作为一方或以其他方式参与的本公司及其附属公司的任何雇佣、股权补偿或福利协议、计划或安排,包括Trenary先生与本公司之间日期为2021年7月6日的某项高管聘用协议(“雇佣协议”)而言的无“事由”终止。因此,在Trenary先生签立并未撤销载有解除对本公司索赔的离职协议的情况下,Trenary先生有权在终止后12个月内继续支付其基本工资、一次性支付终止日历年目标奖金的100%、最长12个月的员工福利、将当时未归属的股权奖励的50%全额转归,以及偿还至终止日为止欠他的费用。
2024年12月3日,公司首席财务官Lawrence A.Kenyon被任命为公司临时首席执行官,自生效日期起生效,在董事会进行正式遴选程序以确定和任命一名常任首席执行官期间任职。
劳动力的减少
2024年12月10日,董事会批准了一项与削减运营费用和保留资本计划相关的公司裁员计划。2024年12月13日,该公司裁员
128
项目9.会计和财务披露方面的变化和与会计师的分歧
没有。
项目9A.控制和程序
披露控制和程序的评估
在提交本年度报告Form 10-k之前,我们的管理层在临时首席执行官和首席财务官的参与下,评估了我们的披露控制和程序(如1934年证券交易法(经修订)或交易法下的规则13a-15(E)和15d-15(E)所定义)。基于这一评估,我们的临时首席执行官和首席财务官得出结论,截至本年度报告Form 10-k所涵盖的期间结束时,我们的披露控制和程序在设计和运行方面于2024年9月30日生效。
财务报告的内部控制
我们的管理层负责建立和维护对财务报告的充分内部控制,这一术语在《交易法》第13a-15(F)条中有定义。我们的内部控制系统旨在根据公认的会计原则,为对外财务报表的编制和公平列报提供合理保证。所有的内部控制系统,无论设计得多么好,都有其固有的局限性,只能合理地保证内部控制系统的目标得以实现。
在包括首席执行官和首席财务官在内的管理层的监督和参与下,我们根据特雷德韦委员会(COSO)赞助组织委员会在其2013年内部控制-综合框架中建立的标准,对我们对财务报告的内部控制的有效性进行了评估。根据我们的评估,我们得出结论,我们对财务报告的内部控制自2024年9月30日起有效。
作为一家规模较小的报告公司,我们的独立注册会计师事务所不需要就我们的财务报告内部控制出具认证报告。
财务报告内部控制的变化
在截至2024年9月30日的季度内,我们对财务报告的内部控制没有发生重大影响或合理地可能对我们的财务报告内部控制产生重大影响的变化。
内部控制有效性的内在局限性。
任何财务报告内部控制制度的有效性,包括我们的内部控制制度,都受到内在限制,包括在设计、实施、运作和评估控制和程序时行使判断力,以及无法完全消除不当行为。因此,任何财务报告的内部控制制度,包括我们的制度,无论设计和运作有多好,都只能提供合理的保证,而不是绝对的保证。此外,对未来期间进行任何有效性评估的预测可能会因为条件的变化而出现控制不足的风险,或者政策或程序的遵守程度可能会恶化。我们打算继续对我们的业务需要或适当的内部控制进行监控和升级,但不能向您保证这些改进将足以为我们提供对财务报告的有效内部控制。
项目90亿。其他信息
在本年度报告所涵盖的财政年度内,我们的董事或第16科人员
129
130
第三部分
由于我们打算不迟于2025年1月28日根据修订后的1934年证券交易法第14A条为我们的下一届股东年会提交我们的最终委托书或2025年委托书,因此本报告在10-k表格中省略了第III部分所要求的某些信息,将包括在2025年委托书中的某些信息通过引用并入本文。
项目10.董事、执行官和公司治理
本项目所需信息将包括在我们的2025年委托书中,具体如下:
· | 有关我们的董事和董事提名人的信息将包括在题为“董事选举”的部分; |
· | 有关本公司行政人员的资料将包括在题为“本公司行政人员”的章节内; |
· | 如有需要,应将关于遵守《交易法》第16(A)条的信息列入题为“拖欠第16(A)条报告”的章节; |
· | 关于家庭关系的信息将列入题为“选举董事--家庭关系”的一节; |
· | 关于我们的审计委员会和审计委员会财务专家的信息将包括在题为“关于董事会和公司治理的信息-审计委员会”的部分。 |
我们已经通过了适用于我们所有员工、高级管理人员和董事的商业行为和道德准则,包括我们的首席执行官、首席财务官、首席会计官或财务总监或执行类似职能的人员。《商业行为和道德准则》在我们的网站ir.outlookTreateutics.com的投资者和媒体部分公开提供。此网站地址仅供非活跃的文本参考;本网站上的任何材料均不是本Form 10-k年度报告的一部分。我们打算在我们的网站上或在未来的Form 8-k当前报告中迅速披露:(I)适用于我们的主要高管、主要财务官、主要会计官或财务总监或执行类似职能的人员的行为准则任何修订(技术性、行政或其他非实质性修订除外)的日期和性质,并与S-k条例第406(B)项中列举的道德准则定义的任何要素有关;以及(Ii)任何放弃的性质,包括默示放弃;根据授予其中一名特定个人的《行为守则》中与S-k条例第406(B)项所列道德守则定义的一个或多个要素有关的规定,获得豁免的人的姓名和豁免的日期。
我们采取了内幕交易政策,规范我们的董事、高级管理人员和员工以及我们对我们证券的购买、销售和/或其他处置。内幕交易政策的副本以10-k表格的形式作为本年度报告的证物存档。
项目11.高管薪酬
此项目所要求的信息将包括在我们的2025年委托书中题为“高管薪酬”的一节下,并通过引用并入本文,但如果2025年委托书没有在本年度报告所涵盖的10-k表格所涵盖的财政年度结束后120天内提交,遗漏的信息将被包括在不迟于该120天期间结束时提交的本10-k表格年度报告的修正案中。
131
项目12.某些受益所有人和管理层的证券所有权以及相关股东事宜
有关股权补偿计划的所需信息将包括在我们的2025年委托书中题为“股权补偿计划信息”的部分中,而本项目所要求的有关某些受益人和管理层的担保所有权的信息将包括在我们的2025年委托书中题为“某些受益所有人和管理层的担保所有权”一节下,并通过引用并入本文,前提是如果2025年委托书没有在本年度报告所涵盖的财政年度结束后120天内以Form 10-k的形式提交,遗漏的信息将包括在不迟于120天期限结束前提交的本年度报告的10-k表格修正案中。
项目13.某些关系和关联交易以及董事独立性
此项目所要求的信息将包括在我们的2025年委托书中题为“与相关人士的交易”和“关于董事会和公司治理的信息-董事会的独立性”的部分,并以引用的方式并入本文,但如果2025年委托书没有在本年度报告所涵盖的10-k表格所涵盖的财政年度结束后120天内提交,遗漏的信息将被包括在不迟于该120天期限结束前提交的本10-k表格年度报告的修正案中。
项目14.主要会计费用和服务
此项目所要求的信息将包括在我们的2025年委托书中题为“批准选择独立注册会计师事务所”一节中,并以引用的方式并入本文,但如果2025年委托书没有在本年度报告所涵盖的10-k表格所涵盖的财政年度结束后120天内提交,遗漏的信息将被包括在不迟于该120天期间结束前提交的本10-k表格年度报告的修正案中。
132
第四部分
项目15.证物和财务报表附表
(a) (1) 第15(a)项要求的财务报表以表格10-k形式归档在本年度报告的第8项中。
(2) 第15(a)项要求的财务报表附表被省略,因为它们不适用、不要求或所需信息包含在本年度报告10-k表格第8项中提交的财务报表或附注中。
展品
133
134
10.25 | ||
10.26 | ||
10.27 | 公司与BTIG,LLC于2023年5月16日签订的市场销售协议(通过引用附件10.1纳入) 注册人的 2023年5月16日向SEC提交的8-k表格的当前报告)。 | |
10.28 | 公司与投资者方之间的注册权协议格式,日期为2024年1月22日(参考注册人于2024年1月24日向SEC提交的当前8-k表格的附件10.3合并). | |
10.29 | 公司与Syntone之间的注册权协议,日期为2024年1月22日(参考注册人于2024年1月24日向SEC提交的当前8-k表格报告的附件10.5合并). | |
10.30 | ||
10.31 | ||
10.32 | 公司与BTIG于2024年4月12日对2023年5月16日签订的销售协议进行了修订(参考注册人于2024年4月12日向SEC提交的当前表格8-k报告的附件10.1合并). | |
19.1 | ||
21.1 | ||
23.1 | ||
31.1 | 根据1934年证券交易法(经修订)颁布的第13 a-14(a)条和第15 d-14(a)条对首席执行官和首席财务官进行认证. | |
32.1* | ||
97 | ||
101.INS | 内联MBE实例文档 | |
101.SCH | 内联XBRL分类扩展架构文档 | |
101.CAL | 内联XBRL分类扩展计算链接库文档 | |
101.DEF | 内联MBE定义Linkbase文档 | |
101.LAb | Inline MBE分类扩展标签Linkbase文档 |
135
101.PRE | 内联XBRL分类扩展演示文稿Linkbase文档 | |
104 | 封面交互式数据文件(格式为内联BEP,包含在附件101中) |
† | 根据美国证券交易委员会的命令,本文件中包含的某些信息已获得保密处理。此类信息(由Inskks表示)已被省略,并单独提交给SEC。 |
¥ | 本展览的某些部分(用“[*]”表示)被省略,因为它们不重要。 |
* | 特此提供,不应被视为根据1934年证券交易法(经修订)第18条的目的“提交”,并且不应被视为通过引用纳入根据1933年证券法(经修订)或1934年证券交易法(经修订)下的任何提交。 |
# | 指管理合同或补偿计划。 |
** | 根据法规S-k第601(a)(5)项,省略了本展览的某些展品和时间表。注册人同意应美国证券交易委员会的要求向其提供所有省略的证据和附表的副本。 |
项目16.表格10-k摘要
没有。
136
签名
根据1934年证券交易法第13或15(d)条的要求,登记人已正式促使以下签署人代表其签署本报告,并经正式授权。
日期: 2024年12月27日 | 作者: | /s/劳伦斯A.肯扬 |
姓名: | 劳伦斯·A肯扬 | |
标题: | 首席财务官兼临时首席执行官 |
签名
根据1934年证券交易法的要求,以下人员代表注册人以所示的身份和日期签署了本10-k表格年度报告。
/s/ Ralph H.瑟曼 |
| 执行主席 |
| 2024年12月27日 |
拉尔夫·H瑟曼 | ||||
首席财务官, 临时首席执行官, | ||||
/s/劳伦斯A.肯扬 | 财务主管、秘书和董事 | 2024年12月27日 | ||
劳伦斯·A肯扬 | (首席执行官、财务会计官) | |||
/s/叶赞·哈达丁 | 主任 | 2024年12月27日 | ||
叶赞·哈达丁 | ||||
/s/ Kurt J. Hilzinger | 主任 | 2024年12月27日 | ||
库尔特·J·希尔辛格 | ||||
/s/ Julia A.哈勒 | 主任 | 2024年12月27日 | ||
朱莉娅·A哈勒 | ||||
/s/ Faisal G. Sukhtian | 主任 | 2024年12月27日 | ||
费萨尔·G Sukhtian | ||||
/s/朱利安·甘戈利 | 主任 | 2024年12月27日 | ||
朱利安·甘戈利 | ||||
/s/ Gerd Auffarth | 主任 | 2024年12月27日 | ||
格尔德·奥法特 | ||||
/s/黄安东 | 主任 | 2024年12月27日 | ||
黄安东 | ||||
137