DBCHgosh
がいいねしました
$アップ・フィンテック・ホールディング(TIGR.US$注意してください…申し訳ありませんが、私がHFを正しく読んだ場合、彼らは株価を52週間の最低値まで引き下げる可能性があります…
翻訳済み
17
6
DBCHgosh
がいいねしました
コラム OCGN
参考までに、私の意見を再編成します。
1. OCGNの背景情報
"Ocugen, Inc.は、目の病気を治療しワクチンを開発・商業化するバイオ製薬会社です。COVID-19から命を救います。"(公式情報によると、OCGNは目の病気を治療しワクチンを開発・研究・商業化するバイオ製薬会社です。)
1.1 OCGNとCovaxinの関係
実際に、OCGNとBharat Biotechは2021年2月に契約を結んでいます。契約条件によると、Ocugenは、ワクチン(Covaxin)の特許権をアメリカとカナダで保有し、アメリカとカナダにおける臨床開発、規制承認(EUAを含む)と市場開発を担当することになります。Bharat Biotechは、アメリカとカナダでの使用のための初回投与量も提供します。
さらに、Bharat Biotechは、アメリカとカナダでの製造のための技術移転をサポートします。アメリカとカナダの市場における独占ライセンスを考慮して、OcugenはCOVAXINの販売利益をBharat Biotechと共有し、Ocugenはその利益の45%を保持します。
OCGNは現在、カナダのEUA申請を提出し、アメリカはIND申請を提出して、その後のBLA申請の基盤を築いています。
2. カナダのEUA
2020年9月、カナダの保健省はCOVID-19に関連する薬剤の輸入、販売、広告に関する暫定命令による緊急ワクチン使用許可の処理プロセスを迅速化するために決議を採択しました。その後、COVID-19のための新薬提出に変更されました。全ての試験が終了した後に申請者はEU承認を当局に申請できます。当局は申請の処理に優先的に対応します。
申請書は、次の条件を満たす必要があります。
1. 前臨床研究(動物実験など)
2. 臨床研究(すべての試験結果、安全性データ、正当なデータ)
3. 製造データ(製造データ:ワクチン製造プロセス)
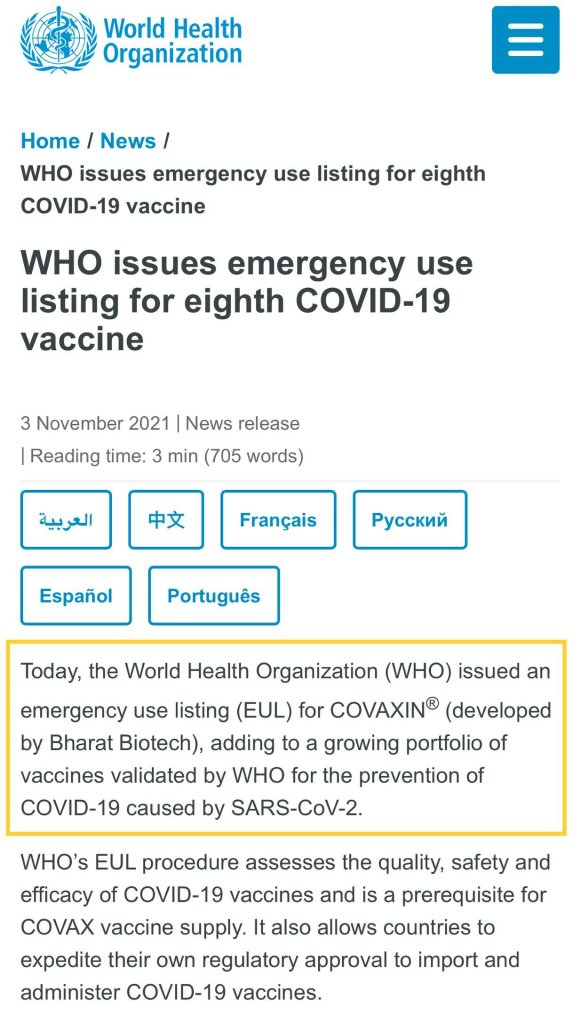
現在、カナダのVaccigen Ltdを通じてOCGNのEU承認申請の審査はまだ進行中です。WHOがCovaxinのEUL申請を承認したことと重なります。今後の状況を注視することができます。
3. WHO EULとOCGNの関係
EUAとFDAに加えて、最近WHO EULについての議論が始まった人たちもいます。タイトルを簡単に説明しましょう。WHOは、2021年3月11日にCovaxinのEUL申請を正式に承認しました。実際、Bharat BiotechはWHOに直接EUL申請をしました。OCGNとは関係がないようですが、OCGNが恩恵を受ける可能性があります!
OCGNとBharat Biotechが締結した契約による別の一節に注目が必要です。"必要に応じて商業供給契約に基づき、そしてOcugenのキャパシティに合理的な制限がある場合(商業供給契約で詳細に説明されている)、BBILがBBIL領土内で製品の製造と出荷、商業包装にて責任を負います。製品に関する規制当局の承認がBBIL領土で受け取られた後、BBILはFieldにて使用することができます。"
簡単に言えば、OCGNがWHO/他の国の規制当局から承認を得た後、バーラット・バイオテック(カナダとアメリカ以外の地域にワクチンを供給する)にワクチンを供給することができます。バーラット・バイオテックがWHO EULを取得すれば、CovaxinはCOVAX(コロナウイルスワクチンの実施計画)に参加して他の国々(特に貧しい国々)にワクチンを配布する支援をすることができます。CovaxinのEU承認申請の承認がEULによりより多くの国・地域で急速化する可能性があるため(バーラット・バイオテックは60以上の国・地域にEUAを提出していたことに注意してください)、OCGNはこの機会を利用して他の国々にワクチンを供給することができます。
4米国のBLA申請(BLA申請の第1ステップ)
OCGNは10月27日に、Covaxinの有効性が米国にも適用できるかどうかを探るため、米国FDAに対して新薬申請(IND)を提出したことを発表しました。これはOCGNが米国のBLAの第1段階を開始したことに相当します。
OCGNによると、IND申請が承認された場合、OCGNは米国で正式に臨床試験を行い、米国とインドの試験結果が同じかどうかを比較します。OCGNは、上記の試験を2022年第1四半期に完了することを望んでいます。ただし、この申請は米国でのテストの申請であり、正式なBLAの申請ではありません。
FDAのデータによると、INDは、アメリカでの販売・使用の承認がまだされていないことを意味しています。FDAは、IND申請を受けたら30日以内に申請を承認します。OCGNが30日後にFDAから反対意見を受けなければ、米国での試験が行われます。
結論として、IND申請はOCGNにとって、Covaxinを米国に導入するための最初のステップである。また、上記の情報はOCGNがBLAの準備を始めたことを反映しています。ここで1つ追加すると、米国における地元の試験結果がFDAがBLAを承認するかどうかの重要な部分であることに留意してください。
$オキュジェン(OCGN.US$
1. OCGNの背景情報
"Ocugen, Inc.は、目の病気を治療しワクチンを開発・商業化するバイオ製薬会社です。COVID-19から命を救います。"(公式情報によると、OCGNは目の病気を治療しワクチンを開発・研究・商業化するバイオ製薬会社です。)
1.1 OCGNとCovaxinの関係
実際に、OCGNとBharat Biotechは2021年2月に契約を結んでいます。契約条件によると、Ocugenは、ワクチン(Covaxin)の特許権をアメリカとカナダで保有し、アメリカとカナダにおける臨床開発、規制承認(EUAを含む)と市場開発を担当することになります。Bharat Biotechは、アメリカとカナダでの使用のための初回投与量も提供します。
さらに、Bharat Biotechは、アメリカとカナダでの製造のための技術移転をサポートします。アメリカとカナダの市場における独占ライセンスを考慮して、OcugenはCOVAXINの販売利益をBharat Biotechと共有し、Ocugenはその利益の45%を保持します。
OCGNは現在、カナダのEUA申請を提出し、アメリカはIND申請を提出して、その後のBLA申請の基盤を築いています。
2. カナダのEUA
2020年9月、カナダの保健省はCOVID-19に関連する薬剤の輸入、販売、広告に関する暫定命令による緊急ワクチン使用許可の処理プロセスを迅速化するために決議を採択しました。その後、COVID-19のための新薬提出に変更されました。全ての試験が終了した後に申請者はEU承認を当局に申請できます。当局は申請の処理に優先的に対応します。
申請書は、次の条件を満たす必要があります。
1. 前臨床研究(動物実験など)
2. 臨床研究(すべての試験結果、安全性データ、正当なデータ)
3. 製造データ(製造データ:ワクチン製造プロセス)
現在、カナダのVaccigen Ltdを通じてOCGNのEU承認申請の審査はまだ進行中です。WHOがCovaxinのEUL申請を承認したことと重なります。今後の状況を注視することができます。
3. WHO EULとOCGNの関係
EUAとFDAに加えて、最近WHO EULについての議論が始まった人たちもいます。タイトルを簡単に説明しましょう。WHOは、2021年3月11日にCovaxinのEUL申請を正式に承認しました。実際、Bharat BiotechはWHOに直接EUL申請をしました。OCGNとは関係がないようですが、OCGNが恩恵を受ける可能性があります!
OCGNとBharat Biotechが締結した契約による別の一節に注目が必要です。"必要に応じて商業供給契約に基づき、そしてOcugenのキャパシティに合理的な制限がある場合(商業供給契約で詳細に説明されている)、BBILがBBIL領土内で製品の製造と出荷、商業包装にて責任を負います。製品に関する規制当局の承認がBBIL領土で受け取られた後、BBILはFieldにて使用することができます。"
簡単に言えば、OCGNがWHO/他の国の規制当局から承認を得た後、バーラット・バイオテック(カナダとアメリカ以外の地域にワクチンを供給する)にワクチンを供給することができます。バーラット・バイオテックがWHO EULを取得すれば、CovaxinはCOVAX(コロナウイルスワクチンの実施計画)に参加して他の国々(特に貧しい国々)にワクチンを配布する支援をすることができます。CovaxinのEU承認申請の承認がEULによりより多くの国・地域で急速化する可能性があるため(バーラット・バイオテックは60以上の国・地域にEUAを提出していたことに注意してください)、OCGNはこの機会を利用して他の国々にワクチンを供給することができます。
4米国のBLA申請(BLA申請の第1ステップ)
OCGNは10月27日に、Covaxinの有効性が米国にも適用できるかどうかを探るため、米国FDAに対して新薬申請(IND)を提出したことを発表しました。これはOCGNが米国のBLAの第1段階を開始したことに相当します。
OCGNによると、IND申請が承認された場合、OCGNは米国で正式に臨床試験を行い、米国とインドの試験結果が同じかどうかを比較します。OCGNは、上記の試験を2022年第1四半期に完了することを望んでいます。ただし、この申請は米国でのテストの申請であり、正式なBLAの申請ではありません。
FDAのデータによると、INDは、アメリカでの販売・使用の承認がまだされていないことを意味しています。FDAは、IND申請を受けたら30日以内に申請を承認します。OCGNが30日後にFDAから反対意見を受けなければ、米国での試験が行われます。
結論として、IND申請はOCGNにとって、Covaxinを米国に導入するための最初のステップである。また、上記の情報はOCGNがBLAの準備を始めたことを反映しています。ここで1つ追加すると、米国における地元の試験結果がFDAがBLAを承認するかどうかの重要な部分であることに留意してください。
$オキュジェン(OCGN.US$
翻訳済み

9
2
DBCHgosh
がいいねしました
4
DBCHgosh
がいいねしました
$ChemoCentryx(CCXI.US$新規売600,000株が今朝やっとカバーされました。もう壁はありません。市場が開くとあなたが待っていたものになるでしょう。
翻訳済み
82
62
DBCHgosh
がいいねしました
DBCHgosh
がいいねしました



![[empty]](https://static.moomoo.com/node_futunn_nnq/assets/images/folder.5c37692712.png)
![[error]](https://static.moomoo.com/node_futunn_nnq/assets/images/no-network.991ae8055c.png)